Ni-琼脂糖凝胶6FF(His标签纯化树脂)预装重力柱说明书
NiNTA琼脂糖纯化树脂
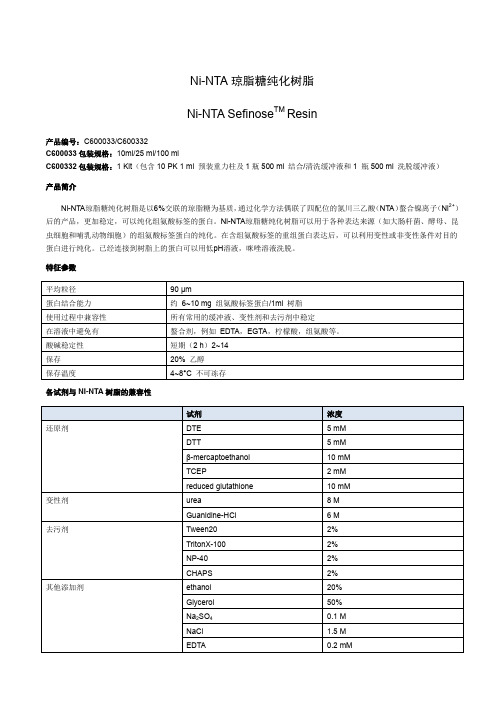
Ni-NTA琼脂糖纯化树脂是以6%交联的琼脂糖为基质,通过化学方法偶联了四配位的氮川三乙酸(NTA)螯合镍离子(Ni2+) 后的产品,更加稳定,可以纯化组氨酸标签的蛋白。Ni-NTA琼脂糖纯化树脂可以用于各种表达来源(如大肠杆菌、酵母、昆 虫细胞和哺乳动物细胞)的组氨酸标签蛋白的纯化。在含组氨酸标签的重组蛋白表达后,可以利用变性或非变性条件对目的 蛋白进行纯化。已经连接到树脂上的蛋白可以用低pH溶液,咪唑溶液洗脱。
淀完全溶解。 4. 12,000 rpm离心30 min去除剩余的不溶物。小心的将上清转移到干净的管中而不触碰下面的沉淀。
组氨酸标签蛋白纯化步骤
离心法组氨酸标签蛋白纯化步骤 可根据自身实验情况进行调整,可以再室温或是4°C进行纯化。 1. 加入适量的 Ni-NTA树脂到离心管中。离心管在3000 rpm离心2 min然后小心的去除上清。 2. 加入两倍柱体积的Binding/wash buffer 将缓冲液和树脂完全混匀。 3. 离心管在3000 rpm离心2 min 然后小心的去除上清。 4. 将蛋白提取物与Binding/wash buffer混匀,使总体积相当于两个柱体积。 5. 将上步中的混合液加入柱,在旋转振荡器混匀30 min,使混合液与树脂混匀。 6. 离心管在3000 rpm离心2 min,吸出上清,如需要可将上清留存进行下游分析。 7. 用两倍柱体积的Binding/wash buffer清洗。离心管在3000 rpm离心2 min吸出上清,如需要可将上清留存进行下游分析。. 8. 重复清洗步骤,通过测量在280 nm吸光度,直到洗出液值达到基线值。 9. 用一倍柱体积的Elution Buffer 洗脱柱上的组氨酸标签蛋白。离心管在3000 rpm离心2 min 然后小心的吸出并保存上清。
英芮诚 Ni-IDA 琼脂糖微球 使用说明书

英芮诚生化科技✧Ni-IDA琼脂糖磁珠✧Ni-IDA琼脂糖微球使用说明书苏州英芮诚生化科技有限公司目录Ni-IDA琼脂糖磁珠使用说明书 (1)Ni-IDA琼脂糖磁珠使用注意事项 (6)Ni-IDA琼脂糖微球使用说明书 (7)Ni-IDA琼脂糖微球使用注意事项 (11)附1:Ni-IDA琼脂糖磁珠和微球溶剂耐受性表 (12)附2:标签蛋白纯化磁珠&微球部分产品一览表 (13)附3:抗体偶联纯化磁珠&微球部分产品一览表 (14)Ni-IDA琼脂糖磁珠使用说明书【产品名称】Ni-IDA琼脂糖磁珠【产品型号】MAgr25K/IDA Ni;MAgr100K/IDA Ni【产品介绍】英芮诚Ni-IDA琼脂糖磁珠以高度交联琼脂糖磁珠为基质,拥有良好的刚性、磁响应性和单分散性,表面修饰有丰富的IDA螯合Ni2+,专为纯化组氨酸标签(His-tag)蛋白而设计的功能化材料。
适合各种来源如大肠杆菌表达的可溶性及包涵体等形式的带组氨酸标签蛋白的纯化。
【产品规格】产品型号MAgr25K/IDA Ni MAgr100K/IDA Ni目录号P20 MP05平均粒径25 µm 90 µm螯合金属离子Ni2+金属离子密度50~80 μmol/mL (100%,v/v)固形物浓度10% (v/v)(科研用)50% (v/v)(工业用)分散液20%乙醇水溶液目标蛋白结合量75~85 mg 6×His标签蛋白(30 KD) / mL磁珠(100%,v/v)65~75 mg 6×His标签蛋白(30 KD) / mL磁珠(100%,v/v)备注:表中科研用与工业用仅为推荐,可以互通,不同粒径的产品均可科研或者工业用。
【产品特点】✧良好的磁响应性;✧生物样品中良好的分散性;✧良好的物理、化学稳定性;✧高结合载量;✧非特异性吸附低。
【作用对象】细菌,酵母,昆虫和哺乳动物细胞等分泌或胞内表达的组氨酸标签蛋白。
镍胶

镍-琼脂糖微球FF 说明书一、产品简介镍-琼脂糖微球FF 主要用于纯化带组氨酸标签(6×HIS标签)的重组蛋白。
以6FF琼脂糖微球为基质,将亚氨基二乙酸接到其表面,再络合Ni 2+而形成。
纯化原理是利用重组蛋白组氨酸标签的咪唑环可与过渡金属Ni 2+形成稳定的配位键,因此能特异、牢固、可逆地吸附于固定这些金属离子的基质。
二、理化指标三、适用范围能被金属离子吸附的多肽、蛋白、核苷酸、磷酸化蛋白及带His标签的重组蛋白。
四、使用过程简介1)色谱柱装填1、所有需要用到的材料的温度要与色谱操作的温度一样,液体最好做脱气处理。
2、在柱子下端加入蒸馏水,以除去柱子中的空气,关闭柱子出口,在柱内保留少量的蒸馏水。
3、将琼脂糖凝胶连续倒入柱子时,要用玻璃棒的紧靠柱子内壁引流,以减少气泡的产生,让填料先自然沉降。
4、柱压不超过0.3MPa,如果装柱系统中无法测柱压,则控制流速高于300cm/h,但是在使用中一般只用最大流速的75%。
2)固定金属离子1、金属离子的固定必须用过滤好的金属离子溶液,以防止金属盐在胶上沉淀。
项目指标配基-N(CH 2COOH)2基质6%交联琼脂糖微球形状球形粒径50~160μm Zn 2+)30~40μmol/ml 最高流速(25℃)≧600cm/h 耐压0.3MPa 耐热pH7.0水中120℃20min pH 适用范围2~14(短时间);3~13(长时间)化学稳定性以下溶液中稳定;1mol/L NaOH;20%EtOH;0.01mol/L 盐酸;2、用2-5倍柱床体积的蒸馏水充分平衡柱子。
3、选择合适的金属离子(Cu2+,Zn2+,Ni2+,Co2+,Fe3+等),溶解在中性或弱酸性的溶液中,浓度为0.1-0.3M。
如果是Fe3+必须在低pH下螯合(pH3),以防止Fe3+产生沉淀。
4、用2-5个柱床体积的金属离子溶液上柱,再用不少于5倍柱床体积的蒸馏水洗涤色谱柱,洗去未螯合的金属离子。
Ni-琼脂糖凝胶6FF(His标签纯化树脂)说明书

Ni-琼脂糖凝胶6FF(His标签纯化树脂)说明书货号:P2010规格:5mL/10mL(凝胶体积)保存:4°C保存,有效期至少一年产品说明:Ni-NTA琼脂糖凝胶6FF是用于纯化6×His标签重组蛋白的一种纯化介质,它是由6%交联的Sepharose 耦连了一种四齿螯合剂NTA而得.它可用于在非变性或变性条件下纯化任何表达系统表达的6×His标签重组蛋白。
NTA,含有四个螯合区,较一般的三齿螯合剂能更好的结合Ni2+。
6×His可与Ni2+螯合,从而使His 标签蛋白结合在Ni-NTA纯化介质上,未结合的蛋白被洗涤下去,结合在介质上的蛋白经过一定浓度的咪唑或低pH缓冲液的温和洗脱下来,从而得到高纯度的目的蛋白。
该纯化介质与His标签蛋白具有极高的亲和力,可达5-20mg/mL。
可在非变性和变性条件下纯化任何表达系统所得的His标签蛋白。
纯化程序简单,所得的蛋白纯度可高达95%。
Ni-NTA可再生4-6次,重复使用。
本产品悬浮液为20%乙醇,已螯合Ni2+。
操作方法:A.非变性条件下抽提His标签蛋白1)准备细胞,接种,诱导表达。
收集细胞,置于-70°C或立即进行步骤2操作。
2)加入1/20细胞生长体积的NTA-0Buffer和PMSF。
PMSF使用的工作浓度为1mM现用现加。
3)将细胞悬浮起来,加入溶菌酶,混匀,冰上放置30分钟,超声或匀浆破碎细胞。
该步骤冰上操作。
4)加入10%Triton X-100,使终浓度为0.05%,充分混匀,冰上放置15分钟。
5)12000rpm/min(20,000×g以上),4°C离心15分钟以上。
取上清,置于冰上备用或-20°C保存。
6)将NTA树脂装入合适的层析柱,层析用10倍NTA体积的NTA-0Buffer洗。
7)将样品加至NTA层析柱中,流速在15mL/h左右,收集穿透部分,用SDS/PAGE分析蛋白的结合情况。
Ni柱层析说明书

Ni-IDA Sefinose TM ResinIntroduces:Ni-IDA sefinose Resin is an agarose resin (6% cross-linked) covalently coupled to a tridentate chelating agent ((iminodiacetic acid or IDA) that binds Ni2+ions by four coordination sites for high-affinity purification of His-tagged recombinant proteins without leacking of Ni2+,His-tagged proteins may be purified under either native or denaturing conditions from any of the common recombinant expression systems, such as bacteria, yeast, insect, and mammalian. Proteins bound to the resin are then eluted with either low pH buffer or imidazole solution or even with histidine solution.Features:Average bead size 90 µmProtein binding capacity* Approx. 6 mg histidine-tagged protein/1ml resinCompatibility during use Stable in all commonly used buffers, denaturants and detergents.Avoid in buffers Chelating agents, e.g. EDTA, EGTA, citrate, histidine ,and so on.pH stability, short-term (2 h) 2–14Storage 20% ethanolStorage temperature +4 to +30ºCRecommended buffers:Native conditions:Binding/wash buffer: BSP030-3(BBI)Elution buffer: BSP030-4(BBI)Denaturing conditions:Binding/wash buffer: 20 mM Tris-HCl, 8 M urea, 500 mM NaCl, 5 mM imidazole, pH 8.0,Elution buffer: 20 mM Tris-HCl, 8 M urea, 500 mM NaCl, 500 mM imidazole, pH 8.0,Notice:The optimal concentration of imidazole needed in the sample and buffer to obtain the best purity and yield differs from protein to protein. Under native conditions, 20–40 mM imidazole in the binding buffer is suitable for many proteins. 500 mM imidazole in the elution buffer is most often sufficient to completely elute the target protein:Sample preparation:The protocol below has been used successfully in our laboratories, but other established procedures may also work.1. For protein expressed in E. coli or yeast cytoplasm. Dilute the cell paste: Add 5–10 ml of binding buffer foreach gram of cell paste. It is essential that the sample and binding buffers contain the same concenctration of imidazole to prevent binding of host cell proteins with exposed histidines.at the same time , remove large particles and high concentration of reagents such as EDTA, amino acids and reducing agents, which can destroy Ni-IDA resins.2. Enzymatic lysis: 0.2 mg/ml lysozyme, 20 µg/ml DNAse, 1 mM MgCl2, 1 mM PMSF (final concentrations)or other protease inhibitors. The inhibitors must have no effect on the ability of the Ni resin.then Stir for 30 160 Torbay Road Markham Ontario L3R 1G6 Canadaminutes at +4°C3. Mechanical lysis: Sonication, homogenization, repeated freeze/thaw or similar techniques.4. Adjust the pH of the lysate to pH 7.4: Do not use strong bases or acids for pH-adjustment (precipitation risk).5. Centrifuge the lysate: Transfer to tubes and centrifuge at 12000rmp for 20 minutes at room temperature or+4°C depending on the sensitivity of the protein.6. Collect supernatants and perform the purification.7. For proteins secreted into culture medium by yeast, insect, or mammalian expression systems,if have a lot oflarge volume of supernatant, concentrate the proteins by ammonium sulphate precipitation Dialyze with 1× PBS,then apply to the column, If bit culture supernatant does not contain EDTA, histidine, or any other reducing agents that might affect the Ni column, it can be applied directly to the column.Note: You can also apply unclarified sample to the column (i.e. omitting step 5 above). If so, extend the mechanical lysis somewhat, e.g. sonicate for 10 minutes. Total purification time will increase due to the higher viscosity of the unclarified sample.Purification Procedures:1). Column preparation.(a) Mix the slurry by gently inverting the bottle several times to completely suspend the resin.(b) Use a pipette to transfer an appropriate volume of Ni resin slurry to the column. Allow the resin to settle andthe storage buffer to drain from the column.(c) Equilibrate the column with four bed volumes of binding/wash buffer or until A280 is stable.2). Purification protein(a)Binding the protein to the resin.Apply the above soluble cleared sample containing His-tagged protein to the column with a flow-rate of 0.5-1 ml per minute. Collect and save the flow-through for analysis.(b) Washing.Wash the column with eight bed volumes of binding/wash buffer or until A280 is stable at the flow-rate of 1 ml per minute.(c). Elution of the target protein.Elute the polyhistidine-tagged protein with five to ten bed volumes of Elution buffer. Collect the elute and dialyze it against 20 mM Tris-HCl pH 8.0 or 1×PBS, pH 7.4, according to the specific application of the target protein.3).Purification of polyhistidine-tagged proteins ( expressed mainly in inclusion bodies)from E. coli underdenaturing conditions:(1). Resuspend the cell pellet in 1× PBS (about 5 ml per ml of pellet), and disrupt cells by sonication as describedabove.(2). Collect inclusion bodies by centrifuging the lysate at 12,000 rpm for 10 minutes. Wash inclusion bodies with1× PBS several times if necessary.(3). Solubilize the inclusion bodies in binding/wash buffer (about 5 ml per ml of pellet), and incubate for 30-60minutes at room temperature. Homogenization or sonication may be necessary to fully solubilize the pellet. (4). Centrifuge at 12,000 rpm for 30 minutes to remove any remaining insoluble material. Carefully transfersupernatant to a clean tube without disturbing the pellet and load it on the Ni column pre-equilibrated with binding/wash buffer.160 Torbay Road Markham Ontario L3R 1G6 Canada(5). Wash the column with binding/wash buffer for 3-4 times until the absorption at 280 nm is close to zero.(6). Elute with minimal volume of elution buffer.Note: The process recommended here is the purification of protein from inclusion body, the eluted protein from this process may need to be refolded to obtain the active and soluble protein.The concentrations of reagents compatible with the NI-NTA columnare given as the followings:Denaturing agents 8 M urea6 M guanidine-HClDetergents 2% TritonX-100 (nonionic)2% Tween 20 (nonionic)2% NP-40 (nonionic)2% cholate (anionic)1% CHAPS (zwitterionic)Other additives 20% ethanol50% glycerol100 mM Na2SO41.5 M NaCl1 mM EDTA60 mM citrateBuffers 50 mM sodium phosphate, pH 7.4100 mM Tris-HCl, pH 7.4100 mM Tris-acetate, pH 7.4100 mM HEPES, pH 7.4100 mM MOPS, pH 7.4100 mM sodium acetate, pH 4Notice: 1. For optimal performance, remove any weakly bound Ni2+ ions by performing a pre-wash as described under the above purification procedures. Do not leave the columns with buffers containing reducing agents when not in use.2. Use at room temperature due to the higher viscosity.3. Generally, chelating agents should be used with caution (and only in the sample, not in the buffers). Anymetal-ion stripping may be counteracted by adding a small excess of MgCl2before centrifugation/filtration of the sampleTroubleshootings:Trouble Because SuggestionsFlow rate is too slow The sample istoo viscousIf the purification has been performed at +4ºC change to room temperatureif possible.Increase dilution of the cell paste before sonication or dilute after sonication.Continue sonication until the viscosity is reduced, and/or add an additionaldose of DNAse and Mg2+Filter the sample (or centrifuge if unclarified sample has been used).If very viscous solutions are used, connect the column to a vacuum manifold160 Torbay Road Markham Ontario L3R 1G6 Canadato speed up the flow rate.Target protein is difficult to dissolve or precipitates during purification Add detergents, or other additives and mix gently for 30 minutes to aid solubilization of the tagged protein. Note that Triton X-100 and NP-40 (but not Tween) have a high absorbance at 280 nm,Furthermore, detergents cannot be easily removed by buffer exchange.Inclusion bodies: the protein can usually be solubilized (and unfolded) from inclusion bodies using common denaturants such as 4–6 M guanidine-HCl, 4–8 M urea, or strong detergents. Mix gently for 30 minutes or more to aid solubilization of the tagged protein.Histidine-taggedprotein is notcompletelyeluted.Elute with an additional several ml of elution buffer.Histidine- tagged protein found in the flow-through during sample application and wash Imidazole concentration in the sample and binding buffer is too high. Use a lower concentration.Ensure that the concentration of chelating or strong reducing agents in the sample is not too high.The histidine tag may be insufficiently exposed; perform purification of unfolded protein in urea or guanidine-HCl as for inclusion bodies. To minimize dilution of the sample, add solid urea or guanidine-HCl.The histidine tag has been lost. Check the sequence of the construct.Low yield of histidine- tagged proteinHistidine- tagged protein is not eluted during purification Histidine-tagged protein still bound. Elute with a higher concentration of imidazole in the elution buffer.The target protein has precipitated in the column. Decrease the amount of sample.Decrease imidazole concentration during elution. Try detergents or change NaCl concentration, or elute under denaturing (unfolding) conditions. Non-specific hydrophobic or other interaction.Add a non-ionic detergent to the elution bufferor increase NaCl concentration.Too low imidazole concentration in sample and binding buffer Use a higher imidazole concentration in sample and binding buffer to prevent binding of unwanted host cell proteins. 20–40 mM is recommended, but higher concentrations may also be appropriateWashing ofunboundmaterial isinsufficientRepeat the wash step after sample application to obtain optimal purity.Partial degradation of tagged protein by proteases Add protease inhibitors (avoid contains EDTA ).Perform lysis and purification at +4ºC.Eluted histidine tagged proteinis not pureContaminants are associated with tagged proteins Before sonicating the cells. Increase detergent levels (e.g. up to 2% Triton X-100 or 2% Tween), or add glycerol (up to 50%) to the wash buffer to disrupt non-specific interactions.160 Torbay Road Markham Ontario L3R 1G6 Canada。
镍琼脂糖凝胶_FF和镍NTA琼脂糖凝胶_FF[1]
![镍琼脂糖凝胶_FF和镍NTA琼脂糖凝胶_FF[1]](https://img.taocdn.com/s3/m/cee1d4020740be1e650e9ae4.png)
1
北京韦氏博慧色谱科技有限公司
北京经济技术开发区中和街 14 号 B 座 411 室
邮政编码:100176 TEL:010-67804548 或 51029828 13911415318 FAX:010-51029829
5、 用分别含 10、20、50、100、200、300、400mM mM 咪唑的缓冲液 3 进行阶段洗脱, 流速为 2ml/min,收集各阶段洗脱峰,用 SDS-PAGE 检测融合蛋白的分子量大小和 纯度
实验结果: (一) 使用镍螯合琼脂糖凝胶色谱分离 His 标签重组蛋白
使用色谱填料为镍琼脂糖凝胶 FF,His 标签重组蛋白的上样量为 20ml,用分别含 10、20、 50、100、200、300、400mM 咪唑的缓冲液 B 进行洗脱,色谱结果见图 3,色谱各组分的 SDS-PAGE 结果见图 4。
(二) 镍螯合琼脂糖凝胶色谱分离 His 标签重组蛋白包涵体 条件和前面的方法基本相同,只是缓冲液中加了 8M 的脲,溶液配方如下表,其纯化
色谱图和电泳图见图 3、4。 要注意的是不同的包涵体溶解度不同,也可以用 6M 盐酸胍代替 8M 脲,因为盐酸胍
溶解包涵体更完全。
缓冲液组成: 缓冲液 1:50mM pH7.4 的PBS缓冲液。配制:0.5M NaH2PO4 19ml,0.5M Na2HPO4 81ml,
2)固定金属离子 1、金属离子的固定必须用过滤好的金属离子溶液,以防止金属盐在胶上沉淀。 2、用 2-5 倍柱床体积的蒸馏水充分平衡柱子。 3、选择合适的金属离子(Cu2+,Zn2+,Ni2+,Co2+,Fe3+等),溶解在中性或弱酸性的溶 液中,浓度为 0.1-0.3M。如果是Fe3+必须在低pH下螯合(pH 3),以防止Fe3+产生沉淀。 4、用 2-5 个柱床体积的金属离子溶液上柱,再用不少于 5 倍柱床体积的蒸馏水洗涤色 谱柱,洗去未螯合的金属离子。(当然也可以直接把洗净没有螯合的填料直接和需要 的金属离子溶液在摇床上震荡过夜,这样螯合效果更好,镍 NTA 琼脂糖凝胶尤其适 合用这样的方法。) 5、用 2-5 倍柱床体积的起始缓冲溶液平衡柱子,再上样。 6、如果是螯合铁离子,要注意的是在中性条件下,Fe3+很容易被还原而生成沉淀,所 以Fe3+溶液的pH最好是 3-5。螯合Fe3+的色谱柱不能长时间保存在中性溶液中。建议每 次用完后都要将螯合的Fe3+用 50 mMEDTA溶液洗净,下次使用时再重新螯合。如果洗不 干净,也可以将凝胶浸在 50 mM的EDTA中过夜后再清洗保存。
CM Sepharose 6FF 预装柱说明书

CM Sepharose 6FF 预装柱说明书货号:YA2551规格:1*1mL /1*5mL /5*1mL /3*1mL+1*5mL /5*5mL 保存:2-8℃产品说明:CM Sepharose 6FF 是一种弱阳离子交换树脂,离子交换基团为-O-CH 2COO-,本产品以高交联的6%琼脂糖为介质,可耐受较高的流速及更高的化学稳定性,适合实验室及工业大规模纯化。
离子交换树脂广泛用于生物制药和生物工程下游蛋白质、核酸及多肽的分离纯化。
表1:介质性能参数基质高度交联的6%琼脂糖微球离子交换类型弱阳离子离子载量约0.09-0.13mmol H +/ml 介质粒径(μm)45-165建议流速300-600cm/hpH 稳定范围4-13储存缓冲液20%乙醇纯化流程:1、Buffer 的准备所用水和缓冲液在使用之前建议用0.22μm 或0.45μm 滤膜过滤。
所使用的平衡液和洗脱液,根据不同离子交换填料自行选择基。
本原则是低盐上样,高盐洗脱。
2、样品准备样品在上样前建议离心或用0.22μm 或0.45μm 滤膜过滤,减少杂质,提高蛋白纯化效率和防止堵塞柱子。
3、样品纯化预装柱产品,可以用各种常规的中低压色谱系统,以AKTA 仪器使用为例介绍CM Sepharose 6FF 预装柱使用方法。
1)水洗:将泵管道中注满去离子水。
去掉上塞子,将层析柱连接至色谱系统中。
再折断下口,将预装柱接到色谱系统中,并旋紧。
用3-5倍柱体积的去离子水冲洗出存储缓冲液。
2)平衡:使用至少5倍柱床体积的平衡液平衡色谱柱。
3)上样:利用泵或样品环上样。
注:样品的粘度增加使得即使上样体积很少,也会导致层析柱很大的反压。
上样量不要超过柱子的结合能力。
大量的样品体积也可能造成很大的反压,使得进样器更难使用。
4)洗杂:用洗杂液冲洗柱子,直到紫外吸收达到一个稳定的基线(一般至少10-15个柱体积),洗杂流速与平衡时一致即可。
5)洗脱:用洗脱液采用一步法或线性梯度洗脱。
蓝胶亲和介质BlueQZT6FF产品说明书

蓝胶亲和介质(Blue QZT 6FF)产品说明书1. 产品简介蓝胶亲和介质广泛用于白蛋白、干扰素、脂蛋白、凝血因子和激酶、脱氢酶等需要NAD+和NADH+辅助因子的酶的分离纯化。
Blue QZT 6FF亲和介质以自制的琼脂糖凝胶为基质,以Cibacron Blue 3G为配基,具有很高的物理化学稳定性,配基不易脱落,寿命长,应用广泛。
2. 产品特性3. 应用Blue QZT 6FF亲和介质广泛用于白蛋白、干扰素、脂蛋白、凝血因子和激酶、脱氢酶等需要NAD+和NADH+辅助因子的酶的分离纯化。
层析操作通常包括装柱、平衡、进料、淋洗、洗脱、再生等步骤。
平衡:用5~10CV的平衡缓冲液(20 mM PB,pH 7.0)平衡层析柱,至流出液电导和pH不变(与平衡液一致)。
进料:样品缓冲液应尽可能与平衡液一致。
固体样品可用平衡液溶解配制;低浓度样品溶液可用平衡液透析;高浓度样品溶液可用平衡液稀释。
为了避免堵塞层析柱,样品应经离心或微滤(0.45μm)处理。
进料量根据介质的载量和料液中目标蛋白的含量计算。
淋洗:上样完毕后继续用平衡缓冲液淋洗至基线。
洗脱:用洗脱缓冲液(20 mM PB+1M MgCl2(或KCl),pH 7.0)洗脱,收集流出液。
再生、原位清洗:介质使用数次(5-10次,具体次数与原料的种类和来源及实验要求有关)后,需要对介质进行再生、在位清洗。
(1)用0.1M的NaOH以40cm/h的速度清洗柱子3-5CV,然后用20%的乙醇清洗3CV,缓冲液洗到中性即可重复使用;(2)对疏水性结合的蛋白、脂蛋白和脂类物质,可用3~4 CV的70%乙醇或30%异丙醇清洗,并用3~10 CV的纯水冲洗。
其它注意事项:在装柱、使用和保存柱子的时候,要避免柱子流干,气泡进入;第1次使用时先用2M NaCl冲洗5CV,洗去残留的染料,平衡后即可使用。
具体的应用实例如下:蛋白:;层析介质:Blue QZT 6FF介质(CV=1.0 ml);对照介质:CV=1.0 ml, 国际领先品牌;样品:;平衡缓冲液:20 mM PB,pH 7.0;洗脱缓冲液:20 mM PB+1M MgCl2,pH 7.0;流速:0.5 ml/min。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Ni-琼脂糖凝胶6FF(His标签纯化树脂)预装重力柱说明书
货号:YA2410
规格:5mL/10mL/25mL(凝胶体积)
保存:4°C保存,有效期至少一年。
产品说明:
Ni NTA Beads6FF是以高度交联的6%琼脂糖凝胶为基质,配体与Ni NTA Beads相同,蛋白的载量可以大于40mg6×His-taggedprotein/ml介质;微球粒径为45–165μm。
Ni NTA Beads6FF除了可以耐受苛刻的试剂条件(多种还原剂、去污剂、高浓度变性剂等)外,因其耐压的基质,可以耐受最高0.3MPa的压力,更稳定,因此该产品更适合用于工业大规模蛋白的纯化,可以在相对较高的流速下,实现对目的蛋白的纯化。
本产品悬浮液为含20%乙醇的1×PBS,已螯合Ni2+。
操作方法:
1、样品制备
(1)细菌或酵母表达的蛋白
1)挑取单菌落到LB培养基中,根据载体使用说明加入相应浓度的诱导剂诱导相应的时间。
2)表达结束后,将培养液转移到离心杯中,7,000rpm,离心15min收集菌体,然后加入1/10体积的Lysis Buffer和PMSF,PMSF在破碎前加入,最终浓度为1mM。
加入溶菌酶(工作浓度为0.2-0.4mg/ml,如果表达的宿主细胞内含pLysS或pLysE,可以不加溶菌酶),(同时也可加入其他蛋白酶抑制剂,但不能影响目的蛋白与树脂的结合)。
3)将菌体沉淀悬浮起来,(如果菌液浓度高,也可考虑加入10μg/ml RNase A和5μg/ml DNase I),混匀,放置于冰上,然后冰上超声破碎细胞,至菌液基本保持澄清。
4)将澄清的破碎液转移至离心管中,10,000rpm下,4度离心20-30分钟。
取上清,置于冰上备用或-20℃保存。
(2)酵母、昆虫和哺乳细胞分泌表达可溶性蛋白
1)将细胞培养液转移至离心杯,5000rpm下,离心10min,收集菌体得上清,如上清中不含EDTA、组氨酸和还原剂等物质,即可直接加入柱子使用;如含有EDTA、组氨酸和还原剂等物质,需用1×PBS4℃下透
析才能加入柱子。
2)对于大量体积的上清,需加入硫酸氨沉淀浓缩后,蛋白还需用1×PBS4℃透析后才能加入柱子。
2、包涵体蛋白纯化(变性条件)
1)将培养液转移到离心杯中,7,000rpm,离心15min收集菌体,去掉上清。
2)按照菌体:Lysis buffer=1:10(W/V)将菌体悬浮起来,混匀,冰浴超声破碎。
3)将破碎液转移至离心管中,10,000rpm下,4度离心20-30分钟。
去掉上清,步骤2)和3)可以重复一次。
4)按照菌体:Lysis buffer(含8M尿素)=1:10(W/V)将包涵体悬浮起来。
5)变性条件下进行His标签蛋白纯化,具体缓冲液配方见表2。
3、样品纯化
1)Ni NTA Beads6FF装柱。
(该预装柱为重力柱不适合加压操作)
2)用3-5倍柱体积的去离子水冲洗出储存缓冲液。
3)使用至少5倍柱床体积的Lysis Buffer平衡柱子。
4)利用泵或注射器上样。
注:样品的粘度增加使得即使上样体积很少,也会导致层析柱很大的反压。
上样量不要超过柱子的结合能力。
大量的样品体积也可能造成很大的反压,使得进样器更难使用。
5)用Wash Buffer冲洗柱子,直到紫外吸收达到一个稳定的基线(一般至少10-15个柱体积)。
注:在样品和结合缓冲液中加入咪唑可以提高样品纯度。
6)用Elution Buffer采用一步法或线性梯度洗脱。
一步洗脱中,通常5倍柱体积洗脱液就足够了。
可以用一个小的梯度,例如20倍柱体积或更多,来分离不同结合强度的蛋白质。
填料清洗与再生:
1)去除强疏水结合的蛋白,脂蛋白和脂类
通过使用30%异丙醇清洗5-10个柱体积,接触时间为15-20分钟可以去除此类污染物。
然后,再使用10倍柱体积的去离子水清洗。
也可以选择使用含有去污剂的酸性或碱性溶液,清洗填料2倍柱体积。
例如,含有0.1–0.5%非离子去污剂的0.1M醋酸溶液,接触时间为1–2小时。
去污剂处理后,需要使用70%的乙醇清洗5个柱体积,以彻底去除去污剂。
最后使用10倍柱体积的去离子水清洗。
2)去除离子作用结
合的蛋白使用1.5M NaCl溶液接触时间为10-15分钟清洗。
然后,再使用去离子水清洗10个柱体积。
2)填料再生
组氨酸标签蛋白亲和纯化填料所带的镍离子不需要经常螯合去除和重新挂镍离子。
当填料使用过程中发现反压过高,填料上面出现明显的污染,或者填料载量明显变低时,需要进行对填料进行镍离子剥离和重新挂镍离子,也就是填料再生。
将填料装填在合适的层析柱内,按照下面步骤:
1)使用0.2M醋酸溶液(含6M GuHCl)清洗2倍柱体积;2)使用去离子水清洗5倍柱体积;3)使用2%SDS清洗3倍柱体积;
4)使用去离子水清洗5倍柱体积;5)使用乙醇清洗5倍柱体积;6)使用去离子水清洗5倍柱体积;7)使用100mM EDTA(pH8.0)清洗5倍柱体积;8)使用去离子水清洗5倍柱体积;9)使用100mM NiSO4清洗5倍柱体积;10)使用去离子水清洗10倍柱体积;填料再生后,可以立即使用,如不立即使用,需要将填料悬浮于等体积的20%乙醇中,置于4℃保存。
表1可溶性组氨酸标签蛋白纯化所需缓冲液及配方
名称体积配方
Lysis Buffer1L50mM NaH2PO4(7.80g NaH2PO4·2H2O)
300mM NaCl(17.54g NaCl)
10mM imidazole(0.68g imidazole)
使用NaOH溶液调节pH至8.0,使用0.22或者0.45μm滤膜过滤除菌。
Wash Buffer1L50mM NaH2PO4(7.80g NaH2PO4·2H2O)
300mM NaCl(17.54g NaCl)
20mM imidazole(1.36g imidazole)
使用NaOH溶液调节pH至8.0,使用0.22或者0.45μm滤膜过滤除菌。
Elution Buffer1L50mM NaH2PO4(7.80g NaH2PO4·2H2O)
300mM NaCl(17.54g NaCl)
250mM imidazole(17.0g imidazole)
使用NaOH溶液调节pH至8.0,使用0.22或者0.45μm滤膜过滤除菌。
表2包涵体组氨酸标签蛋白纯化所需缓冲液及配方
名称体积配方
Lysis Buffer1L8M Urea(480.50g urea)
100mM NaH2PO4(15.60g NaH2PO4·2H2O)
100mM Tris·HCl(15.76g Tris·HCl)
使用盐酸溶液调节pH至8.0,使用0.22或者0.45μm滤膜过滤除菌。
Wash Buffer1L8M Urea(480.50g urea)
100mM NaH2PO4(15.60g NaH2PO4·2H2O)
100mM Tris·HCl(15.76g Tris·HCl)
使用盐酸溶液调节pH至6.3,使用0.22或者0.45μm滤膜过滤除菌。
Elution Buffer1L8M Urea(480.50g urea)
100mM NaH2PO4(15.60g NaH2PO4·2H2O)
100mM Tris·Cl(15.76g Tris·Cl)
使用盐酸溶液调节pH至4.5,使用0.22或者0.45μm滤膜过滤除菌。
