材料科学基础作业(分章)
材料科学基础章作业参考答案.
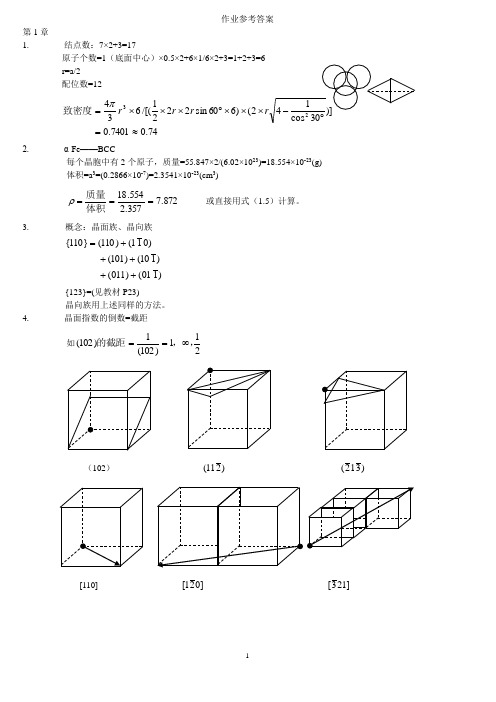
作业参考答案第1章1. 结点数:7×2+3=17原子个数=1(底面中心)×0.5×2+6×1/6×2+3=1+2+3=6r=a/2配位数=1274.07401.02()660sin2221/[(6343≈=⨯⨯⨯︒⨯⨯⨯=rrrπ致密度2. α-Fe——BCC每个晶胞中有2个原子,质量=55.847×2/(6.02×1023)=18.554×10-23(g)体积=a3=(0.2866×10-7)=2.3541×10-23(cm3)872.7357.2554.18===体积质量ρ或直接用式(1.5)计算。
3.概念:晶面族、晶向族)101()011()110()101()011()110(}110{+++++={123}=(见教材P23)晶向族用上述同样的方法。
4. 晶面指数的倒数=截距如211)102(1)102(,,的截距∞==(102))211()312( [110] ]021[]213[5.晶向指数:]101[和]011[6.7.8. 9. (略,不要求) 10.设晶格常数为a22100a =)面密度(785.048210022==⨯=ππr r )面致密度( 222110a=)面密度(555.02428211022==⨯=ππrr )面致密度(2234321111a r ==)面密度(906.03232111122==⨯=ππr r )面致密度( 11. (略,不要求)12. (略,不要求) 13. 6/2+12/4=614.立方晶系晶面间距计算公式:)011()110()112(]011[]2[]111[222lk h na d ++=① )nm (143.0286.02100121222100=⨯=++=ad)nm (202.0286.021011222110=⨯=++=a d)nm (0764.0286.0141321222123=⨯=++=a d②)nm (1825.0365.02100121222100=⨯=++=ad)nm (2107.0365.031111222111=⨯=++=a d)nm (09125.0365.042121121222112=⨯=++=ad③(略,不要求)15. (略,不要求) 16. (略,不要求)一、 单项选择题。
(完整版)材料科学基础第1-2章作业及解答彭

第一章作业——材料结构的基本知识1、简述一次键与二次键的差异及各键的特点。
2、简述三大类材料中的结合键类型及性能(物性、力性)特点。
3、为什么金属材料的密度比陶瓷材料及高分子材料密度高?4、用金属键的特征解释金属材料的性能-----①良好的导电;②良好的导热性;③正的电阻温度系数;④不透明性及具有金属光泽;⑤良好的塑性⑥金属之间的溶解性(固溶能力)。
5、简述晶体与非晶体的主要区别。
6、简述原子结构、原子结合键、原子的排列方式及显微组织对材料性能的影响。
第一章作业解答1、述一次键与二次键的差异及各键的特点。
解答:(1)一次键结合力较强,包括金属键、离子键、共价键;二次键结合力较弱,包括范德华键和氢键。
一次键主要依靠外壳层电子转移或共享以形成稳定的电子壳层;二次键是借原子之间的偶极吸引力结合而成。
(2)金属键电子共有化,没有方向性和饱和性;离子键没有方向性,但要满足正负电荷平衡要求;共价键有明显的方向性和饱和性;范德华键没有方向性、饱和性;氢键(X-H…Y)有饱和性、方向性。
2、简述三大类材料中的结合键类型及性能(物性、力性)特点。
解答:(1)三大类材料主要指金属材料、陶瓷材料和高分子材料。
(2)金属材料中的结合键主要是金属键,其次是共价键、离子键,使金属材料具有较高的熔点、密度,良好的导电、导热性能及较高的弹性模量、强度和塑性。
陶瓷材料中的结合键主要是离子键和共价键,使其熔点高、密度低,具有良好的绝缘性能和绝热性能,高的弹性模量和强度,但塑性差,脆性大。
高分子材料中分子链内部虽为共价键结合,但分子链之间为二次键结合,使其具有较低的熔点、密度,良好的绝缘性能、绝热性能及较低的弹性模量、强度和塑性。
3、为什么金属材料的密度比陶瓷材料及高分子材料密度高?金属材料的密度较高是因为①金属元素具有较高的相对原子质量,②金属材料主要以金属键结合,金属键没有方向性和饱和性,使金属原子总是趋于密集排列,达到密堆结构。
材料科学基础课后作业及答案(分章节)

材料科学基础课后作业及答案(分章节)第一章8.计算下列晶体的离于键与共价键的相对比例(1)NaF (2)CaO (3)ZnS 解:1、查表得:XNa=,XF= 根据鲍林公式可得NaF中离子键比例为:[1?e共价键比例为:%=% 2、同理,CaO中离子键比例为:[1?e共价键比例为:%=% 12?(?)412?(?)4]?100%?% ]?100%? % 23、ZnS中离子键比例为:ZnS 中离子键含量?[1?e?1/4(?)]?100%?% 共价键比例为:%=% 10说明结构转变的热力学条件与动力学条件的意义.说明稳态结构与亚稳态结构之间的关系。
答:结构转变的热力学条件决定转变是否可行,是结构转变的推动力,是转变的必要条件;动力学条件决定转变速度的大小,反映转变过程中阻力的大小。
稳态结构与亚稳态结构之间的关系:两种状态都是物质存在的状态,材料得到的结构是稳态或亚稳态,取决于转交过程的推动力和阻力(即热力学条件和动力学条件),阻力小时得到稳态结构,阻力很大时则得到亚稳态结构。
稳态结构能量最低,热力学上最稳定,亚稳态结构能量高,热力学上不稳定,但向稳定结构转变速度慢,能保持相对稳定甚至长期存在。
但在一定条件下,亚稳态结构向稳态结构转变。
第二章1.回答下列问题:(1)在立方晶系的晶胞内画出具有下列密勒指数的晶面和晶向:(001)与[210],(111)与[112],(110)与[111],(132)与[123],(322)与[236](2)在立方晶系的一个晶胞中画出晶面族各包括多少晶面?写出它们的密勒指数。
[1101]4.写出六方晶系的{1012}晶面族中所有晶面的密勒指数,在六方晶胞中画出[1120]、晶向和(1012)晶面,并确定(1012)晶面与六方晶胞交线的晶向指数。
5.根据刚性球模型回答下列问题:(1)以点阵常数为单位,计算体心立方、面心立方和密排六方晶体中的原子半径及四面体和八面体的间隙半径。
《材料科学基础》作业

摘一支轻雨,铺一笺墨迹,在灯火阑珊处窥探一叶棂窗,熟悉的倩影淡淡一笑,倾城了岁月的柔情,暖雨中蜜意了情侣的梦香。
一杯轻风,半壶墨迹。
捧着安静的角落,独饮墨香,留韵素白。
轻风拂过,开满了一园禅意,一片樱花。
轻风缓缓,墨香袭袭。
长长的倩影里,柔软了风韵的味律,洒脱的静悟中遥远变成了传说,把爱定格在一瞬间。
这第一段似乎是着重描摹春的美丽,可起首有“多事的东风”一句,暗示着有人恼春,于是有个人物忽悠地闪了一下,桃红“醉依在封姨的臂弯里”,一下子就不见了。
但“多事”里隐蕴着的愠意,因封姨的出现有了着落。
春天写足了,那位对春天怀着恨意的人物便在作者的笔下十分不情愿地亮相了。
“只有一个孤独的影子,她,倚在栏杆上,”这就是封姨了,她“才从青春之梦醒过来”,茫然不解这眼前发生的一切。
作者笔下的她原来是一个芳华已失的女人!眼前的春天只是她过去的影子。
《材料科学基础》作业-答案全

绪论一、填空题1、材料科学主要研究的核心问题是结构和性能的关系。
材料的结构是理解和控制性能的中心环节,结构的最微细水平是原子结构,第二个水平是原子排列方式,第三个水平是显微组织。
2. 根据材料的性能特点和用途,材料分为结构材料和功能材料两大类。
根据原子之间的键合特点,材料分为金属、陶瓷、高分子和复合材料四大类。
第一章材料的原子结构一、填空题1. 金属材料中原子结合以金属键为主,陶瓷材料(无机非金属材料)以共价键和离子键结合键为主,聚合物材料以共价键和氢键以及范德华键为主。
第二章材料的结构一、填空题1、晶体是基元(原子团)以周期性重复方式在三维空间作有规则的排列的固体。
2、晶体与非晶体的最根本区别是晶体原子排布长程有序,而非晶体是长程无序短程有序。
3、晶胞是晶体结构中的最小单位。
4、根据晶体的对称性,晶系有三大晶族,七大晶系,十四种布拉菲Bravais点阵,三十二种点群,230种空间群。
5、金属常见的晶格类型有体心立方、面心立方、密排六方。
6、fcc晶体的最密排方向为<110>,最密排面为{111},最密排面的堆垛顺序为ABCABCABCABC……。
7、fcc晶体的致密度为0.74,配位数为12,原子在(111)面上的原子配位数为6。
8、bcc晶体的最密排方向为<111>,最密排面为{110},致密度为0.68,配位数为8。
9、晶体的宏观对称要素有对称点、对称轴、对称面。
10、CsCl型结构属于简单立方格子,NaCl型结构属于面心立方格子,CaF2型结构属于面心立方格子。
11、MgO晶体具有NaCl型结构,其对称型是3 L44L36L29PC,晶族是高级晶族,晶系是立方晶系,晶体的键型是离子键。
12、硅酸盐晶体结构中的基本结构单元是硅氧四面体[SiO4]。
?13、几种硅酸盐晶体的络阴离子分别为[Si2O7]6-、[Si2O6]4-、[Si4O10]4-、[AlSi3O8]1-,它们的晶体结构类型分别为组群状,链状,层状,和架状。
分章作业题

分章作业题材料科学基础参考答案材料科学基础第一次作业1.举例说明各种结合键的特点。
⑴金属键:电子共计化,并无饱和状态性,并无方向性,趋向构成高能量的密堆结构,金属受力变形时不能毁坏金属键,较好的延展性,通常具备较好的导电和导热性。
⑵离子键:大多数盐类、碱类和金属氧化物主要以离子键的方式结合,以离子为结合单元,无方向性,无饱和性,正负离子静电引力强,熔点和硬度均较高。
常温时良好的绝缘性,高温熔融状态时,呈现离子导电性。
⑶共价键:存有方向性和饱和状态性,原子共用电子对,配位数比较大,融合稳固,具备结构平衡、熔点低、质硬脆等特点,导电能力差。
⑷范德瓦耳斯力:并无方向性,并无饱和状态性,包含静电力、诱导力和色散力。
融合较差。
⑸氢键:极性分子键,存在于hf,h2o,nf3有方向性和饱和性,键能介于化学键和范德瓦尔斯力之间。
2.在立方晶体系的晶胞图中画出以下晶面和晶向:(102)、(11-2)、(-21-3),[110],[11-1],[1-20]和[-321]。
(213)(112)[110](102)[321][120][111]3.写出六方晶系的{11-20},{10-12}晶面族和<2-1-10>,晶向族中各等价晶面及等价晶向的具体指数。
{1120}的等价晶面:(1120)(2110)(1210)(1120)(2110)(1210){1012}的等价晶面:(1012)(1102)(0112)(1012)(1102)(0112)(1012)(1102)(0112)(1012)(1102)(0112)2110的等价晶向:[2110][1210][1120][2110][1210][1120]?1011?的等价晶向:[1011][1101][0111][0111][1101][1011][1011][1101][0111][0111][1101][1011]4立方点阵的某一晶面(hkl)的面间距为m错误!未找到引用源。
(完整版)材料科学基础习题及答案
第一章材料的结构一、解释以下基本概念空间点阵、晶格、晶胞、配位数、致密度、共价键、离子键、金属键、组元、合金、相、固溶体、中间相、间隙固溶体、置换固溶体、固溶强化、第二相强化.二、填空题1、材料的键合方式有四类,分别是(),( ),(),().2、金属原子的特点是最外层电子数(),且与原子核引力(),因此这些电子极容易脱离原子核的束缚而变成( )。
3、我们把原子在物质内部呈( )排列的固体物质称为晶体,晶体物质具有以下三个特点,分别是(),( ),( ).4、三种常见的金属晶格分别为(),( )和().5、体心立方晶格中,晶胞原子数为( ),原子半径与晶格常数的关系为( ),配位数是(),致密度是( ),密排晶向为(),密排晶面为( ),晶胞中八面体间隙个数为(),四面体间隙个数为( ),具有体心立方晶格的常见金属有()。
6、面心立方晶格中,晶胞原子数为( ),原子半径与晶格常数的关系为(),配位数是( ),致密度是(),密排晶向为( ),密排晶面为(),晶胞中八面体间隙个数为( ),四面体间隙个数为(),具有面心立方晶格的常见金属有()。
7、密排六方晶格中,晶胞原子数为(),原子半径与晶格常数的关系为(),配位数是(),致密度是(),密排晶向为( ),密排晶面为(),具有密排六方晶格的常见金属有( )。
8、合金的相结构分为两大类,分别是()和( )。
9、固溶体按照溶质原子在晶格中所占的位置分为()和(),按照固溶度分为()和(),按照溶质原子与溶剂原子相对分布分为()和()。
10、影响固溶体结构形式和溶解度的因素主要有()、()、()、()。
11、金属化合物(中间相)分为以下四类,分别是( ),( ),( ),( )。
12、金属化合物(中间相)的性能特点是:熔点()、硬度( )、脆性(),因此在合金中不作为()相,而是少量存在起到第二相()作用。
13、CuZn、Cu5Zn8、Cu3Sn的电子浓度分别为(),( ),( ).14、如果用M表示金属,用X表示非金属,间隙相的分子式可以写成如下四种形式,分别是( ),(),( ),( ).15、Fe3C的铁、碳原子比为(),碳的重量百分数为(),它是( )的主要强化相。
《材料科学基础》各章习题
图2-1 第一章 金属的晶体结构1. 试证明四方晶系中只有简单四方和体心四方两种点阵类型。
2. 为什么密排六方结构不能称作为一种空间点阵?3. 标出面心立方晶胞中(111)面上各点的坐标,并判断]101[是否位于(111)面上,然后计算]101[方向上的线密度。
4. 标出具有下列密勒指数的晶面和晶向:a) 立方晶系)421(,)231(,)130(,[]112,[]311;b) 六方晶系 )1112(,)0111(,)2123(,]1112[,]1321[。
5. 在立方晶系中画出{}111晶面族的所有晶面,并写出{123}晶面族和﹤221﹥晶向族中的全部等价晶面和晶向的密勒指数。
6. 在立方晶系中画出以]001[为晶带轴的所有晶面。
7. 试证明在立方晶系中,具有相同指数的晶向和晶面必定相互垂直。
8. 已知纯钛有两种同素异构体,低温稳定的密排六方结构Ti -α和高温稳定的体心立方结构Ti -β,其同素异构转变温度为882.5℃,计算纯钛在室温(20℃)和900℃时晶体中(112)和(001)的晶面间距(已知a a 20℃=0.2951nm, c a 20℃=0.4679nm, a β900℃=0.3307nm )。
9. 试计算面心立方晶体的(100),(110),(111)等晶面的面间距和面致密度,并指出面间距最大的面。
10. 平面A 在极射赤平面投影图中为通过NS 极和点0°N ,20°E 的大圆,平面B 的极点在30°N ,50°W处,a)求极射投影图上两极点A 、B 间的夹角;b)求出A绕B 顺时针转过40°的位置。
11. a)说明在fcc 的(001)标准极射赤面投影图的外圆上,赤道线上和0°经线上的极点的指数各有何特点?b)在上述极图上标出)101(、)011(、)112(极点。
12. 由标准的(001)极射赤面投影图指出在立方晶体中属于[110]晶带轴的晶带,除了已在图2-1中标出晶面外,在下列晶面中那些属于[110]晶带?)212(),231(),131(),210(),211(。
北京科技大学材料科学基础(金属学)作业
北京科技大学材料科学基础(金属学)作业第一章概论作业1.金属学及其主要研究内容是什么?2. 材料的组织和结构分别指什么?第二章金属和合金的固态结构(第一节、第二节)作业1. 分别计算体心立方(bcc)和密集六方(hcp)结构时原子所占体积和空位所占体积的百分数?(第三节)作业1. 单胞的特征参数指的是什么?其中点阵常数是哪些?2. 对于四方晶系,只有简单四方和体心四方两种空间点阵。
请说明四方晶系的底心化和面心化都不构成新的空间点阵。
3. 说明空间点阵与晶体点阵的区别与联系?4. 在单胞中画出(010)、(110)、(121)和(312)晶面,画出[111]、 [123]、[ 1 10]和[211]晶向。
5. 用四轴坐标系画出六方晶系的(1120)、(1012)、(1011)晶面及[1120]、[2113]、[3125]晶向。
第四节金属和合金中原子间的结合第五节金属和合金的晶体结构类型1. 假定发生晶体结构变化时,体积保持不变,计算同一种金属呈简单立方结构和面心立方结构时,原子半径之比:r简单/r 面心。
2. 画出一个六方晶系的单胞,并标出点阵参数及相互关系?3. 六方晶系中,只有简单六方一种平移点阵,怎样认识密排六方?4. 合金中的相的结构类型有哪些?第六节固溶体第七节结构缺陷1. 影响固溶体固溶度的主要因素是什么?2. 合金形成超结构或超点阵指什么?3. 晶体中缺陷的类型及主要特征?4. 分别说明刃型位错和螺型位错的柏氏矢量与位错线的关系?5. 位错与点缺陷的相互作用怎样?第三章金属及合金的相图1什么是相图、相律、自由度?2.简述二元共晶型和包晶型三相反应。
3.相区的邻接关系是什么?4.写出三元系平衡相的定量法则―杠杆定律与重心法则。
第四章金属及合金的凝固与组织作业第一节凝固概论作业1.试说明过冷度与亚稳极限。
2.试推导均匀形核情况下的临界晶核尺寸。
3.简述决定晶体成长的内外因素及规律。
4.晶体的成长有哪几种机理?5.怎样的情况下凝固组织中易出现树枝晶?第二、三、四节作业1.理解组成过冷的概念。
材料科学基础1-8章例题、作业题及其解答
第2章 例 题(A )1. 在面心立方晶胞中画出[012]和[123]晶向。
2. 在面心立方晶胞中画出(012)和(123)晶面。
3. 右图中所画晶面的晶面指数是多少?4. 设晶面(152)和(034)属六方晶系的正交坐标表述,试给出其四轴坐标的表示。
反之,求(3121)及(2112)的正交坐标的表示。
5. (练习),上题中均改为相应晶向指数,求相互转换后结果。
答案:2. (2110) 4. (1562), (0334) 5. [1322] [1214] (123) (212)[033] [302]第2章 例题答案(A)4. (152))2615(6)51()(⇒-=+-=+-=v u t (034))4303(3)30()(⇒-=+-=+-=v u t (1213)⇒ (123) (2112) ⇒ (212)5. [152]]2231[22)51(31)(313)152(31)2(311)512(31)2(31⇒⎪⎪⎪⎭⎪⎪⎪⎬⎫==-=+-=+-==-⨯=-=-=-⨯=-=W w V U t U V v V U u [034]]4121[41)30(31)(312)032(31)2(311)302(31)2(31⇒⎪⎪⎪⎭⎪⎪⎪⎬⎫==-=+-=+-==-⨯=-=-=-⨯=-=W w V U t U V v V U u]3121[]033[33)1(20)1(1⇒⎪⎭⎪⎬⎫===--=-==---=-=w W t v V t u U[2112]]302[20)1(13)1(2⇒⎪⎭⎪⎬⎫===---=-==--=-=w W t v V t u U第2章 例 题(B )1. 已知Cu 的原子直径为2.56A ,求Cu 的晶格常数,并计算1mm 3Cu 的原子数。
2. 已知Al 相对原子质量Ar (Al )=26.97,原子半径γ=0.143nm ,求Al 晶体的密度。
3. bcc 铁的单位晶胞体积,在912℃时是0.02464nm 3;fcc 铁在相同温度时其单位晶胞体积是0.0486nm 3。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
材料科学基础作业第一章材料科学概论1.氧化铝既牢固又坚硬而且耐磨,为什么不用来制造榔头?[答]因为Al2O3的耐震性不佳,且脆性较高,故不适合做榔头的材料。
2.将下列材料按金属、陶瓷、聚合物或复合材料进行分类:黄铜、氯化钠、环氧树脂、混凝土、镁合金、玻璃钢、沥青、碳化硅、铅-锡焊料、橡胶、纸杯[答]金属有黄铜、铅-锡焊料、镁合金。
陶瓷有氯化钠、碳化硅。
聚合物有环氧树脂、橡胶、沥青、纸杯。
复合材料有混凝土、玻璃钢。
3.下列用品选材时,哪些力学性能和物理性能具有特别重要性:汽车曲柄轴、电灯泡灯丝、剪刀、汽车挡风玻璃、电视机荧光屏[答]汽车曲柄轴的疲劳寿命最为重要。
电灯泡灯丝的熔点需高,其发光力要强。
剪刀的刀刃的硬度要强。
汽车挡风玻璃的光的穿透性要强。
电视机荧光屏光学的颜色及其他穿透性各种光学特性极重要。
4. 什么是纳米材料?纳米材料有哪些效应?请举例说明。
[答] 通常把粒子尺寸小于0.1μm(10nm)的颗粒称为纳米材料纳米材料有以下效应:⑴小尺寸效应⑵表面效应⑶量子尺寸效应⑷宏观量子隧道效应举例略第二章原子结构1.原子序数为12的Mg有三个同位素:78.70%的Mg原子有12个中子,10.13%的Mg原子有13个中子,11.17%的Mg原子有14个中子,计算Mg的原子量。
[答]M = 0.7870×(12+12)+0.1013×(12+13)+0.1117×(12+14) = 24.3247 g/mol2.试计算原子N壳层内的最大电子数,若K、L、M和N壳层中所有的能级都被填满,试确定该原子的原子序数。
[答]N壳层内最大电子数为2×42= 32。
但考虑能级交错:N壳层内刚刚达到最大电子数时的电子排布为:1s22s22p63s23p64s23d104p65s24d105p66s24f14,该原子的原子数为70。
(本题目书上原解:N壳层中电子最多有2+6+10+14 = 32个,K、L、M、N壳层中电子共有2+8+18+32 = 60个,故原子序数为60。
)3.试计算原子O壳层内的最大电子数,并定出K、L、M、N和Q壳层中所有能级都被填满时的原子序数。
[答]O壳层内最大电子数为2×52 = 50。
但考虑能级交错:O壳层内刚刚达到最大电子数时的电子排布为:1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d105g18,该原子的原子数为130。
(本题目书上原解:O壳层中电子最多有2+6+10+14+18 = 50个,K、L、M、N、O壳层中电子共有2+8+18+32+50 = 110个,故原子序数为110。
)4.试说明四种原子结合力并举例说明。
[答]金属键:由金属中的自由电子与金属正离子相互作用所构成的键合称为金属键。
其基本特点是电子的共有化,无饱和性,无方向性。
例如:Hg、Al、Fe、W。
离子键:金属原子将最外层家电子给予非金属原子成为带正电的正离子,非金属原子得到价电子后成为带负电的负离子,正负离子依靠静电引力结合在一起。
其基本特点是以离子而不是以原子为结合单元。
大多数盐类、碱类和金属氧化物主要以离子键的方式结合,例如:NaCl、MgO。
共价键:共价键是由两个或多个电负性相差不大的原子间通过共用电子对而形成的化学键。
共价键有方向性和饱和性。
氢分子中两个氢原子的结合是最典型的共价键。
其它例如:Si、C(金刚石)。
范德华(Van der Waals)力:包括静电力、诱导力和色散力,没有方向性和饱和性。
例如:Ar、Cl2。
P36 习题2. ⑴1s22s22p63s23p63d74s2过渡元素Co⑵1s22s22p63s23p6 惰性元素Ar⑶1s22s22p5 卤素元素F⑷1s22s22p63s2碱土元素Mg⑸1s22s22p63s23p63d24s2 过渡元素Ti⑹1s22s22p63s23p64s1碱金属K3. 镧系稀土族元素的电子排列特点是1s22s22p63s23p63d104s24p64d104f1~145s25p66s2,这些元素的核外电子依次填入4f态,而外层电子数没有变化,因此这些元素具有几乎相同的化学性质,将他们划为一组元素而放入周期表的一格。
5. 氢键的本质与范德华力一样,也是靠原子(或分子、原子团)的偶极吸引力结合起来的,但是氢键中氢原子起了关键作用。
当H原子与一个电负性很强的原子(或原子团)结合成分子时,氢原子的一个电子转移至该原子壳上;分子的氢离子则实质上是裸露的质子,对另一个电负性很强的原子表现出吸引,这样氢原子便将两个电负性很强的原子结合起来,形成氢键。
6. 1)金属元素有较高的相对原子质量2)金属键的结合方式没有方向性,所以金属原子总是趋于密集排列,得到原子排列结构;而对于共价键,相邻原子的个数要受到共价键树木的限制,离子键结合,则要满足正、负离子间电荷平衡的要求。
9. 单相组织是指具有单一相的组织,即所有的晶粒的化学组成相同,晶体结构也相同。
两相组织指具有两相,两个相的晶粒尺度不同。
采用金相显微镜或电子显微镜才能观测清楚晶粒的形貌特征,称为显微组织。
显微组织是材料的四级结构,主要随组成和加工工艺而变化,它是影响材料机械性能的重要因素。
材料的组织包括粒径的大小、形状、分布及其相对量等特征,比如单相多晶材料的强度很低,而多相组织可以增加弥散相的个数,大幅提高材料的强度。
11.原子结构(一级结构)决定了原子的结合方式,并影响材料的化学、物理性质。
原子结合键(二级结构)决定了结合力的大小,并影响材料的物理和力学性能。
原子排列方式(三级结构)决定了材料的形态,影响材料的物理力学性能,并与加工工艺有关。
显微组织结构(四级结构)决定了材料机械性能如强度、塑性等、主要由加工工艺来决定。
第三章 固体材料的晶体结构1. 面心立方镍的原子半径是1.243 Å,试计算:(a )镍的点阵参数,(b )镍的密度。
[答] (a)-80 3.516A =3.51610 cm a ===⨯。
(b )33-832304458.718.977 g /cm (3.51610) 6.0210A M a N ρ⨯⨯===⨯⨯⨯⨯2. 体心立方钼的点阵参数是3.1468 Å,试计算钼的原子半径。
[答]-800 3.1468A =1.3626A =1.362610 cm 44a r a =⇒==⨯。
3. 铬的点阵参数是2.8844 Å,密度是7.19 g/cm 3,通过适当计算确定铬是简单立方、体心立方还是面心立方结构。
[答] 383230307.19(2.884410) 6.02101.99752()52A A a N n M n a N M ρρ-⨯⨯⨯⨯⨯=⇒===≈⨯ 所以铬为面心立方结构。
4. 试确定图中所示方向的密勒指数。
[答]方向A:0,1,1 → 1,0,1 = -1,1,0,故为[110];方向B:0,1,0 → 1,0,1 = -1,1,-1,故为[111];方向C:1,0,1/2 → 1/2,1,0 = 1/2,-1,1/2,故为[121];方向D:0,1,1/2 → 1,0,0 = -1,1,1/2,故为[221]。
方向A:0,0,1 → 1,1,1 = -1,-1,0,故为[110];方向B:1,2/3,0 → 0,0,1 = 1,2/3,-1,故为[323];方向C:1/2,0,0 → 1,1,3/4 = -1/2,-1,-3/4,故为[243];方向D:1/2,1,1 → 0,1,0 = 1/2,0,1,故为[102]。
5.在立方系中绘出{110}、{111}晶面族所包括的晶面以及(112)、(120)的晶面。
[答]{110}(110)(110)(110)(110)(101)(101)(101)(101)(011)(011)(011)(011)=(图略)={111}(111)(111)(111)(111)(111)(111)(111)(111)(图略)(图略)(图略)6.试比较间隙固溶体、间隙相和间隙化合物的结构和性能特点。
[答]间隙固溶体:溶质原子分布于溶剂晶格间隙而形成的固溶体成为间隙固溶体。
当溶质原子半径很小,使溶质与溶剂的原子半径差Δr > 41%时,溶质原子就可能进入溶剂晶格间隙中而形成间隙固溶体。
溶质原子通常是原子半径小于0.1 mm的一些非金属元素。
溶质原子引起溶剂点阵畸变,点阵常数变大,畸变能升高。
因此,间隙固溶体都是有限固溶体,而且溶解度很小。
原子半径较小的非金属元素如C,H,N,B等可与金属元素(主要是过度族金属)形成间隙相或间隙化合物。
这主要取决于非金属(X)和金属(M)原子半径的比值r X/r M;当r X/r M < 0.59时,形成具有简单晶体结构的相,称为间隙相;当r X/r M > 0.59时,形成具有复杂晶体结构的相,通常称为间隙化合物。
间隙相具有比较简单的晶体结构,如FCC,HCP,少数为BCC或简单六方结构,与组元的结构均不相同。
间隙相可以用化学分子式表示。
间隙相不仅可以溶解其组成元素,而且间隙相之间还可以相互溶解。
间隙相中原子间结合键为共价键和金属键,即使大于非金属组元的原子数分数大于50%时,仍具有明显的金属特性,而且间隙相具有极高的熔点和硬度,同时其脆性也很大,是高合金钢和硬质合金中的重要强化相。
间隙化合物的晶体结构都很复杂,原子间结合键位共价键和金属键。
间隙化合物也具有很高的熔点和硬度,脆性较大,也是钢中重要的强化相之一。
但与间隙相相比,间隙化合物的熔点和硬度以及化学稳定性都要低一些。
7.简述陶瓷材料的相组成及常见相结构。
[答]陶瓷材料中的相组成较为复杂,常见的相有晶相、玻璃相和气相。
它们对陶瓷性能都有很大影响。
晶相是陶瓷材料的主要组成相,常见结构有氧化物结构和硅酸盐结构。
氧化物结构包括AB型结构(NaCl型)、AB2型结构(金红石型)、A2B3型结构(刚玉型)以及其它一些结构。
硅酸盐的结构特点是硅、氧离子组成四面体,硅离子位于四面体中心。
硅氧四面体SiO44-之间又以共有顶点的氧离子相互连接起来。
由于连接方式不同而形成多种硅酸盐结构,如岛状、环状、链状和层状等。
玻璃相是在陶瓷烧结时形成的一种非晶态物质,其结构是由离子多面体(如硅氧四面体)构成的无规则排列的空间网络,如非晶态石英的结构。
玻璃相热稳定性差,在较低温度下即开始软化。
玻璃相的作用是粘结分散的晶相、降低烧结温度、抑制晶相的粗化。
气相是指陶瓷中的气孔,它是在陶瓷生产过程中形成并被保留下来的。
气孔的存在降低了陶瓷的密度,能吸收震动,并进一步降低了导热系数。
但也导致陶瓷强度下降,介电损耗增大,绝缘性降低。
