2023年中考化学专题复习-与化学方程式有关的计算
2023年中考化学复习之再探化学方程式的计算课件

68 x
2H2O+ O2
32
1.6g
32 1.6g
x=3.4g
3.4g
答该:溶该液溶的液质中 量过为氧: 1化0氢%的X%溶10液0质=g量34为34g.
不纯量的计算:
【感悟一】
由于化学方程式中的每一种物质指的都是纯 净物,因而在分析数据时,一定要找准与化 学方程式相对应的纯净物的已知量或未知量 。遇到不纯物时一定要转换成纯物质 的质量 ,才能进行化学方程式的计算。
48 4=8g
80 x
48g×80
x=
=80 g
48
答:生成氧化镁80g。
【活动二】过量的计算
2、48g镁在48g氧气中充分反应,可生成氧化镁的
质量为多少?
解: 48g镁对应参加反应的氧气质量为x
2Mg + O2 点燃
2MgO
48 32
因为32g<48g
48g X
48
48g
所以O2过量,则生成MgO= 48g +32g=80g
不纯量的计算:
【感悟二】 化学反应的计算中,经常需要根据不纯量把生成
气体的质量求出代入化学方程式,气体质量的求算
经常运用 质量守恒法 ________等方法求解。
具体方法如下: 化学反应前各物质的质量总和 = 剩余物的质量 + 生
成气体的质量
质量守恒定律:参加化学反应的各物质的 质量总和等于反应后生成的各物质的质量 总和。
如果体内产生180g乳酸,需要多少 克氧气才能将它完全分解?
解:设需氧气质量为x
---0.5分
2C3H6O3 + 6O2===6CO2+6H2O ----1分 2×90 6 × 32 ------1分
2023年中考化学专题复习---计算题

2023年中考化学专题复习-计算题一、计算题1.将10g赤铁矿样品(杂质既不溶于水,也不参与反应)放入烧杯中,再加入100g稀硫酸,恰好完全反应,过滤,得到滤液和2g滤渣。
请计算。
(1)赤铁矿样品中氧化铁的质量是______g。
(2)所用稀硫酸的溶质质量分数?(写出计算过程)2.某校化学研究性学习小组了解到,某石材厂新购进一批石灰石原料(其所含的杂质既不溶于水,也不溶于盐酸,高温时也不发生反应)。
甲、乙、丙、丁四位同学分别取该石灰石样品,并取稀盐酸200g平均分成....4份进行实验,结果如下:实验甲乙丙丁加入样品的质5101520量/g生成CO2的质1.76 3.52 4.40m量/g求:(1)m=_________;(2)所用稀盐酸中溶质的质量分数为_____。
3.将3.2g某红棕色粉末与足量的碳充分反应,将产生的二氧化碳气体全部通入足量的澄清石灰水中,得到3g白色沉淀。
计算:(1)生成二氧化碳的质量;______(2)红棕色粉末中氧元素的质量分数。
______4.N(NO2)3是科学家2011年发现的一种新型火箭燃料。
计算:(1)N(NO2)3中氮、氧元素的质量比;(2) gN(NO2)3中含28g氮元素。
5.某同学用20 g含杂质的碳酸钠混合固体制取氢氧化钠(杂质不溶于水),用于制作“叶脉书签”。
操作过程如下:(1)实验中玻璃棒的作用是______。
(2)计算混合固体中碳酸钠的质量分数。
6.根据所示的实验和提供的数据、图像,回答下列问题:求:(1)a 的质量_______g 。
(2)b 点溶液质量______。
(写出计算过程)(3)恰好完全反应后所得溶液中溶质质量分数______。
(写出计算过程)7.实验室有一瓶标签腐蚀的氢氧化钠溶液,为测量其溶质质量分数,小明做了如下实验:①取20g 氢氧化钠溶液于烧杯;①滴加无色酚酞;①滴加20%的稀硫酸至恰好褪色;①称量实验后烧杯内溶液总质量。
(1)将50g98%的浓硫酸稀释为20%的稀硫酸需加水的质量为______g 。
2023-2024学年九年级化学人教版上册 5.3 《复习有关化学方程式的综合计算》教案

2023-2024学年九年级化学人教版上册 5.3 《复习有关化学方程式的综合计算》教案教学目标1.复习化学方程式的写法与表示方法;2.掌握化学方程式的配平方法;3.学会进行化学方程式的综合计算。
教学重点1.化学方程式的配平方法;2.化学方程式的综合计算。
教学准备1.九年级化学人教版上册教材;2.黑板、粉笔。
教学过程导入(5分钟)教师可以进行简单的导入活动,例如通过提问或介绍一则与化学方程式相关的新闻事件,引起学生的兴趣,让学生预习本节课的内容。
知识讲解(15分钟)1.复习化学方程式的写法与表示方法。
回顾化学方程式的基本写法,包括反应物、生成物、反应箭头、物质状态等的表示方法。
2.归纳化学方程式的配平方法。
介绍化学方程式配平的基本原理,包括质量守恒定律和电荷守恒定律。
讲解配平的方法,例如调整系数法和半反应法,并通过示例进行说明。
练习与讨论(25分钟)1.学生进行配平练习。
教师提供一些化学方程式,并让学生利用所学的配平方法进行配平练习,巩固对配平方法的理解。
2.学生互相讨论并解答问题。
教师组织学生进行小组讨论,让学生互相讨论配平的方法和答案,并解答学生在配平过程中遇到的问题。
拓展应用(20分钟)1.进行化学方程式的综合计算练习。
教师提供一些化学方程式,并让学生结合配平的结果进行综合计算练习,例如计算反应的摩尔比例、反应的质量比例等。
2.学生应用化学方程式解决实际问题。
教师提供一些实际情境,让学生结合所学的化学方程式知识,应用化学方程式解决实际问题,提高学生的综合运用能力。
小结与评价(5分钟)教师对本节课的内容进行小结,并进行相关的评价,对学生的学习情况进行反馈。
课后作业1.阅读相关教材,并完成课后练习题;2.总结化学方程式的配平方法,并写一篇100字以上的心得体会。
教学反思通过本节课的教学,学生掌握了化学方程式的配平方法,并能够进行综合计算。
但是,教学过程中发现有些学生在配平化学方程式时仍存在一定的困难,下节课需要进行更多的练习和巩固,并提供更多的配平示例和综合计算题目,以帮助学生更好地掌握配平方法和应用能力。
2024年中考化学总复习专题九化学式与化合价中考命题23有关化学式的计算

中考命题23 有关化学式的计算
中考·化学
答案:C 解析:A.由乙酸的结构模型图可知,乙酸的化学式为 CH3COOH, 故正确;B.乙酸中碳元素和氢元素的质量比为(12×2)∶(1×4)=6∶1,故正确; C.1 个乙酸分子是由 2 个碳原子、4 个氢原子和 2 个氧原子构成的,故错误;D.乙 酸中碳元素、氢元素、氧元素的质量比为(12×2)∶(1×4)∶(16×2)=6∶1∶8,则 乙酸中氧元素的质量分数最大,故正确。
中考·化学
5.[2023 广安]食醋是生活中常用的调味剂,其主要成分乙酸的结构模型图如 图所示。下列说法不正确的是( )
A.乙酸的化学式为 CH3COOH B.乙酸中碳元素和氢元素的质量比为 6∶1 C.乙酸由 2 个碳原子、4 个氢原子和 2 个氧原子构成 D.乙酸中氧元素的质量分数最大
第9页
返回层目录 返回目录
A.常温下 N2 的化学性质很活泼 B. 和 按个数比 1∶1 进行该反应 C. 中 N、H 元素的质量比为 1∶3 D.反应前后分子种类和数目发生变化
第4页
返回层目录 返回目录
中考命题23 有关化学式的计算
中考·化学
答案:D 解析:由微观反应示意图可知,该反应是由氮气和氢气在催化剂 的作用下反应生成氨气,化学方程式为 N2+3H2催==化==剂= 2NH3。A.常温下氮气化学 性质稳定,不易和其他物质反应,说法错误;B.由化学方程式 N2+3H2催==化==剂= 2NH3 可知,参加反应的 N2 和 H2 按个数比 1∶3 进行该反应,说法错误;C.由分子结构
答案:A 解析:A.奥司他韦中碳、氢、氮、氧四种元素的质量比=(12×16)∶(1 ×28)∶(14×2)∶(16×4)=48∶7∶7∶16,则奥司他韦中碳元素的质量分数最大,故 A 正确;B.奥司他韦的相对分子质量=12×16+1×28+14×2+16×4=312,相对分子质
2023年中考化学专题复习课件专题八 化学计算

1
(2)要从物质B的饱和溶液中得到其晶体,一般采用
蒸发溶剂
(填“冷却”或
“蒸发溶剂”)结晶法。
(3)t2 ℃时物质A的饱和溶液的溶质质量分数为 33.3% (结果精确到0.1%),若将
100 g该温度下的饱和溶液加水稀释至3.33%,加入水的质量为 900 g 。
答案:(3)①4.8
g。
铁的质量为 y。
3NaOH+FeCl3
3NaCl+Fe(OH)3↓
120
107
6 g×20%
×%
=
y
y=1.07 g
因此所得溶液的质量 m=50+100-1.07=148.93。
答案:(3)148.93
一、选择题
1.(2021营口)防控新冠肺炎期间,很多医院使用来苏水进行杀菌消毒,来苏水的主
敏感,为了便于及时发现煤气泄漏,人们在管道煤气中常添加微量乙硫醇。下列有
关说法不正确的是(
)
A.乙硫醇是一种化合物
B.乙硫醇的相对分子质量为62
C.乙硫醇中硫元素的质量分数是51.61%
D.乙硫醇中C、H、S三种元素的质量比是2∶6∶1
解析:乙硫醇(化学式为C2H6S)是由三种元素组成的纯净物,属于化合物,A正确;乙
1.溶质质量分数与溶液的稀释计算
[方法点拨]
1.已知物质溶解度的前提下,饱和溶液中溶质的质量分数=
溶解度
×100%。
溶解度+
2.在不饱和溶液中,溶质的质量分数的计算公式如下:
(1)计算公式
溶质的质量
溶质的质量分数=
专题11 质量守恒定律 化学方程式(解析版)-备战2024年中考化学真题题源解密(全国通用)
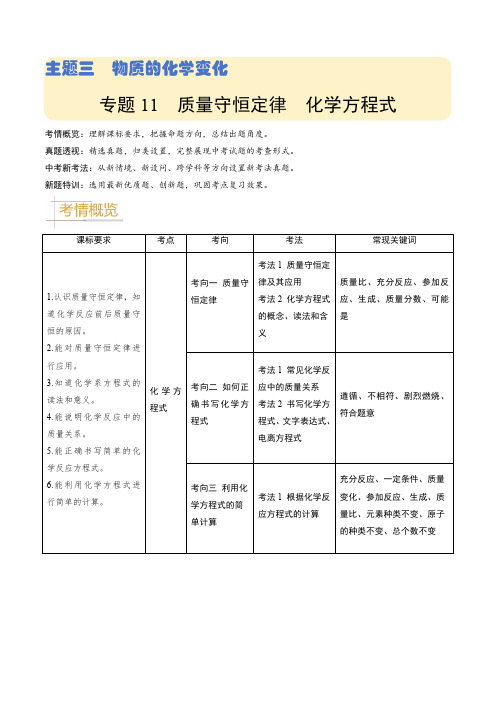
主题三物质的化学变化专题11 质量守恒定律化学方程式考情概览:理解课标要求,把握命题方向,总结出题角度。
真题透视:精选真题,归类设置,完整展现中考试题的考查形式。
中考新考法:从新情境、新设问、跨学科等方向设置新考法真题。
新题特训:选用最新优质题、创新题,巩固考点复习效果。
课标要求考点考向考法常现关键词考向一质量守恒定律考法1 质量守恒定律及其应用考法2 化学方程式的概念、读法和含义质量比、充分反应、参加反应、生成、质量分数、可能是考向二如何正确书写化学方程式考法1 常见化学反应中的质量关系考法2 书写化学方程式、文字表达式、电离方程式遵循、不相符、剧烈燃烧、符合题意1.认识质量守恒定律,知道化学反应前后质量守恒的原因。
2.能对质量守恒定律进行应用。
3.知道化学系方程式的读法和意义。
4.能说明化学反应中的质量关系。
5.能正确书写简单的化学反应方程式。
6.能利用化学方程式进行简单的计算。
化学方程式考向三利用化学方程式的简单计算考法1 根据化学反应方程式的计算充分反应、一定条件、质量变化、参加反应、生成、质量比、元素种类不变、原子的种类不变、总个数不变►考向一质量守恒定律考法1 质量守恒定律及其应用1.(2023•淄博)现有8gA和足量B在一定条件下充分反应,生成22gC和18gD,则参加反应的A和B的质量比是( )A.4:11B.1:2C.1:4D.11:9【答案】C【解析】现有8gA和足量B在一定条件下充分反应,生成22gC和18gD,由质量守恒定律,参加反应的A和B的质量之和等于生成C和D的质量之和,则参加反应的B的质量为22g+18g﹣8g=32g,参加反应的A和B的质量比是8g:32g=1:4。
故选:C。
2.(2023•日照)t1时刻,在密闭容器内投入SO2、O2、SO3、V2O5(五氧化二钒)四种物质,在一定条件下SO2和O2发生反应生成SO3,在t2时刻测得容器内各物质的质量如表所示,下列说法错误的是( )甲乙丙丁t114.8g10g 6.2g1gt2a26g3g1gA.丁可能是催化剂V2O5B.乙是SO3C.a=2g D.丙是SO2【答案】D【解析】丁反应前后质量不变,是五氧化二钒,乙反应后质量增大,是生成物,即是三氧化硫,丙反应后质量减小,是反应物,a=14.8g+10g+6.2g+1g﹣26g﹣3g﹣1g=2g,甲物质质量减少,属于反应物。
2023年中考化学----《质量守恒定律与化学方程式》复习知识梳理PPT课件

3
5
18
22
C. 甲的相对分子质量一定等于丙和丁的相对分子质量之和
D. 该反应中丙和丁的质量变化之比为9:11
聚焦中考:题型典例聚焦
【题型二 质量守恒定律表格题】
【解析】 A、x=3+5+18+22-6-10-27=5,反应后甲质量减小,是反应物,丙、丁 质量增大,都是生成物,即甲分解生成丙、丁,因此甲是化合物,该选 项说法正确; B、乙反应前后质量不变,可能是催化剂,也可能是没有参加反应的物质 ,该选项说法不正确; C、不知道化学计量数,因此甲的相对分子质量不一定等于丙和丁的相对 分子质量之和,该选项说法不正确;D、该反应中丙和丁的质量变化之比 为(18-10):(22-6)=1:2,该选项说法不正确。 故选:A。
AB→A+B+ … AB + C→A +BC
AB + CD→ AD+ BC
特征
反应物为多种 而生成物只有 一种,即“多 变一”
反应物只有一 种而生成物有 多种,即“一 变多”
反应物与生成物都 是两种,且都是单 质和化合物
反应物和生成物都 为化合物
聚焦中考:考点梳理 考点3:化学反应类型
2、氧化还原反应 氧化反应:物质 得到氧 的反应;还原反应:物质 失去氧 的反应 氧化剂:提供氧的物质;还原剂:夺取氧的物质(常见还原剂:H2、C、CO) 3、中和反应: 酸 与 碱 作用生成 盐 和 水 的反应。中和反应不属于四大基 本反应类型,但是中和反应属于其中的 复分解反应。
聚焦中考:题型典例聚焦
【趁热打铁】
2、【2021湖南常德】一定条件下,在密闭容器内发生某一化学反应,测得反应前
后各物质的质量如下表所示。
2023年中考化学分类复习:化学计算题附答案

2023 年中考化学分类复习:化学计算题附答案1.疫情防控期间常用到一种免洗手消毒凝胶,其中含有正丙醇(化学式为 C H O)。
请回答下列问题:3 8(1)正丙醇的相对分子质量为______。
(2)正丙醇中碳元素和氢元素的质量比为______ (写出最简整数比)。
(3)6g 正丙醇中氧元素的质量为______g。
2.嘌呤是合成 DNA 的主要物质,广泛存在于细胞核中,嘌呤的化学式为 C H N ,在人体内会被氧化成尿酸,5 4 4血液中尿酸含量过高容易引起痛风。
(1)嘌呤的相对分子质量为___________。
(2)嘌呤中碳元素和氢元素的质量比为___________。
3.某公司需要 320kg 氧气作原料。
若用电解水的方法制取这些氧气,请计算:(1)消耗水的质量是多少?(写出计算过程)(2)同时得到的氢气在足量的氯气中燃烧,生成氯化氢的质量是多少?(写出计算过程)4.某造纸厂在造纸过程中会产生含氢氧化钠的废水,需经处理至中性后才能排放。
现有 5%的稀盐酸 365kg。
能处理废水中氢氧化钠的质量是______?5.某 NaCl 样品中只含有杂质 CaCl ,为测定样品中 CaCl 质量分数,取样品 20g 完全溶解于水中,并向其中2 2加入过量的 Na CO 溶液,生成沉淀的质量是 2g。
计算样品中 CaCl 的质量分数。
2 3 26.取 MgCl 、KCl 两种固体的混合物 19g,向其中加入 160.8g 水,完全溶解后,再滴加 KOH 溶液,当恰好完2全反应时,过滤得沉淀质量为 5.8g,所得滤液中溶质的质量分数为 10%。
计算:(1)混合物中 MgCl 的质量。
2(2)加入 KOH 溶液的溶质质量分数。
7. 实验室常用氯酸钾和二氧化锰混合加热制取氧气。
(1)若氯酸钾完全分解,请写出从反应后的物质中提取纯净二氧化锰的操作步骤_________。
(2)现取 30g 氯酸钾与少量二氧化锰混合后加热,共制得 9.6g 氧气,请根据化学方程式计算,氯酸钾是否完全分解?8.小东做家务时,发现厨房所用炉灶清洁剂的有效成分为氢氧化钠。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2023年中考化学专题复习-与化学方程式有关的计算
1.在含氯化钠杂质的碳酸钠13.6g中逐渐加入质量分数为7.3%稀盐酸,所加稀盐酸的质量与pH的关系如图所示:
(1)100g稀盐酸中氯化氢的质量。
(2)完全反应后,计算生成二氧化碳的质量?(写出计算步骤)
(3)完全反应后,所得溶液中溶质的质量分数?(写出计算步骤)
2.为测定某石灰石中碳酸钙的含量,小明用足量稀盐酸设计了如图Ⅰ所示的实验装置。
(已知样品中其他成分均不与稀盐酸反应,空气中气体也不与所给试剂反应)
(1)理论计算:请根据图Ⅰ数据,计算石灰石样品中碳酸钙的质量分数。
(写出计算过程)_____
(2)实验分析:小明反思方案发现,反应前后装置B质量变化值可能________(填“大于”“小于”或“等于”)生成CO2质量的理论值,理由是________。
3.某实验小组同学为了测定高锰酸钾样品的纯度,取10.00 g 该样品加热一定时间后(样品中的杂质不参与化学反应),冷却,称量剩余固体的质量,重复以上操作,记录数据如下表:
加热时间t1t2t3t4
剩余固体质量/g9.129.089.049.04
问:(1)完全反应后生成的氧气的质量为g(计算结果精确到0.01);
(2)求该样品中高锰酸钾的纯度(计算结果精确到0.1%)。
4.某化学兴趣小组为了测定石灰石样品中碳酸钙的质量分数,取用15g石灰石样品,把200g稀盐酸分4次加入样品中(样品中杂质既不与盐酸反应,也不溶于水)每次实验数据如表,请计算:(Ca:40H:1C:12O:16Cl:
9.为测定铜锌合金中铜的质量分数,现将 10g 该合金放入烧杯中,逐渐加入稀硫酸至不再产生气泡时,恰好用去溶质质量分数为 20%的稀硫酸 49g 。
试计算该合金中铜的质量分数 _________。
10.某校化学兴趣小组在参加社会实践活动时,监测到一湿法冶铜厂排放的废水中含有硫酸和硫酸铜两种污染物,为测定该废水中各污染物的含量,给冶铜厂处理废水提供参考,该小组的同学进行了以下实验:取废水300g ,向其中加入溶质质量分数为20%的氢氧化钠溶液,测得沉淀质量与所加入氢氧化钠溶液的质量关系如图,请计算:(计算结果精确到0.1%)
(1)300g 该废水中所含硫酸铜的质量。
(2)该废水中硫酸的溶质质量分数。
11.空气中CO 2的含量升高将导致温室效应加剧,有科学家提出可利用FeO 吸收和利用,反应的化学方程式为2346FeO+CO 2Fe O +C 一定条件,若成功转化CO 2 22g ,生成Fe 3O 4的质量是多少?
12.黄铜是铜和锌的合金,某化学兴趣小组的同学在测定黄铜中铜的含量时,取黄铜样品40g ,放入烧杯中,向其中加入200g 稀硫酸,恰好完全反应,反应后烧杯中剩余物的总质量为239.6g ,请计算
Ⅰ产生氢气的质量是 ;
Ⅰ参与反应的稀硫酸的质量是 ;
Ⅰ黄铜中铜的质量分数
13.计算题
铜的氧化物有两种,分别是Cu 2O 和CuO ,都能被一氧化碳还原成铜。
某固体粉末可能含有Cu 2O 、CuO 和Cu 。
取14.4克固体粉末,向其中通入足量一氧化碳并加热(假设固体完全反应),将反应生成的气体通入足量的澄清石灰水中。
生成10.0克沉淀。
试计算:
(1)固体粉末可能含有____________或____________。
(2)反应生成二氧化碳的质量为________克?(要求写出计算过程)
14.小丽同学利用碳酸钠与稀盐酸反应来测定所用的稀盐酸的质量分数,进行了如下的实验,实验数据如下:
1 2 3 4 5 6 稀盐酸(g ) 10 20 30 40 50 60
(1)第________次稀盐酸是过量的。
(2)求所用的稀盐酸中溶质的质量分数。
15.工业上常用NaOH溶液处理铝土矿(主要成分为Al2O3),反应的化学方程式:Al2O3 + 2NaOH = 2NaAlO2 + H2O。
欲对含Al2O3204 t的铝土矿进行处理(杂质不参与反应),理论上需要消耗NaOH的质量为多少?
16.某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁,他们为了测定水垢中碳酸钙的含量,取某种稀盐酸100 g加入到15.8 g水垢中,产生CO2气体的情况如下图所示。
计算:
(1)从图中可以看出15.8 g水垢与盐酸反应后生成CO2最多是_________。
(2)水垢中碳酸钙的质量分数是多少_________?(计算结果保留0.1%)
(3)所用稀盐酸中溶质质量分数是多少__________?(计算结果保留0.1%)
参考答案:
答:水垢中碳酸钙的质量分数是63.3%,所用稀盐酸中溶质质量分数是7.3%.。
