《氧化还原反应》PPT课件[优秀课件资料]
合集下载
氧化还原反应ppt课件

根据下列反应判断有关物质还原性强弱的顺序 A
H2SO3 + I2 + H2O === 2HI + H2SO4
2FeCl3 + 2HI === 2FeCl2 + 2HCl + I2 A.H2SO3 > I- > Fe2+ B.I- > Fe2+ > H2SO3 C.Fe2+ > I- > H2SO3 D.Fe2+ > H2SO3 >I-
电子的得失、共用电子对的偏移
氧化反应 还原反应 二者关系
元素化合价
电子的转移
升高
失电子(偏离)
降低
得电子(偏向)
二者是同时进行的
1.下列变化过程中,元素失去电子的是( D )
A.MnO2 → Mn2+
B.CuO → CuCl2
C.Ag+ → Ag2O
D.Sn2+ → Sn4+
2.下列说法正确的是( D ) A.有得、失氧的反应才是氧化还原反应 B.氧化还原反应中,氧化反应与还原反应是先后进行的 C.有电子得失的反应才是氧化还原反应 D.凡是有化合价升降的反应,都是氧化还原反应
高温
C + H2O ===== H2 + CO
CuO + H2 ==== Cu + H2O
物质 CuO
C H2O
C CuO H2
氧化(还原)反应 还原 氧化 还原 氧化 还原 氧化
化合价变化 降低 升高 降低 升高 降低 升高
化合价升高 —— 氧化反应
化合价降低 —— 还原反应
化合价升高,发生氧化反应
Zn + 2HCl ==== ZnCl2 + H2↑
化合价
得失电子
氧化还原反应ppt课件

0
+5
+6
+4
1 S+ 6HNO3(浓)= H12SO4+ NO62↑+
得1e-
第四步、用质量守恒法配平其他物质
H2O
1 S+ 6HNO3(浓)= H12SO4+ NO62↑+ H2O2
第五步、检查质量,电荷,电子是否守恒
新/课/授/课
标变价 列得失 求总数 配系数 查守恒
标出有变价的元素的化合价 列出变价元素的得失电子情况 用最小公倍数配平使得得失电子数相等 用质量守恒法配平其他物质 检查质量,电荷,电子是否守恒
。
变式2
例/题/详/解
下列有关金属元素特征的叙述正确的是( ) A.金属元素的原子只有还原性,其阳离子只有氧化性 B.金属元素的单质在常温下都为固体 C.含金属元素的离子都是阳离子 D.金属阳离子被还原不一定得到金属单质
新/课/授/课
氧化性、还原性强弱的比较方法
氧化性强弱: 氧化剂 氧化产物 还原性强弱: 还原剂 还原产物
变式1
例/题/详/解
变式2
例/题/详/解
下 课见 中 学 次 BYE
下列微粒中,只有氧化性的是(
①S²- ②Fe2+ ③Fe3+ ④S
A.①②
B.②④
D.②④⑤⑥
) ⑤H+ ⑥Na+ ⑦Mg C.③⑤⑥
变式1
例/题/详/解
写出下列微粒在反应中表现出的性质。
S2-、Fe2+ 、H+、Cu、HCl、H2O
只能作氧化剂的是
。
只能做还原剂的是
。
既能作氧化剂又能做还原剂的是
氧化 还原 2
氧化还原反应ppt课件

请找出下列反应的氧化剂、氧化产物、还原剂、还原产物
Fe2O3 + 3CO
高温
=
2Fe + 3CO2
2KMnO4 Δ= K2MnO4+MnO2+O2 ↑
SO2 + 2H2S = 3S↓+2H2O
1.3 氧化还原反应
第二课时
4、氧化还原反应的本质
点燃
2Na + Cl2 = 2NaCl 化合价发生改变的原因:电子得失
部分非金属单质
含有高价态元素的
氧
化合物
化 某些金属活动性较
剂 弱的元素对应的高
价态离子
过氧化物
O2、Cl2等 浓硫酸、HNO3、KMnO4、MnO2、
KClO3、K2Cr2O7等
Fe3+、Ag+、Pb4+、Cu2+等
Na2O2、H2O2等
4、氧化性 还原性
还原剂具有还原性(降低其他物质元素的化合价)
化合价升高,失电子,被氧化
化合价降低,得电子,被还原
氧化剂:所含元素的化合价降低, 即得到电子(或电子对偏向)的反应物。
还原剂:所含元素的化合价升高, 即ห้องสมุดไป่ตู้去电子(或电子对偏离)的反应物。
记忆口诀
升失氧,降得还,要说剂,恰相反 还原剂: 化合价升高,失去电子,发生氧化反应,被氧化,生成氧化产物 氧化剂: 化合价降低,得到电子,发生还原反应,被还原,生成还原产物
2.单线桥法(不同元素,失电子物质指向得电子物质)
2×3e-
0 +3
0 +3
①必须箭头(失电子物质元素)指向箭尾(得电子物质对应元素) ②单线桥上不须注明“得到”或“失去”,仅注明电子转移数目
B (大本 P27 第 4 题)下列反应中,电子转移的方向和数目正确的是( )
氧化还原反应ppt课件

化合价降低,得电子,被还原
化合价升高,失电子,被氧化
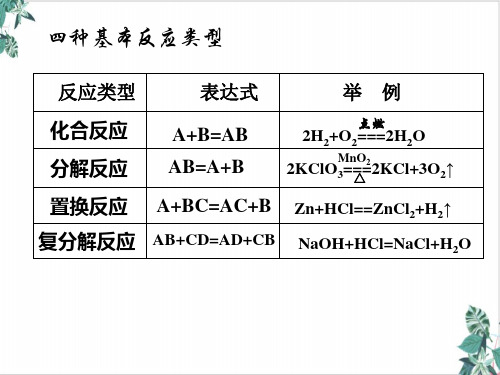
三、四个基本反应类型与氧化还原反应的关系
1、化合反应:
A + B = AB
2、分解反应:
3、置换反应:
4、复分解反应:
AB = A + B
A + BC = B + AC
思考:有单质参加或生成的反应一定是置换反应吗?
AB + CD = AD + CB
C
B D
自我检测
5、下列哪个反应表示二氧化硫被还原( )A、SO2+2H2O+Cl2 = H2SO4+2HCl B、SO2+2H2S = 2H2O+3S↓C、SO2+2NaOH = Na2SO3+H2O D、SO2+Na2CO3 = Na2SO3+CO2↑
B
自我检测
氧化还原反应 第一课时
一、从不同角度认识氧化还原反应
1、从得氧失氧的角度认识氧化还原反应
得到氧原子,发生氧化反应
失去氧原子,发生还原反应
H2 + CuO = Cu + H2O
化合价升高
化合价降低
氧化反应
还原反应
0 +1
失去电子
发生氧化反应
元素化合价降低
得到电子
发生还原反应
口诀:
升、失、氧
降、得、还
二、关于氧化还原反应的几个重要概念
1、氧化剂:
2、还原剂:
反应物中元素化合价降低的物质
(被还原的物质)
(主要从升失氧、降得还入手分析)
氧化性:
(氧化剂具有氧化性)
物质得到电子的性质
√
化合价升高,失电子,被氧化
三、四个基本反应类型与氧化还原反应的关系
1、化合反应:
A + B = AB
2、分解反应:
3、置换反应:
4、复分解反应:
AB = A + B
A + BC = B + AC
思考:有单质参加或生成的反应一定是置换反应吗?
AB + CD = AD + CB
C
B D
自我检测
5、下列哪个反应表示二氧化硫被还原( )A、SO2+2H2O+Cl2 = H2SO4+2HCl B、SO2+2H2S = 2H2O+3S↓C、SO2+2NaOH = Na2SO3+H2O D、SO2+Na2CO3 = Na2SO3+CO2↑
B
自我检测
氧化还原反应 第一课时
一、从不同角度认识氧化还原反应
1、从得氧失氧的角度认识氧化还原反应
得到氧原子,发生氧化反应
失去氧原子,发生还原反应
H2 + CuO = Cu + H2O
化合价升高
化合价降低
氧化反应
还原反应
0 +1
失去电子
发生氧化反应
元素化合价降低
得到电子
发生还原反应
口诀:
升、失、氧
降、得、还
二、关于氧化还原反应的几个重要概念
1、氧化剂:
2、还原剂:
反应物中元素化合价降低的物质
(被还原的物质)
(主要从升失氧、降得还入手分析)
氧化性:
(氧化剂具有氧化性)
物质得到电子的性质
√
人教版化学必修一氧化还原反应ppt33张课件
单质还原性逐渐减弱:K>Ca>Na>Mg>Al>Zn>Fe…
2.元素处于最低价态时,只能做还原剂:Cl-、S2-、I- 元素处于最高价态时,只能做氧化剂:KMnO4、 FeCl3、H2SO4、HNO3
阳离子氧化性逐渐增强: K+<Ca2+<Na+<Mg2+<Al3+<Zn2+<Fe 2+…
3.归中规律 同种元素不同价态间发生氧坏反应时,高价+ 低价 中间价态,即“只靠拢,不交叉。”
例:在KClO3+6HCl(浓)===KCl+3Cl2+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为 。
3、这是从电子得失的角度看(也是氧化还原反应的实质):
因此,有电子转移(得失或电子对偏移)的反应都是氧化还原反应。
Fe + 2HCl = FeCl2 + H2 ↑
2e-
CH4 + 2O2 = CO2 + 2H2O
8e-
-4 0 +4 -2
0 +1 +2 0
有单质参加的
有单质生成的
三、氧还反应中电子转移的表示方法
1.双线桥法:
(1)标出反应中化合价发生变化的元素的化合价,判断其升降。
(2)画线条,箭头由反应物指向生成物中同种元素。
(3)在桥上标明电子“得”“失”电子,同时用a×b e-形式表示得、失电子数。 a—得、失电子的原子总数 b—每个原子得失电子数(a,b为1时可省略)
如: 2Fe+3Cl2 =2FeCl3 Fe+S= FeS 则氧化性:Cl2 > S
氧化还原反应ppt课件

思考与讨论: (1)请根据初中学过的氧化反应和还原反应的知识,分析以下反应,完成下表。
2CuO+C 2Cu+CO2↑ Fe2O3+3CO 2Fe+3CO2↑
物质 得氧物质 失氧物质
反应物 C、CO CuO、Fe2O3
发生的反应(氧化反应或还原反应) 氧化反应 还原反应
思考:你判断氧化反应和还原反应的依据是什么?
另一条线始于反应物中的升价元素,止于产物中同种元素。
注得失---正确标出反应前后“得到”或“失去”电子总数
课堂探究 氧化还原反应电子转移的表示方法
双线桥法的注意事项: (1)箭头、箭尾必须对应化合价变化的同种元素的原子; (2)必须注明“得到”或“失去”; (3)电子转移数用a×be-形式表示,a表示发生氧化反应或还原反应的原子 个数,b表示每个原子得到或失去的电子数,当a=1或b=1时,要省略; (4)被还原的物质和被氧化的物质得失电子数守恒。
注意:两个可能:化合反应和分解反应可能是氧化还原反应。
两个一定:置换反应一定是氧化还原反应,复分解反应一定是非氧化还原反应。
课堂探究 氧化还原反应与四大基本反应的关系
思考与讨论:观察下列反应,它们是氧化还原反应吗?属于四大基本反应类型吗?
有单质参加或生成的化学反应一定是氧化还原反应吗?
4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O
人教版(2019)必修第一册
第一章 物质及其变化
第三节 氧化还原反应
第一课时 氧化还原反应
素养目标
宏观辨识与微观探析:
从宏观上理解化合价变化是氧化还原反应的表观现象,从微观上明确在氧化还原 反应中物质发生化合价变化的本质原因是电子的转移(得失和共用电子对偏移)。
氧化还原反应ppt课件

失2C氧u物O质+ CC高=u温O2C、u +Fe2COO32
Fe2O3 +还3 C原O反=高应温2Fe + 3 CO2
氧化反应和还原反应是同时发生的,这样的反应称为氧化还原反应。
2CuO + C 高==温= 2Cu + CO2↑ 失去氧,被还原,发生还原反应
CuO 还原反应 Cu O
Fe2O3 + 3CO ==高=温 2Fe + 3CO2
练习:以上面的双线桥表示形式为例,对下面的反应进
行双线桥分析: (1)Zn + 2HCl = ZnCl2 + H2↑
失去1x2e-,化合价升高,被氧化,发生氧化反应
0 +1
Zn + 2HCl
+2
0
= ZnCl2 + H2↑
得到2×1e-,化合价降低,被还原, 发生还原反应
典例 〔变式训练 2〕根据下列两个氧化还原反应回答问题: ①2KClO3=M=△n=O==2 2KCl+3O2↑ ②MnO2+4HCl(浓)==△===MnCl2+Cl2↑+2H2O
NaCl+H2SO4==Na2SO4+2HCl
人教版必修第一册
网第一章 物质及其变化
科
第三节 氧化还原反应 1.3.1 氧化还原反应
学
钢铁会生锈
食物会腐败
都因为发生了氧化还原反应
补充维生素为何能延缓皮肤老化?
1.从得失氧角度认识氧化还原反应
物质
反应物
发生的反应(氧化反应或还氧反应) 已学知识
(1得)氧请物根质据初中C学、过的CO氧化反应和还氧反应的知识氧,分化析反以应下反应,完成下表。
根据是否有 化合价变化
氧化还原反应 非氧化还原反应
氧化还原反应ppt课件

化合价降低,被还原,发生还原反应
+2
0 高温 0
+4
2CuO + C = 2Cu + CO2
有氧参与的反应
化合价升高,被氧化,发生氧化反应
一、氧化还原反应
凡有元素化合价升降的化学反应都是氧化还原反应。
化合价降低,被还原,发生还原反应
+1
0
0
+2
无氧参与的反应
化合价升高,被氧化,发生氧化反应
(2019·抚顺高一期末)下列化学反应中,不属于氧化还原反应的是
解析 A项,氧化性:Z2>W2,不符合题给信息,反应不能发生; B项,氧化性:Z2>X2,符合题给信息,反应能发生; C项,氧化性:Y2>W2,不符合题给信息,反应不能发生; D项,氧化性:X2>Z2,不符合题给信息,反应不能发生。
二、氧化性、还原性强弱比较
(3)根据反应的难易(反应条件)比较下列物质的氧化性强弱
√A.CaCO3+2HCl===CaCl2+CO2↑+H2O
B.Fe+CuSO4===Cu+FeSO4 高温
C.Fe2O3+3CO===== 2Fe+3CO2 D.2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
判断正误
(1)氧化还原反应中一定有氧元素的得失(× ) (2)氧化还原反应中得电子的物质发生还原反应(√ ) (3)氧化还原反应中所有元素的化合价都一定发生变化(× ) (4)一个反应中可以只有元素化合价升高,而无元素化合价降低(× ) (5)有单质参加的反应一定是氧化还原反应(× )
②Fe+S
△ =====
FeS
可判断氧化性:氯气__>__硫。
1.下列微粒:①Al3+ ②Cl- ③N2 ④S2- ⑧MnO-4 。既具有氧化性又具有还原性的是
+2
0 高温 0
+4
2CuO + C = 2Cu + CO2
有氧参与的反应
化合价升高,被氧化,发生氧化反应
一、氧化还原反应
凡有元素化合价升降的化学反应都是氧化还原反应。
化合价降低,被还原,发生还原反应
+1
0
0
+2
无氧参与的反应
化合价升高,被氧化,发生氧化反应
(2019·抚顺高一期末)下列化学反应中,不属于氧化还原反应的是
解析 A项,氧化性:Z2>W2,不符合题给信息,反应不能发生; B项,氧化性:Z2>X2,符合题给信息,反应能发生; C项,氧化性:Y2>W2,不符合题给信息,反应不能发生; D项,氧化性:X2>Z2,不符合题给信息,反应不能发生。
二、氧化性、还原性强弱比较
(3)根据反应的难易(反应条件)比较下列物质的氧化性强弱
√A.CaCO3+2HCl===CaCl2+CO2↑+H2O
B.Fe+CuSO4===Cu+FeSO4 高温
C.Fe2O3+3CO===== 2Fe+3CO2 D.2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
判断正误
(1)氧化还原反应中一定有氧元素的得失(× ) (2)氧化还原反应中得电子的物质发生还原反应(√ ) (3)氧化还原反应中所有元素的化合价都一定发生变化(× ) (4)一个反应中可以只有元素化合价升高,而无元素化合价降低(× ) (5)有单质参加的反应一定是氧化还原反应(× )
②Fe+S
△ =====
FeS
可判断氧化性:氯气__>__硫。
1.下列微粒:①Al3+ ②Cl- ③N2 ④S2- ⑧MnO-4 。既具有氧化性又具有还原性的是
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
种性质。如反应4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O
中,参加反应的HCl一半表现了还原性,另一半表现了
酸性。
(2)得电子难的元素不一定易失去电子。如碳元素、稀 有气体元素既不容易失电子也不容易得电子。 (3)元素由化合态转变为游离态不一定被氧化,也可能 被还原。如HCl转化为Cl2,氯元素被氧化,CuO转化为Cu, 铜元素被还原。
提示:没有涉及分解反应,属于氧化还原反应的有2个。 分析可知,这几种物质之间的反应有铁和稀盐酸间的置 换反应、稀盐酸和氢氧化钠溶液之间的复分解反应、 二氧化碳和氢氧化钠溶液之间的反应、碳和二氧化碳 之间的化合反应,注意二氧化碳和氢氧化钠溶液之间发 生的反应不是复分解反应。
知识点一 氧化还原反应的概念、本质 【重点释疑】 1.氧化还原反应的有关概念 (1)从特征和本质认识氧化还原反应
角度
氧化 反应
还原 反应
氧化还 原反应
化合价(特征)
化合价升高的 反应
化合价降低的 反应
有化合价升高 和降低的反应
电子转移(本质)
失去电子或电子对偏离的 反应
得到电子或电子对偏向的 反应
有电子转移(电子得失或电 子对偏移)的反应
(2)氧化还原反应中对立统一的关系: ①化合价有升必有降。 ②电子有得必有失。 ③有氧化反应,必然有还原反应。
第三节 氧化还原反应 第1课时 氧化还原反应
一、氧化还原反应 1.从得氧、失氧的角度认识氧化还原反应
化学 反应
得氧 物质
3CO+Fe2O3
2CuO+C
2Fe+3CO2
2Cu+CO2
_C_O_
C
发生_氧__化__反应
失氧 物质
结论
Fe2O3
CuO
发生_还__原__反应
氧化反应与还原反应__同__时_发生
2H2O是否属于氧化还原反应?根据该反应思考四种基本
反应类型能否涵盖所有反应?
提示:反应中氯元素化合价升高,锰元素化合价降低,反
应属于氧化还原反应,但不属于四种基本反应类型中的
任何一种。
(2)有单质参加或生成的反应一定是氧化还原反应吗?
提示:不一定。反应3O2
2O3中有单质参加或生
成,但元素的化合价没有变化,不属于氧化还原反应。
【情境·思考】北京冬奥会将在2022年2月4日至2月20 日在我国北京和河北张家口市联合举行,这是我国第一 次举办冬奥会。如图所示的奥运五连环中填入了5种物 质,相连环物质间能发生反应,不相连环物质间不能发 生反应。你认为“五连环”中物质间发生的反应,没有 涉及的基本反应类型和属于氧化还原反应的个数有几
一定”或“一定不”,下同)
(2)复分解反应__一__定__不___是氧化还原反应。 (3)化合反应和分解反应_不__一__定__是氧化还原反应。 ①有单质参加的化合反应_一__定__是氧化还原反应。
一定 ②有单质生成的分解反应_____是氧化还原反应。
【微思考】(1)反应4HCl(浓)+MnO2
MnCl2+Cl2↑+
4.氧化还原反应的特征和本质: (1)特征和本质
(2)两者关系
元素原子 被_氧__化__
元素原子 还原 _____
元素化合价_升__高__
物质
降低 元素化合价_____
物质被
二、氧化还原反应与四种基本反应类型的关系 1.图示关系
2.文字表述
(1)置换反应_一__定__是氧化还原反应。(填“一定”“不
古诗词是古人为我们留下的宝贵精神财富,思考下列诗 句是否都涉及氧化还原反应。 ①野火烧不尽,春风吹又生 ②粉身碎骨浑不怕,要留清白在人间 ③春蚕到死丝方尽,蜡炬成灰泪始干 ④爆竹声中一岁除,春风送暖入屠苏
提示:②不涉及。“粉身碎骨浑不怕,要留清白在人间” 实质是碳酸钙的分解和氧化钙与水的反应,都没有元素 化合价的变化,不属于氧化还原反应。
【思考·讨论】
在氧化还原反应中,被氧化的物质和被还原的物质是
否可以为同一反应物?请举例说明原因。
提示:可以。如反应2KMnO4
K2MnO4+MnO2+O2↑中,参
加反应的KMnO4既表现了还原性,又表现了氧化性。
【案例示范】
【典例】(2019·济南高一检测)ClO2是一种高效水处
理剂,实验室通过以下反应制得ClO2:2KClO3+H2C2O4+
H2SO4
2ClO2↑+K2SO4+2CO2↑+2H2O,关于此反应的
(3)当反应中有一种元素被氧化时,一定有另一种元素 被还原。 ( ) 提示:×。可能是同种元素化合价的升降,如 2H2O2====2H2O+O2↑。
(4)Na2O+H2O====2NaOH属于氧化还原反应。( ) 提示:×。此反应中各元素的化合价均没有发生变化,因 此为非氧化还原反应。
【情境·思考】 《中国诗词大会》是央视首档全民参与的诗词节目,节 目以“赏中华诗词、寻文化基因、品生活之美”为基 本宗旨,力求通过对诗词知识的比拼及赏析,带动全民 重温那些曾经学过的古诗词,分享诗词之美,感受诗词 之趣,从古人的智慧和情怀中汲取营养,涵养心灵。
___有__电__子_转__移_(_得__失_或__偏__移_)_的____ ___化__学_反__应__是_氧__化_还__原__反_应____
【巧判断】 (1)氧化还原反应中一定有氧元素参加。 ( ) 提示:×。氧化还原反应的特征是有元素化合价的变化, 因此与是否有氧元素参加无关。
(2)在氧化还原反应中可能只有元素化合价的升高,而 无元素化合价的降低。 ( ) 提示:×。元素化合价升降是氧化还原反应的特征。
2.氧化还原反应的实质和特征 (1)实质:电子的转移,包括电子的得失和电子对的偏移。 (2)特征:元素化合价的升高和降低。 (3)关系: 原子失去1个电子,元素的化合价就升高1价; 原子得到1个电子,元素的化合价就降低1价;
【易错提醒】认识氧化还原反应的误区
(1)在氧化还原反应中,一种反应物不一定只表现出一
2.从化合价的角度认识氧化还原反应
3.从电子转移的角度认识氧化还原反应
电子得失
分析
氧化 反应
_失__的__去__原__电__子__子___
电子转移
__电离____子的____对原____偏 子____
还原 反应
结论
电子得失
电子转移
__得_到__电__ __子_的__原__子__
__电_子__对__偏__ __向_的__原__子__
