中考化学一轮复习:走进化学世界(知识框架图)
九年级化学各单元知识框架图

初中化学知识框架图第一单元走进化学世界第二单元我们周围的空气第三单元自然界的水第四单元物质构成的奥秘第五单元化学方程式第六单元碳和碳的氧化物第七单元燃料及其利用第八单元金属和金属材料九、溶液十、酸 碱 盐一、化学用语1、电离方程式23224424342;;()23H SO H SO NaOH Na OH Al SO Al SO +-+-+-=+=+=+2、物质的俗称和主要成分:生石灰CaO ;熟石灰、消石灰、石灰水的主要成分Ca(OH)2;石灰石、大理石CaCO3;食盐的主要成分NaCl ;纯碱、口碱Na2CO3;烧碱、火碱、苛性钠NaOH ;胆矾、蓝矾CuSO4.5H2O ;碳酸钠晶体Na2CO3.10H2O ;氨水NH3.H2O ;二、金属活动性1、金属活动性顺序:K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb(H)Cu>Hg>Ag>Pt>Au2、金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
3、金属活动性顺序的应用:(1)排在氢前的金属能置换出酸里的氢(元素)。
(2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K 、Ca 、Na 除外)。
四、酸、碱、盐的溶解性1、常见盐与碱的溶解性:钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
不 饱 和 溶 液 饱 和 溶 液 溶 解 度 结 晶溶 质+溶 剂 溶 液 溶液组成的表示方法 溶质的 质量分数 溶解过程放热现象吸热现象2、八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙、氢氧化镁、氢氧化铜、氢氧化铁3、四微溶物:Ca(OH)2(石灰水注明“澄清”的原因)、CaSO4(实验室制二氧化碳时不用稀硫酸的原因)Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因)、MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)4、三个不存在的物质:氢氧化银、碳酸铝、碳酸铁五、复分解反应发生的条件反应:有气体、水或沉淀生成(即有不在溶液中存在或在水溶液中不易电离的物质)(1)不溶性碱只能与酸性发生中和反应(2)不溶性盐,只有碳酸盐能与酸反应(3)KNO3、NaNO3、AgNO3、BaSO4不能做复分解反应的反应物六、溶液的酸碱性与酸碱度的测定1、指示剂---溶液的酸碱性紫色的石蕊试液遇酸性溶液变红;遇碱性溶液变蓝无色的酚酞试液只遇碱溶液变红注:不溶性碱与指示剂无作用;碱性溶液不一定是碱的溶液(特例:碳酸钠的水溶液显碱性)2、pH值---溶液的酸碱度:pH<7溶液为酸性(越小酸性越强);pH=7溶液为中性;pH>7溶液为碱性(越大碱性越强)七、离子的检验Cl-(在溶液中)---在被测溶液中加入硝酸银溶液,如果生成不溶于硝酸的白色沉淀,则原被测液中含氯离子。
初中化学知识框架图

初中化学知识框架图第一单元走进化学世界知识脉络图第二单元我们周围的空气知识脉络图第三单元自然界的水知识脉络图第四单元物质构成的奥秘知识脉络图第五单元化学方程式知识脉络图第六单元碳和碳的氧化物知识脉络图第七单元燃料及其利用知识脉络图第八单元金属和金属材料知识脉络图第九单元 溶液知识脉络图第十单元 酸碱盐知识脉络图 氧化物、酸、碱和盐的知识点可以从以下十个方面掌握:一、化学用语1、电离方程式23224424342;;()23H SO H SO NaOH Na OH Al SO Al SO +-+-+-=+=+=+2、物质的俗称和主要成分生石灰—CaO ;熟石灰、消石灰、石灰水的主要成分—Ca(OH)2;石灰石、大理石—CaCO 3;食盐的主要成分—NaCl 纯碱、口碱—Na 2CO 3;烧碱、火碱、苛性钠—NaOH ;胆矾、蓝矾—CuSO 4.5H 2O ;碳酸钠晶体—Na 2CO 3.10H 2O ;氨水—NH 3.H 2O二、化合物的分类三、金属活动性1、金属活动性顺序:KCaNaMgAlZnFeSnPb(H)CuHgAgPtAu2、金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
3、金属活动性顺序的应用:(1)排在氢前的金属能置换出酸里的氢(元素)。
(2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K 、Ca 、Na 除外)。
四、酸、碱、盐的溶解性1、常见盐与碱的溶解性:(如果不读出括号中的字,是不是一个较好记忆的顺口溜?) 钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
不 饱 和 溶 液 饱 和 溶 液 溶 解 度 结 晶溶 质+溶 剂 溶 液 溶液组成的表示方法 溶质的 质量分数 溶解过程放热现象吸热现象2、八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙氢氧化镁、氢氧化铜、氢氧化铁3、四微溶物:Ca(OH)2(石灰水注明“澄清”的原因)CaSO4(实验室制二氧化碳时不用稀硫酸的原因)Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因)MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)4、三个不存在的物质:所谓的氢氧化银、碳酸铝、碳酸铁五、分解反应发生的条件反应后有气体、水或沉淀生成。
初中化学各单元知识框架图!家长赶紧为孩子收藏着!

初中化学各单元知识框架图!家长赶紧为孩子收藏着!唠叨一句:图片看不清的,可以点击图片放大看!初中化学知识框架图第一单元走进化学世界第二单元我们周围的空气第三单元自然界的水第四单元物质构成的奥秘第五单元化学方程式第六单元碳和碳的氧化物第七单元燃料及其利用第八单元金属和金属材料九、溶液十、酸碱盐一、化学用语1、电离方程式2、物质的俗称和主要成分:生石灰CaO;熟石灰、消石灰、石灰水的主要成分Ca(OH)2;石灰石、大理石CaCO3;食盐的主要成分NaCl ;纯碱、口碱Na2CO3;烧碱、火碱、苛性钠NaOH;胆矾、蓝矾CuSO4.5H2O;碳酸钠晶体Na2CO3.10H2O;氨水NH3.H2O;二、金属活动性1、金属活动性顺序:K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb(H)Cu>Hg>Ag>Pt>Au2、金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
3、金属活动性顺序的应用:(1)排在氢前的金属能置换出酸里的氢(元素)。
(2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K、Ca、Na除外)。
四、酸、碱、盐的溶解性1、常见盐与碱的溶解性:钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2、八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙、氢氧化镁、氢氧化铜、氢氧化铁3、四微溶物:Ca(OH)2(石灰水注明“澄清”的原因)、CaSO4(实验室制二氧化碳时不用稀硫酸的原因)Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因)、MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)4、三个不存在的物质:氢氧化银、碳酸铝、碳酸铁五、复分解反应发生的条件反应:有气体、水或沉淀生成(即有不在溶液中存在或在水溶液中不易电离的物质)(1)不溶性碱只能与酸性发生中和反应(2)不溶性盐,只有碳酸盐能与酸反应(3)KNO3、NaNO3、AgNO3、BaSO4不能做复分解反应的反应物六、溶液的酸碱性与酸碱度的测定1、指示剂---溶液的酸碱性紫色的石蕊试液遇酸性溶液变红;遇碱性溶液变蓝无色的酚酞试液只遇碱溶液变红注:不溶性碱与指示剂无作用;碱性溶液不一定是碱的溶液(特例:碳酸钠的水溶液显碱性)2、pH值---溶液的酸碱度:pH7溶液为碱性(越大碱性越强)七、离子的检验Cl-(在溶液中)---在被测溶液中加入硝酸银溶液,如果生成不溶于硝酸的白色沉淀,则原被测液中含氯离子。
初中化学各单元知识点框架图

初中化学各单元知识点框架图work Information Technology Company.2020YEAR初中化学各单元知识点框架图第一单元走进化学世界第二单元我们周围的空气第三单元自然界的水第四单元物质构成的奥秘第五单元化学方程式第六单元碳和碳的氧化物第七单元燃料及其利用第八单元金属和金属材料第九单元溶液第十单元 酸、碱、盐(一)化学用语1电离方程式:-++=24422SO H SO H ;-++=OH Na NaOH ;-++=24334232)(SO Al SO Al2物质的俗称和主要成分:生石灰CaO ;熟石灰、消石灰、石灰水的主要成分Ca(OH)2;石灰石、大理石CaCO 3;食盐的主要成分NaCl ;纯碱、口碱Na 2CO 3;烧碱、火碱、苛性钠NaOH ;胆矾、蓝矾CuSO 4·5H 2O ;碳酸钠晶体Na 2CO 3·10H 2O ;氨水NH 3·H 2O 。
(二)金属活动性 1金属活动性顺序:K >Ca >Na >Mg >Al >Zn >Fe >Sn >Pb(H)Cu >Hg >Ag >Pt >Au 2金属活动性顺序的意义:在金属活动顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失去电子而变成离子,它的活动性就越强。
3金属活动性顺序的应用:⑴排在氢前的金属能置换出酸里的氢(元素)。
⑵排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K 、Ca 、Na 除外)。
(三)酸、碱、盐的溶解性1常见盐与碱的溶解性钾(盐)、钠(盐)铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2八个常见的沉淀物氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙、氢氧化镁、氢氧化铜、氢氧化铁 3四微溶物Ca(OH)2(石灰水注明:澄清“的原因)CaSO 4(实验室制二氧化碳时不用稀硫酸的原因)Ag 2SO 4(鉴别-24SO 和-Cl 时,不用硝酸银的原因)MgCO 3(碳酸根离子不能用于在溶液中除去镁离子的原因)4三个不存在的物质氢氧化银、碳酸铝、碳酸铁(四)复分解反应发生的条件反应有气体、水或沉淀生成(即有不在溶液中存在或在水溶液中不易电离的物质)1、不溶性碱只能与酸性发生中和反应;2、不溶性盐,只有碳酸盐能与酸反应;3、KNO 3、NaNO 3、AgNO 3、BaSO 4不能做复分解反应的反应物。
(完整版)初中化学全册十个知识框架图

初中化学全册10个知识框架图,轻松拿高分!化学好老师第一单元:走进化学世界第二单元:我们周围的空气第三单元:自然界的水第四单元:物质构成的奥秘第五单元:化学方程式第六单元:碳和碳的氧化物第七单元:燃料及其利用第八单元:金属和金属材料第九单元:溶液第十单元:酸碱盐一、化学用语1、电离方程式:2、物质的俗称和主要成分:生石灰CaO;熟石灰、消石灰、石灰水的主要成分Ca(OH)2;石灰石、大理石CaCO3;食盐的主要成分NaCl ;纯碱、口碱Na2CO3;烧碱、火碱、苛性钠NaOH;胆矾、蓝矾CuSO4·5H2O;碳酸钠晶体Na2CO3.10H2O;氨水NH3.H2O。
二、金属活动性1、金属活动性顺序:K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb(H)Cu>Hg>Ag>Pt>Au2、金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
3、金属活动性顺序的应用:(1)排在氢前的金属能置换出酸里的氢(元素)。
(2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K、Ca、Na 除外)。
三、酸、碱、盐的溶解性1、常见盐与碱的溶解性:钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2、八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙、氢氧化镁、氢氧化铜、氢氧化铁3、四微溶物:Ca(OH)2(石灰水注明“澄清”的原因)、CaSO4(实验室制二氧化碳时不用稀硫酸的原因)Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因)、MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)4、三个不存在的物质:氢氧化银、碳酸铝、碳酸铁四、复分解反应发生的条件反应有气体、水或沉淀生成(即有不在溶液中存在或在水溶液中不易电离的物质)1、不溶性碱只能与酸性发生中和反应;2、不溶性盐,只有碳酸盐能与酸反应;3、KNO3、NaNO3、AgNO3、BaSO4不能做复分解反应的反应物。
初中化学各单元知识框架图
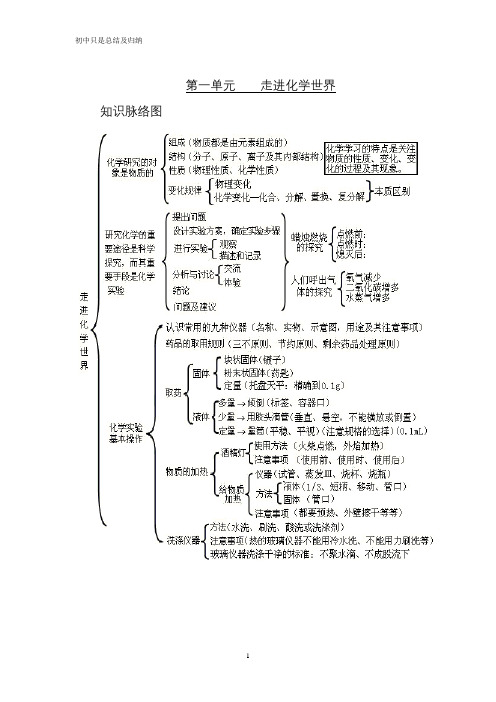
第一单元走进化学世界知识脉络图第二单元我们周围的空气知识脉络图第三单元自然界的水知识脉络图第四单元物质构成的奥秘知识脉络图第五单元化学方程式知识脉络图第六单元碳和碳的氧化物知识脉络图第七单元燃料及其利用第八单元金属和金属材料九、溶液十、酸 碱 盐氧化物、酸、碱和盐的知识点可以从以下十个方面掌握: 一、化学用语 1、电离方程式23224424342;;()23H SO H SO NaOH Na OH Al SO Al SO +-+-+-=+=+=+2、物质的俗称和主要成分生石灰:CaO熟石灰、消石灰、石灰水的主要成分:Ca(OH)2石灰石、大理石:CaCO3 食盐的主要成分:NaCl 纯碱、口碱:Na2CO3 烧碱、火碱、苛性钠:NaOH 胆矾、蓝矾:CuSO4.5H2O 碳酸钠晶体:Na2CO3.10H2O 氨水:NH3.H2O 二、化合物的分类三、金属活动性1、金属活动性顺序: KCaNaMgAlZnFeSnPb(H)CuHgAgPtAu2、金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
3、金属活动性顺序的应用: (1)排在氢前的金属能置换出酸里的氢(元素)。
(2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K 、Ca 、Na 除外)。
四、酸、碱、盐的溶解性1、常见盐与碱的溶解性:(如果不读出括号中的字,是不是一个较好记忆的顺口溜): 钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2、八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙氢氧化镁、氢氧化铜、氢氧化铁四微溶物:Ca(OH)2(石灰水注明“澄清”的原因)CaSO4(实验室制二氧化碳时不用稀硫酸的原因)Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因)MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)4、三个不存在的物质:所谓的氢氧化银、碳酸铝、碳酸铁五、分解反应发生的条件反应后有气体、水或沉淀生成。
初中化学各单元知识框架图(全)

第六单元 碳和碳的氧化物
二氧化碳气体通到紫色石蕊溶液中,溶液变红,是因为二氧化碳与水反映生成了碳酸。不用燃着木条熄灭来查验二氧化碳,用澄清石灰水。因为使木条熄灭的还有氮气、稀有气体等,但能够验满。
第七单元 燃料及其利用
通式:AB + CD === AD + CB
复分解反映 条件:有H2O或↑或↓生成(酸、碱、盐的溶解性表P109)
应用:(物质共存、除杂质、辨别)
分类:氮肥、磷肥、钾肥、复合肥
各类化肥的作用:氮肥(叶)、磷肥(果实)、钾肥(茎,抗倒伏)
氮肥
辨别 磷肥 (①看外观或溶解→②加熟石灰研磨,有刺激性气味是铵盐)
第十பைடு நூலகம்单元盐与化肥
俗称:食盐
物性:溶解度随温度转变改变小。
用途:调味品,生理盐水
步骤:溶解→过滤→蒸发→计算产率
仪器:
溶解时:搅拌,加速溶解
粗盐提纯 玻璃棒用途 过滤时:引流
蒸发时:搅拌,避免液滴飞溅
产率误差 偏高:①过滤不干净;②水没有蒸干。
偏低:①过滤时无润洗烧杯和玻璃棒②过滤或蒸发时液滴飞溅③
外因:温度温度升高,溶解度转变不大(如NaCl)
温度升高,溶解度降低(如熟石灰)
读出某温度下的溶解度(读出某溶解度下的温度)
比较(某温度)下不同物质的溶解度
交点意义:表示该温度下两物质的溶解度相同
溶解度受温度阻碍大:用降温结晶的方式
溶解度受温度阻碍小:用蒸发溶剂的方式
二、气体溶解度:阻碍因素:温度(温度升高,溶解度降低,反之)
第八单元 金属和金属材料
第九单元溶液
初中化学知识框架图

初中化学各单元知识框架图第一单元走进化学世界知识脉络图第二单元我们周围的空气知识脉络图第三单元自然界的水知识脉络图第四单元物质构成的奥秘知识脉络图第五单元化学方程式知识脉络图第六单元碳和碳的氧化物知识脉络图第七单元燃料及其利用第八单元金属和金属材料九、溶液十、酸 碱 盐氧化物、酸、碱和盐的知识点可以从以下十个方面掌握: 一、化学用语 1、电离方程式23224424342;;()23H SO H SO NaOH Na OH Al SO Al SO +-+-+-=+=+=+2、物质的俗称和主要成分生石灰:CaO熟石灰、消石灰、石灰水的主要成分:Ca(OH)2石灰石、大理石:CaCO3 食盐的主要成分:NaCl 纯碱、口碱:Na2CO3 烧碱、火碱、苛性钠:NaOH 胆矾、蓝矾:CuSO4.5H2O 碳酸钠晶体:Na2CO3.10H2O 氨水:NH3.H2O 二、化合物的分类三、金属活动性1、金属活动性顺序: KCaNaMgAlZnFeSnPb(H)CuHgAgPtAu2、金属活动性顺序的意义:在金属活动性顺序中,金属位置越靠前,金属在水溶液(酸溶液或盐溶液)中就越容易失电子而变成离子,它的活动性就越强。
3、金属活动性顺序的应用: (1)排在氢前的金属能置换出酸里的氢(元素)。
(2)排在前面的金属才能把排在后面的金属从它们的盐溶液中置换出来(K 、Ca 、Na 除外)。
四、酸、碱、盐的溶解性1、常见盐与碱的溶解性:(如果不读出括号中的字,是不是一个较好记忆的顺口溜): 钾(盐)、钠(盐)、铵盐全都溶,硝酸盐遇水影无踪。
硫酸盐不溶硫酸钡,氯化物不溶氯化银。
碳酸盐只溶钾(盐)、钠(盐)、铵(盐)。
碱类物质溶解性:只有(氢氧化)钾、(氢氧化)钠、(氢氧化)钙、(氢氧化)钡溶。
2、八个常见的沉淀物:氯化银、硫酸钡碳酸银、碳酸钡、碳酸钙氢氧化镁、氢氧化铜、氢氧化铁四微溶物:Ca(OH)2(石灰水注明“澄清”的原因)CaSO4(实验室制二氧化碳时不用稀硫酸的原因)Ag2SO4(鉴别SO42-和Cl-时,不用硝酸银的原因)MgCO3(碳酸根离子不能用于在溶液中除去镁离子的原因)4、三个不存在的物质:所谓的氢氧化银、碳酸铝、碳酸铁五、分解反应发生的条件反应后有气体、水或沉淀生成。
