3 化学反应速率和化学平衡 PPT课件
选修4 第二章 化学反应速率与化学平衡 第三节 化学平衡(化学平衡常数) .ppt

一、化学平衡常数(K) 1、定义
一定温度下,对于已达平衡的反应体系中, 生成物浓度幂之积与反应物浓度幂之积的比值是 一个常数是个常数,这个常数叫做该反应的化学 平衡常数。
【试一试】
1、写出反应:2SO2(g) + O2(g) 2SO3(g)的化学 平衡常数表达式,并判断K的单位。
2、对任意可逆反应: mA(g)+nB(g) pC(g)+ qD(g),写出其化学平衡常数的表达式。
探究:将NO2球浸泡在冷水、热水中,观察颜色变化 【交流、探讨】科学家设计并进行了严密的实验,在 298K、333K时分别测得下表中的数据:
温度 初始浓度(mol/L) 平衡浓度(mol/L) (K) c(N2O4) c(NO2) c(N2O4) c(NO2) 298 333 0.050 0.050 0 0 0.02175 0.00488 0.05650 0.0901
c(I2)
0.01196 0.009044
c (HI)
0 0
c(I2)
0.003129 0.001250
c (HI)
0.01767 0.01559
54.498
54.618 54.329 8.298
③
④ 798.6 ⑤ ⑥
0
0.01135 0 0
0
0.00904 0 0
0.01069
0 0.01655 0.01258
0.008410
0.00859 0.00977 0.00742
8.306
8.272
1、请计算填写表中空格。 2、讨论:分析上述数据,你能得出什么结论?
结论: 在一定温度下,可逆反应无论从正反 应开始,还是从逆反应开始,又不论反应 物起始浓度的大小,最后都能达到化学平 衡,这时HI(g)浓度的平方与I2(g)浓度和 H2(g)浓度之积的比值是一个常数。
2023届高三化学高考备考二轮复习课件专题七 化学反应速率和化学平衡

衡状态,x<0.4,即x≠0.4,B正确;C.
实验①、实验②中0~20 min、20~40 min氨气浓度变化量都是4.00×10-4 mol·L-1,
实验②中60 min时反应达到平衡状态,实验①和实验②催化剂表面积相同,实验①
中氨气初始浓度是实验②中氨气初始浓度的两倍,实验①60 min时反应未达到平衡
浓度c随反应时间t的部分变化曲线如图,则
A.无催化剂时,反应不能进行
B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低
C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化
答案:D
(
)
2Y的影响,各物质
解析:A.由图可知,无催化剂时,随时间推移,生成物浓度也在增加,说明反应也
在进行,故A错误;B.由图可知,催化剂Ⅰ比催化剂Ⅱ催化效果好,说明催化剂Ⅰ
答案:(2)5.4
相同催化剂,400 ℃的反应速率更快,相同温度,催化剂Ⅱ副产
物浓度低,甲烷与甲醇比例高
解析(2)在选择使用催化剂Ⅰ和350 ℃条件下反应,由表中信息可知,0~2 min
CH3OH的浓度由0增加到10.8 μmol·L-1,因此,0~2 min生成CH3OH的平均反应
. ·−
素,降低反应温度,化学反应速率减小,k减小,D项正确。
解题技法
信息条件下化学反应速率的比较方法
(1)讨论外界条件c、T、p、催化剂不同时,研究化学反应速率的大小。
(2)讨论不同反应的活化能,研究化学反应速率的大小。
(3)讨论化学反应方向,如Q与K相对大小、平衡建立过程等,研究v正、v逆的相对
大小,正向进行:v正>v逆,逆向进行:v正<v逆。
度变化来表示反应速率,但是固态反应物颗粒的大小是影响反应速率的条件之一,
公开课化学反应速率和化学平衡图像PPT课件
T2C
T1C
看图技巧: •先拐先平衡,
0 t1
t2 时间
•先平衡则速率快, •速率快则温度高。
1.物质百分含量(w%)——时间(t)曲线
7
mA(g)+nB(g) pC(g)+qD(g)
问题:1 、P1与P2的相对大小
2 、 m+n 与 p+q 的大小
B
?的
物
质 的 量
P2 P1
答 P1 > P2 案 m+n > p+q
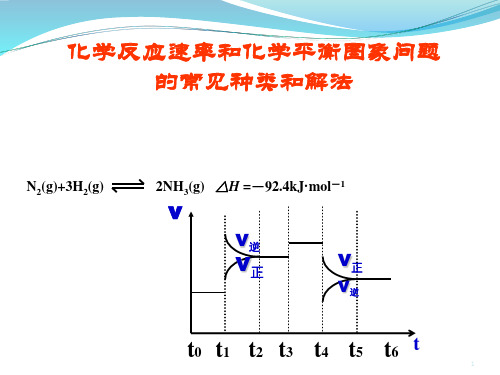
△H =-92.4kJ·mol-1右图是某一时间段中反应速率与反
应进程的曲线关系图,回答下列问题:
(1)处于平衡状态的时间段 ν
是_t0_~__t1_,__t_2~__t_4_,__t5_~__t6。
ν逆
(2)t1、t3、t4时刻体系中分
ν正
ν逆
别是什么条件发生了变化?
ν正
t1:升温; t3:加催化剂; t4:减压
0
时间
8
2.转化率(α)——时间(t)曲线
mA(g)+nB(g) pC(g)+qD(g) ΔH=Q
问题: m+n<p+q还是 m+n<p+q
A
m+n>p+q
的
转
化
1.01106Pa
率
1.01107Pa
0 t1
t2
时间
9
mA(g)+nB(g) pC(g)+qD(g)
A
转
化
1.01107Pa
率
m+n = p+q
时间(t)图
高考化学复习《化学反应速率和化学平衡图象》名师专题讲解PPT

入1 mol SO3(g)
D.保持温度和压强不变,充入1
mol SO3(g)
走进高考
(09年广东化学15)取五等份NO2 ,分别加入温度不同、 容积相同的恒容密闭容器中,发生反应:2NO2(g) N2O4(g), ΔH<0 反应相同时间后,分别测定体系中NO2的百分量 (NO2%),并作出其随反应温度(T)变化的关系图。 下列示意图中,可能与实验结果相符的是( ) BD
X A 温度 Y C的体积分数
B C D
充入稀有气体 再加入A 再加入C
A的物质的量 B的转化率 A的百分含量
可逆反应mA(g)+nB(g) pC(g)+gD(g)的v-t图象如 左图所示,若其他条件都不变,只是在反应前加入合适 的催化剂,则其v-t图象如右图所示。 ①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧图Ⅱ中阴影 部分面积更大。以上所列正确的为( A ) A.②④⑤⑦ B.②④⑥⑧ C.②③⑤⑦ D.②③⑥⑧
走进高考
( 10年· 四川高考)反应aM(g)+bN(g) cP(g)+dQ(g)达到 平衡时,M的体积分数y(M)与反应条件的关系如下图所 示.其中z表示反应开始时N的物质的量与M的物质的量之 比.下列说法正确的是 ( B )
A.同温同压同z时,加入催化剂,平衡时Q的体积分数增加 B.同压同z时,升高温度,平衡时Q的体积分数增加 C.同温同z时,增加压强,平衡时Q的体积分数增加 D.同温同压时,增加z,平衡时Q的体积分数增加
课堂总结:解答图像题的一般步骤:
第一步:看图像——明白坐标轴代表的是什么量,弄 清图中曲线的形状和涵义 ⑴一看面——坐标含义:坐标代表的物理量和单位是 什么?是反应物、生成物,还是两者的混合物。原点是否 为 0。 ⑵二看线——即线的斜率大小,平与陡的含义;函数 的增减性。(看图像的走向,即变化趋势) ⑶三看点——即起点、终点、转折点、交叉点。(转折 点是解题重要依据) ⑷四看要不要作辅助线——等温线、等压线等。 ⑸五看量——定量图像中有关量的问题。
高二化学化学反应速率和化学平衡图象PPT精品课件

[解题指导] 选 A 根据图象可知A正确;前20 min内A的平 均反应速率为0.05 mol/(L·min),B错;因为A、B变化的趋 势一样,故x=1,再根据时间—速率图象可知,升高温度反 应逆向移动,因此正反应为放热反应,C错;30 min时,速 率下降,但平衡未发生移动,故改变的条件是降低了压强, D也错.
(2)如右图,对于化学反应mA(g)
+nB(g)
qC(g)+pD(g),l线
上所有的点都是平衡点.在上方
(E点),A%大于此压强时平衡体
系中的A%,所以,E点v(正)>v(逆);在下方(F点),A%小于
此压强时平衡体系中的A%,则v(正)<v(逆).
二、方法思路 1.看懂图象
一看面,即看清横坐标和纵坐标;二看线,即看线的 走向和变化趋势;三看点,即看线是否通过原点,两 条线的交点和线的拐点;四看要不要作辅助线,即看 是否需要作等温线和等压线;五看定量图象中有关量 的多少.
由(3)可知,p1压强先到达平衡,故p1>p2, 而C%不变说明m+n=p+q,或条件为 加入了催化剂.
由(4)中(A)、(B)两线可知,p1<p2,m+ n<p+q.由(B)、(C)两线可知,T1<T2, ΔH<0.
4.几种特殊图象 (1)如右图,对于化学反应mA(g)+nB(g)
qC(g)+pD(g),M点前,表示从反应物开始, 则v(正)>v(逆);M点为刚好达到平衡点.M 点后为平衡受温度的影响情况,即升温, A%增加,平衡左移,ΔH<0.
的浓度表示的逆反应速率 D.从反应开始到平衡,H2的平均反应速率v(H2)=0.075
2024届高考一轮复习化学课件:化学反应速率和平衡图像及分析

图像
温 升高
降低
t1时刻 度 正反应为放热的反应
所改变
增大
减小
压
的条件
正反应为气体物质的量增大的反
强
应
升高
降低
正反应为吸热的反应
增大
减小
正反应为气体物质的量减小
的反应
3.“平台”类v-t图像及分析
图像
分析
结论
其他条件不变,t1时使用
t1时v'(正)、v'(逆)均突然 催化剂
增大且v'(正)=v'(逆),平衡 其他条件不变,t1时增大
增大X或Y的浓度,平衡正向移动,则Z的浓度增大,D错误。
考点二
化学平衡图像
必备知识 自主预诊
1.浓度(转化率、百分含量)—时间图像及分析
C%指生成物的百分含量,B%指反应物的百分含量。
(a 用催化剂,b 不用)
(T2>T1,正反应为吸热反应)
(T2>T1,正反应为放热反应)
(p1>p2,正反应为体积减小的反应)
D.反应进行至25 min时,曲线发生变化的原因是增加Y的浓度
思路导引(1)分析体系及反应特点:①恒温恒容体系;②正反应是气体体积
减小的放热反应。
(2)分析图像:横坐标是时间,纵坐标是浓度
的大小;25 min 时 c(Y)逐渐增大,c(X)瞬间增大
图中曲线的斜率表示反应速率
外界条件的变化。
答案 D
mol
(1- + 3-3 + + )mol
×100%=30%,解得x=0.75,则CO2的转化率为75%,B正确;随着温度的升高,
甲醇的体积分数减小,平衡向逆反应方向移动,正反应为放热反应,压强越
化学反应的调控ppt课件
第四节 化学反应的调控
学习目标(1min)
1. 知道如何应用化学反应速率和化学平衡分析合成氨的适宜条件,体会 应用化学原理分析化工生产条件的思路和方法。 2. 认识化学反应速率和化学平衡的综合调控在生产、生活和科学研究中 的重要作用。 3. 在合成氨适宜条件的讨论中,形成多角度分析化学反应和化工生产条 件的思路。
(1)根据化学理论和以上数据综合分析,为了使二氧化硫尽可能转化为三氧化硫,可 控制的条件是什么? 常压、450 ℃、催化剂
5. 在硫酸工业中,通过下列反应使SO2氧化成SO3:2SO2(g) + O2(g)
2SO3(g)
ΔH = -198 kJ·mol-1。回答下列(1)-(5)题:(已知催化剂是V2O5,在400~500℃时催化
平衡分析
外界条件 使NH3生产得快 使NH3生产得多 理论选择适宜条件
压强
高压 一致 高压
高压
温度
高温 矛盾 低温
?
催化剂
使用
无影响
?
反应物浓度 增大浓度
增大浓度
增大浓度
(一)压强:合成氨厂一般采用的压强为10 MPa~30 Mpa。
【思考1】合成氨时压强越大越好,为何 不采用比30 MPa更大的压强?
浓度 增大 移走氨
影响因素
温度 升温
压强 增大
降温
增大
催化剂 正催化剂 不影响
增大合成氨的反应速率与提高平衡混合物中 氨的含量所应采取的措施是否一致?
在实际生产中到底选择哪些 适宜的条件呢?
二、合成氨反应的数据分析 把成本也考虑进去,即综合考量速率、产率、成本
(初始时氮气和氢气的体积比是1:3) 下表的实验数据是在不同温度、压强下,平衡混合物中氨的含量的变化情况
化学平衡经典完整ppt课件
①增大水蒸汽浓度 ②加入固体炭 ③增加H2浓度
正向移动,CO浓度增大 不移动,CO浓度不变 逆向移动,CO浓度减小
结论:对平衡体系中的固态和纯液态物质,增加或减
小固态或液态纯净物的量并不影响v正、v逆的大小,所 以化学平衡不移动。
精选PPT课件
27
思考与交流
(3)如图是合成氨的反应,N2(g)+3H2(g) 速率随时间的变化关系图。
2NH3
v—t图
v v正 v’正 = v’逆
v逆
0
t1
t
精选PPT课件
5
二、化学平衡
1、概念: 在外界条件不变的情况下,可逆反应进行到一定
的程度时,v正 = v逆,反应物和生成物的浓度不再 发生变化,反应达到限度的状态,即化学平衡
精选PPT课件
6
2、化学平衡的特征: 逆、等、动、定、变 ⑴逆: 研究的对象是可逆反应。 ⑵动: v正>0; v逆 >0
2NH3(g),
①t0时反应从哪方开始?
②t1、t2分别改变的 条件及平衡移动的方向?
t0
t1
t2
精选PPT课件
28
2、压强对化学平衡的影响
思考3:对于可逆反应:2SO2(g)+O2(g)⇌2SO3(g) ①密闭容器中,加2molSO2,1molO2,画出达到平衡时 的v-t图 ②平衡后的某个时刻t1,缩小容器的体积(即增大压强), 此时v正、v逆如何变?为什么?
(1)体系中各组分的浓度不变√ (2)当m+n不等于p时,体系总压强不变√
(3)当m+n等于p时,体系总压强不变 (4)当A有颜色(B、C都无色)时,体系的颜色和
深浅不变√
精选PPT课件
《化学反应的速率和限度》课件23(45张PPT)
《化学反应的速率和限度》课件23(45张ppt)第三节化学反应的速率和限度化学反应有快有慢:hcl+naoh=nacl+h2o千分之一秒即完成h2+cl2=2hcl百分之一秒即完成救心丹几分钟见效钢铁腐蚀若干年煤、石油等化石燃料的形成几千万年以上定义:化学反应速率用单位时间(如每秒,每分,每小时)内反应物浓度的减小或生成物浓度的增大来表示。
计算式:一、化学反应速率(物质的量浓度)练习巩固= 0.3mol/(l·s)v (nh3) ==例题:反应4nh3+5o2 4no+6h2o 在5升的密闭容器中进行,30秒后,no 的物质的量增加了0.3mol,此反应的平均反应速率用no来表示为多少?问题1:若用o2的浓度变化来表示此反应速率是多少?若用nh3 来表示呢?问题2:此反应化学反应速率用不同物质表示为什么数值不同?数值上有何规律?v(no)=0.002mol/l·sv(o2)=0.0025mol/l·sv(nh3)=0.002mol/l·s化学反应速率的特点—①同一反应,可用不同物质在单位时间内浓度的变化来表示,但必须指明是用哪种反应物或哪种生成物来表示。
②用不同物质在单位时间内浓度变化表示时,速率比等于方程式中的系数比③均取正值,且是某一段时间内的平均速率。
练习向一个容积为1l的密闭容器中放入2molso2和1molo2,在一定条件下反应,2s末,测得容器内有0.8molso2,求2s内so2,o2,so3的反应速率和反应速率比.练习2在一定条件下,ma+nb=pc的反应中,各物质的化学反应速率为v(a)=amol·l-1·s-1,v(b)=a/2mol·l-1·s-1,v(c)=amol·l-1·s-1,则该反应的化学方程式是。
2a+b=2c练习则该反应速率的快慢顺序为:反应 a + 3b = 2c + 2d 在四种不同条件下的反应速率为:(1)ν(a)=0.3mol/(l·s )(2) ν(b)=0.6mol/(l·s)(3) ν(c)=0.4mol/(l·s)(4) ν(d)=0.45mol/(l·s)(1)>(4)>(2)=(3)反思:比较反应的快慢,应取同一参照物在相同条件下,等质量(金属颗粒大小相同)的下列金属与足量1mol/l 盐酸反应时,速率最快的是a 镁b 铝c 钠d 铁二、影响化学反应速率的因素§化学反应速率是由反应物的性质决定的;内因是主要因素外因因素:实验2-5产生气泡速率增大,带火星火柴复燃升高温度,反应速率增大有气泡冒出产生气泡速率减小降低温度,反应速率减小规律:当其它条件不变时,升高温度,化学反应速率增大。
