化学式的简单计算
化学方程式的简单计算

化学方程式的简单计算
化学方程式是用来表示化学反应的重要工具,它由反应物和生成物组成,反应物通常出现在左边,而生成物则出现在右边。
它们之间通常用箭头来表示反应发生的方向。
例如,水的化学方程式可以写为:2H2 + O2 → 2H2O。
这个方程式表明,当两个氢原子和一个氧原子发生反应时,会产生两个水分子。
在这个例子中,反应物是氢和氧,而生成物是水。
另外,系数的使用是必要的,因为反应物和生成物的数量必须是化学方程式中指定的数量。
化学方程式的计算是用来预测一个化学反应中每种物质的含量。
它通过确定一个反应中反应物和生成物的组成来实现这一目的。
例如,如果我们想要预测2H2 + O2 → 2H2O反应中水的含量,我们可以计算出氢的数量和氧的数量,然后将它们相乘以计算出水的数量。
化学方程式的计算可以用来确定某个化学反应的稳定性。
例如,如果某个反应中反应物的数量比生成物的数量少,则反应不会发生,即使在把外加能量的情况下也是如此。
总之,化学方程式的计算是一种强有力的工具,可以用来描述和预测反应物和生成物之间的权衡。
它还可以用来确定反应的稳定性,以及反应中每种物质的含量。
因此,理解并正确使用化学方程式的
计算非常重要。
利用化学方程式的简单计算
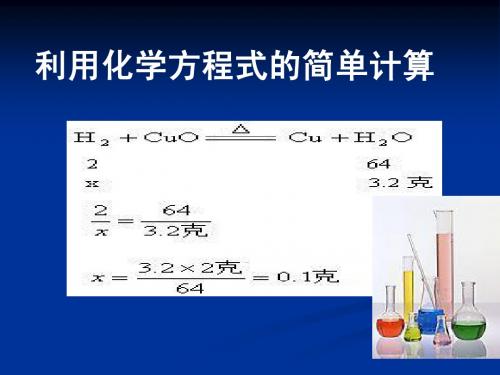
分析
石灰石中含CaCO3的质量:100t×(1-20%)=80t
得到的生石灰中含CaO:1-12%=88%
解:设可以得到含杂质12%的生石灰为χ。
CaCO3
100
高温
CaO + CO2↑
56
100t × (1-20%)
χ(1-12%)
100 56
=
100t X (1-20%)
χ(1-12%)
χ= 51t
答:放出氧气的质量为4.8g;剩余固体是氯化钾和二氧化锰,氯化 钾为7.5g二氧化锰为3.2g;参加反应的氯酸钾为12.3g。
利用化学方程式进行简单计 算时的主要步骤:
1.设未知量…………………………设
2.写方程式并配平…………………写 3.在相关物质的化学………………标 式下面标出其相对分 子质量和真实质量 4.列比例式求解……………………列 5.简明的写出答案…………………答
化学方程式计算的注意事项:
三个关键:
准确书写化学式 化学方程式要配平 准确计算相对分子质量
三个要领:
步骤要完整
格式要规范 得数要准确
“混合物”,一般要将之换算成“纯净物”ห้องสมุดไป่ตู้
请你“诊断”
15.8g高锰酸钾粉末加热至完全分解最多得到 氧气多少克?
解:设最多能生成氧气的质量为Xg
KMnO4 158 15.8g
解:设需要碳酸钙的质量为x CaCO3 + 2HCl CaCl2 + H2O 100 X 100 X = 8.8g 44 X= 20g 答:至少需要碳酸钙20g
C:12 O:16)
+ CO2 44 8.8g
有关混合物的计算
“混合物”,一般要将之换算成“纯净物”
化学方程式的简单计算

化学方程式的简单计算
化学方程式是用来描述化学反应及其中反应物及反应产物的化学组成的一种表示方法,它有助于我们理解化学反应的本质,及由此引起的变化。
化学方程式的简单计算是通过把反应的化学物质的分子式、原子数和化学符号等信息表示出来,然后根据反应前后化学物质的原子数之间的变化来进行简单的计算,从而对化学反应进行确定性分析。
例如,当氧化物和酸反应时,可以用一个化学方程式来表示:H2O2 +2HCl →2H2O + Cl2 。
从这个化学方程式中可以看出,氢氧化物的原子数从2个减少到0个,氯原子的原子数从0个增加到2个,水的原子数从0个增加到2个,酸的原子数从2个减少到0个,因此可以计算出氢氧化物的量为2 mol,氯的量为2 mol,水的量为2 mol,酸的量为2 mol。
化学方程式的简单计算是化学研究的重要工具,它可以帮助我们更好地理解和掌握反应的性质。
通过计算反应中物质的数量,我们可以探究该反应的活化能、生成物的选择性、反应速率等,从而得出有效的解决方案。
例如,在反应的物质数量不变的情况下,当反应温度增加时,反应速率会增加,从而可以更快地完成反应。
总之,化学方程式的简单计算是一种用来描述化学反应及其中反应
物及反应产物的化学组成的有效表示方法,它可以帮助我们更好地理解和掌握反应的性质,从而得出有效的解决方案。
化学人教版九上培优必备精讲精练:5.3 化学方程式简单计算

课题3 化学方程式的简单计算【知识精要】一、利用化学方程式计算的步骤及格式1.设未知量;2.写出相关的化学方程式;3.根据化学方程式把各物质的质量比列在相应化学式的下面;4.把题中的已知条件和待求的未知量列在相应物质的化学式下面;5.列比例式求解;6.写出简明答案。
例:工业上,高温煅烧石灰石(主要成分是CaCO 3)可制得生石灰(CaO )和二氧化碳。
请问制取1t 氧化钙,需要碳酸钙多少吨? 解:①根据题意设未知量设需要碳酸钙的质量为x 。
②写出反应的化学方程式并配平 CaCO 3 CaO +CO 2↑ ③写出相关物质的相对分子质量 100 56和已知量、未知量x1t④列出比例式,求解 x=1.8t ⑤简明地写出答案 答:需要碳酸钙1.8t 。
【特别注意】根据化学方程式计算注意的问题:1.计算过程必须规范,步骤可概括为“一设、二写、三列、四解、五答”。
2.设未知数X 时,不能在X 后面带上单位。
3.只写出已知条件和未知量相关的物质的质量比。
4.计算过程中已知量一定要带上单位。
5.一定要将化学方程式配平后才能进行化学计算。
6.计算出的结果一定要带上单位。
7.不纯物质的质量不能代入化学方程式进行计算。
x 56100 1t【题典精讲】【例题1】能根据化学方程式计算是由于( )A.化学方程式表示了化学反应过程B.化学方程式表示了反应物和生成物各是什么物质C.化学方程式表示了反应物和生成物之间的粒子个数比D.化学方程式表示了反应物和生成物之间的质量比【答案】D【解析】化学反应方程式计算表示反应物和生成物的质量关系。
故选D 【例题2】6g 镁在足量的氧气中完全燃烧,可得到氧化镁的质量是( )A.20g B.12g C.10g D.8g【答案】C【解析】设生成的氧化镁质量x 2Mg+O 2点燃¯2MgO 48 806gx4880=6gx,x=10g 故选C【例题3】在天平两边的托盘各放一个质量相等的烧杯,并分别加入等质量、等质量分数的足量的稀盐酸,若向左盘烧杯中加入50g CaCO 3,欲使天平平衡,应向右盘烧杯加入的物质可能是( )①Al 粉31.5g②MgCO 3与Na 2CO 3的混合物50g③固体铜30g ④MgO 与Mg (OH )2的混合物28g A .只有① B .只有①、②C .只有①②③D .只有①②④【答案】D【解析】设左边烧杯中产生的二氧化碳的质量为x CaCO 3+2HCl═CaCl 2+H 2O+CO 2↑ 100 44 50g x10044=50gxx =22g左边烧杯的质量增加量为:50g ﹣22g =28g ,也就是说右边烧杯的质量增加量也为28g 天平才能保持平衡;①根据2Al~3H2可知,31.5gAl生成氢气的质量为3.5g,右盘增加的质量为:31.5g﹣3.5g=28g,故①正确;②50g全部是MgCO3生成二氧化碳的质量是26.2g;50g全部是生成二氧化碳的质量为20.8g,右盘增加的质量在23.8g~29.2g之间,故②正确;③固体铜不与稀盐酸反应,右盘增加的质量是30g,故③错误;④MgO与Mg(OH)2都和稀盐酸反应生成氯化镁,没有气体生成,右盘质量增加28g,故④正确。
利用化学方程式的简单计算最全

利用化学方程式的简单计算最全化学方程式是用化学符号和化学方程来描述化学反应的方式。
通过化学方程式,我们可以了解反应物与产物之间的物质的数量关系,从而进行计算。
下面将介绍几种常见的利用化学方程式进行简单计算的方法。
1.计算反应物与产物的物质的摩尔数关系:化学方程式中的化学式代表了物质里的原子或分子的数量。
根据方程式,可以计算反应物与产物的物质的摩尔数关系。
例如,对于反应式:2H2+O2->2H2O,可以得知每2摩尔的H2反应生成2摩尔的H2O。
2.计算反应物的摩尔数及质量:根据已知的反应物的摩尔数和化学式里的原子质量,可以计算反应物的质量。
例如,对于反应式:H2 + O2 -> H2O,已知2mol的H2,需要计算H2的质量。
根据氢气的摩尔质量(2g/mol),可以计算出质量为4g。
3.计算反应产物的摩尔数及质量:根据已知的反应物的摩尔数和化学式里的摩尔比,可以计算反应产物的摩尔数及质量。
例如,对于反应式:H2 + O2 -> H2O,已知4g的H2,需要计算产生的H2O的质量。
根据反应式的摩尔比为1:1,可以计算出摩尔数为2mol 的H2O,进而计算出质量为36g的H2O。
4.计算反应后剩余物质的摩尔数及质量:根据已知的反应物的摩尔数和化学式里的摩尔比,可以计算反应后剩余物质的摩尔数及质量。
例如,对于反应式:2H2 + O2 -> 2H2O,已知2mol的H2和2mol的O2,需要计算剩余的H2O的摩尔数和质量。
根据反应式的摩尔比为2:1,可以计算出剩余的摩尔数为1mol的H2O,进而计算出质量为18g的H2O。
5.计算反应过程中的气体的体积:对于气体反应,可以利用化学方程式计算反应过程中的气体的体积。
根据烧瓶法则(Avogadro's law),相同条件下,气体的体积与物质的摩尔数成正比。
例如,对于反应式:2H2 + O2 -> 2H2O,已知2mol的H2和1mol的O2,根据化学反应的摩尔比,可以计算出反应产生2mol的H2O。
化学式的简单计算

化学式的简单计算化学式是化学反应和化学方程式中的重要表达方式,可以用来描述化学反应中参与反应的物质的种类和数量。
化学式的计算是化学学习的基础,本文将介绍化学式的简单计算方法。
一、化学式元素的计算在化学式中,元素的种类和数量对于反应的平衡和产物的生成有着重要的影响,因此了解如何计算元素在化学式中的数量是很重要的。
1.统计元素的原子数量化学式中的元素以原子为单位计数,需要统计元素的原子数量。
例如,对于化学式H2O,其中包含两个氢原子和一个氧原子,可以根据下方的计算方式进行计算:-氢原子数量:原子符号为H,原子数量为2-氧原子数量:原子符号为O,原子数量为12.统计化学式中的元素总数在计算化学式中的元素数量时,还需要统计化学式中的元素总数。
这可以通过以下公式进行计算:-元素总数=该元素的原子数量*个数例如,对于化学式CO2,其中包含一个碳原子和两个氧原子,可以根据下方的计算方式进行计算:-碳原子数量:原子符号为C,原子数量为1-氧原子数量:原子符号为O,原子数量为2根据公式可以得到:-碳的总数=1*1=1-氧的总数=2*2=4二、摩尔计算摩尔是化学中用于表示物质数量的单位,常用符号为mol。
在化学反应中,根据化学方程式可以计算出摩尔之间的关系。
1.化学方程式的摩尔比例化学方程式可以表示物质之间的摩尔比例,因此可以根据已知物质的摩尔数量来计算其他物质的摩尔数量。
例如,对于以下化学方程式:2H2+O2->2H2O化学方程式表明了氢气和氧气之间的摩尔比例为2:1、因此,如果我们已知氧气的摩尔数量,可以根据化学方程式计算出氢气的摩尔数量。
2.摩尔质量的计算摩尔质量是指物质的摩尔质量,常用符号为M。
摩尔质量的计算可以通过化学式中各个元素的摩尔质量之和来实现。
例如,对于化学式H2O,其中包含两个氢原子和一个氧原子,可以根据下方的计算方式进行计算:- 氢的摩尔质量:1.01 g/mol- 氧的摩尔质量:16.00 g/mol根据公式可以得到:- 摩尔质量 = 1.01 * 2 + 16.00 = 18.02 g/mol三、理论产量的计算理论产量是指在理想条件下反应所能生成的产品的最大数量。
教学案例:化学方程式的简单计算

化学方程式的简单计算在化学学科中,方程式是非常重要的概念,涉及到化学反应的基本过程。
化学方程式可以理解为化学反应过程的表达式,它表明了反应中各成分的摩尔比例和化学反应的程度。
化学方程式的表示有一定的规范,一般来说,它包括两部分:反应物和产物。
反应物通常写在左边,而产物则写在右边。
方程式中以箭头表示反应方向,箭头左侧表示反应物,箭头右侧表示产物。
然而,化学方程式的表达并不是简单的写出来,还需要进行一些简单计算。
以下是一些化学方程式的计算例子。
例1:氢气和氧气反应生成水的化学方程式是:H2 + O2 → H2O其中,H2和O2是反应物,H2O是产物。
根据方程式,可知一摩尔的H2和O2可以反应生成一摩尔的H2O。
问题: 20克的H2和20克的O2,可以反应生成多少克的H2O?解答:首先将质量转化为摩尔数。
根据元素的相对原子质量,可以计算出一摩尔的H2的质量为2g,一摩尔的O2的质量为32g。
因此,20克的H2相当于10摩尔,20克的O2相当于0.625摩尔。
根据化学方程式,可知一摩尔的H2可以生成一摩尔的H2O,因此10摩尔的H2可以生成10摩尔的H2O。
而一摩尔的O2可以生成一摩尔的H2O,因此0.625摩尔的O2可以生成0.625摩尔的H2O。
因此,总共可以生成10.625摩尔的H2O,相当于10.625 × (2+16) = 202.5克的H2O。
总结:在化学方程式的计算过程中,需要将质量转化为摩尔数,根据方程式中摩尔比例的关系,计算出反应物可以生成的产物的摩尔数,最后将摩尔数转化为质量即可。
例2:燃烧20克甲烷(CH4)需要多少克氧气(O2)才能完全燃烧?解答:首先可以写出甲烷燃烧的化学方程式:CH4 + 2O2 → CO2 + 2H2O其中,CH4是反应物,O2是反应物,CO2和H2O是产物。
根据化学方程式中的比例关系,一摩尔CH4需要两摩尔O2才能完全燃烧。
因此,20克的CH4相当于0.5摩尔。
化学式计算方法大全

化学式计算方法大全1.组成比例计算方法:-用适量的物质先进行定性分析,确定盐酸中含有H和Cl元素;-通过量的比较确定H和Cl的相对含量;-根据元素的电价确定H和Cl的相对比例;-得出盐酸的化学式HCl。
2.摩尔计算方法:-确定待计算化合物中各种元素的相对含量;-将各元素的摩尔数除以最小的摩尔数得到相对的摩尔比;-将相对的摩尔比化为整数比;-得出化合物的化学式。
3.水合物计算方法:-确定水合物中金属元素的摩尔数和非金属元素的摩尔数;-根据填入的水分子数等于非金属元素的摩尔数,计算水合物的摩尔比;-根据非金属元素与水的单位比例关系,填写化学式。
4.化合价计算方法:-查找元素在元素周期表中的化合价;-比较化合价的大小,确定元素的相对比例;-根据元素的电价填写化学式。
5.摩尔质量计算方法:-根据要计算的物质的化学式,查找元素的摩尔质量;-将各元素的摩尔质量相加,得到物质的摩尔质量。
6.摩尔浓度计算方法:-确定溶液中溶质的摩尔数和溶液的体积;-将溶质的摩尔数除以溶液的体积,得到溶液的摩尔浓度。
7.水解反应计算方法:-确定反应物和生成物的相对摩尔比;-根据反应物的摩尔比,确定反应物的化学式。
8.燃烧反应计算方法:-根据反应物的摩尔比和生成物的摩尔比,确定反应物和生成物的化学式。
需要注意的是,化学式计算方法的选择和应用需要根据具体的问题和实验条件进行判断。
在实际应用中,化学式计算方法可以配合使用,以获得更准确的结果。
另外,化学式计算需要熟练掌握元素周期表和元素化学式的相关知识,才能进行准确的计算。
总结起来,化学式计算包括组成比例计算、摩尔计算、水合物计算、化合价计算、摩尔质量计算、摩尔浓度计算、水解反应计算和燃烧反应计算等方法。
不同的计算方法适用于不同的问题和实验条件。
化学式计算的准确性需要依赖于对元素周期表和元素的化学式的熟练掌握,同时也需要注意计算过程中的单位转换和数值精度的保证。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
相 同
56 56+16×1.333
②
解题技巧之三:混合后求平均质量分数
某硝酸铵样品中,氮元素的质量分数为38%,这种氮肥种 可能混入的杂质是( C)
A、NH4HCO3
17.7%
B、NH4Cl
26.2%
C、CO(NH2)2
46.7%
D、(NH4)2SO4
21.2%
NH4NO3中N的质量分数为35%
10:3:12
C2H5OH
C:H:O = 12:3:8
CO(NH2)2 N:H = 7:1
NH4NO3
N:H =
7:1
思考:①若碳酸钙中钙元素为40克,
碳元素铵中N与H的质量比为什么相同?
H:1 C:12 O:16 Ca:40 N:14
Fe:56 三、计算下列物质中加点元素的质量分数
3.人尿中含有2%的尿素CO(NH2)2, 如不考虑其他成分,则人尿中N元素的质量 分数是多少?
4、农技术员给出施肥配方,该土壤施加NH4NO3、 K2CO3,若测定该混合化肥中氮元素的质量分数为28%, 则固体混合物中K2CO3的质量分数为?
5、用NH4NO3和 KCl的固体混合物配置无土栽培 营养液,已知固体混合物中氮元素质量分数14%, 则固体混合物中钾元素质量分数约为( )
该元素的质量与组成物质元素总质量之比×100%
.CaCO3 . CO(NH2)2 . . NH4NO3 .Fe2O3
40 ×100%=40%
100
28 60
×100%≈ 46.7%
28 80
×100%= 35%
112 160
×100%= 70%
记忆大比拼
1、需记忆的相对分子质量
H2O
CO2
CaCO3
A
14×2 80
B 14×2
132
C 141×4 2
71958 14×2
D
14×2 60
79×2
将以下铁的氧化物,按着铁的质量分数由大到小排列:
FeO:
56 56+16
56 让 56+16
①
Fe2O3:
56×2 56×2+16×
分 子
56 56+16×1.5
③
Fe3O4 :
3 56×3 56×3+16×
交流与讨论
H:1 C:12 O:16
N:14
1、36g水中含有多少克氢元素,多少克氧元素?
2,多少克水含氧元素与80克硝酸铵喊氧元素质量相等
3、买多少吨CO(NH2)2和80吨NH4NO3等效呢?
解题技巧之一:
质量比=质量分数之比 1、硝酸铵中N的质量分数为35%,H元素的质量分数为?
2、用一定量的尿素和硝酸铵固体混合物配制氮肥营养液, 已知固体混合物中氢元素的质量分数为6%, 则混合物中氮元素的质量分数为?
A、28.6% B、31.4% C、60% D、70%
3、由Na2SO4、Na2SO3、Na2S三种物质组成的混合 物中,钠元素的质量分数位46%,则其中氧元素的质 量分数是?
解题技巧之二:质量分数大小的比较
以下氮肥含氮量最高的是:
NH4NO3 (NH4)2SO4 NH4HCO3 CO(NH2)2
H2O 18
CO2 44
CaCO3 100
CO(NH2)2 NH4NO3 Fe2O3
60
80
160
H2SO4 98
HCl 36.5
CuSO4·5H2O 250
H:1 C:12 O:16 Ca:40 N:14
二、计算下列物质中元素的质量比
(各原子相对原子质量×各原子个数)之比
CaCO3
Ca:C:O =
学习目标:
1、掌握相对分子质量的概念 2、会计算物质组成元素的质量比 3、会计算物质中某元素的质量分数 4、掌握一些关于化学式简单计算
的技巧
H:1 C:12 O:16 Ca:40 N:14 Fe:56 S:32 Cl:35.5 Cu:64
一、计算下列物质的相对分子质量
(各原子的相对原子质量×相应原子个数)之和
18
44
100
CO(NH2)2 NH4NO3 Fe2O3
60
80
160
H2SO4
SO4
98
96
2、需记忆的质量分数
.CaCO3
.Fe2O3
40/100=40% 112/160=70%
. . NH4NO3
. . CO(NH2)2 NH4HCO3
28/80=35% 28/60≈46.7% 14/79≈17.7%
