高三一轮复习沉淀溶解平衡39页PPT
合集下载
高考化学一轮复习8.4难溶电解质的沉淀溶解平衡课件高三全册化学课件

若加入的物质使难溶电解质生成更难溶的电解质、弱电解质 或气体时,平衡向_沉__淀_溶__解___的方向移动
12/12/2021
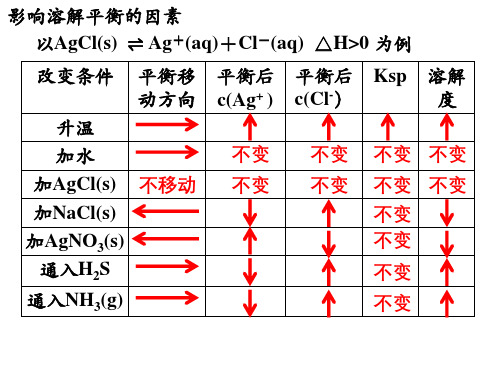
(2)实例 以AgCl(s)
Ag+(aq)+Cl-(aq) ΔH>0为例,2O 升温 通入HCl 加入K2S
移动方向 _逆__向__ _正__向__ _正__向__ _逆__向__ _正__向__
12/12/2021
(4) 在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小。( ) 提示:√。H+可以与ZnS中S2-结合促进溶解平衡,进而溶解ZnS,而H+不能溶解 CuS,所以CuS的溶解度比ZnS的小。 (5)已知常温下:Ksp(AgCl)=1.8×10-10,将0.002 mol·L-1的AgNO3溶液与 0.002 mol·L-1的KCl溶液等体积混合会产生AgCl沉淀。 ( ) 提示:×。混合后Qc=c(Ag+)·c(Cl-) =0.001 mol·L-1×0.001 mol·L-1 =1.0×10-6>1.8×10-10,故生成AgCl沉淀。
①实质:_____________的移动(沉淀的溶解度差别越大,越容易转化)。
②应用:锅炉除垢、矿物转化等。
沉淀溶解平衡
12/12/2021
【易错警示】 (1)对于化学式中阴、阳离子个数比不同的难溶电解质,Ksp小的溶解度不一定小。如 Ksp (AgCl)>Ksp(Ag2CrO4),但c(Ag+)是Ag2CrO4>AgCl。 (2)不可能使要除去的离子全部通过沉淀除去。一般认为残留在溶液中的离子浓度小 于1.0×10-5 mol·L-1时,沉淀已经完全。
中的溶解度。
12/12/2021
12/12/2021
(2)实例 以AgCl(s)
Ag+(aq)+Cl-(aq) ΔH>0为例,2O 升温 通入HCl 加入K2S
移动方向 _逆__向__ _正__向__ _正__向__ _逆__向__ _正__向__
12/12/2021
(4) 在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小。( ) 提示:√。H+可以与ZnS中S2-结合促进溶解平衡,进而溶解ZnS,而H+不能溶解 CuS,所以CuS的溶解度比ZnS的小。 (5)已知常温下:Ksp(AgCl)=1.8×10-10,将0.002 mol·L-1的AgNO3溶液与 0.002 mol·L-1的KCl溶液等体积混合会产生AgCl沉淀。 ( ) 提示:×。混合后Qc=c(Ag+)·c(Cl-) =0.001 mol·L-1×0.001 mol·L-1 =1.0×10-6>1.8×10-10,故生成AgCl沉淀。
①实质:_____________的移动(沉淀的溶解度差别越大,越容易转化)。
②应用:锅炉除垢、矿物转化等。
沉淀溶解平衡
12/12/2021
【易错警示】 (1)对于化学式中阴、阳离子个数比不同的难溶电解质,Ksp小的溶解度不一定小。如 Ksp (AgCl)>Ksp(Ag2CrO4),但c(Ag+)是Ag2CrO4>AgCl。 (2)不可能使要除去的离子全部通过沉淀除去。一般认为残留在溶液中的离子浓度小 于1.0×10-5 mol·L-1时,沉淀已经完全。
中的溶解度。
12/12/2021
高考化学专题复习17沉淀溶解平衡及其应用(共54张PPT)

(3)沉淀的转化 ①实质:_沉__淀__溶__解__平__衡__的移动(沉淀的溶解度差别__越__大__, 越容易转化)。
②应用
1.沉淀溶解平衡是化学平衡的一种,沉淀溶解平衡的移动也 同样遵循勒夏特列原理。 2.绝大多数固体的溶解度随温度的升高而增大,但有少数物质的溶解度 随着温度的升高而减小,如Ca(OH)2。 3.Ksp大的物质,溶解度不一定大,只有组成相似的物质,才能用Ksp比较其 溶解度的大小。 4.复分解反应总是向着某些离子浓度减小的方向进行,若生成难溶电解 质,则向着生成溶度积较小的难溶电解质的方向进行。 5.习惯上将溶解度小于0.01 g的电解质称为难溶电解质。对于常量的化 学反应来说,化学上通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀就达完全。
②沉淀剂法 如用H2S沉淀Cu2+,离子方程式为
。
(2)沉淀的溶解 ①酸溶解法 如CaCO3溶于盐酸,离子方程式为
。 ②盐溶液溶解法 如Mg(OH)2溶于NH4Cl溶液,离子方程式为
。 ③氧化还原溶解法 如不溶于盐酸的硫化物Ag2S溶于稀HNO3。 ④配位溶解法 如AgCl溶于氨水,离子方程式为
。
BaSO4沉淀。( √ )
(9)向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色沉淀:2AgCl+S2-
Ag2S+2Cl-。( )
√
2.常温下,往饱和石灰水中加入一定量的生石灰,一段时
间后恢复到原温度,以下叙述错. 误. 的是( )。
A.有溶质析出
B.溶液中Ca2+的数目不变
C.溶剂的质量减小
升高温度 加水稀释 加入少量 AgNO3 通入HCl 通入H2S
平衡后c(Ag+
移动方向
2024届高考一轮复习化学课件(人教版):水溶液中的离子反应与平衡-沉淀溶解平衡图像的分析

加入BaCl2固体(忽略溶液的体积变化) 曲线上变化,增大c(Ba2+)
曲线上方的点表示有沉淀生成;曲线下方的点表示不饱和溶液
2.沉淀溶解平衡移动中离子浓度对数关系曲线
图像
说明
横坐标数值越大,c(CO23-)__越__小__ 纵坐标数值越大,c(M)_越__小___
曲线上方的点为 不饱和 溶液
曲线上的点为 饱和 溶液
(二)分析沉淀溶解平衡曲线图像的一般思路
1.明确图像中横、纵坐标的含义。 2.分析曲线上或曲线外的点对应的溶液是否为饱和溶液时,要明确点所对应的溶液中, 若Q>Ksp,能形成沉淀,则该点所对应的溶液为过饱和溶液;若Q<Ksp,不能形成沉 淀,则该点所对应的溶液为不饱和溶液。 3.分析曲线上指定点的离子浓度时,需根据Ksp计算或抓住Ksp的特点,结合选项分析 判断。溶液在蒸发时,离子浓度的变化分两种情况:原溶液不饱和时,离子浓度都增 大;原溶液饱和时,离子浓度都不变。溶度积常数只是温度的函数,与溶液中的离子 浓度无关,在同一曲线上的点,溶度积常数都相同。
首先析出MS沉淀 D.蒸发a点的QS溶液可得到b点状态的QS溶液
A项,由图知,当-lg c(S2-)=0即c(S2-)=1 mol·L-1时, c(M2+)=1× 10-30 mol·L-1、c(Q2+)=1×10-20 mol·L-1,故 Ksp(MS)=1× 10-30,Ksp(QS)=1× 10-20,MS(s)+Q2+(aq)
D.d点的CaWO4溶液中,加入CaCl2固体,d点溶液 组成沿da线向c点移动(假设混合后溶液体积不变)
由图可知常温下,饱和Ca(OH)2溶液中当c(Ca2+)= 10 - 3 mol·L - 1 时 , c(OH - ) = 10 - 2 mol·L - 1 , Ksp[Ca(OH)2]=10-7,c点当c(Ca2+)=10-6 mol·L-1 时,c( WO24- )=10-4 mol·L-1,Ksp(CaWO4)=10-10, 则Ksp(CaWO4)<Ksp[Ca(OH)2],A正确;
曲线上方的点表示有沉淀生成;曲线下方的点表示不饱和溶液
2.沉淀溶解平衡移动中离子浓度对数关系曲线
图像
说明
横坐标数值越大,c(CO23-)__越__小__ 纵坐标数值越大,c(M)_越__小___
曲线上方的点为 不饱和 溶液
曲线上的点为 饱和 溶液
(二)分析沉淀溶解平衡曲线图像的一般思路
1.明确图像中横、纵坐标的含义。 2.分析曲线上或曲线外的点对应的溶液是否为饱和溶液时,要明确点所对应的溶液中, 若Q>Ksp,能形成沉淀,则该点所对应的溶液为过饱和溶液;若Q<Ksp,不能形成沉 淀,则该点所对应的溶液为不饱和溶液。 3.分析曲线上指定点的离子浓度时,需根据Ksp计算或抓住Ksp的特点,结合选项分析 判断。溶液在蒸发时,离子浓度的变化分两种情况:原溶液不饱和时,离子浓度都增 大;原溶液饱和时,离子浓度都不变。溶度积常数只是温度的函数,与溶液中的离子 浓度无关,在同一曲线上的点,溶度积常数都相同。
首先析出MS沉淀 D.蒸发a点的QS溶液可得到b点状态的QS溶液
A项,由图知,当-lg c(S2-)=0即c(S2-)=1 mol·L-1时, c(M2+)=1× 10-30 mol·L-1、c(Q2+)=1×10-20 mol·L-1,故 Ksp(MS)=1× 10-30,Ksp(QS)=1× 10-20,MS(s)+Q2+(aq)
D.d点的CaWO4溶液中,加入CaCl2固体,d点溶液 组成沿da线向c点移动(假设混合后溶液体积不变)
由图可知常温下,饱和Ca(OH)2溶液中当c(Ca2+)= 10 - 3 mol·L - 1 时 , c(OH - ) = 10 - 2 mol·L - 1 , Ksp[Ca(OH)2]=10-7,c点当c(Ca2+)=10-6 mol·L-1 时,c( WO24- )=10-4 mol·L-1,Ksp(CaWO4)=10-10, 则Ksp(CaWO4)<Ksp[Ca(OH)2],A正确;
高考化学一轮复习苏教版沉淀溶解平衡 课件(59张)

-9-
关键能力·考向突破
基础小练
1.下列说法正确的是( C )
①难溶电解质达到沉淀溶解平衡时,溶液中各种离子的溶解(或
沉淀)速率都相等
②难溶电解质达到沉淀溶解平衡时,增加难溶电解质的量,平衡
向溶解方向移动
2③向Na2SO4溶液中加入过量的BaCl2溶液,则 SO4 沉淀完全,溶液
中只含Ba2+、Na+和Cl-,不含 SO24
关键能力·考向突破
(3)特点。
不再变化
核心考点分层突破
考点一
考点二
-3-
必备知识·自主预诊
关键能力·考向突破
(4)沉淀溶解平衡的影响因素。
沉淀溶解的方向
吸热
沉淀溶解的方向
不变
生成沉淀的方向
沉淀溶解的方向
核心考点分层突破
考点一
考点二
必备知识·自主预诊
-4-
关键能力·考向突破
2.沉淀溶解平衡常数——溶度积
核心考点分层突破
考点一
考点二
必备知识·自主预诊
-1-
关键能力·考向突破
考点一 沉淀溶解平衡与溶度积
1.溶解平衡状态
(1)定义。
沉淀溶解平衡状态是指在一定温度下,当难溶强电解质溶于水形
成饱和溶液时, 沉淀溶解 速率和 沉淀生成 速率相等的状态。
例如,在一定温度下,当AgCl溶于水形成 饱和
溶液时,AgCl
易错警示①并非Ksp越小,其物质的溶解性就越小。对于阴、阳
离子的个数比相同的难溶电解质,它们的溶解性可以直接用Ksp的
大小来比较,Ksp越小,其物质的溶解性就越小;而对于阴、阳离子的
个数比不同的难溶电解质,它们的溶解性就不能直接用Ksp的大小
2024届高三化学高考备考一轮复习:沉淀溶解平衡课件

的沉淀。沉淀的溶解度差别越大,越容易转化。但溶解度小的沉淀
在一定条件下也可以转化为溶解度大的沉淀。
(4)应用
①锅炉除垢:用Na2CO3溶液处理,将CaSO4转化为CaCO3,离子 方程式为___C__a_S_O_4_(_s_)+__C__O_23_-_(_a_q_) ___C__a_C_O__3(_s_)_+__S_O_24_-_(_a_q_) ______。
2.沉淀转化 (1)实验探究
①2 mL 0.1 mol/L ZnSO4 溶液―滴―入―1―m―ol―/L―N―a2S―溶―液→ZnS(白色) ―滴―入―0―.1―m―ol―/L―Cu―S―O4―溶―液→CuS(黑色)。 结论:Ksp(ZnS)__>_Ksp(CuS)。
②2 mL 0.1 mol/L MgCl2(aq) ―2―~―4滴―2―m―o―l/L―N―aO―H―a―q→Mg(OH)2(白色) ―4滴―0―.1―m―ol―/L―F―eC―l3―aq→ Fe(OH)3(红褐色)。 结论:Ksp[Mg(OH)2]>Ksp[Fe(OH)3]。
沉淀溶解平衡的工业应用 3.化工生产中常用 MnS 作为沉淀剂除去工业废水中 Cu2+:Cu2+(aq) +MnS(s) CuS(s)+Mn2+(aq),下列说法错误的是( B ) A.MnS 的 Ksp 比 CuS 的 Ksp 大 B.该反应达平衡时 c(Mn2+)=c(Cu2+) C.往平衡体系中加入少量 CuSO4 固体后,c(Mn2+)变大 D.该反应的平衡常数 K=KKssppMCunSS
2.已知:常温下,Ksp(BaSO4)=a mol2·L-2。取过量 BaSO4 溶于蒸 馏水,过滤得到滤液 R 溶液。下列有关说法正确的是( B ) A.R 溶液中 c(Ba2+)=a mol·L-1 B.常温下,向 R 溶液中加入少量 Na2SO4 固体,产生白色沉淀 C.常温下,向 R 溶液中加入少量 BaCl2 固体,Ksp(BaSO4)增大 D.向 R 溶液中加水,c(Ba2+)、c(SO24-)均增大
在一定条件下也可以转化为溶解度大的沉淀。
(4)应用
①锅炉除垢:用Na2CO3溶液处理,将CaSO4转化为CaCO3,离子 方程式为___C__a_S_O_4_(_s_)+__C__O_23_-_(_a_q_) ___C__a_C_O__3(_s_)_+__S_O_24_-_(_a_q_) ______。
2.沉淀转化 (1)实验探究
①2 mL 0.1 mol/L ZnSO4 溶液―滴―入―1―m―ol―/L―N―a2S―溶―液→ZnS(白色) ―滴―入―0―.1―m―ol―/L―Cu―S―O4―溶―液→CuS(黑色)。 结论:Ksp(ZnS)__>_Ksp(CuS)。
②2 mL 0.1 mol/L MgCl2(aq) ―2―~―4滴―2―m―o―l/L―N―aO―H―a―q→Mg(OH)2(白色) ―4滴―0―.1―m―ol―/L―F―eC―l3―aq→ Fe(OH)3(红褐色)。 结论:Ksp[Mg(OH)2]>Ksp[Fe(OH)3]。
沉淀溶解平衡的工业应用 3.化工生产中常用 MnS 作为沉淀剂除去工业废水中 Cu2+:Cu2+(aq) +MnS(s) CuS(s)+Mn2+(aq),下列说法错误的是( B ) A.MnS 的 Ksp 比 CuS 的 Ksp 大 B.该反应达平衡时 c(Mn2+)=c(Cu2+) C.往平衡体系中加入少量 CuSO4 固体后,c(Mn2+)变大 D.该反应的平衡常数 K=KKssppMCunSS
2.已知:常温下,Ksp(BaSO4)=a mol2·L-2。取过量 BaSO4 溶于蒸 馏水,过滤得到滤液 R 溶液。下列有关说法正确的是( B ) A.R 溶液中 c(Ba2+)=a mol·L-1 B.常温下,向 R 溶液中加入少量 Na2SO4 固体,产生白色沉淀 C.常温下,向 R 溶液中加入少量 BaCl2 固体,Ksp(BaSO4)增大 D.向 R 溶液中加水,c(Ba2+)、c(SO24-)均增大
2023届高三化学一轮复习 沉淀溶解平衡 课件
√
例2(1)向NaCl、NaI的混合稀溶液中滴入少量稀
AgNO3溶液,有黄色沉淀生成,则Ksp(AgCl)>
Ksp(AgI) ×
(2)向2支盛有2 mL相同浓度银氨溶液的试管中分别加 入2滴相同浓度的NaCl和NaI溶液。一支试管中产生黄色 沉淀,另一支中无明显现象,说明Ksp(AgI)<Ksp(AgCl)
3、用实验证明Ksp或溶解度的大小
例1(1)①将0.1 mol·L-1 MgCl2溶液和0.5 mol·L-1 NaOH溶液等体积混合得到浊液 ②取少量①中浊液,滴加0.1 mol·L-1 FeCl3溶液,出 现红褐色沉淀 ③将①中浊液过滤,取少量白色沉淀,滴加0.1 mol·L -1 FeCl3溶液,白色沉淀变为红褐色沉淀 实验②和③哪个能说明Fe(OH)3比Mg(OH)2难溶?③
除杂:NH4Cl(FeCl3) 氨水
除杂:CuCl2(FeCl3)
已知Ksp[Fe(OH)3]=10-38,求使0.1mol/L的FeCl3(aq) 中Fe3+开始沉淀的pH和完全沉淀的pH。
Fe3+
Cu2+
开始沉淀的pH
1.7
4
完全沉淀的pH
3
6
加入CuO、Cu(OH)2等调节pH在3~4之间,保证Fe3+ 沉淀完全,Cu2+还未开始沉淀
除杂MnCl2(ZnCl2) MnS
向浓度均为1×10-5mol·L-1 的Cu2+、Zn2+、Mn2+混合 溶液中逐滴加入1×10- 4mol·L-1的Na2S溶液, _____C_u_2_+____先沉淀
向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而 除去Cl-
除Cl-反应为 Cu+Cu2++2Cl-==2CuCl
高考化学一轮复习第八章第四节沉淀溶解平衡课件
根离子,因此 c(Ca2+)>c(CO23- ),A 错误;根据 Ka2=4.7×10-11 可得 c(c(COH23C- O)-3·c)(H+)=4.7×10-11,则碳酸根的水解平衡常数为 Kh= c(HcC(OC- 3 O)23- ·c)(OH-)=KKaw2≈2×10-2>Ka2,说明碳酸根的水解程度较大, 则上层清液中含碳微粒主要为碳酸氢根离子,B 正确;向体系中通入 CO2, 碳酸钙与 CO2 反应生成碳酸氢钙,碳酸氢钙易溶于水,则溶液中钙离子浓 度增大,C 错误;由题干可知,Ksp(CaCO3)=3.4×10-9,Ksp(CaSO4)=4.9×10-5, 碳酸钙比硫酸钙更难溶,加入硫酸钠后碳酸钙不会转化成硫酸钙,D 错误。
生反应生成碳酸氢钙,溶液体积不变,n(Ca2+)不变,则 c(Ca2+)不
变,D 正确。
答案:B
考向 2 溶度积常数及应用
3.(2023 年浙江卷)碳酸钙是常见难溶物,将过量碳酸钙粉末置 于水中达到溶解平衡:CaCO3(s) Ca2+(aq)+CO23- (aq)[已知 Ksp(CaCO3)=3.4×10-9,Ksp(CaSO4)=4.9×10-5,H2CO3 的电离常 数 Ka1=4.5×10-7,Ka2=4.7×10-11],下列有关说法正确的是( )
A.上层清液中存在 c(Ca2+)=c(CO23- ) B.上层清液中含碳微粒最主要以 HCO3- 形式存在 C.向体系中通入 CO2 气体,溶液中 c(Ca2+)保持不变 D.通过加 Na2SO4 溶液可实现 CaCO3 向 CaSO4 的有效转化
解析:上层清液为碳酸钙的饱和溶液,碳酸根离子水解生成碳酸氢
ⅱ.图 2 中曲线Ⅰ的离子浓度关系符合 c(Mg2+)·c2(OH-)= Ksp[Mg(OH)2];曲线Ⅱ的离子浓度关系符合 c(Mg2+)·c(CO23- )= Ksp(MgCO3)[注:起始 c(Na2CO3)=0.1 mol·L-1,不同 pH 下 c(CO23- ) 由图 1 得到]。
生反应生成碳酸氢钙,溶液体积不变,n(Ca2+)不变,则 c(Ca2+)不
变,D 正确。
答案:B
考向 2 溶度积常数及应用
3.(2023 年浙江卷)碳酸钙是常见难溶物,将过量碳酸钙粉末置 于水中达到溶解平衡:CaCO3(s) Ca2+(aq)+CO23- (aq)[已知 Ksp(CaCO3)=3.4×10-9,Ksp(CaSO4)=4.9×10-5,H2CO3 的电离常 数 Ka1=4.5×10-7,Ka2=4.7×10-11],下列有关说法正确的是( )
A.上层清液中存在 c(Ca2+)=c(CO23- ) B.上层清液中含碳微粒最主要以 HCO3- 形式存在 C.向体系中通入 CO2 气体,溶液中 c(Ca2+)保持不变 D.通过加 Na2SO4 溶液可实现 CaCO3 向 CaSO4 的有效转化
解析:上层清液为碳酸钙的饱和溶液,碳酸根离子水解生成碳酸氢
ⅱ.图 2 中曲线Ⅰ的离子浓度关系符合 c(Mg2+)·c2(OH-)= Ksp[Mg(OH)2];曲线Ⅱ的离子浓度关系符合 c(Mg2+)·c(CO23- )= Ksp(MgCO3)[注:起始 c(Na2CO3)=0.1 mol·L-1,不同 pH 下 c(CO23- ) 由图 1 得到]。
高考化学一轮复习课件第六单元难溶电解质的溶解平衡PPT文档ppt
A.盐酸浓度越大,Ksp(PbCl2)越大 B.PbCl2 能与一定浓度的盐酸反应 C.x、y 两点对应的溶液中 c(Pb2+) 相等 D.往含 Pb2+的溶液中加入过量浓盐酸,可将 Pb2+完全转 化为 PbCl2(s)
解析:Ksp(PbCl2)只与温度有关,温度不变,Ksp(PbCl2)不 变,A错误;根据图象知当盐酸的浓度大于1 mol·L-1时PbCl2 的溶解度随盐酸浓度的增大而增大,则PbCl2能与一定浓度的 盐酸反应,B正确;y点铅元素的存在形式不是Pb2+,x、y两点 对应的溶液中c(Pb2+)不相等,C错误;往含Pb2+的溶液中加入 浓盐酸至过量,可将Pb2+先转化为PbCl2(s)(存在沉淀溶解平衡, 溶液中含有Pb2+),然后转化为其他形式,D错误。
ห้องสมุดไป่ตู้(2)沉淀剂法:如用 H2S 沉淀 Cu2+,离子方程式为______ ________C_u_2_+_+__H__2S_=_=__=_C_u_S_↓__+__2_H_+______________。
2.沉淀的溶解 (1)酸溶解:难溶于水的 CaCO3 可溶于盐酸,用离子方程式 表示为______C__a_C_O_3_+__2_H_+__=_=_=_C_a_2_+_+__C__O_2_↑__+__H_2_O__________。 (2)盐溶解:用离子方程式表示 Mg(OH)2 溶于 NH4Cl 溶液: __________________________________________________。 3.沉淀的转化 (1)实质:___沉__淀__溶__解__平__衡____的移动。如 MgCl2 溶液―Na―O→H Mg(OH)2―Fe―C→l3 Fe(OH)3,则 Ksp[Mg(OH)2]>Ksp[Fe(OH)3]。
解析:Ksp(PbCl2)只与温度有关,温度不变,Ksp(PbCl2)不 变,A错误;根据图象知当盐酸的浓度大于1 mol·L-1时PbCl2 的溶解度随盐酸浓度的增大而增大,则PbCl2能与一定浓度的 盐酸反应,B正确;y点铅元素的存在形式不是Pb2+,x、y两点 对应的溶液中c(Pb2+)不相等,C错误;往含Pb2+的溶液中加入 浓盐酸至过量,可将Pb2+先转化为PbCl2(s)(存在沉淀溶解平衡, 溶液中含有Pb2+),然后转化为其他形式,D错误。
ห้องสมุดไป่ตู้(2)沉淀剂法:如用 H2S 沉淀 Cu2+,离子方程式为______ ________C_u_2_+_+__H__2S_=_=__=_C_u_S_↓__+__2_H_+______________。
2.沉淀的溶解 (1)酸溶解:难溶于水的 CaCO3 可溶于盐酸,用离子方程式 表示为______C__a_C_O_3_+__2_H_+__=_=_=_C_a_2_+_+__C__O_2_↑__+__H_2_O__________。 (2)盐溶解:用离子方程式表示 Mg(OH)2 溶于 NH4Cl 溶液: __________________________________________________。 3.沉淀的转化 (1)实质:___沉__淀__溶__解__平__衡____的移动。如 MgCl2 溶液―Na―O→H Mg(OH)2―Fe―C→l3 Fe(OH)3,则 Ksp[Mg(OH)2]>Ksp[Fe(OH)3]。
