乙醛教学完整(修改)ppt课件
合集下载
人教课标版高中化学必修一《乙醛》教学PPT

水浴
CH3CHO+2[Ag(NH3)2] OH
CH3COONH4
+2Ag↓+3NH3+H2O
银镜反应该注意的问题:
1、关注反应中试剂加入的先后顺序,可见, 反应在碱性条件下进行。
2、方程式的书写:C H 3 C H 2 C H O + A g ( N H 3 ) 2 O H
CH3COONH4+2Ag↓+3NH3+H2O 3、每摩尔醛基可生成2摩尔银:-CHO~2Ag 4、AgOH不稳定,但可以短暂存在,加入氨 水可溶解。A gCl能否溶于氨水中?为什么? 5、此反应用途:制热水瓶瓶胆(用葡萄糖).
8、有些事,不可避免地发生,阴晴圆缺 皆有规 律,我 们只能 坦然地 接受;有些事 ,只要 你愿意 努力, 矢志不 渝地付 出,就 能慢慢 改变它 的轨迹 。
9、与其埋怨世界,不如改变自己。管好 自己的 心,做 好自己 的事, 比什么 都强。 人生无 完美, 曲折亦 风景。 别把失 去看得 过重, 放弃是 另一种 拥有;不要经 常艳羡 他人, 人做到 了,心 悟到了 ,相信 属于你 的风景 就在下 一个拐 弯处。
O C OH
①银氨溶液作氧化剂 —— 银镜反应
银氨溶液的配制
在洁净的试管里加1mL2%(质量分数)的硝酸银溶 液,然后一边摇动试管,一边逐渐滴入2%(质量分 数)的稀氨水,直到最初产生的沉淀溶解为止。
Ag++NH3·H2O=AgOH+NH4+
AgOH+2NH3·H2O=[Ag(NH3)2]++OH-+2H2O
6、无论你正遭遇着什么,你都要从落魄 中站起 来重振 旗鼓, 要继续 保持热 忱,要 继续保 持微笑 ,就像 从未受 伤过一 样。
人教版高中化学必修一课件乙 醛

还原剂
氧化剂
注意:
CH3COONH4+2Ag↓+3NH3+H2O
1、碱性环境下,乙醛被氧化成乙酸后又与NH3反应生成乙酸铵。 2、1mol–CHO被氧化,就应有2molAg被还原。
3、银氨溶液必须现用现配,不可久置,否则会产生易爆炸物质。
4、可用稀HNO3清洗试管内壁的银镜。
2%CuSO4溶液 乙醛 10%NaOH溶液
这个反应属于 氧化反应还是 还原反应?
还原反应
[思考]:
?
O
CH3CH2OH
CH3-C-H
O CH3-C_OH
?
?
预测反应—加成反应: 与Br2的加成
HO H C C H Br Br
H
该物质不稳定
注意:和C=C双键不同的是,通常情况下,
乙醛一般不能和HX、X2发生加成反应
与氢氰酸加成:
与水的加成:
H
10%NaOH
H 5℃
OH
OCH3 CH CH2 C H Nhomakorabea学习目标:
1.了解乙醛的物理性质和用途 2.掌握乙醛的分子结构主要化学性质 3.会配制银氨溶液和新制的氢氧化铜悬浊液,学会
应用上述试剂检验醛基的存在。 4.学会构建几种重要有机化合物的相互转化关系。
重点:乙醛的结构和化学性质 醛基的检验
作业
CH3CHO + 2Cu(OH)2 +NaOH
CH3COONa+ Cu2O↓+3H2O
砖红色
注意: 氢氧化铜溶液一定要新制, 且碱一定要过量。
应用: (1)检验醛基的存在 (2)医学上检验病人是否患糖尿病
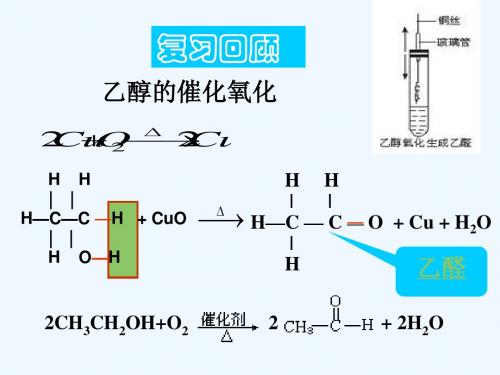
加成反应 根据加成反应的概念,写出CH3CHO 和H2加成反应的方程式。 CH3CHO+H2 Ni CH3CH2OH
2024年度乙醛PPT课件1人教课标版

2024/3/23
21
废弃乙醛的处理与资源化利用
废弃乙醛处理
对于废弃的乙醛,应按照危险废物的管理要 求进行收集、运输和处置。可以采取焚烧、 化学氧化等方法进行处理,确保废弃乙醛得 到安全有效的处置,防止对环境和人体造成 危害。
资源化利用
为了实现废弃乙醛的资源化利用,可以研究 开发新的技术和方法,将其转化为有价值的 化学品或燃料。例如,通过催化转化、生物 降解等技术手段,将废弃乙醛转化为乙酸、 乙醇等有用的化学品;或者将其作为燃料使 用,为能源领域提供新的补充。
对于无法利用的废弃物,应采取适当 的处理方法,如焚烧、填埋等,以减 少对环境的污染。同时,应加强废弃 物的管理和监管,确保处理过程符合 环保要求。
10
2024/3/23
03
乙醛的反应与机理
CHAPTER
11
乙醛的氧化反应
01
02
03
催化氧化
在催化剂作用下,乙醛与 氧气反应生成乙酸。
2024/3/23
14
2024/3/23
04
乙醛在生活中的应用
CHAPTER
15
乙醛在香精香料中的应用
乙醛是合成香精的重要原料之一,可用于制造各种水果香型、花香型和草香型的香 精。
在香水、化妆品、洗涤剂等产品中,乙醛能增加香气的扩散力和持久性,提高产品 的感官品质。
2024/3/23
乙醛还可用于食品加工业,为食品增添香味,如用于糖果、饮料、糕点等食品的调 味。
乙醇氧化法
在实验室中,常用乙醇氧化法制备乙醛。通过将乙醇与氧化剂(如铬酸、高锰 酸钾等)反应,可以得到乙醛。
乙炔水化法
乙炔在催化剂存在下与水反应,生成乙醛。这种方法也是实验室制备乙醛的常 用方法之一。
乙醛优质课课件PPT教学

分析结H构-: -CH-C-H
醛 基
预测性质: -H
醛断碳氧双键之一易加成 Nhomakorabea基
受C=O的影响,碳氢键
易断裂
第22页/共35页
对比:
脱氢
加氢
HH H—C—C=O + H2
Ni △
HH H—C—C—OH
H
HH
第23页/共35页
化合价分析
H 1
CH3 C O H
H
乙醛发生还原 反应体现氧化 性
CH3 +C1_ H
CH3COOH+Cu2O+2H2O
砖红色
(此反应必须在碱性条件下进行) d、被酸性KMnO4或溴水氧化
第19页/共35页
实验探究
供选试剂
问题1、如何快速检验乙醛具有还原性?
①酸性KMnO4溶液
实验探究1
与酸性KMnO4溶液作用
紫色退去,乙醛有还原性
②新制Cu(OH)2悬浊液 问题2、如何检验乙醛还原性的强弱?
第30页/共35页
乙醛的化学性质
• 加成反应(碳氧双键上的加成)
H2
第31页/共35页
乙醛的化学性质
氧化反应 [O]
→
[O]:合适的氧化剂
第32页/共35页
羧基
脱氢酶
CH3CH2OH
乙醇
_ 氧化酶
CH3 C H O
乙醛
_
CH3 C O
H
O
乙酸
第33页/共35页
CO2、H2O
第34页/共35页
O
O
催化剂
2 CH3 C H + O2
O
2
CH3
_
CO
H
高中化学《乙醛》课件ppt

体内乙醛积累,导致血管扩张而脸红。
乙醛是一种无色液体, 有刺激性气味,密度小于 水,可与水和乙醇等有机 物互溶,沸点低,易挥发
HO HC C H
H 醛基
烃基
乙醛的结构
官能团:
O
醛基
CH
结构决定性质
HO
HC C H
H 醛基
烃基 1.从醛基的结构特点出发,预测乙醛可 能会有什么化学性质? 2.分析醛基上C的化合价,预测醛基可 能会有什么化学性质?
乙醛
在日常生活中 我们都会有这样的 疑问,为什么有的 人喝酒“千杯万杯 都不醉”,而有的 人喝一点酒后就面 红耳赤,甚至酩酊 大醉?酒量的大小 到底与什么有关呢?
原来如 此啊!
研究发现,饮酒后乙醇进入人体内, 首先在乙醇脱氢酶的作用下氧化为乙醛, 然后又在乙醛脱氢酶的作用下将乙醛氧化 为乙酸,并进一步转化为CO2和H2O。如果 人体内缺少乙醛脱氢酶,饮酒后就会引起
氧化
CH3CH2OH
氧化
CH3CHO
CH3COOH
CH3CH2OH 还原(加成)CH3CHO 氧化 CH3COOH
生成的砖红色沉淀可 能是什么物质? CuO? CuOH是黄色
或淡黄色固体,
CuOH?不溶于水 ,非
常不稳定
Cu2O?C溶u于2O水是的红固色体难
问题解决:
试管内壁 的银镜如 何清洗?
小结: 乙醛能被酸性高锰酸钾溶液 氧化吗?
乙醛能使溴水褪色吗?
问题解决:已知柠檬醛的结构简式为:
CH3
CH3 O
|
|
‖
CH3–C=CH–CH2–CH2–C=CH–C–H
柠檬酸中含C=C和醛基两个官能团, 实验操作中,先检验哪一个官能团? 用什么检验试剂?
乙醛是一种无色液体, 有刺激性气味,密度小于 水,可与水和乙醇等有机 物互溶,沸点低,易挥发
HO HC C H
H 醛基
烃基
乙醛的结构
官能团:
O
醛基
CH
结构决定性质
HO
HC C H
H 醛基
烃基 1.从醛基的结构特点出发,预测乙醛可 能会有什么化学性质? 2.分析醛基上C的化合价,预测醛基可 能会有什么化学性质?
乙醛
在日常生活中 我们都会有这样的 疑问,为什么有的 人喝酒“千杯万杯 都不醉”,而有的 人喝一点酒后就面 红耳赤,甚至酩酊 大醉?酒量的大小 到底与什么有关呢?
原来如 此啊!
研究发现,饮酒后乙醇进入人体内, 首先在乙醇脱氢酶的作用下氧化为乙醛, 然后又在乙醛脱氢酶的作用下将乙醛氧化 为乙酸,并进一步转化为CO2和H2O。如果 人体内缺少乙醛脱氢酶,饮酒后就会引起
氧化
CH3CH2OH
氧化
CH3CHO
CH3COOH
CH3CH2OH 还原(加成)CH3CHO 氧化 CH3COOH
生成的砖红色沉淀可 能是什么物质? CuO? CuOH是黄色
或淡黄色固体,
CuOH?不溶于水 ,非
常不稳定
Cu2O?C溶u于2O水是的红固色体难
问题解决:
试管内壁 的银镜如 何清洗?
小结: 乙醛能被酸性高锰酸钾溶液 氧化吗?
乙醛能使溴水褪色吗?
问题解决:已知柠檬醛的结构简式为:
CH3
CH3 O
|
|
‖
CH3–C=CH–CH2–CH2–C=CH–C–H
柠檬酸中含C=C和醛基两个官能团, 实验操作中,先检验哪一个官能团? 用什么检验试剂?
乙醛教学课件修改精制课件
医学上检验病人是否患糖尿病
精制课件
14
学与问
结合乙醛的结构,说明乙醛 的氧化反应和还原反应有什 么特点?
HO H C CH
H
乙醛能发生氧化反应是由于醛基上的H原子 受C=O的影响,活性增强,能被氧化剂所氧化; 能发生还原反应是由于醛基上的C=O与C=C类似, 可以与H2发生加成反应。
总结:CH3CH2OH
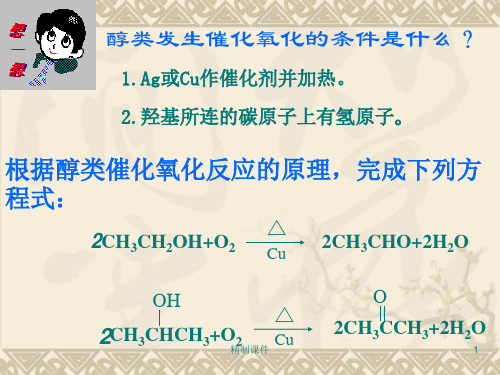
醇类发生催化氧化的条件是什么?
1.Ag或Cu作催化剂并加热。 2.羟基所连的碳原子上有氢原子。
根据醇类催化氧化反应的原理,完成下列方
程式:
△ 2CH3CH2OH+O2 Cu
2CH3CHO+2H2O
OH
△
2CH3CHCH3+O精2制课件 Cu
O
2CH3CCH3+2H2O
1
一、醛
醛的定义:
从结构上看,由烃基
氧化 还原
CH3CHO
氧化
CH3COOH
精制课件
15
【思考】乙醛能否使溴水或酸性KMnO4溶液褪色?
能
精制课件
16
乙醛性质的小结:
1、加成反应 醛+H2
醇
2、氧化反应
a 燃烧
b 催化氧化 c 被弱氧化剂氧化 (银氨溶液、新制的Cu(OH)2)
乙酸
d 使酸性高锰酸钾溶液、溴水褪色
精制课件
17
已知:柠檬醛的结构为:
R—C—R
分子式通式为 CnH2nO
官能团: O —C—精制课件
n≥3
29
3. 化学 性质
加氢还原为相应的醇;
不能发生银镜反应;
不与新制Cu(OH)2悬浊液 反应
(可用于鉴别酮与醛)
乙醛的教学课件ppt

乙醛可以发生加成反应 、氧化反应和还原反应
乙醛可以与羧酸发生酯 化反应
乙醛可以与醇发生酯化 反应
乙醛的用途
乙醛可以用于制造香料、医 药、农药等化工产品
乙醛可以用于合成树脂、橡 胶等高分子材料
乙醛可以用于制造醋酸、醋 酸盐等化学品
乙醛可以用于生产甲醛、乙 醇等其他有机化合物
02 乙醛的生产方法
乙炔水合法
在皮革加工中,乙醛也 被用作脱毛剂和鞣制剂 ,可以提高皮革的质量 和耐用性。
乙醛在科学Leabharlann 究中的应用在科学研究领域,乙醛作为一种重要 的有机化合物,被广泛用于合成和研 究各种复杂有机物和生物分子。
在生物学研究中,乙醛可以用于研究 生物分子的结构和功能,例如蛋白质 的修饰和基因的表达调控等。
乙醛可以作为反应中间体,用于研究 化学反应机理和合成方法学。
总结词
乙炔水合法是一种常用的生产乙醛的方法,通过将乙炔和水的反应来制备乙醛 。
详细描述
乙炔水合法通常在高温和催化剂的作用下进行,将乙炔气体和蒸气混合后通过 催化剂床层,反应生成乙醛和水。该方法具有较高的选择性,能够得到高纯度 的乙醛产品。
乙醇脱氢法
总结词
乙醇脱氢法是一种通过乙醇的脱氢反 应来制备乙醛的方法。
控制源头
加强生产过程中的密闭 和通风措施,减少乙醛 的逸散和排放。
定期检测
定期对工作环境进行乙 醛浓度检测,及时发现 和处理超标情况。
乙醛的未来发展
05
乙醛的生产技术的发展趋势
01
生物发酵技术
利用微生物发酵将糖类物质转化为乙醛,具有环保、高 效的特点,是未来发展的重要方向。
02
合成气直接转化技术
乙醛教学课件
化学:3.2《乙醛》课件(新人教版选修5)
20.8℃,易挥发
推测: 醛基的性质
想 一 想 ?
O C H
结构分析
O CH3 C H
O
发生在
O C
醛基
H
C
O
H 上的反应,断碳氧双键之一
发 生 在
C H
上的反应 ,受C=O的影响,断碳氢键
三、乙醛的化学性质
1.加成反应
O CH 3 C H +H2
O
Ni
△
H H
CH3 C
H 注意:C=O和C=C双键不同,通常情况下,乙醛不 能和HX、X2、H2O发生加成反应。 OH O
3. 由以上两点得出反应规律:
乙 醇
氧 化
还 原
乙 醛
氧 化
乙 酸
4. 醛基的检验方法: (1)与新制的银氨溶液反应有光亮的银镜生成 (2)与新制的氢氧化铜共热煮沸有砖红色沉淀生成
思考
乙醛能被氧气、弱氧化剂银氨溶液、 氢氧化铜氧化,能否被强氧化剂溴水、 酸性高锰酸钾溶液氧化? 溴水、酸性高锰酸钾都能使乙醛氧化 (5)与酸性高锰酸钾反应 乙醛能使高锰酸钾溶液溴水褪色
银氨溶液的配制
在洁净的试管里加入 1 mL 2%的AgNO3溶液,一边振荡试 管,一边逐渐滴入2%的稀氨水,直到最初产生的
沉淀恰好溶解为止,这时得到的溶液通常叫做银氨溶液。
生成 沉淀 NH3· H2 O NH4+ + OH-
AgNO3 + NH3· H2O = AgOH↓+ NH4NO3 Ag+ + NH3· H2O = AgOH↓+ NH4+ AgOH + 2NH3· H2O = Ag(NH3) 2OH + 2H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
精选ppt
13
Ⅱ.与新制的氢氧化铜反应 [实验3-6 ]
a、配制新制的Cu(OH)2悬浊液:在试管里加入 2ml10%NaOH溶液,滴入2%CuSO4溶液4~6滴, 振荡。
Cu2++2OH-= Cu(OH)2
b、乙醛的氧化:在上述蓝色浊液中加入 0.5ml乙醛溶液,加热至沸腾。
精选ppt
14
现象:有红色(Cu2O)沉淀生成
Ag++NH3·H2O→AgOH +NH4+
AgOH+2 NH3·H2O=[Ag(NH3)2]++OH-+2H2O
水浴加热生成银镜
:在配好的上述银氨
溶液中滴入三滴乙醛溶液,然后把试管放在热
水浴中静置。
CH3CHO+2Ag(NH3)2OH
△
→CH3COONH4+2Ag↓+3NH3+H2O
由于生成的银附着在试管壁上形成银镜,所以叫银镜反应
醛的定义:
从结构上看,由烃基
R (或氢原子3
O
H C H 甲醛
O
CH3CH2 C H
O
CH3 C H 乙醛
丙醛
精选ppt
4
二、乙醛
(一).乙醛的分子结构
分子式
C2H4O
结构式
HO H C CH
H
结构简式 CH3CHO 官能团 醛基: CHO 或
乙醛 醛类
精选ppt
1
醇类发生催化氧化的条件是什么?
1.Ag或Cu作催化剂并加热。 2.羟基所连的碳原子上有氢原子。
根据醇类催化氧化反应的原理,完成下列方
程式:
△ 2CH3CH2OH+O2 Cu
2CH3CHO+2H2O
OH
△
2CH3CHCH3+O精2选ppt Cu
O
2CH3CCH3+2H2O
2
一、醛
友情 提示
醛基的写法,不要写成
精选ppt
O CH
COH
5
精选ppt
6
(二)乙醛的物理性质: 密度比水小,沸点20.8℃,易挥发,易燃烧,
能和水、乙醇、乙醚、氯仿等互溶。
名称 分子式 分子量 沸点 溶解性
丙烷 C3H8
44
-42.07 不溶于水
乙醇 C2H6O
46
78.5 与水以任
乙醛 C2H4O
精选ppt
23
4. 物理通性
醛一般有特殊的刺激性气味,密度一 般比水小。
含有1-3个碳原子的醛能以任意比例和 水互溶。
精选ppt
24
5. 醛的化学性质
-H(氧化)
+ O(氧化)
醇
醛
酸
+H(还原) (氧化性)
(还原性)
① 与H2加成→醇
② 与O2催化氧化→酸
③ 与银氨溶液 、新制Cu(OH)2悬浊液→酸
21
五、醛类
1. 醛的定义:
分子里由烃基(包括氢原子)跟醛基相连 而构成的化合物。
2. 醛类通式: O R—C—H
饱和一元醛的通式为:
CnH2nO n≥1
精选ppt
22
3. 醛的同分异构体
(1) 写出符合分子式C4H8O属于醛的同 分异构体的结构简式。
(2) 写出符合分子式C5H10O属于醛的同 分异构体的结构简式。
2Cu(OH)2+CH3CHO+NaOH △ Cu2O↓+CH3COONa+3H2O
注意:氢氧化铜溶液一定要新制 碱一定要过量
应用: 检验醛基的存在
医学上检验病人是否患糖尿病
精选ppt
15
学与问
结合乙醛的结构,说明乙醛 的氧化反应和还原反应有什 么特点?
HO H C CH
H
乙醛能发生氧化反应是由于醛基上的H原子 受C=O的影响,活性增强,能被氧化剂所氧化; 能发生还原反应是由于醛基上的C=O与C=C类似, 可以与H2发生加成反应。
总结:CH3CH2OH
氧化 还原
CH3CHO
氧化
CH3COOH
精选ppt
16
【思考】乙醛能否使溴水或酸性KMnO4溶液褪色?
能
精选ppt
17
乙醛性质的小结:
1、加成反应 醛+H2
醇
2、氧化反应
a 燃烧
b 催化氧化 c 被弱氧化剂氧化 (银氨溶液、新制的Cu(OH)2)
乙酸
d 使酸性高锰酸钾溶液、溴水褪色
(1)乙醇氧化法:
2CH3CH2OH+O2
Cu
△
2CH3CHO+2H2O
(2)乙炔水化法:
HC CH+H2O 催化剂 CH3CHO
(3)乙烯氧化法:
2CH2=CH2+O2
催化剂
加热、
2CH3CHO
加精选压ppt
20
四、乙醛的用途
主要用于生产乙酸、丁醇、乙酸乙酯等, 是有机合成的重要原料。
精选ppt
精选ppt
11
注意点:
(1)试管内壁必须洁净;
(2)必须水浴;
(3)加热时不可振荡和摇动试管;
(4)须用新配制的银氨溶液;
(5)配制银氨溶液时,氨水不能过量. (防止生成易爆物质)
(6)实验后,银镜用HNO3浸泡,再用水洗
精选ppt
12
银镜反应有什么应用, 有什么工业价值?
应用: 检验醛基的存在, 工业上用来制瓶胆和镜子
CH3CHO+H2 Ni CH3CH2OH 学与问 这个反应属于氧化反应还是还原反应?为什么?
通常C=O双键加成:H2、HCN
C=C双键加成:H2、X2、HX、H2O
精选ppt
8
(2)氧化反应
a. 乙催化醛氧可化以被还原为乙醇, 能否被氧化?
催化剂
2CH3CHO+O2 △ 2CH3COOH
2、氧化反应
精选ppt
9
a.燃烧
点燃
2CH3CHO+5O2
4CO2+4H2O
b.在一定温度和催化剂条件下:
O
O
-C-H O
-C-O-H
2CH3CHO+O2 催化剂 2CH3COOH
精选ppt
10
c. 被弱氧化剂氧化 Ⅰ.银镜反应
配制银氨溶液 :取一洁净试管,加入 1ml2%的AgNO3溶液,再逐滴滴入2%的稀氨 水,至生成的沉淀恰好溶解。
精选ppt
18
已知:柠檬醛的结构为:
练习二
O
CH3 C CHCH2CH2C CH C H
CH3
CH3
如何证明存在碳碳双键?
先加足量的银氨溶液(或新制的Cu(OH)2)使 醛基氧化。然后再用酸性KMnO4溶液(或溴水) 检验碳碳双键,碳碳双键能使酸性KMnO4溶液 (或溴水)褪色
精选ppt
19
三、乙醛的制备
④ 与溴水、KMnO4溶液 反应→能使之褪
色(反应式不要求)
精选ppt
25
6. 特殊的醛——甲醛(蚁醛)
(1) 分子式:CH2O O
结构式: H—C—H;
结构简式:HCHO
特殊性:分子中有两个醛基
44
20.8 意比互溶
(C*1比原)较不子以互数上为多数同少据系来,物比你的较得有,出机在些物分什,子么熔量结沸接论点近或不时看能,法由通?
常极性强的分子间作用力强而熔沸点高。
(2)相似相溶规律。 精选ppt
7
(三)乙醛的化学性质
1、加成反应
根据加成反应的概念写出CH3CHO 和H2 加成反应的方程式。
