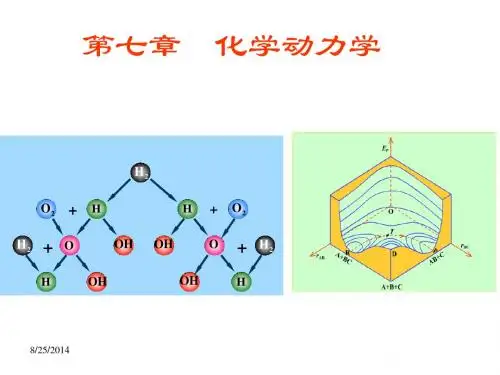
(推荐)《物理化学动力学》PPT课件
合集下载
物理化学化学动力学PPT课件

第10页/共105页
(1) 化学方法:
不同时刻取出一定量反应物,设法用骤冷、冲稀、 加阻化剂、除去催化剂等方法使反应立即停止,然后 进行化学分析。
(2) 物理方法:
用各种物理性质测定方法(旋光、折射率、电导 率、 电动势、 粘度等 )或现代谱 仪(IR、 UV-VIS、 ESR、NMR、ESCA等)监测与浓度有定量关系的物 理量的变化,从而求得浓度变化。
第14页/共105页
反应分子数(Molecularity of reaction)
反应分子数:是指在基元反应过程中参与反应的粒 子(分子、原子、离子、自由基等)的数目。根据反 应分子数可以将化学反应分为单分子反应,双分子 反应,三分子反应,三分子以上的反应目前还未发 现。
第15页/共105页
单分子反应
第11页/共105页
化学反应的速率方程
速率方程 基元反应 反应分子数 反应机理 质量作用定律 反应级数 反应的速率系数 反应分子数与反应级数的区别
第12页/共105页
速率方程 (Rate equation of chemical reaction) 速率方程又称动力学方程。它表明了反应速率与 浓度等参数之间的关系或浓度等参数与时间的关 系。速率方程分为微分式和积分式。
0
ax
k1t
k1
1 ln t
a
a
x
(a x) aek1t
不定积分式 或
ln cA k1t B
lna x k1t B
第33页/共105页
若令y为时间t时,反应物已反应的分数
y x a
则
r
d
a
1
dt
y
k1a
1
y
y d 1 y t
(1) 化学方法:
不同时刻取出一定量反应物,设法用骤冷、冲稀、 加阻化剂、除去催化剂等方法使反应立即停止,然后 进行化学分析。
(2) 物理方法:
用各种物理性质测定方法(旋光、折射率、电导 率、 电动势、 粘度等 )或现代谱 仪(IR、 UV-VIS、 ESR、NMR、ESCA等)监测与浓度有定量关系的物 理量的变化,从而求得浓度变化。
第14页/共105页
反应分子数(Molecularity of reaction)
反应分子数:是指在基元反应过程中参与反应的粒 子(分子、原子、离子、自由基等)的数目。根据反 应分子数可以将化学反应分为单分子反应,双分子 反应,三分子反应,三分子以上的反应目前还未发 现。
第15页/共105页
单分子反应
第11页/共105页
化学反应的速率方程
速率方程 基元反应 反应分子数 反应机理 质量作用定律 反应级数 反应的速率系数 反应分子数与反应级数的区别
第12页/共105页
速率方程 (Rate equation of chemical reaction) 速率方程又称动力学方程。它表明了反应速率与 浓度等参数之间的关系或浓度等参数与时间的关 系。速率方程分为微分式和积分式。
0
ax
k1t
k1
1 ln t
a
a
x
(a x) aek1t
不定积分式 或
ln cA k1t B
lna x k1t B
第33页/共105页
若令y为时间t时,反应物已反应的分数
y x a
则
r
d
a
1
dt
y
k1a
1
y
y d 1 y t
物理化学简明教程印永嘉化学动力学PPT课件

nB V
pB RT
18
第18页/共128页
以分压代替浓度 cB =pB /RT
r dc酯 1 dp酯 1 dp总
dt RT dt
RT dt
p酯=2p0 – p总
r 1 dc光 1 dp光 1 dp总 2 dt 2RT dt RT dt
p光气=2[p总– p0]
但对同样类型的反应如:C2H6(g) C2H4(g)+ H2(g) 由于副反应使产物中有一定量的甲烷存在,因此就不能 用系统总压力的增加来求算上述反应中各组分的分压, 亦即不能用压力这一物理性质来测量反应速率。
19
第19页/共128页
3. 反应速率的经验表达式:
微分式 :
r
f
(cB )
1
B
dcB dt
积分式:cB =f(t)
一般说来,只知道化学反应的计量方程式是不能预言其速
率公式的。反应速率公式的形式通常只能通过实验方可确
定。例如,H2与三种不同卤素的气相反应,其化学计量方 程式是类似的
H2 + I2
应当强调指出,反应分子数是针对基元反应而言的,表 示反应微观过程的特征。简单反应和复合反应是针对宏 观总反应而言的。这些概念不可混为一谈。
10
第10页/共128页
§9.2 反应速率和速率方程
1.反应速率的表示法 2.反应速率的实验测定 3.反应速率的经验表达式 4.反应级数 5.质量作用定律 6.速率常数
24
第24页/共128页
由质量作用定律可知,简单反应的反应级数与其相应 的基元反应的反应分子数是相同的。但值得注意的是, 反应级数与反应分子数毕竟是两个不同的概念。前者对 总反应而言,后者对基元反应而言。对于复合反应,说 其反应分子数是没有意义的。例如复合反应中有零级、 分数级或负数级反应,但反应分子数是不可能有零分子、 分数分子或负数分子反应的。
物理化学课件---第七章化学反应动力学
称为微分式;表示浓度与时间等参数间的关系式,称为积分式 。
一. 反应速率的定义
若某反应的计量方程:
a A bB cC d D
以代数方程表示其总的计量式:
0 vB B
B
在恒容条件下:
1 d cB v vB d t
def
恒容
1 d cA 1 d cB 1 d cC 1 d cD v vA d t vB d t vC d t vD d t
浓度的方次为反应方程中相应组分的分子个数。此即是质量作 用定律。
注意:质量作用定律仅仅适用于基元反应 。
例:
A
产物
dc A k cA dt
A + B
dc A k产 c A cB dt
dc A 2 k cA dt
A + A
产物
速率方程中的比例常数 k,叫做反应速率常数。它与温度有 关,与浓度无关。它是各反应物均为单位浓度时的反应速率。 它表示了反应的能力大小,同一温度下,对于不同反应,k 越 大,反应越快。
则有:
dc A dc B k1c A cB k 1c X dt dt dc X k1c A cB k 1c X k 2 c X dt dc Z k2cX dt
反应分子数 在基元反应中,实际参加反应的分子数目称为 反应分子数。反应分子数可区分为单分子反应、双 分子反应和三分子反应,四分子反应目前尚未发现 。反应分子数只可能是简单的正整数1,2或3。
基元反应
反应分子数
单分子反应
A P AB P 2A B P
双分子反应
三分子反应
化学速率方程的一般形式,反应级数
对于一般的化学反应: aA+bB+······→······+yY+zZ 反应速率可表示为:
物理化学课件第九章 化学动力学基本原理

1 N 2O5 N 2O4 O2 2
r k[N 2O5 ]
一级反应的微分速率方程 ---differential rate equation of first order reaction)
反应:
t 0
A P cA,0 a 0
t t cA a x x dcA r k1cA dt dx 或 r k1 (a x) dt
以分压代替浓度 ci =pi /RT dc酯 1 dp总 1 dp酯 r dt RT dt RT dt
p酯=2p0 – p总 p光气=2[p总– p0]
1 dc光 1 dp光 1 dp总 r 2 dt 2 RT dt RT dt
除压力外,旋光度、折光率、电导、比色、光谱等 物理性质均可应用,其优点是间接测量,不干扰反 应,方便,迅速,可连续测定。
例如对于气相反应: ( )T,V
2NO + Br2 2NOBr
1 d [ NO ] d [ Br2 ] 1 d [ NOBr ] r 2 dt dt 2 dt
二、反应速率的实验测定
Experimental measurement of rate
浓度c
d[P] dt
反应物和 产物的浓 度随时间 的变化
def
ni ni ,0 i
ni / mol i
or
dni d i
def
2 、反应速率的定义 对于任意反应
d 1 dni J dt i dt
def
aA + bB gG + hH
1 dnA 1 dnB 1 dnG 1 dnH J a dt b dt g dt h dt
《物理化学动力学》PPT课件

若活化络合物或产物的极性比反应物的大,则极性溶剂 往往能促进反应;若活化络合物或产物的极性比反应物的小, 则极性溶剂往往抑制反应。
② 溶剂化的作用。若活化络合物溶剂化比反应物的大,则该 溶剂能降低反应活化能而加速反应;反之,若活化络合物溶 剂化不如反应物的大,则活化能升高而不利于反应。
§11.10 溶液中反应
必需考虑溶剂与溶质的作用,及溶质在溶剂中的扩散。
1.溶剂对反应组分无明显相互作用的情况
(1)笼蔽效应(又称笼效应)
指反应物(溶质)分子被周围溶剂分子所包围,就好象关 在溶剂分子构成的笼子中,笼中的分子不能像气体分子那样自 由地运动,只能不停地在笼子中振动。若某一分子具有足够的
精选PPT
1
能量,或向某方向振动时,该方向的周围分子在这一瞬间密 度较稀,它即可能在该方向冲出溶剂的笼子。但它立即又陷 入另一个笼子。分子由于这种笼中运动所产生的效应,称为 笼蔽效应。
估计,反应物分子在一个笼子中的停留时间约为 10-12 ~ 10-8 s ,同时,发生约 102 ~ 104 次碰撞。
k 4 π L (D A D B )r A f B 11 .10.
上式中 f 为静电因子,量纲为1 。当反应物因所带电荷相反相 互吸引时,反应加速;当反应物因所带电荷相同,相互排斥时, 反应减慢,若无静电影响,则 f = 1。
精选PPT
6
若反应物分子半径相同,且无静电影响,由(11.10.2)与 (11.10.3)可得扩散控制的二级反应的速率常数:
c大
c小
扩散方向及 x正向
Fick 扩散第一定律:
在一定温度下,单位时间内向x方向扩散,通过截面积AS的
物质B的量 d n B
dt
正比于浓度梯度 d c B dx
② 溶剂化的作用。若活化络合物溶剂化比反应物的大,则该 溶剂能降低反应活化能而加速反应;反之,若活化络合物溶 剂化不如反应物的大,则活化能升高而不利于反应。
§11.10 溶液中反应
必需考虑溶剂与溶质的作用,及溶质在溶剂中的扩散。
1.溶剂对反应组分无明显相互作用的情况
(1)笼蔽效应(又称笼效应)
指反应物(溶质)分子被周围溶剂分子所包围,就好象关 在溶剂分子构成的笼子中,笼中的分子不能像气体分子那样自 由地运动,只能不停地在笼子中振动。若某一分子具有足够的
精选PPT
1
能量,或向某方向振动时,该方向的周围分子在这一瞬间密 度较稀,它即可能在该方向冲出溶剂的笼子。但它立即又陷 入另一个笼子。分子由于这种笼中运动所产生的效应,称为 笼蔽效应。
估计,反应物分子在一个笼子中的停留时间约为 10-12 ~ 10-8 s ,同时,发生约 102 ~ 104 次碰撞。
k 4 π L (D A D B )r A f B 11 .10.
上式中 f 为静电因子,量纲为1 。当反应物因所带电荷相反相 互吸引时,反应加速;当反应物因所带电荷相同,相互排斥时, 反应减慢,若无静电影响,则 f = 1。
精选PPT
6
若反应物分子半径相同,且无静电影响,由(11.10.2)与 (11.10.3)可得扩散控制的二级反应的速率常数:
c大
c小
扩散方向及 x正向
Fick 扩散第一定律:
在一定温度下,单位时间内向x方向扩散,通过截面积AS的
物质B的量 d n B
dt
正比于浓度梯度 d c B dx
第七章:化学动力学(物理化学) ppt课件

对任何反应: AA BB YY ZZ
A的消耗速率 Z的生成速率
vA dcA / dt vZ dcZ / dt
PPT课件
8
反应速率与消耗速率和生成速率
v 1 dcA = 1 dcB = 1 dcY = 1 dcZ
A dt B dt Y dt Z dt
例如,下列反应 为总包反应:
H2 Cl2 2HCl H2 I2 2HI H2 Br2 2HBr
PPT课件
17
在总反应中,连续或同时发生的所有基元反应称为 反应机理。
PPT课件
18
4.反应分子数与质量作用定律
在基元反应中,实际参加反应的分子数目称为 反应分子数。反应分子数可区分为单分子反应、双 分子反应和三分子反应,四分子反应目前尚未发现。 反应分子数只可能是简单的正整数1,2或3。
例如: Cl2 M 2Cl M
Cl H2 HCl H
H Cl2 HCl Cl
2Cl M Cl2 M
PPT课件
16
3.复杂反应——总包反应(overall reaction)
我们通常所写的化学方程式只代表反应的化学 计量式,而并不代表反应的真正历程。如果一个化 学计量式代表了若干个基元反应的总结果,那这种 反应称为复杂反应,也称总包反应或总反应。
PPT课件
6
§7.1 化学反应的反应速率及速率方程
速度(velocity)是矢量,有方向性。 速率(rate)是标量 ,无方向性,都是正值。
速率方程又称动力学方程。它表明了反应速 率与浓度等参数之间的关系或浓度等参数与时间 的关系。速率方程可表示为微分式或积分式。
PPT课件
物理化学PPT
3. 快速流动法
因快速反应完成迅速,用静态法无法准确 计时以作出动力学曲线; 一般流动法适合的反应半寿期:10 +210 3 s;
例如,生物体系中: 酶 (E) + 基质 (S) 络合物 (ES)
为一快速反应。
流动法测反应速率装置示意图:
反应一段时间后达到稳态,即反应管内各测 量点 xi 的组成浓度不变,设测得气体流速 1000 cm/s,则:xi 处的反应时间为:
1 dc i r i dt
i :反应计量系数;
反应物: R 0;产物:P 0 • 显然,反应速率 r 是一个强度量。
说明:
1)反应常有中间步骤、中间产物,因而时刻 t
时反应物、产物的浓度变化率瞬时关系式:
d[R] d[P] ( : ) t : dt dt
可能复杂化,即上式不是严格地成立。但 通常中间物寿命短、浓度非常小,其影响 可忽略。
3 H2 + N2 2 NH3(300 atm,500C)
考虑动力学因素:
反应若无催化剂,其反应速率 0,完全不 能用于生产; 若采用适合的催化剂,改变其反应历程,
则可加快反应的速度(常用 Fe 催化剂)。
研究反应机理,能为控制反应产物、反应
速度提供依据。
2. a)研究反应机理,有助了解分子结构,如化
……
2. 实验检测技术的限制
反应的中间产物(常为自由基或自由
原子)的活泼性、短寿命,导致极难
检测它们的存在及浓度之变化;
因此也就难以用实验手段来验证所假 设的反应机理(如上述的反应中自由 原子 I· H· , 的测定)。
第八章动力学基础 物化课件(修改版1209)
对于非依时计量学反应,其反应进度定义为:
d dnB B
上一内容 下一内容 回主目录
返回
2020/10/10
转化速率(rate of conversion) 转化速率的定义为:
•
d
1 dnB
dt B dt
转化速率的大小与所选取的物质B无关;与反 应方程式的写法有关
上一内容 下一内容 回主目录
返回
我们通常所写的化学方程式只代表反应的化学 计量式,而并不代表反应的真正历程。如果一个 化学计量式代表了若干个基元反应的总结果,那 这种反应称为总反应。
例如,下列反
应为总反应: H 2 Cl 2 2HCl
H 2 I2 2HI
H 2 Br2 2HBr
上一内容 下一内容 回主目录
返回
2020/10/10
例如:
dcA dt
kAcA
ln
c A,0 cA
k At
上一内容 下一内容 回主目录
返回
2020/10/10
基元反应(elementary reaction)
基元反应简称元反应,如果一个化学反应, 反应物分子在碰撞中相互作用直接转化为生 成物分子,这种反应称为元反应。
例如:
I2(g) M0 I I M0 H2(g) I I HI HI I +I M0 I2 (g) M 0
例如: 基元反应
(1) C2l M2Cl M
反应速率 B
k1[C2l][M]
(2) ClH2 HClH (3) HC2l HClCl (4) 2Cl MC2l M
k2[Cl][H2] k3[H][C2]l k4[Cl2][M]
上一内容 下一内容 回主目录
返回
物理化学-第六章化学动力学
反应刚开始,速率大, 然后不断减小,体现了 反应速率变化的实际情 况。
10
5. 化学反应速率的其它表示方法
rA rD rG rH d 以反应进度定义的速率为r, 表示为 r Vdt a d g h
对于反应:
aA+ dD gG +hH
dnA dnD dnG dnH d a d g h
Vdt
rG rA rD 数值与方程式书写有关,指定反应,指 rH d r Vdt a d 定时刻,反应组分的速率值唯一。 g h
5. 以反应进度表示的反应速率最为规范,在实际工作中各种表示 方法都在普遍使用。
13
四. 化学反应速率的测定
1. 化学反应速率测定的原理--绘制动力学曲线
dcH rH dt
对于恒容反应,反应速率的物理意义:任一组分B的浓度随时 间的变化率。
3. 消耗速率与生成速率 消耗速率:rA, rD, 等式右端取负号。 生成速率:rG, rH, 等式右端取正号。
9
4. 化学反应速率的曲线表示方法
在浓度随时间变化的图 上,在时间t 时,作交点 的切线,就得到 t 时刻的 瞬时速率。
反应速率可写作:
rA = –
dnA Vdt
rD = –
dnD Vdt
dnG rG = Vdt
dnH rH = Vdt
反应速率的物理意义:单位体积的反应系统中,任一组分B的 物质的量随时间的变化率。 8
对于恒容反应,反应速率可写作:
dcA rA dt
dcD rD dt
dcG rG dt
16
§6-2 化学反应的速率方程------微分速率方程 dcA rA 浓度是影响化学反应速率的主要因素之一。 dt
10
5. 化学反应速率的其它表示方法
rA rD rG rH d 以反应进度定义的速率为r, 表示为 r Vdt a d g h
对于反应:
aA+ dD gG +hH
dnA dnD dnG dnH d a d g h
Vdt
rG rA rD 数值与方程式书写有关,指定反应,指 rH d r Vdt a d 定时刻,反应组分的速率值唯一。 g h
5. 以反应进度表示的反应速率最为规范,在实际工作中各种表示 方法都在普遍使用。
13
四. 化学反应速率的测定
1. 化学反应速率测定的原理--绘制动力学曲线
dcH rH dt
对于恒容反应,反应速率的物理意义:任一组分B的浓度随时 间的变化率。
3. 消耗速率与生成速率 消耗速率:rA, rD, 等式右端取负号。 生成速率:rG, rH, 等式右端取正号。
9
4. 化学反应速率的曲线表示方法
在浓度随时间变化的图 上,在时间t 时,作交点 的切线,就得到 t 时刻的 瞬时速率。
反应速率可写作:
rA = –
dnA Vdt
rD = –
dnD Vdt
dnG rG = Vdt
dnH rH = Vdt
反应速率的物理意义:单位体积的反应系统中,任一组分B的 物质的量随时间的变化率。 8
对于恒容反应,反应速率可写作:
dcA rA dt
dcD rD dt
dcG rG dt
16
§6-2 化学反应的速率方程------微分速率方程 dcA rA 浓度是影响化学反应速率的主要因素之一。 dt
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1
能量,或向某方向振动时,该方向的周围分子在这一瞬间密 度较稀,它即可能在该方向冲出溶剂的笼子。但它立即又陷 入另一个笼子。分子由于这种笼中运动所产生的效应,称为 笼蔽效应。
估计,反应物分子在一个笼子中的停留时间约为 10-12 ~ 10-8 s ,同时,发生约 102 ~ 104 次碰撞。
若两反应物分子扩散到同一笼中,互相接触,称为遭遇, 两个溶质分子只有遭遇才能反应。
k 8RT 3η
25 °C 水溶液中扩散控制的二级反应的速率常数 k = 7.4 109 dm3 mol -1 s-1 。
(3)活化控制的反应
若反应活化能较大,反应速率较慢,相对来说扩散较快, 则为活化控制。若溶剂对反应物无明显作用,其反应速率与 气相反应相似
7
这是因为 : ①溶剂无明显作用,所以对活化能影响不大; ②虽然由于笼罩效应,反应物分子扩散到同一笼子中要慢于在 气相中自由运动,但一旦进入同一笼子,它们的重复碰撞则快 的多,所以其总结果,对分子碰撞只起到分批的作用, 对单 位时间内碰撞总数则影响不大。
§11.10 溶液中反应
必需考虑溶剂与溶质的作用,及溶质在溶剂中的扩散。
1.溶剂对反应组分无明显相互作用的情况
(1)笼蔽效应(又称笼效应) 指反应物(溶质)分子被周围溶剂分子所包围,就好象关
在溶剂分子构成的笼子中,笼中的分子不能像气体分子那样自 由地运动,只能不停地在笼子中振动。若某一分子具有足够的
实际上,一些溶液中二级反应的速率与按气体碰撞理论算 得的值相近;而某些一级反应也与气相反应速率相近。如下 表所示:
表11.10.1 N2O5 在不同溶剂中分解的速率常数、指前因子及活化能
(25°C溶) 剂
k/(10-5 s-1)
lg(A/s-1)
Ea/(kJ mol-1)
(气 相)
3.38
13.6
k 4 π L (D A D B )r A f B 11 .10.
上式中 f 为静电因子,量纲为1 。当反应物因所带电荷相反相 互吸引时,反应加速;当反应物因所带电荷相同,相互排斥时, 反应减慢,若无静电影响,则 f = 1。
6
若反应物分子半径相同,且无静电影响,由(11.10.2)与 (11.10.3)可得扩散控制的二级反应的速率常数:
② 溶剂化的作用。若活化络合物溶剂化比反应物的大,则该 溶剂能降低反应活化能而加速反应;反之,若活化络合物溶 剂化不如反应物的大,则活化能升高而不利于反应。
敏感,而扩散控制的反应对温度不敏感。
(2)扩散控制的反应
一些快速反应,如自由基复合或酸碱中和反应,多为扩散控制 的。其反应总速率等于扩散速率。而扩散速率可用扩散定律计算。
3
扩散定律:溶液中每一个溶质分子向 任意方向运动的概率都一样,但在浓 度高处,单位体积中分子数比浓度低 处多,所以扩散方向总是从高浓度指 向低浓度。
笼罩效应使反应分两个步骤: 先扩散,后反应。
AB扩 散AB 反 应产物
(遭 遇)
2
AB扩 散AB 反 应产物
(遭 遇)
其中 AB 表示反应物A与B扩散到一起形成的遭遇对。
若反应活化能: Ea 小,则反应速率常数 k大 —— 扩散控制。 Ea 大,则反应速率常数 k大 —— 反应控制,或活化控制 由于扩散受温度影响较小,因此反应控制的反应对温度比较
c大
c小
扩散方向及 x正向
Fick 扩散第一定律:
在一定温度下,单位时间内向x方向扩散,通过截面积AS的
物质B的量 d n B
dt
正比于浓度梯度 d c B dx
和 As 的乘积。
dd ntBDAsd dcxB 11.10.1
D — 扩散系数,单位 m2.s-1,表示单位浓度梯度时扩散通过单 位截面的扩散速率。
103.3
四氯化碳
4.69
13.6
101.3
三氯甲烷
3.72
13.6
102.5
8
表11.10.1(续)
溶剂 二氯乙烯 硝基甲烷
溴
k/(10-5 s-1) 4.79 3.13 4.27
lg(A/s-1) 13.6 13.5 13.3
Ea/(kJ mol-1) 102.1 102.5 溶剂中分解速率几乎都相等。
4
dd ntBDAsd dcxB 11.10.1
因为 x 增大的方向为 cB 减小的方向,
所以 d cB 0 ,为保持扩散为正值,
c大
c小
dx
故上式右边加负号。
扩散方向及 x正向
对球形粒子,D可按爱因斯坦—斯托克斯方程计算:
D RT 11.10.2
6Lπηr 上式中,L 为阿伏加德罗常数,η [eta]为粘度,r 为球形粒 子的半径。
AlCl3
OH
在硝基苯 溶剂中被 加速
在CS2 溶 剂中被加 速
COCH3
COCH3 OH
10
又如,溴与甲苯的作用:
在 CS2 溶剂溶 剂中主产物
CH2Br (85.2% )
CH3 + Br2
在硝基苯 溶 Br 剂中主产物
+
CH3 (对位) (98% )
CH(3 邻位)
Br
可见,选择适当溶剂有时还能加速主反应,抑制副反应, 这对于降低原料消耗,减轻分离工作,很有意义。
11
溶剂对于反应速率的影响,原因比较复杂。以下作一简 单的定性介绍,以作选择溶剂时的参考。
① 溶剂的极性越大,一般介电常数越大,则有利于削弱异 号离子间的吸引力,有利于产生阴阳离子的反应,而不利于 阴阳离子的化合反应。
若活化络合物或产物的极性比反应物的大,则极性溶剂 往往能促进反应;若活化络合物或产物的极性比反应物的小, 则极性溶剂往往抑制反应。
* 2. 溶剂对反应组分产生明显作用的情况—溶剂对 反应速率的影响
在许多情况下,溶剂与反应物确有相互作用,从而对反应 速率产生显著影响。例如:C6H5CHO 的溴化,在CCl4 中就比 在CHCl3 或 CS2 中快 1000 倍。
9
有的平行反应,一定的溶剂只加速其中的一种反应,如:
OH
CH3COCl +
5
扩散控制的二级反应的速率常数:
若两种半径为 rA与 rB , 扩散系数为 DA 与 DB 的球形分子 进行扩散控制的溶液反应,可假设一种分子 A 不动,另一种 分子 B 向它扩散,在 rAB = rA + rB 处 cB = 0 ,向外浓度逐渐增 大,形成球形对称浓度梯度,则由扩散定律可导出,该二级 反应速率常数 k 为:
能量,或向某方向振动时,该方向的周围分子在这一瞬间密 度较稀,它即可能在该方向冲出溶剂的笼子。但它立即又陷 入另一个笼子。分子由于这种笼中运动所产生的效应,称为 笼蔽效应。
估计,反应物分子在一个笼子中的停留时间约为 10-12 ~ 10-8 s ,同时,发生约 102 ~ 104 次碰撞。
若两反应物分子扩散到同一笼中,互相接触,称为遭遇, 两个溶质分子只有遭遇才能反应。
k 8RT 3η
25 °C 水溶液中扩散控制的二级反应的速率常数 k = 7.4 109 dm3 mol -1 s-1 。
(3)活化控制的反应
若反应活化能较大,反应速率较慢,相对来说扩散较快, 则为活化控制。若溶剂对反应物无明显作用,其反应速率与 气相反应相似
7
这是因为 : ①溶剂无明显作用,所以对活化能影响不大; ②虽然由于笼罩效应,反应物分子扩散到同一笼子中要慢于在 气相中自由运动,但一旦进入同一笼子,它们的重复碰撞则快 的多,所以其总结果,对分子碰撞只起到分批的作用, 对单 位时间内碰撞总数则影响不大。
§11.10 溶液中反应
必需考虑溶剂与溶质的作用,及溶质在溶剂中的扩散。
1.溶剂对反应组分无明显相互作用的情况
(1)笼蔽效应(又称笼效应) 指反应物(溶质)分子被周围溶剂分子所包围,就好象关
在溶剂分子构成的笼子中,笼中的分子不能像气体分子那样自 由地运动,只能不停地在笼子中振动。若某一分子具有足够的
实际上,一些溶液中二级反应的速率与按气体碰撞理论算 得的值相近;而某些一级反应也与气相反应速率相近。如下 表所示:
表11.10.1 N2O5 在不同溶剂中分解的速率常数、指前因子及活化能
(25°C溶) 剂
k/(10-5 s-1)
lg(A/s-1)
Ea/(kJ mol-1)
(气 相)
3.38
13.6
k 4 π L (D A D B )r A f B 11 .10.
上式中 f 为静电因子,量纲为1 。当反应物因所带电荷相反相 互吸引时,反应加速;当反应物因所带电荷相同,相互排斥时, 反应减慢,若无静电影响,则 f = 1。
6
若反应物分子半径相同,且无静电影响,由(11.10.2)与 (11.10.3)可得扩散控制的二级反应的速率常数:
② 溶剂化的作用。若活化络合物溶剂化比反应物的大,则该 溶剂能降低反应活化能而加速反应;反之,若活化络合物溶 剂化不如反应物的大,则活化能升高而不利于反应。
敏感,而扩散控制的反应对温度不敏感。
(2)扩散控制的反应
一些快速反应,如自由基复合或酸碱中和反应,多为扩散控制 的。其反应总速率等于扩散速率。而扩散速率可用扩散定律计算。
3
扩散定律:溶液中每一个溶质分子向 任意方向运动的概率都一样,但在浓 度高处,单位体积中分子数比浓度低 处多,所以扩散方向总是从高浓度指 向低浓度。
笼罩效应使反应分两个步骤: 先扩散,后反应。
AB扩 散AB 反 应产物
(遭 遇)
2
AB扩 散AB 反 应产物
(遭 遇)
其中 AB 表示反应物A与B扩散到一起形成的遭遇对。
若反应活化能: Ea 小,则反应速率常数 k大 —— 扩散控制。 Ea 大,则反应速率常数 k大 —— 反应控制,或活化控制 由于扩散受温度影响较小,因此反应控制的反应对温度比较
c大
c小
扩散方向及 x正向
Fick 扩散第一定律:
在一定温度下,单位时间内向x方向扩散,通过截面积AS的
物质B的量 d n B
dt
正比于浓度梯度 d c B dx
和 As 的乘积。
dd ntBDAsd dcxB 11.10.1
D — 扩散系数,单位 m2.s-1,表示单位浓度梯度时扩散通过单 位截面的扩散速率。
103.3
四氯化碳
4.69
13.6
101.3
三氯甲烷
3.72
13.6
102.5
8
表11.10.1(续)
溶剂 二氯乙烯 硝基甲烷
溴
k/(10-5 s-1) 4.79 3.13 4.27
lg(A/s-1) 13.6 13.5 13.3
Ea/(kJ mol-1) 102.1 102.5 溶剂中分解速率几乎都相等。
4
dd ntBDAsd dcxB 11.10.1
因为 x 增大的方向为 cB 减小的方向,
所以 d cB 0 ,为保持扩散为正值,
c大
c小
dx
故上式右边加负号。
扩散方向及 x正向
对球形粒子,D可按爱因斯坦—斯托克斯方程计算:
D RT 11.10.2
6Lπηr 上式中,L 为阿伏加德罗常数,η [eta]为粘度,r 为球形粒 子的半径。
AlCl3
OH
在硝基苯 溶剂中被 加速
在CS2 溶 剂中被加 速
COCH3
COCH3 OH
10
又如,溴与甲苯的作用:
在 CS2 溶剂溶 剂中主产物
CH2Br (85.2% )
CH3 + Br2
在硝基苯 溶 Br 剂中主产物
+
CH3 (对位) (98% )
CH(3 邻位)
Br
可见,选择适当溶剂有时还能加速主反应,抑制副反应, 这对于降低原料消耗,减轻分离工作,很有意义。
11
溶剂对于反应速率的影响,原因比较复杂。以下作一简 单的定性介绍,以作选择溶剂时的参考。
① 溶剂的极性越大,一般介电常数越大,则有利于削弱异 号离子间的吸引力,有利于产生阴阳离子的反应,而不利于 阴阳离子的化合反应。
若活化络合物或产物的极性比反应物的大,则极性溶剂 往往能促进反应;若活化络合物或产物的极性比反应物的小, 则极性溶剂往往抑制反应。
* 2. 溶剂对反应组分产生明显作用的情况—溶剂对 反应速率的影响
在许多情况下,溶剂与反应物确有相互作用,从而对反应 速率产生显著影响。例如:C6H5CHO 的溴化,在CCl4 中就比 在CHCl3 或 CS2 中快 1000 倍。
9
有的平行反应,一定的溶剂只加速其中的一种反应,如:
OH
CH3COCl +
5
扩散控制的二级反应的速率常数:
若两种半径为 rA与 rB , 扩散系数为 DA 与 DB 的球形分子 进行扩散控制的溶液反应,可假设一种分子 A 不动,另一种 分子 B 向它扩散,在 rAB = rA + rB 处 cB = 0 ,向外浓度逐渐增 大,形成球形对称浓度梯度,则由扩散定律可导出,该二级 反应速率常数 k 为:
