电化学原理及其应用二轮复习
第一篇主题八选择题17膜技术在电化学原理中的应用-2025届高考化学二轮复习

选择题17膜技术在电化学原理中的应用1.(2023·湖北,10)我国科学家设计如图所示的电解池,实现了海水直接制备氢气技术的绿色化。
该装置工作时阳极无Cl2生成且KOH溶液的浓度不变,电解生成氢气的速率为x mol·h-1。
下列说法错误的是()A.b电极反应式为2H2O+2e-===H2↑+2OH-B.离子交换膜为阴离子交换膜C.电解时海水中动能高的水分子可穿过PTFE膜D.海水为电解池补水的速率为2x mol·h-1答案 D解析b电极为阴极,发生还原反应,电极反应为2H2O+2e-===H2↑+2OH-,故A正确;该装置工作时阳极无Cl2生成且KOH浓度不变,阳极发生的电极反应为4OH--4e-===O2↑+2H2O,为保持OH-浓度不变,则阴极产生的OH-要通过离子交换膜进入阳极室,即离子交换膜应为阴离子交换膜,故B正确;电解时电解槽中不断有水被消耗,海水中的动能高的水可穿过PTFE膜,为电解池补水,故C正确;由电解总反应可知,每生成1 mol H2要消耗1 mol H2O,生成H2的速率为x mol·h-1,则补水的速率也应是x mol·h-1,故D错误。
2.(2023·辽宁,11)某低成本储能电池原理如图所示。
下列说法正确的是()A.放电时负极质量减小B.储能过程中电能转变为化学能C.放电时右侧H+通过质子交换膜移向左侧D.充电总反应:Pb+SO2-4+2Fe3+===PbSO4+2Fe2+答案 B解析放电时,负极上Pb失电子结合硫酸根离子生成PbSO4附着在负极上,负极质量增大,A错误;储能过程中,该装置为电解池,将电能转化为化学能,B正确;放电时,右侧为正极,电解质溶液中的阳离子向正极移动,左侧的H+通过质子交换膜移向右侧,C错误;充电时,总反应为PbSO4+2Fe2+===Pb+SO2-4+2Fe3+,D错误。
3.(2022·全国乙卷,12)Li-O2电池比能量高,在汽车、航天等领域具有良好的应用前景。
2024届高三化学二轮复习+专题七++:离子交换膜在电化学中的应用

近年高考中涉及离子交换膜原理的考题 频繁出现,这一类题型的特点是新情境、 老问题,考查的知识点有原电池原理、 电解池原理、化学电源等。能够多方位 考查化学学科核心素养。
近几年高考卷中有关离子交换膜考查内容统计
阳离子交换膜 阴离子交换膜
小专题 2023年河北卷, 2023年湖北卷,10
13
2023年6月浙江 2023年山东卷,11 卷,13
3.重温经典
平衡电荷,溶质单一
原电池
【例2】(2023河北卷7题)我国科学家发明了一种以
负极
和MnO2为电极材料的新型电池,其内部结构
正极
如下图所示,其中①区、②区、③区电解质溶液的酸碱性不同。放电时,电极材料
转化 -2e-
为
B 。+下2K列+说法错误的是( )
负极反应
A.充电时,b 电极上发生还原反应 B.充电时,外电源的正极连接 b 电极 C.放电时,①区溶液中的SO42-向②区迁移
稀
2.知识重构
7. 分离提纯时,杂质离子一般从“原料室”移出。
(6)离子交换膜的选择 离子交换膜作用:③分离提纯。
例4:[2016·全国卷Ⅰ]三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性 电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过 离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。 ab、cd均选何种交换膜?
质子交换膜
2023年全国 甲卷,6
2020年北京 卷,节选
双极膜
2023年广东 卷,16
2021年全国 甲卷,13
离子交换膜 2022年全国甲卷,4
2023年北京卷,5
2022年山东卷, 2023年河北卷,13 13 2021河北卷,9 2022河北卷,12
高三新人教化学二轮专题复习教案七:《电化学原理及其应用》
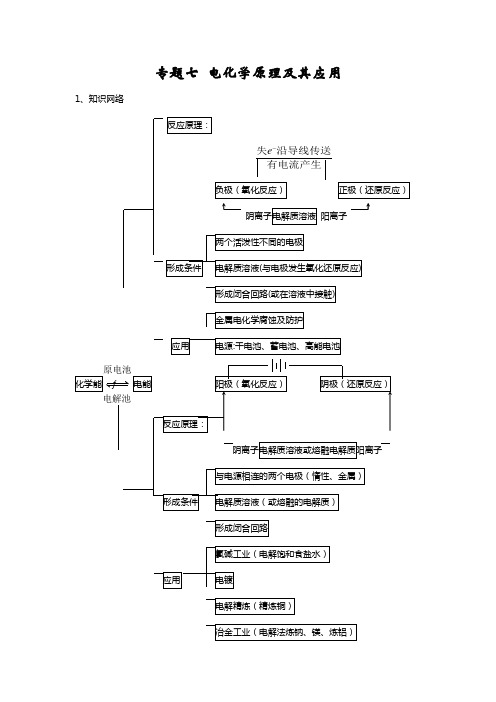
专题七电化学原理及其应用1、知识网络失沿导线传送e有电流产生阳离子例1:一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2—。
下列对该燃料电池说法正确的是()A、在熔融电解质中,O2—由负极移向正极B、电池的总反应是:2C4H10+13O2→8CO2+10H2OC、通入空气的一极是正极,电极反应为:O2+4e—=2O2—D、通入丁烷的一极是正极,电极反应为:C4H10+26e-+13O2-=4CO2+5H2O命题意图:本题以丁烷燃料电池为载体综合考查了原电池原理涉及到的有关“电子流向、电极反应式、总反应式”等内容。
侧重考查学生对原电池原理的理解程度。
答案:BC例2.电解原理在化学工业中有着广泛的应用,如图,表示一个电解池装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
请回答以下问题:(1)若X、Y都是惰性电极,a是饱和氯化钠溶液,实验开始时,同①电解池中X极上的电极反应式是。
在X附近观察到的现象是。
②Y电极上的电极反应式是。
检验该电极反应产物的方法是。
(2)如要用电解方法精炼粗铜,电镀液a选用硫酸铜溶液,则①X电极的材料是。
电极反应式是。
②Y电极的材料是。
电极反应式是。
(说明:杂质发生的电极反应不必写出)答案:(1)①2H++2e-=H2↑放出气体,溶液变红。
②2Cl-+2e-=Cl2↑把湿润的KI淀粉试纸放在Y电极附近,试纸变蓝色。
(2)①纯铜Cu2++2e-=Cu ②粗铜Cu-2e-=Cu2+例3.X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。
已知:①X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;②乙可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
请回答:(1)Z2Y的化学式是。
(2)Z2Y2与X2Y反应的化学方程式是。
(3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(I)C(II)为多孔石墨电极。
高三化学二轮复习 电化学原理及应用

电化学原理及其应用【高考要求】1.了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。
2.了解常见化学电源的种类及其工作原理。
3.理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施。
【高考再现】1.判断下列说法是否正确:①[2011·山东理综化学卷T12]D.电解AlCl3、FeCl3、CuCl2的混合溶液是阴极上依次析出Cu,Fe,Al。
()②[2011·T8]D.电解NaCl溶液得到22.4LH2(标准状况),理论上需要转移N A个电子()2.[2012·山东理综化学卷T28](4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是。
a电能全部转化为化学能 b粗铜接电源正极,发生氧化反应c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为。
3.[2013·山东理综化学卷T28]右图为电解精炼银的示意图 ,若b极有少量红棕色气体生成,则生成该气体的电极反应式为 AgNO3-HNO3溶液4.[2014·山东理综化学卷T30]离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品应接电源的极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为。
若改用AlCl3水溶液作电解液,则阴极产物为。
5.[2010·山东理综化学卷]如果以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为合作探究一:电极反应式的书写:1、2013年4月1日奇瑞推出甲烷为能源的汽车并试生产100辆,电解质是氢氧化钠溶液。
请写出它的电极反应式和电池反应式:正极 负极 总 如果电解质是稀硫酸溶液呢?2、以CO 为燃料制作新型燃料电池,电池的正极通入O 2和CO 2,负极通入CO ,电解质是熔融碳酸盐。
电化学二轮复习课件

电极反应与电池反应
02
电极反应类型及特点
01
氧化还原反应
在电极上发生氧化和还原反应,分为阳极氧化和阴极还 原。
02
电子转移
电极反应中常伴随电子的转移,从物质的一个部位转移 到另一个部位。
03
能量转化
电极反应中常伴随能量的转化,如光能、电能等。
电池反应方程式书写规则
质量守恒
能量守恒
电池反应前后,元素种类和原子个数 不变。
1.D 定期更换电解液,注意处理废液,避免对环
境造成污染。
1.谢谢聆 听
特点
电解池是一种通过电流作用将电解质分解为离子的装置,其工作原理与原电池 相反。
电解池类型及电极判断方法
类型
电解池可分为水溶液电解池、熔融盐电解池和熔融金属电解池等。
电极判断方法
根据电解时电极上发生的反应类型来判断电极名称,如失去电子的电极为阳极, 得到电子的电极为阴极。
电解池应用举例
氯碱工业
利用电解饱和食盐水溶 液的方法生产氢氧化钠 和氯气。
解液浓度、温度等因素。
原电池计算方法
利用原电池电动势、电流、电阻 等参数进行计算,其中需要考虑 电极电位、离子浓度、温度等因
素。
技巧总结
掌握电解池和原电池的计算方法 和适用范围,注意各个参数的含 义和单位,同时注意不同类型电
池的特点和计算方法。
电化学实验设计与操作规范回
06
顾
电化学实验设计原则与注意事项
原电池类型及电极判断方法
原电池类型 一次电池:使用后即丢弃,如碳锌电池、碱性电池等。
二次电池:可充电重复使用,如镍镉电池、锂离子电池等。
原电池类型及电极判断方法
01
化学二轮复习题型分组训练7电化学原理应用__化学电源与电解技术含解析

题型分组训练7 电化学原理应用——化学电源与电解技术(A组)1.用石墨电极完成下列电解实验。
实验一实验二装置现象a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化两个石墨电极附近有气泡产生;n处有气泡产生……下列对实验现象的解释或推测不合理的是()A.a、d处:2H2O+2e-===H2↑+2OH-B.b处:2Cl--2e-===Cl2↑C.c处发生了反应:Fe-2e-===Fe2+D.根据实验一的原理,实验二中m处能析出铜2.根据光合作用原理,设计如图原电池装置。
下列说法正确的是()A.a电极为原电池的正极B.外电路电流方向是a→bC.b电极的电极反应式为:O2+2e-+2H+===H2O2D.a电极上每生成1 mol O2,通过质子交换膜的H+为2 mol 3.甲醇燃料电池是目前应用比较广泛的一种燃料电池,其工作原理如下图所示:下列说法正确的是()A.N为正极,发生氧化反应B.a气体为氧气,b气体为甲醇C.甲池溶液pH增大,乙池溶液pH减小D.若有1 mol CO2生成,则有6 mol H+从甲池透过交换膜进入乙池4.如图所示装置,开关K闭合时,电流表指针发生偏转,下列有关开关K闭合时的说法正确的是()A.b极是负极B.a极电极反应式为H2-2e-===2H+C.当装置中有1 mol电子通过时,右池产生标准状况下5.6 L 气体D.电池总反应式为2H2+O2===2H2O5.利用微生物可将废水中苯酚的化学能直接转化为电能,装置如图所示。
电池工作时,下列说法正确的是()A.a极为正极,发生氧化反应B.b极的电极反应式为:2NO-3+12H+-10e-===N2↑+6H2O C.中间室的Cl-向左室移动D.左室消耗苯酚(C6H5OH)9.4 g时,用电器流过2.4 mol电子6.工业上联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极。
测得同温同压下,气体甲与气体乙的体积比约为1:2,下列有关说法正确的是()A.a电极的电极反应式为:2H++2e-===H2↑B.产物丙为硫酸C.离子交换膜d为阴离子交换膜D.每转移0.1 mol电子,产生1。
高考化学第二轮专题复习:电解原理及其应用
优 秀 课 件 PPT公开 课优质 课PPT课 件202 0年高 考化学 第二轮 专题复 习:电 解原理 及其应 用(共2 6张PPT ) 优 秀 课 件 PPT公开 课优质 课PPT课 件202 0年高 考化学 第二轮 专题复 习:电 解原理 及其应 用(共2 6张PPT )
历年真题研习 必备知能整合
高考二轮专题复习·化学
返回目录
该装置工作时,下列叙述错误的是( ) A.阴极的电极反应:CO2+2H++2e-===CO+ H2O B.协同转化总反应:CO2+H2S===CO+H2O+S C.石墨烯上的电势比ZnO@石墨烯上的低 D.若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2 +,溶液需为酸性
优 秀 课 件 PPT公开 课优质 课PPT课 件202 0年高 考化学 第二轮 专题复 习:电 解原理 及其应 用(共2 6张PPT )
高考二轮专题复习·化学
返回目录
解析 在水银电极上,Na+比H+容易放电,故在 水银电极上Na+得电子发生还原反应;碳棒为阳极,在 碳棒上Cl-失电子,发生氧化反应2Cl--2e-===Cl2↑, 产生的气体甲为Cl2,丙电极是正极;
返回目录
A.丙电极是负极,碳棒上发生氧化反应 B.气体甲是氯气,气体乙是氢气 C.电子迁移路径:碳棒→丙电极,丁电极→水银 D.该方法获取的苛性钠纯度高,但存在汞蒸气污 染 答案 A
优 秀 课 件 PPT公开 课优质 课PPT课 件202 0年高 考化学 第二轮 专题复 习:电 解原理 及其应 用(共2 6张PPT )
优 秀 课 件 PPT公开 课优质 课PPT课 件202 0年高 考化学 第二轮 专题复 习:电 解原理 及其应 用(共2 6张PPT )
返回目录
高考化学二轮专题复习提升训练电化学原理及其应用
提升训练11 电化学原理及其应用1.我国“蛟龙”号载人潜水器进行第五次下潜试验,最大深度达到7 062米,并安全返回。
其动力电源是Al—AgO电池,原理如图所示。
下列说法中正确的是( )A.Al电极是该电池的正极B.Ag在AgO/Ag电极上发生氧化反应C.该电池负极反应是2Al+8OH--6e-2Al+4H 2OD.AgO/Ag电极附近溶液中的pH减小2. (2017·学军中学)氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如下。
下列有关氢氧燃料电池的说法不正确的是( )A.该装置将化学能转化为电能B.为了增加灯泡亮度,可以将电极石墨棒变得粗糙多孔C.电子迁移方向:电极a→灯泡→电极b→电解质溶液→电极aD.该电池的总反应:2H2+O22H2O3.下列各组中,每种电解质溶液在惰性电极条件下电解时只生成氢气和氧气的是( )A.HCl、CuCl2、Ba(OH)2B.NaOH、CuSO4、H2SO4C.NaOH、H2SO4、Ba(OH)2D.NaBr、H2SO4、Ba(OH)24.有关下列电化学装置说法正确的是( )A.装置①中,盐桥中的K+移向ZnSO4溶液B.装置②工作一段时间后,a极附近溶液的pH增大C.用装置③精炼铜时,c极为粗铜D.装置④电池负极的电极反应式为O2+2H2O+4e-4OH-5.下图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔融盐,阴极最后只剩下纯钛。
下列说法中正确的是( )A.阳极的电极反应式为2Cl--2e-Cl2↑B.阴极的电极反应式为TiO2+4e-Ti+2O2-C.通电后,O2-、Cl-均向阴极移动D.石墨电极的质量不发生变化6.一种用于驱动潜艇的液氨—液氧燃料电池的工作原理示意如图,下列有关该电池说法正确的是( )A.该电池工作时,每消耗22.4 L NH3转移3 mol电子B.电子由电极A经外电路流向电极BC.电池工作时,OH-向电极B移动D.电极B上发生的电极反应为:O2+ 4H++ 4e-2H2O7.(2017·全国卷3)全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a 常用掺有石墨烯的S8材料,电池反应为:16Li+x S88Li2S x(2≤x≤8)。
2019高考化学二轮复习课件第10讲电化学原理及应用.ppt
电源负极―导―线→阴极 电源正极―导―线→阳极
同电解 池
离子 阳离子移向正极
移动 阴离子移向负极
方向
阴离子移向阳极 阳离子移向阴极
12
知识点二 电解规律及电解原理的应用 1.电解时电极产物的判断 (1)阳极产物的判断 首先看阳极材料,如果是活泼性电极(金属活动顺序 表 Ag 以前),则电极材料失电子,电极溶解。如果是惰性 电极(Pt、Au、石墨),则要再看溶液中的离子的失电子能 力。阴离子放电顺序为:S2->I->Br->Cl->OH->……
基本理论
第10讲 电化学原理及应用
2
考纲展示
1.了解原电池和电解池的工作原理,能写出电极 反应式和电池反应方程式。
2.了解常见化学电源的种类及其工作原理。
3
考点启迪
(学生用书 P36)
判断正误(正确的打“√”,错误的打“×”) 1.(2011·江苏卷)铜的金属活动性比铁的弱,可在海 轮外壳上装若干铜块以减缓其腐蚀( ) 2.(2011·山东卷)电解 AlCl3、FeCl3、CuCl2 的混合 液时阴极上依次析出 Cu、Fe、Al( )
2H2O
溶液 H2SO4 溶液 Na2SO
4
溶液
水 水 水
增大
增 大
增大
减 小
增大
不 变
电解 质
溶液 复原 所加 物质
水
水
水
15
电极反 应特点
实例
电解 电解 质型
电解质 电离出 的阴、 阳离子 分别在 两极放
电
HCl 溶液
CuCl2 溶液
被电 解
的物 质
电解 质
电解 质
电解
高考化学二轮复习课件电解原理及其应用
以 及 应 用 ②安全性问题。有机溶剂应该性能稳定且为___态,具有_____结构的高分子
电镀铜
(3)由题干可知,LiFePO4的晶胞中,Fe存在于由O构成的正八面体内部,P存在于
由②O对构于成反的应正前四后面气体体内分部子;数再不分变析化题的干化中学给反出应的,(a混),合(气b)和体(的c)三总个压不强同、物总质体的积、总物质的量、相电对冶分金子质量都不随时间而变化,都不能作为判断平衡的依据。
电解原理
考向一 电解原理分析
考向二 电解规律的理解与应用
命题 角度
通过对电解装置的正确分析,掌握电解原理
下列是四套不同介质的电解装置,通电后在 A 装置石墨电极 a 和 b 附近分别滴加一滴石蕊溶液。
(1) ①在 A 装置中,Na+、SO42- 如何移动?②石墨 a 周围溶液颜色如何改变?③石墨 b 周围溶液颜色如何改变? (2) 根据四套装置的电极反应,分析电解一段时间后,四套装置溶液的 pH 如何变化?
惰性电极电解电解质溶液的产物判断
10-2 mol·L-1;
mol,m(Co)=59× g;在1 000 ℃时,固体质量不再变化,说明Co(OH)2完全
答案:向试管中加入2 mL NaOH溶液,然后向其中滴加CuSO4溶液4~6滴,产生Cu(OH)2蓝色絮状沉淀,取少量反应后的溶液,加入新制Cu(OH)2悬浊液中,加热煮沸,观察有无砖红
电极名称及电极反应式
电解过程
电子和离子的移动方向
惰性电极电解电解质溶液的产物判断
电解原理
电解池
电解过程
惰性电极电解电解质溶液的产物判断
作用。双氢键是指带正电的H原子与带负电的H原子之间的一种弱电性相互作用。 【解析】(1)基态Se原子的核外电子排布式为[Ar]3d104s24p4,则基态Se原子的价层电子排布式为4s24p4;(2) Cd的价电子排布式为4d105s2,5s轨道全充满,Cd的第一电离能大于同周 期相邻元素,原因是Cd的电子排布式为[Kr]4d105s2,原子轨道为全充满状态;(3) 从熔点看,CdS、CdSe、CdTe都形成离子晶体,晶格能与离子带电荷成正比,与离子半径的平方成反
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(1)根据两个电极反应式,写出总反应式。使两个电极反应式 得失电子数相等后,将两式相加,消去相同的化学式。 (2)根据总反应式写电极反应式一般分四个步骤:①列物质, 标得失;②选离子,配电荷;③配个数,巧用水;④两式加,验 总式。
针对训练 1.人类活动产生的 CO2 长期积累,威胁到生态环境,其减 排问题受到全世界关注。 (1)工业上常用高浓度的 K2CO3 溶液吸收 CO2,得溶液 X, 再利用电解法使 K2CO3 溶液再生,其装置示意图如下:
CuO 或 CuCO3 入 _________________ 复 原 , 而 Cu2 完 全放 电 之 后 , 应 加 入
+
Cu(OH)2 或 Cu2(OH)2CO3 复原。
(6)掌握惰性电极电解的四大类型及规律: ①电解水型:含氧酸、强碱、活泼金属的含氧酸盐 (如
NaOH、H2SO4、K2SO4 等)的电解。 ______________________
2- 2.一种熔融碳酸盐燃料电池,电池工作时,CO3 向电极正
极移动。(
)
3.由铜片、铝片和浓硝酸组成的电池,工作时正极的电极 反应式为:2H +NO3 +e ===NO2↑+H2O。(
+ - -
)
4.锂碘电池,该电池反应为:2Li(s)+I2(s)===2LiI(s)则碘电 极作该电池的负极。( )
- -
2- 正极:2O2+8e-+4CO2===4CO3
(4)掺杂 Y2O3 的 ZrO3 固体电解质, 在高温下能传导正极生成 的 O2-。 根据 O2 移向负极, 在负极上 CH4 失电子生成 CO2 气体, 而
-
O2 在正极上得电子生成 O2-,电极反应式为 负极:CH4-8e-+4O2-===CO2↑+2H2O 正极:2O2+8e ===4O2
热点二
电解池工作原理及应用
金属的腐蚀与防护
1.在固态金属氧化物电解池中,高温电解 H2O—CO2 混合 通电 气体制备 H2 和 CO, 总反应可表示为:H2O+CO2=====H2+CO +O2。( )
2.用铜电极电解饱和食盐水时,反应的离子方程式是 2Cl- 通电 +2H2O=====Cl2↑+H2↑+2OH-。( )
② 对 同解质溶液中>弱电解质溶液中>非电解质溶液中 ______________________________________________ 。
③活泼性不同的两种金属,活泼性差别越大,腐蚀越快。 ④对同一种电解质溶液来说,电解质溶液浓度越大,金属腐 蚀的速率越快。
- -
2.可充电电池 以铅蓄电池为基础: 研究它的负极材料 Pb, 正极材料 PbO2, 电解质 H2SO4;电池总反应 Pb + PbO2 + 2H2SO4===2PbSO4+ 2H2O;
2- 放电电极方程式:负极 Pb-2e-+SO4 ===PbSO4
正极 PbO2+2e +4H +SO2 4 ===PbSO4+2H2O
等)溶液的电解。 阴极:2Cu2++4e-===2Cu 阳极:4OH -4e ===O2↑+2H2O 电解 总 反 应 化 学 方 程 式 : 2CuSO4 + 2H2O =====
- -
2.金属的腐蚀与防护 (1)析氢腐蚀和吸氧腐蚀的比较: 类型 条件 正极反应 负极反应 析氢腐蚀 水膜呈酸性 2H +2e ===H2↑
阴极:4H +4e ===2H2↑ 阳极:4OH--4e-===O2↑+2H2O 电解 总反应化学方程式:2H2O=====2H2↑+O2↑ (阴) (阳)
+
-
(2)电解电解质型:无氧酸(除 HF 外)、不活泼金属的无氧酸
CuCl2 等)溶液的电解。 盐(氟化物除外)(如_______
阴极:Cu2++2e-===Cu 阳极:2Cl -2e ===Cl2↑ 电解 总反应化学方程式:CuCl2=====Cu+Cl2↑。 (阴) (阳)
- + - - 充电电极方程式:阴极 PbSO4+2e-===Pb+SO2 4
阳极 PbSO4-2e +2H2O===PbO2+4H +SO2 4
- +
-
在做可充电电池的问题时,要利用好总电池反应方程式的放 电过程,书写出正负极的电极方程式,利用放电和充电电极方程 式的关系,即可分析出充电的电极方程式。 二次电池解题技巧: 对于可充电电池,放电时为原电池,符合原电池工作原理, 负极发生氧化反应,正极发生还原反应;外电路中电子由负极流 向正极,内电路中阳离子向正极移动,阴离子向负极移动。 可充电电池充电时为电解池,阳极发生氧化反应,阴极发生 还原反应;充电时电池的“+”极与外接直流电源的正极相连, 电池的“-”极与外接直流电源的负极相连。
电解池中电极反应式的书写步骤:
针对训练 2.A、B、C 三种强电解质,它们在水中电离出的离子如下 表所示: 阳离子 阴离子 Na+、K+、Cu2+
2- SO4 、OH-
热点三
燃料电池和可充电电池
1.某模拟“人工树叶”电化学实验装置如图所示,该装置 能将 H2O 和 CO2 转化为 O2 和燃料(C3H8O)。下列说法正确的是 ( )
A.该装置将化学能转化为光能和电能 B.该装置工作时,H+从 b 极区向 a 极区迁移 C.每生成 1 mol O2,有 44 g CO2 被还原 D.a 电极的反应为:3CO2+16H -18e ===C3H8O+4H2O
+ -
2.(2015· 新课标全国Ⅰ)微生物电池是指在微生物的作用下 将化学能转化为电能的装置,其工作原理如图所示。下列有关微 生物电池的说法错误的是( )
3.以 CuSO4 溶液为电解质溶液进行粗铜(含 Al、Zn、Ag、 Pt、Au 等杂质)的电解精炼,溶液中的 Cu2+向阳极移动。( )
4.电解 NaCl 溶液得到 22.4 L H2(标准状况),理论上需要转 移 NA 个电子。(NA 阿伏加德罗常数)( )
5.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈。 ( )
经典例题 例 3 (2015· 江苏)一种熔融碳酸盐燃料电池原理示意图。下 )
A.正极反应中有 CO2 生成 B.微生物促进了反应中电子的转移 C.质子通过交换膜从负极区移向正极区 D.电池总反应为 C6H12O6+6O2===6CO2+6H2O
1.燃料电池 不同“介质”下燃料电池电极反应式的书写,大多数学生感 到较难。主要集中在:一是得失电子数目的判断,二是电极产物 的判断。 下面以 CH4、 O2 燃料电池为例, 分析电极反应式的书写。 (1)酸性介质,如 H2SO4。 CH4 在负极上失去电子生成 CO2 气体,O2 在正极上得到电 子,在 H+作用下生成 H2O。电极反应式为 负极:CH4-8e-+2H2O===CO2↑+8H+
- -
(3) 放氢生碱型:活泼金属的无氧酸盐 ( 氟化物除外 )( 如
NaCl、MgBr2 溶液的电解。 ______________)
阴极:2H++2e-===H2↑ 阳极:2Cl--2e-===Cl2↑ 电解 总反应化学方程式:2NaCl+2H2O=====
CuSO4、AgNO3 (4)放氧生酸型:不活泼金属的含氧酸盐 (如______________
正极:2O2+8e +8H ===4H2O (2)碱性介质,如 KOH 溶液。
2- CH4 在负极上失去电子, 在碱性条件下生成 CO3 , 1 mol CH4
-
+
失去 8 mol e ,O2 在正极上得到电子生成 OH ,电极反应式为
- 负极:CH4-8e-+10OH-===CO2 3 +7H2O
5.以 CO 和 O2 构成的碱性燃料电池的负极反应式为 CO+ 4OH -2e ===CO2 3 +2H2O。(
- - -
) )
6.多孔碳可用作氢氧燃料电池的电极材料。(
1.明确原电池构成的条件
2.原电池正负极判断方法 (1)根据构成原电池两极的电极材料判断,一般是较活泼的金
负极 ,活泼性较弱的金属或能导电的非金属为_____ 正极 ; 属为_____
【特别注意】 铁作阳极溶解生成 Fe2 ,而不是 Fe3 ;如果
+ +
是惰性电极,则需看溶液中阴离子的失电子能力,阴离子放电顺 序为:_______________________。
Ag >Hg2 >Fe3 >Cu2 >H >Pb2 >Fe2 >H (水)
+ + + + + + + +
S2->I->Br->Cl->OH-(水)
6.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e ===Fe3
- +
。(
)
1.电解原理 (1)判断电解池阴、阳极:与电源正极相连的为阳极,与电源 负极相连的为阴极;两极的反应为“阳失氧阴得还”。 (2)分析电解质溶液中离子种类及离子移向:阳离子移向阴 极,阴离子移向阳极。 (3)注意放电顺序及电极产物的判断: ①阳极产物的判断首先看电极,如果是活泼金属作阳极,则 电极材料失电子,电极溶解。
专题十
电化学原理及其应用
[考纲要求] 1.了解原电池和电解池的工作原理, 能写出电极 反应式和电池反应方程式。 2.了解常见化学电源的种类及其工作 原理。3.理解金属发生电化学腐蚀的原因、金属腐蚀的危害、防 止金属腐蚀的措施。
热点一
原电池工作原理及应用
1.微生物电池工作时,质子通过交换膜从负极区移向正极 区。( )
②阴极产物直接根据阳离子的放电顺序进行判断:
_______________________________________
(4)书写电极反应,注意得失电子守恒。 (5)电解后恢复原状态措施: 电解后有关电解质溶液恢复原态的问题应该用质量守恒法 分析。一般是加入阳极产物和阴极产物的化合物,但也有特殊情 况,如用惰性电极电解 CuSO4 溶液,Cu2+完全放电之前,可加
