第三节---化学平衡导学案(共5课时)
化学平衡教案(优秀4篇)

化学平衡教案(优秀4篇)化学平衡教案篇一班级:姓名:组别:主备人:裴拥爱编号:7神木中学“352”高效课堂高二年级化学导学案【课题】化学平衡中的图像问题【学习目标】1.深化外界条件对化学平衡产生的影响,会将其转化为对应图像2.通过探究掌握几类图像问题的分析方法【重点、难点】图像与平衡知识的结合【学习方法】自主探究讨论学习【方法归纳】处理图像问题的步骤:一看轴(纵、横坐标的意义),二看线(线的走向和变化趋势),三看点(起点、折点、交点、终点、零点的意义),四看要不要作辅助线(等温线、等压线、平衡线),五看量的变化(如浓度变化、温度变化等),六想规律(外界条件对反应速率的影响规律和化学平衡移动规律),七作判断,做出答案。
【合作探究案】探究一:浓度(物质的量)-时间图在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如右图,下列表述中正确的是()A.反应的化学方程式为:2 MNB.t2时,正逆反应速率相等,达到平衡C.t3时,正反应速率大于逆反应速率D、t1时,N的浓度是M浓度的2倍探究二:速率-时间图对达到平衡状态的可逆反应X+YZ+W,在其他条件不变的情况下,增大压强,反应速率变化图象如右图所示,则图象中关于X、Y、Z、W四种物质的聚集状态为()A.Z、W均为气体,X、Y中有一种是气体B.Z、W中有一种是气体,X、Y皆非气体C.X、Y、Z、W皆非气体D.X、Y均为气体,Z、W中有一种为气体探究三:含量-时间-温度(压强)图一可逆反应m A(s)+n B(g)e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:下列叙述正确的是()A.达平衡后,加入催化剂则C%增大B.达平衡后,若升温,平衡左移C.化学方程式中n>e+fD.达平衡后,增加A的`量有利于平衡向右移动探究四:含量-温度-压强图如图所示,反应:X(气)+3Y(气)2Z(气)(正反应为放热反应),在不同温度、不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为()【效果检测】1.T℃时,A气体与B气体反应生成C气体。
学案设计-第三节 化学平衡(配人教新课标)

第三节化学平衡一、学习目标(一)知识与技能1.理解化学平衡移动的涵义;2.理解温度、浓度、压强对化学平衡的影响;3.掌握用图像表示化学平衡移动的方法,并会判断化学平衡移动的方向。
(二)情感态度与价值观培养尊重科学、严谨求学、勤于思考的态度,树立透过现象看本质的认识观点。
二、学习重难点1.重点:温度、浓度、压强对化学平衡的影响。
2.难点:平衡移动的原理分析及应用。
三、学习过程(一)可逆反应与不可逆反应1.溶解平衡:向饱和氯化钠溶液中加入氯化钠晶体时,晶体不再减少,实际上氯化钠还继续溶解,只是和溶液中析出氯化钠晶体的速率相等,此时则建立了“溶解平衡”。
当达到溶解平衡时,“v溶解=v结晶”。
2.可逆反应的定义:在相同条件下,既可以正向进行,又可以逆向进行的反应,称为可逆反应。
(二)化学平衡状态1.化学平衡状态的建立以CO+H2O(g)CO2+H2反应为例。
在一定条件下,将0.01 mol CO和0.01 mol H2O(g)通入1 L密闭容器中。
(1)反应刚开始时反应物的浓度最大,正反应速率最大;生成物的浓度为0,逆反应速率最小(速率为0)。
(2)反应进行中反应物不断消耗,反应物的浓度不断降低,正反应速率不断减小;生成物不断增多,生成物的浓度不断增加,逆反应速率不断增大。
(3)一段时间以后正反应速率与逆反应速率大小相等。
此时,反应物和生成物的物质的量不再变化,浓度也不再变化,因此正、逆反应速率都不再变化。
反应物和生成物的量保持稳定。
此时该可逆反应达到平衡状态。
2.化学平衡状态(1)定义:在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态,称为化学平衡状态,简称化学平衡。
(2)化学平衡状态的特征①“动”,化学平衡是动态平衡,即处于化学平衡状态时,化学反应并没有停止,而是正、逆反应速率相等。
②“定”,由于达到化学平衡状态时的正、逆反应速率相等,所以,该状态下反应混合物中各组分的质量分数保持一定,不再改变。
2.3化学平衡常数 导学案

第三节 化学平衡(第2课时)导学案 ——化学平衡常数【使用说明】1、请同学们认真阅读课本28-30页,划出重要知识,独立、规范、认真完成导学案,并熟记基础知识。
2、结合课本知识独立思考,AB 层同学规范完成学案合作探究,用红色笔做好疑难标记,准备讨论。
【学习目标】1.了解化学平衡常数的涵义。
2.能利用化学平衡常数计算反应物的转化率。
3.掌握有关化学平衡计算题的一般方法(三段式)4.激情投入,全力以赴,体验学习乐趣【重、难点】化学平衡常数的表示方法和应用,掌握有关化学平衡计算题的一般方法(三段式)自主学习化学平衡常数:1、定义:2、表达式:例如:m A(g )+n B(g )p C(g )+q D(g ) K=3、使用化学平衡常数应注意的问题:(1)化学平衡常数只与_____________有关,与反应物或生成物的浓度无关。
(2)反应物或生成物中有固体和纯液体存在时,由于其浓度可看做常数“1”而不代入公式(3)化学平衡常数是指某一具体反应的平衡常数。
若反应方向改变,则平衡常数改变。
若方程式中各物质的系数等倍扩大或缩小,尽管是同一个反应,平衡常数也会改变。
自主检测【1】在某温度下,将H 2和I 2各0.10mol 的气态混合物充入10L 的密闭容器中,充分反应,达到平衡后,测得c(H 2)=0.008 0 mol/L 。
(1)求该反应的平衡常数。
(2)在上述温度下,该容器中若通入H 2和I 2蒸气各0.20 mol ,试求达到化学平衡状态时各物质的浓度。
合作探究课题:化学平衡常数的应用: 1、判断反应进行的程度:化学平衡常数值的大小是可逆反应进行程度的标志。
它能够表示出可逆反应进行的完全程度。
一个反应的K 值越大,说明平衡时生成物的浓度_____,反应物的浓度____,反应物转化率也越大。
可以说,化学平衡常数是一定温度下一个反应本身固有的内在性质的定量体现。
2、判断反应的热效应:若升高温度,K 值增大,则正反应为 反应 若升高温度,K 值减小,则正反应为 反应3、判断平衡移动方向:可以利用平衡常数的值做标准,判断正在进行的可逆反应是否平衡及不平衡时向何方进行建立平衡。
第三节第二、三课时影响平衡的因素导学案
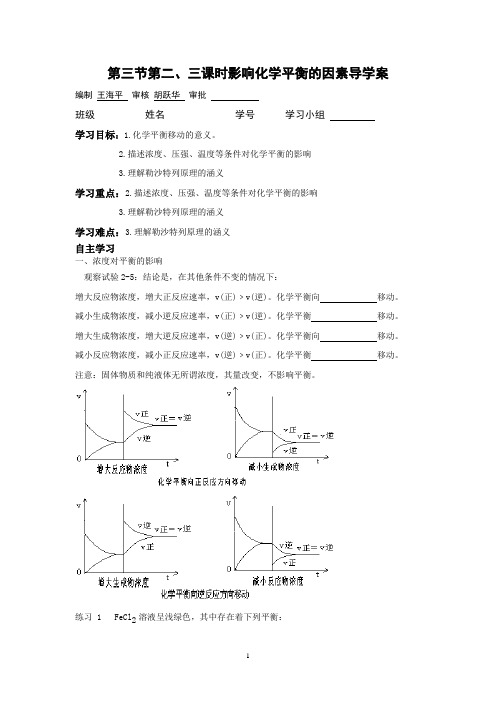
第三节第二、三课时影响化学平衡的因素导学案编制王海平审核胡跃华审批班级__________姓名______________学号______学习小组学习目标:1.化学平衡移动的意义。
2.描述浓度、压强、温度等条件对化学平衡的影响3.理解勒沙特列原理的涵义学习重点:2.描述浓度、压强、温度等条件对化学平衡的影响3.理解勒沙特列原理的涵义学习难点:3.理解勒沙特列原理的涵义自主学习一、浓度对平衡的影响观察试验2-5:结论是,在其他条件不变的情况下:增大反应物浓度,增大正反应速率,v(正)﹥v(逆)。
化学平衡向移动。
减小生成物浓度,减小逆反应速率,v(正)﹥v(逆)。
化学平衡移动。
增大生成物浓度,增大逆反应速率,v(逆)﹥v(正)。
化学平衡向移动。
减小反应物浓度,减小正反应速率,v(逆)﹥v(正)。
化学平衡移动。
注意:固体物质和纯液体无所谓浓度,其量改变,不影响平衡。
练习 1 FeCl2溶液呈浅绿色,其中存在着下列平衡:Fe2++2H2O Fe(OH)2+2H+往该溶液中滴加浓盐酸,发生的变化是()(A) 平衡向逆反应方向移动 (B) 平衡向正反应方向移动(C) 溶液由浅绿色变成黄色 (D) 溶液由浅绿色变为深绿色二、压强对平衡的影响压强对平衡的影响等同于浓度对平衡的影响,因为对有气体参加或生成的反应,增大容器的压强,相当于减小气体的体积即增大气体的浓度;减小容器的压强,相当于增大气体的体积即减小气体的浓度。
⑴对反应前后气体总体积发生变化的化学反应,在其他条件不变的情况下:增大压强,相当于增大反应物、生成物的浓度,正逆反应速率都增大,会使化学平衡向着气体的总物质的量减小的方向移动。
减小压强,相当于减小反应物、生成物的浓度,正逆反应速率都减小,会使化学平衡向着气体总物质的量增大的方向移动。
⑵对于有些可逆反应里,反应前后气态物质的总体积没有发生变化,如2HI(g)H2(g)+I2(g)在这种情况下,增大压强v(正) 、v(逆)同等程度增大,即v(正)=v(逆),减小压强v(正) 、v(逆)同等程度减小,v(正)=v(逆)。
2.3化学平衡(第3课时)导学案

高二化学第二章第3节化学平衡(第3课时)导学案【学习目标】理解浓度对化学平衡的影响,并能初步理解勒夏特列原理。
【使用说明与学法指导】阅读《选修4》教材P26~28,在书上划出知识要点和看不懂的地方;独立完成预习案和预习检测。
【课前预习案】1、化学平衡状态的五大特征是什么?你是如何理解“动态平衡”和“变”这两个特征的?2、其他条件不变,只改变平衡体系中某一条件,使得v正≠v逆,请你分析反应将向哪个方向进行?【预习检测】1、其他条件不变,只改变平衡体系中某一条件,使得v正>v逆,则反应向方向进行,即平衡向移动。
2、增大反应物浓度,正反应的速率,逆反应的速率,使得v正v逆,平衡向移动。
【课内探究案】1、实验2-5:操作1和操作2滴加的物质一个是酸、一个是碱,它们对于平衡中的哪些物质有影响,有什么影响影响的结果是什么从该实验你能归纳出使化学平衡发生移动的因素是什么2、浓度可以影响化学平衡,使平衡发生移动,你能否分析反应物浓度的改变和生成物浓度的改变对化学平衡的影响?3、该实验中除了改变H+的浓度以外,你觉得还能改变哪些物质的浓度使得平衡发生移动?若是反应:Fe + 2H+ == Fe2+ + H2↑,是否可以增大Fe的浓度使平衡向正反应方向移动?4、完成实验2-6,并在书上填写现象、结论。
5、平衡移动的后续问题:增大反应物浓度,正反应速率增大,逆反应速率不变,其结果是v正>v逆,平衡向正反应方向移动,然后正逆反应速率如何变化最终正逆反应的速率对比第一次平衡的速率大小如何6、请你归纳一下平衡移动的方向和浓度的改变之间是什么关系?浓度的变化V 正和V 逆的变化V 正和V 逆变化的相对大小 平衡移动的方向增大反应物浓度 减少反应物浓度 增大生成物浓度 减少生成物浓度结论:平衡移动的方向是朝着 的方向。
7、你能否用速率-时间图像(v —t 图)来表示上表中的结论。
例如:增大反应物浓度,平衡正向移动。
第三节 化学平衡第二、三课时 化学平衡的移动学案
第三节 化学平衡第二、三 化学平衡的移动学案 【学习目标】 1.掌握浓度、压强、温度和催化剂对化学平衡移动的影响。 2.能够画出相关的化学反应速率和平衡移动的图像。 3.理解勒夏特列原理的涵义。 4.理解等效平衡的涵义,并掌握有关计算的技巧。 【自主学习】
【实验探究一】:探究浓度变化对化学平衡的影响 实验原理:已知在K2Cr2O7的溶液中存在如下平衡: Cr2O72- + H2O 2CrO42- + 2H+
K2Cr2O7为橙色,K2CrO4为黄色。 实验步骤:①取两支试管各加入5ml0.1mol/L K2Cr2O7溶液,然后按下表步骤操作,观察并记录溶液颜色的变化。
实验结论: 【实验探究二】:探究浓度变化对化学平衡的影响 实验原理:Fe3+ +3SCN- Fe(SCN)3 (红色) 实验步骤:向盛有5 ml0.005mol/L FeCl3溶液的试管中加入5 ml0.01mol/L KSCN溶液,溶液显红色。 (1)将上述溶液均分置于两支试管中;向其中一支试管中加入饱和FeCl3溶液4滴,充分振荡,观察溶液颜色变化;向另一支试管滴加4滴1 mol/L KSCN溶液,观察溶液颜色变化。 (2)向上述两支试管中各滴加0.01mol/LNaOH溶液3~~5滴,观察现象,填写下表。
编号 1 2 步骤(1) 滴加饱和FeCl3溶液 滴加1 mol/L KSCN溶液 现象 步骤(2) 滴加NaOH溶液 滴加NaOH溶液 现象 结论
【思考与交流】 1、 上述两个实验中,化学平衡状态是否发生了改变?你是如何判断的?
步骤 滴加3~~10滴浓H2SO4 滴加10~~20滴6 mol/LNaOH K2Cr2O7溶液 2、从中你能否推知影响化学平衡状态的因素? 一、浓度变化对化学平衡的影响 1.在其他条件不变的情况下: 增大反应物的浓度或减小生成物的浓度,平衡向 方向移动; 减小反应物的浓度或增大生成物的浓度,平衡向________方向移动。 2.注意点: 【思考1】 (1)在硫酸工业中制取三氧化硫时,通过向反应体系中通入过量空气,其目的是什么?
第三节-化学平衡移动(1)导学案

第三节化学平衡一一平衡移动(第一课时)学习目标:1、理解浓度、压强、温度和催化剂对化学平衡影响的图像。
2、认识化学平衡图像,并利用图像规律解决化学平衡的问题重点、难点:利用图像规律解决化学平衡的问题【复习回顾】1、可逆反应:在同一条件下,既能向进行,同时又能向向进行的反应,叫做可逆反应。
2、化学平衡状态的定义:在一定条件下的可逆反应里,和相等,反应混合物中各组分的保持不变的状态,称为化学平衡状态,简称化学平衡。
3、平衡状态的特征(用五个字概括):4、影响化学反应速率的外界因素主要有:【学习过程】自主学习一一思考交流⑴化学平衡移动的根本原因是 ,化学平衡移动的标志是。
(2)化学平衡的移动方向的速率判断:①若外界条件变化引起v(正)>v(逆):平衡向移动;②若外界条件变化引起v(正)<v(逆):平衡向移动;③若外界条件变化引起v(正)=v(逆):旧平衡未被破坏,平衡。
1、影响化学平衡状态的因素有哪些?考点一浓度对化学平衡的影响观察[实验2—5]方程式:Cr2O72+H2O = 2 CrO42+2H +(橙色)(黄色)[实验2—6]方程式:FeCl3 + 3KSCN U Fe(SCN)3 + 3KCl(浅黄色)(无色)(血红色)(无色)填写课本上表格,并判断上述化学平衡发生了怎样的变化?1、规律:在其他条件不变的情况下,增大反应物浓度或减小生成物浓度,都可以使平衡向_________ 移动;增大生成物浓度或减小反应物浓度,都可以使平衡向移动2、用v-t图表示化学平衡的移动:①旧的化学平衡②增大反应物的浓度后新的化学平衡的移动3.探究浓度影响化学平衡的图像分析浓度变化对速率的影响,得出平衡移动的方向,并将空格填完整:浓度的变化增大反应物浓度减少反应物浓度增大生成物浓度减少生成物浓度速率变化:v(正)首先增大v (逆)随后增大且v'(正)>v'(逆)移动力向正反应方向思考2:可逆反应H2O(g) + C(s)•= CO(g) + H2(g)在一定条件下达到平衡状态,只改变下列条件,能否引起平衡移动?CO的浓度有何变化?①增大水蒸气浓度②加入更多的碳③增加H2浓度考点二温度对化学平衡的影响【实验2-7】NO2浸泡在冰水、热水中。
第三节-化学平衡移动(1)导学案

第三节-化学平衡移动(1)导学案-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN第三节化学平衡——平衡移动(第一课时)【学习目标】1、知识目标:正确理解浓度、温度对化学平衡的影响。
2、能力目标:通过实验探究温度、浓度对化学平衡的影响,培养学生利用实验探究、分析、解决问题能力。
3、情感目标:培养学生透过现象看本质的科学态度与科学素养。
【重点难点】浓度、温度对化学平衡的影响。
【复习回顾】1、可逆反应:在同一条件下,既能向进行,同时又能向向进行的反应,叫做可逆反应。
2、化学平衡状态的定义:在一定条件下的可逆反应里,和相等,反应混合物中各组分的保持不变的状态,称为化学平衡状态,简称化学平衡。
3、平衡状态的特征(用五个字概括):4、影响化学反应速率的外界因素主要有:【学习过程】自主学习——思考交流1、什么是化学平衡状态的移动?(1)定义:把可逆反应中的破坏、建立的过程叫做化学平衡的移动。
思考1:归纳平衡移动的根本原因平衡移动的标志(2)总结:化学平衡移动的根本原因是,化学平衡移动的标志是。
(3)化学平衡的移动方向的速率判断:①若外界条件变化引起v(正)>v(逆):平衡向移动;V 正V 逆 V 逆V 正 V ′正 V ′逆②若外界条件变化引起v (正)<v (逆):平衡向 移动;③若外界条件变化引起v (正)=v (逆):旧平衡未被破坏,平衡 。
2、影响化学平衡状态的因素有哪些?3、4、浓度如何影响化学平衡?(1)增大反应物浓度,平衡向 移动; (2)减小生成物浓度,平衡向 移动; (3)减小反应物浓度,平衡向 移动; (4)增大生成物浓度,平衡向 移动。
5、温度如何影响化学平衡?6、温度升高,会使化学平衡向着 反应的方向移动; 温度降低,会使化学平衡向着 反应的方向移动。
课堂探究考点一 浓度对化学平衡的影响观察[实验2—5] 方程式: Cr 2O 72-+H 2O2 CrO 42-+2H +(橙色) (黄色)[实验2—6] 方程式:FeCl 3 + 3KSCNFe(SCN)3 + 3KCl(浅黄色) (无色) (血红色)(无色)填写课本上表格,并判断上述化学平衡发生了怎样的变化?1、规律:在其他条件不变的情况下,增大反应物浓度或减小生成物浓度,都可以使平衡向 移动;增大生成物浓度或减小反应物浓度,都可以使平衡向 移动。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三节---化学平衡导学案(共5课时)第三节化学平衡导学案(第1课时)课标要求:1.了解可逆反应,掌握化学平衡的概念及其特点。
2.培养学生分析、归纳,语言表达能力。
阅读教材:P25-26知识要点:一、可逆反应与不可逆反应复习:什么叫可逆反应?可逆反应有哪些特点?讨论:可逆反应为什么有“度”的限制?“度”是怎样产生的?分析:在一定温度下,将一定质量的蔗糖溶于100mL 水的过程讨论:在一定条件下,达到溶解平衡后,蔗糖晶体的质量和溶液的浓度是否变化?溶解和结晶过程是否停止?二、化学平衡的建立过程在反应CO+H2O CO2+H2中,将0.01molCO和0.01mol H2O (g)通入1L密闭容器中,反应一段时间后,各物质浓度不变1、反应刚开始时:反应物浓度___________,正反应速率____________生成物浓度为_________,逆反应速率为__________2、反应过程中:反应物浓度___________,正反应速率___________生成物浓度____________,逆反应速率___________3、一定时间后,必然出现_________________________4、t1时刻后,v正=v逆即正反应消耗的量与逆反应生成的量相等,反应物和生物的浓度不再发生变化——化学平衡三、化学平衡1、概念:在外界条件不变的条件下,____________进行到一定的程度时__________________相等,化学反应进行到最大限度,反应物和生成物的______不再发生变化,反应混合物处于化学平衡状态,简称______________2、达到化学平衡的标志:正逆反应速率相等和反应混合物各组分浓度保持不变是判断平衡的两大主要标志⑴、直接标志:①、速率关系:正逆反应速率相等。
即V正=V逆以反应mA(g)+nB (g)pC(g)为例达到平衡的标志为: A 的消耗速率与A 的生成速率;A 的消耗速率与C 的—————;B 的生成速率与C 的——————速率之比等于—————;A 的生成速率与B 的——————速率之比等于—————。
例1、一定条件下,反应A 2(g)+B 2(g) 2AB(g)达到平衡的标志是A 、单位时间内生成n mol A 2同时生成n molAB B 、单位时间内生成2n mol AB 同时生成n mol B 2 C 、单位时间内生成n mol A 2 同时生成n mol B 2 D 、单位时间内生成n mol A 2 同时消耗n mol B 2注意:在判断化学平衡时,要注意化学键数与反应物质的物质的量之间的联系,同时要注意成键、断键与反应方向之间的关系。
例2、一定条件下,反应N 2+3H 2 2NH 3达到平衡的标志是A 、一个N ≡N 键断裂的同时,有三个H -H 键形成B 、一个N ≡N 键断裂的同时,有三个H -H 键断裂C 、一个N ≡N 键断裂的同时,有六个N -H 键断裂D、一个N≡N键断裂的同时,有六个N-H键形成②、含量关系:反应混合物各组分的浓度、质量分数、物质的量、体积分数、分子数之比保持不变⑵、间接标志:以反应mA(g)+nB (g) pC(g)为例①、混合气体的总压强、总体积、总物质的量、平均相对分子质量不随时间改变而________,(适用于____________________________)②、混合气体的密度不随时间改变而________,(适用于_____________________________________)⑶、特殊标志:①、对于有色物质参加反应,如果体系颜色不变,反应达到平衡②、对于吸热或放热反应,如果体系温度不变,反应达到平衡例3、在一定温度下,向aL密闭容器中加入1molX气体和2molY气体发生如下反应:X(g)+2Y(g) 2Z(g),此反应达到平衡的标志是A、容器内压强不随时间变化B、容器内各物质的浓度不随时间变化C、容器内X、Y、Z的浓度之比为1:2:2D、单位时间消耗0.1molX的同时生成0.2molZ第三节化学平衡导学案(第1课时)【随堂检测】班级姓名座号1、在一定温度下,可逆反应A(气)+3B(气) 2C(气)达到平衡的标志是()A.C的生成速率与C分解的速率相等B.单位时间内生成nmolA,同时生3nmolBC.A、B、C的浓度不再变化D.A、B、C的分子数比为1:3:22、下列说法中可以充分说明反应:P(气)+Q(气) R(气)+S(气) , 在恒温下已达平衡状态的是()A. 反应容器内压强不随时间变化B.P和S 的生成速率相等C.反应容器内P、Q、R、S四者共存D.反应容器内总物质的量不随时间而变化3、在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应:A(固)+3B(气) 2C(气)+D(气)已达平衡状态的是( )A.混合气体的压强B.混合气体的密度C.B的物质的量浓度 D.气体的总物质的量4、在一定温度下,下列叙述不是可逆反应A(气)+3B(气) 2C(气)+2D(固)达到平衡的标志的是( )①C的生成速率与C的分解速率相等②单位时间内生成amolA,同时生成3amolB③A、B、C的浓度不再变化④A、B、C的分压强不再变化⑤混合气体的总压强不再变化⑥混合气体的物质的量不再变化⑦单位时间内消耗amolA,同时生成3amolB ⑧A、B、C、D的分子数之比为1:3:2:2A.②⑧B.②⑤⑧C.①③④⑦ D.②⑤⑥⑧5、可逆反应H2(g) + I2(g) 2HI(g),在一定条件下达到平衡的标志是()A、在1molH-H键断裂,同时有2molH-I键生成。
B、容器内各组分物质的量的分数保持不变。
C、容器内颜色的深度保持不变。
D、容器内的总压强保持不变。
第三节化学平衡导学案(第2课时)课标要求:1.了解浓度、压强、温度等外界条件对化学平衡移动的影响。
2.掌握用化学平衡的移动原理来定性定量地分析化学平衡问题。
3.了解平衡移动原理的重要意义,学会解决问题的科学方法。
阅读教材:P26-28知识要点:一、化学平衡的移动化学平衡的研究对象是___________,化学平衡是有条件限制的___________平衡,只有在______________时才能保持平衡,当外界条件(浓度、温度、压强)改变时,化学平衡会被______________,反应混合物里各组分的含量不断___________,由于条件变化对正逆反应速率的影响不同,致使v正__________v逆,然后在新条件下建立___________1、化学平衡移动的定义:化学上把这种可逆反应中旧化学平衡的破坏、新化学平衡建立的过程叫做化学平衡的移动2、化学平衡移动的性质:⑴、若外界条件变化引起v正>v逆:平衡向______方向移动⑵、若外界条件变化引起v正<v逆:平衡向______方向移动⑶、若外界条件变化引起v正=v逆:旧平衡未被破坏,平衡_________巧记:化学平衡总往反应速率______的方向移动二、影响化学平衡的条件1、浓度对化学平衡的影响结论:当其他条件不变时,增大反应物浓度或减小生成物浓度,化学平衡向____反应方向移动;增大生成物浓度或减小反应物浓度,化学平衡向_____反应方向移动。
2、压强对化学平衡的影响规律:增大压强,化学平衡向____________________________________移动;减小压强,化学平衡向____________________________________移动;体积相等的气体反应,压强改变,化学平衡____________________。
3、温度对化学平衡的影响实验现象:温度升高,混合气体颜色加深,____________,平衡向_____________ 方向移动;温度降低,混合气体颜色变浅,___________,平衡向____________ 方向移动结论:升高温度化学平衡向_______________________移动,降低温度化学平衡向________________________移动,4、化学平衡移动原理——勒夏特列原理原理:如果改变影响平衡的一个条件(浓度、温度、压强等),化学平衡就向_______这种改变的方向移动例:反应N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)达到化学平衡,改变下列条件,根据反应体系中的变化填空:①若N2的平衡浓度为a mol/L,其他条件不变时,充入N2使其浓度增大到b mol/L后平衡向______________方向移动,达到新平衡后,N2的浓度为c mol/L,则a、b、c的大小为_________________;②②若平衡体系的压强为P1,之后缩小反应体系体积使压强增大到P2,此时平衡向_____________方向移动,达到新平衡后体系的压强为P3,则P1、P2、P3的大小为_________________;③③若平衡体系的温度为T1,之后将温度升高到T2,此时平衡向__________________方向移动,达到新平衡后体系的温度为T3,则T1、T2、T3的大小为____________________。
5、催化剂对化学平衡的影响催化剂不能使化学平衡发生移动;不能改变反应混合物含量;但可以改变达到平衡的时间第三节化学平衡导学案(第2课时)【随堂检测】班级姓名座号1.在可逆反应2A(气) + B(气)2C(气) + Q中,为了有利于A的利用,应采用的反应条件是()A.高温、高压B.高温、低压C.低温、低压D.适当温度、高压2.在一定条件下,合成氨反应到达平称衡状态,此时,再进行如下操作,平衡不发生移动的是()A.恒温、恒压时,充入NH3B.恒温、恒容时,充入N2C.恒温、恒压时,充入HeD.恒温、恒容时,充入He3. 已知反应A2(g)+2B2(g2(g)△H <0,下列说法正确的A.升高温度,正向反应速率增加,逆向反应速率减小B.升高温度有利于反应速率增加,从而缩短达到平衡的时间C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动4. 恒温下, 反应aX(g) bY(g) +cZ(g)达到平衡后, 把容器体积压缩到原来的一半且达到新平衡时,X的物质的量浓度由0.1mol/L增大到0.19mol/L, 下列判断正确的是: ( )A. a>b+cB. a<b+cC. a=b+cD. a=b=c5.已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是①生成物的百分含量一定增加②生成物的产量一定增加③反应物的转化率一定增大④反应物浓度一定降低⑤正反应速率一定大于逆反应速率⑥使用了合适的催化剂A ①②(B) ②⑤(C) ③⑤(D) ④⑥第三节化学平衡导学案(第3课时)课标要求:1.了解化学平衡常数的涵义。
