2-2化学能与电能
《化学能与电能》说课稿

《化学能与电能》说课稿《化学能与电能》说课稿一、说教材本节教材是人教版化学必修2其次章其次节的教学内容,是电化学中的重要学问。
初中化学已经从燃料的角度初步学习了"化学与能源'的一些学问,在选修模块"化学反应原理'中,将从科学概念的层面和定量的角度比较系统深化地学习化学反应与能量。
该节内容既是对初中化学相关学问的提升与拓展,又为选修"化学反应原理'奠定须要的基础。
从能量转换角度看,本节课程内容是对前一节课中"一种能量转化为另一种能量,能量也是守恒的;化学能是能量的一种形式,它同样可以转化为其他形式的能量,如热能和电能等'论述的补充和完美。
从反应物之间电子转移角度看,原电池概念的形成是氧化还原反应本质的拓展和应用;二、说学情同学已经学习了金属的性质、电解质溶液及氧化还原反应等有关学问;在能力上,同学已经初步具备了观看能力、试验能力、思维能力。
同学在生活中对电池也有所了解。
同学喜爱?通过试验探索化学反应的实质,由试验现象推想反应原理,同学对本节课会有所期盼。
生活在现代社会,同学对"电'有着丰盛而又强烈的感性认识。
当同学了解了化学反应中能量转化的缘由,并感触了探索化学能与热能的互相转化过程之后,会对化学能与电能之间的转化问题产生深厚的爱好。
三、说教学目标(1)学问与技能①清晰地认识原电池的工作原理和构成条件,初步形成原电池概念。
②能够写出电极反应式和电池反应方程式。
(2)过程与办法①同学通过对化学能转化为电能的学习,体验科学探索的过程,理解科学探索的意义,基本过程和办法,初步养成科学探索的能力。
②能对自己探索原电池概念及形成条件的学习过程举行方案、反思、评价和调控,提高自主学习化学的能力。
(3)情感看法与价值观①通过探索化学能转化为电能的神秘,提高学习化学的爱好和热烈,体验科学探索的艰辛与喜悦,感触化学世界的奇异与和睦。
化学能与电能知识点

化学能与电能知识点化学能与电能之间的转化是整个高中化学的重要知识。
下面是店铺为你整理的化学能与电能知识点,一起来看看吧。
化学能与电能知识点1.能源:一次能源,直接从自然界获取的能源,如风能、水能、煤、石油、天然气等;二次能源:一次能源经过加工或转化形成的能源,如电能等。
化学物质都具有化学能,化学反应中的自发氧化还原反应,一般都是放出能量的反应,放出的能量可以转化为热能、光能甚至电能等,但总的能量守恒。
2. 火力发电:煤燃烧,加热水蒸气,驱动发电机发电,化学能----热能------机械能----电能。
缺点是每个过程有能量损耗高,环境污染。
3. 原电池:将化学能直接转化为电能的装置。
(注:放热反应通过反应释放出能量,部分转化为电能,部分转化为热能损耗等,所以原电池不能达到能量的100%转化利用)4. 原电池的形成条件:(1)自发的氧化还原反应(放热反应)----关键和核心(2)两个电极(金属或石墨C):通常为活泼性不同的两极,在燃料电池中等例外是相同的惰性金属(Pt Ag等)------功能:可能参与反应(主要是金属电极失去电子),“强迫”负极失去的电子沿外电路导线传导到正极。
(3)电解质溶液(一般是酸碱盐的水溶液,也可以是盐的熔融状态)。
功能:导电介质(阴阳离子的移动导电)、提供反应物质。
(4)闭合回路:电解质溶液的内电路和导线的外电路闭合连接(“两极一液一连线”)。
5. 原电池的工作原理:几个基本物理知识:(1)电流方向:外电路由“+”到“—”,内电路由“—”到“+”;(2)电子在导体(金属或C)中传导,方向与电流方向相反;电子传导方向:外电路由“—”到“+”,(3)电解质溶液中依靠阴阳离子的移动导电,阳离子的移动方向和溶液中的电流方向一致,阴离子与溶液中的电流方向相反。
6. 原电池的正负极电极方程式书写电极方程式:表示电极上发生的物质和电子的变化的方程式书写基本过程:(1)根据已知条件,判断出正负极,(2)根据总的氧化还原反应或者电极,确定反应物以及对应的正确的产物(产物注意是否与电解质溶液中离子发生反应即不能共存),确保电子的得失和化合价的升降相等。
高中化学第二节化学能与电能课件新人教必修2.ppt
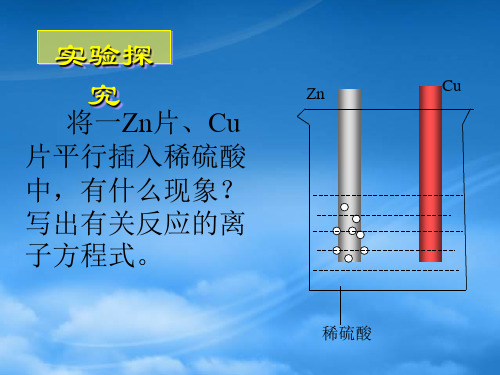
究
Zn
Cu
将一Zn片、Cu
片平行插入稀硫酸
中,有什么现象?
写出有关反应的离 子方程式。
稀硫酸
实验探 究
将Zn片、Cu片 上端连接插入稀硫 酸中,有什么现象? 为什么?
稀硫酸
实验探
Zn
Cu
究
稀硫酸
Zn
Cu 现象
(1)电流表指针有偏转
(2)铜片上有气泡产生
(3)锌片不断溶解
稀硫酸
Zn
ee-
Zn
Cu
(E) 酒精
(F) 稀硫酸Zn源自Cu(G)稀硫酸
稀硫酸
4、构成条件: (1)活泼性不同的两种金属
(或金属与非金属导体)做电极 (2)形成闭合回路
(3) 电解质溶液
(4) 自发的氧化还原反应
练习1:下列烧杯中盛放的都是稀硫酸, 在铜电极上能产生气泡的是哪个?写出 电极反应及总反应。
练习2:利用Fe + Cu2+=Fe2++Cu设计一个 原电池,画出示意图,写出电极反应。
探究
Cu
e-
稀硫酸
e-
H+
SO42-
H+ SO42-
H+
H+
Zn
Cu
ee-
H+ Zn2+
H+
稀硫酸
-
Zn ee-
Zn2+
+ Cu-Zn原电池:
Cu 负极:(氧化反应)
锌片:Zn-2e-=Zn2+
正极:(还原反应)
铜片:2H++2e-=H2↑
H+
总反应:
H+
人教版高中化学必修2第二章 化学反应与能量第二节 化学能与电能导学案(3)

第二章第二节化学能与电能(第2课时)【学习目标】 1. 了解生活中常用的化学电池和新型化学电池;2. 引导学生从电子转移角度理解化学能向电能转化的本质以及这种转化的综合利用价值。
【重、难点】从电子转移角度理解化学能向电能转化的本质。
【预习案】【导学流程】(一)基础过关1.锌锰干电池(一次性电池)(1)普通锌锰电池负极材料是:正极材料是:电解质是(2)碱性锌锰干电池负极材料是:正极材料是:电解质是改进后碱性锌锰电池的优点:2.充电电池(二次性电池) (1)铅蓄电池负极材料是:正极材料是:电解质是优点:缺点:(2)镉镍电池负极材料是:正极材料是:电解质是优点:缺点:3.氢-氧燃料电池电极材料,负极通入正极通入(三)我的疑问【探究案】一、对议【探究一】1.锌锰干电池的电极反应式的书写负极:正极:总反应:2.铅蓄电池的工作原理及电极反应式放电时:负极:正极:总反应:二、组议1.氢氧燃料电池的工作原理电极反应式(1)电解质为H2SO4溶液时:负极:正极:总反应:(2)电解质为KOH性溶液时:负极:正极:总反应:2.甲烷燃料电池在碱性电解质溶液中的电极反应式总反应:正极:负极:三.标注仍未解决的疑问,等待展示和点评环节。
【训 练 案】1.下列电池中不属于二次电池的是( )A.碱性锌锰电池B.铅蓄电池C.镍镉电池D.锂离子电池2.随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是( )A.利用电池外壳的金属材料B.防止电池中汞.镉和铅等重金属离子对土壤和水源的污染C.不使电池中渗泄的电解液腐蚀其他物品D.回收其中石墨电极3.已知空气-锌电池的电极反应为:锌片:Zn+2OH --2e -=ZnO+H 2O 石墨:O 2+2H 2O+4e -=4OH- 根据此判断,锌片是( )。
A.负极,并被氧化B.负极,并被还原C.正极,并被氧化D.正极,并被还原4.银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为2Ag+Zn(OH)2 Ag 2O+Zn+H 2O ,在此电池放电时,负极上发生反应的物质是( ) A.Ag B.Zn(OH)2 C.Ag 2O D.Zn5.日常所用干电池其电极分别为碳棒和锌皮,以糊状NH 4Cl 和ZnCl 2作电解质(其中加入 MnO 2氧化吸收H 2),电极反应可简化为:Zn -2e=Zn 2+;2NH 4++2e =2 NH 3+H 2(NH 3再用于结合Zn 2+。
教育部参赛_必修2第二章第二节《化学能与电能》_杜海彦

教材分析
本节内容是电化学中的重要知识。由于学生之前没有电化学的基础,理解原电池原理有一定的 难度。第一课时的主要内容有:原电池的概念、原理、组成原电池的条件。本节教材设置了大量的 探究教学素材,富有深刻的探究教学思想内涵。首先,新课引入的一个演示实验 2-4 为探究教学创 设了问题情景,当学生观察到 “铜片上产生气泡”这一反常的实验现象,就会情不自禁地提出一 系列问题,产生强烈的探索欲望,并提出各种各样的假设;紧接着,教材又设置了一个讨论题学与 问,让学生自己归纳“组成原电池的正负极” 。当学生理解原电池的原理后,又是科学探究实验为 学生提供“实证性”材料,学生根据实验现象,经过严密的逻辑推理,得出相关结论;同时,课本 后面的“实践活动——水果电池” ,习题中的 4 小题都是本课时探究教学内容的应用和延伸。
学情分析
学生初次接触电化学知识,对原电池的工作原理有神秘感和探索欲望。要充分利用学生的好奇 心和求知欲, 设计层层实验和问题情境, 使学生在自主实验、 积极思考和相互讨论中自己发现问题、 分析问题和解决问题。
教学目标
1.知识目标:理解原电池原理,掌握构成原电池的条件,会进行简单的原电池设计。 2.情感目标: 培养学生的探究精神和依据实验事实得出结论的科学态度, 培养学生的团队协作精神。 3.能力目标:培养学生观察能力、实验能力、实验设计能力、语言表达能力。培养学生正向思维、 逆向思维、发散思维能力。
明锌片上的电子是否通过导线转移到了铜片上? 【学生回答】在铜片和锌片中间连接一个灵敏电流计,检测有无电流 【实验指导】使用灵敏电流计的注意事项 【学生活动】实验并观察现象 【学生回答】现象:电流计指针偏转 结论:有电流流过,说明导线中有电子流过, 说明氢离子得到的电子确实是锌片失去,通过 导线传递到铜片上的。 (但是,对于刚才同学提出的问题,即“既然电子是锌片失去的,氢离子为什么不直接在锌片 上得电子,而要到铜片上得电子呢?”还是觉得难以解释。 ) 【动画演示】由于锌片失去电子后产生锌离子,锌片的周围有许多来不及扩散到溶液中去的锌 离子,对氢离子有排斥作用,使氢离子很难在锌片上直接得到电子 【学生小结】 2+ 锌片:较活泼,电子流出,发生氧化反应 Zn-2e =Zn + 铜片:较不活泼,电子流入,发生还原反应 2H +2e =H2↑ 能量变化:化学能转变为电能 【板书】1.原电池的概念: 【实验指导】给你一节干电池,用实验证明铜锌原电池的正负极 【学生活动】实验并观察现象 【学生回答】现象:测干电池时,电流计指针偏向正极方向,测铜锌原电池时,电流计指针偏 向铜片方向 结论:锌片为负极,铜片为正极 【板书】2.原电池的原理: 2+ 负极:电子流出,较活泼, (锌片) :Zn-2e =Zn (氧化反应) + 正极:电子流入,较不活泼, (铜片) :2H +2e =H2↑(还原反应) 【引导】写出铜锌原电池的总反应方程式,并比较其与锌片直接跟稀硫酸反应有何异同。 + 2+ 总反应方程式为:Zn+2H =Zn +H2 ↑ 相同点:总反应方程式相同 不同点:电子转移途径不同 【过渡】原电池的实质是氧化还原反应,氧化还原反应都可以设计成原电池,那么构成原电池 要有哪些条件呢? 【板书】3.组成原电池的条件 【实验习题】请用实验验证下列哪些装置构成原电池?并据此对比分析,讨论构成原电池的条 件。 【学生活动】实验并观察现象。 【学生回答】C、D、H 构成原电池 【学生讨论】 (通过对比分析、讨论和补充、修改,最后得出组成原电池的条件) 学生甲:从 A、B 不构成原电池可知,构成原电池必须有两种活动性不同的金属作电极。从 F、 G 不构成原电池可知,要组成原电池还必须构成闭合回路 学生乙:H 也构成原电池,是因为水果呈酸性,说明构成原电池需酸溶液。 学生丙:D 也能构成原电池,说明构成原电池不一定要酸溶液,也可以是盐溶液,结合 E 可知, 构成原电池电极材料必须与电解质溶液接触。 学生丁:从 C 可知,电极材料也可以是象石墨这样能导电的非金属。 【学生小结】组成原电池的条件:
人教版高中化学必修2第二章 化学反应与能量第二节 化学能与电能教案

第二章化学反应与能量第二节化学能与电能教材分析:化学能与电能,是化学学科的理论性知识之一,以氧化还原反应原理为依托是对其本质的拓展和应用。
因为学生在初中化学初步学习了“化学与能源”,在选修模块4将系统深入地学习化学反应与能量,本节为选修模块的学习奠定了基础。
本节涉及到以下知识:氧化还原反应;能量的转换;原电池原理的应用;电解质溶液、金属的活泼性;物理学科的电学知识。
通过本节课的学习,学生从实践到理论,以及从理论到实践的认知规律将会有很大的提高。
而且原电池在实际生活、工农业生产、科学研究中应用十分广泛,因此学好本节知识,具有重要的理论意义和现实意义。
学情分析:学生在初中的学习过程中已了解金属活动性,在必修一的学习中了解了氧化还原反应,通过对物理学科电学的学习也有一定的电学知识。
因此,已经具备学习本课的的理论基础。
新课程背景下要求学生自主探索,主动求知,学会收集、分析和利用各种信息及信息资源,并以此发展学生的实践能力、创新精神,合作与分享意识、社会交往能力和社会责任感。
因此,在设计《化学能与电能》这节课时,我采用学案导学、分组实验和小组讨论的形式让学生自主探索问题,分析问题,解决问题,强化学生的探究意识;以实验现象激发学生的探究兴趣,引发学生通过对实验现象的观察,实验原理的分析,真正理解了原电池的本质(氧化还原反应),分析归纳构成原电池的条件。
这样,学生不仅掌握了化学知识和规律,而且获得了探求知识的途径与方法。
教学目标:知识与技能:1、了解原电池原理,能写出电极反应和电池反应方程式。
2、初步了解原电池的装置。
过程与方法:通过对化学能转化为电能的学习,体验科学探究的过程,理解科学探究的意义、基本过程和方法。
情感态度与价值观:关注化学科学对个人生活和社会发展的贡献,关注能源问题,逐步形成正确的能源观。
教学重点:认识原电池的工作原理;形成原电池的概念教学难点:用已经学过的有关知识探究化学能转化为电能的条件和装置教学方法:实验探究法、小组讨论仪器用品:仪器:电流表、导线、小烧杯。
化学必修2第二章第二节化学能与电能
镍-镉碱性蓄电池 P38
新一代可充电的绿色 电池——锂离子电池 特点:高能电池,电 压高,质量轻,贮存 时间长等。 用途:电脑、手表、 心脏起搏器等。
氢氧燃料 电池
新型燃料电池
燃料电池不是把还原剂、 氧化剂物质全部贮藏在电 池内,而是在工作时,不 断从外界输入,同时将电 极反应产物不断排出电池
二、发展中的化学电 源
普通锌锰电池 碱性电池
镍 镉 电 池 小型高性能燃料电池 锂离子电池 镍氢电池
上图是锌-锰干电池
干电池
2、充电电池
铅蓄电池结构 充电电池又称二次电池,它在放 电时所进行的氧化还原反应,在 充电时又逆向进行,使生成物恢 复原状,如此充放电可循环进行, 至一定周期后终止。 汽车用蓄电池 (1)铅蓄电池
锂电池 干电池 叠层电池 纽扣电池 各类电池
减少污染
节约资源
感谢观赏
点击添加副标题
谢谢大家 祝同学们学习愉快!
202X
第二章化学反 应与能量
第二节 化学能与电能
授课教师:
一、化学能转化为电能
2001年我国发电量构成 图
火力发电厂能量转化:
化学能→热能→机械能→电能。
能否将化学能直接转化 为电能呢?
【实验2-4】
请将实验现象记录在课 本P38表中: Cu片有气泡产生 锌片溶解 电流表指针偏转 结论: 有电流产生
铜片
锌片
电流 表
现象
1、将化学能转变为 电能的装置叫原电池 原电池的电极 正极:发生氧化反应 负极:发生还原反应
2.Zn-Cu-H2SO4原电池的工作原理:
电极反应式:
Zn片: Zn -2e- = Zn2+ (氧化反应) Cu片:2H++2e- = H2 ↑ (还原反应)
人教版高中化学必修2第二章 化学反应与能量第二节 化学能与电能课件(共47张PPT)
2.比较金属的活动性强弱 (1)原理:原电池中,一般活动性强的金属为负极,活动性 弱的金属为正极。 (2)应用:有两种金属 A 和 B,用导线连接后插入到稀硫酸 中,观察到 A 极溶解,B 极上有气泡产生,由原电池原理可知, 金属活动性 A>B。 3.设计原电池 (1)依据:已知一个氧化还原反应,首先分析找出氧化剂、 还原剂,一般还原剂为负极材料(或在负极上被氧化),氧化剂 (电解质溶液中的阳离子)在正极上被还原。
燃烧
蒸汽
发电机
提示 化学能――→热能――→机械能―――→电能。
探究 2 原电池工作原理的实验探究源自序号装置现象
结论
①对 比实 验
无明显变化
铜片与稀硫酸 不反应
锌片与稀硫酸 锌片_溶_解___,产生_气__泡__ 发生化学反应
②目 标实 验
锌片:_溶_解___
该装置将化学
铜片:产生_气_泡___
能转化为电能,
1.一种形式的能量可以转化成另一种形式的能量,能量
转化的过程中要遵循什么自然定律? 提示 能量守恒定律。 2.氧化还原反应的本质是什么?写出锌和稀硫酸反应的
化学方程式,并用双线桥法标出电子转移的方向和数目。 提示 氧化还原反应的本质是得失电子。
知识一 化学能转化为电能
[自主探究]
探究 1 燃煤发电时,能量是如何转化的?
3.原电池的构成条件
活动性不同的两金属或一种是非金属 导体作电极 原电池电解质溶液 能自发地进行氧化还原反应 形成闭合回路
即:两极一液一连环,负极氧化正极还
4.电极名称及电极反应 记忆口决:铜锌硫酸一线牵,负锌氧化正铜还。
5.原电池正负极的判断
[应用训练] 1.判断正误(正确的打“√”,错误的打“×”)。 (1)原电池是一种电能转化为化学能的装置。( ) (2)负极失去电子发生氧化反应。( ) (3)正极是电子流出极。( ) (4)用导线连接的铜片和锌片插入到稀 H2SO4 中,锌片上有 大量气泡产生。( ) 答案 (1)× (2)√ (3)× (4)×
高一化学必修2 化学能与电能
高一化学必修2 化学能与电能在我们的日常生活中,电无处不在,它为我们的各种设备提供动力,让我们的生活变得便捷和丰富多彩。
但你有没有想过,电是从哪里来的呢?其实,化学能就是电能的一个重要来源。
今天,咱们就一起来深入探讨一下高一化学必修 2 中的“化学能与电能”这个重要的课题。
首先,咱们得明白什么是化学能。
简单来说,化学能就是物质发生化学反应时所释放或吸收的能量。
比如,当我们燃烧煤炭或者石油时,燃料中的化学物质与氧气发生反应,释放出大量的热能,这就是化学能的一种表现形式。
那化学能又是怎么转化为电能的呢?这就不得不提到电池了。
电池是一种将化学能直接转化为电能的装置。
以最常见的干电池为例,它里面有锌筒、碳棒和糊状的电解质。
锌筒作为负极,碳棒作为正极。
在电池工作时,锌与电解质发生氧化反应,失去电子,电子通过外电路流向碳棒,在碳棒上发生还原反应,从而形成电流,为我们的电器提供电能。
除了干电池,还有一种常见的电池——蓄电池。
蓄电池可以反复充电和放电。
在充电时,电能转化为化学能储存起来;放电时,化学能又转化为电能。
汽车里使用的铅蓄电池就是一个典型的例子。
接下来,咱们再聊聊原电池。
原电池是利用氧化还原反应将化学能转化为电能的装置。
它有两个电极,一个是发生氧化反应的负极,一个是发生还原反应的正极。
在原电池中,电子从负极流出,经过外电路流向正极,从而形成电流。
为了更好地理解原电池的工作原理,咱们来举个例子。
比如铜锌原电池,把锌片和铜片插入稀硫酸溶液中,用导线连接起来,就构成了一个简单的原电池。
在这个原电池中,锌片会逐渐溶解,因为锌失去电子发生氧化反应,产生锌离子进入溶液;而铜片上会有气泡产生,这是因为氢离子在铜片上得到电子发生还原反应,生成氢气。
电子从锌片通过导线流向铜片,从而形成电流。
了解了原电池的工作原理,咱们再看看原电池的构成条件。
首先,要有两种活泼性不同的电极;其次,要有电解质溶液;再者,要形成闭合回路;最后,还得有能自发进行的氧化还原反应。
化学能与电能教案
化学能与电能教案一、教学目标1. 让学生了解化学能和电能的概念及其相互转化原理。
2. 掌握电池的工作原理和常见电池的种类。
3. 能够分析生活中化学能与电能转化的实例,提高环保意识。
二、教学内容1. 化学能与电能的概念及相互转化原理。
2. 电池的工作原理及常见电池的种类。
3. 生活中的化学能与电能转化实例分析。
三、教学重点与难点1. 教学重点:化学能与电能的概念、相互转化原理,电池的工作原理及常见电池的种类。
2. 教学难点:化学能与电能转化的具体实例分析。
四、教学方法1. 采用讲授法讲解化学能与电能的概念、相互转化原理,电池的工作原理及常见电池的种类。
2. 采用案例分析法分析生活中的化学能与电能转化实例。
3. 利用互动讨论法引导学生参与课堂,提问、解答疑问。
五、教学过程1. 引入新课:通过展示手机充电过程的图片,引导学生思考化学能与电能之间的关系。
2. 讲解化学能与电能的概念、相互转化原理。
3. 讲解电池的工作原理及常见电池的种类。
4. 分析生活中的化学能与电能转化实例,如电池使用、电动车充电等。
5. 总结本节课的主要内容,布置课后作业。
6. 课堂互动:提问、解答疑问,巩固所学知识。
六、教学评价2. 课堂表现:观察学生在课堂上的参与程度、提问回答等情况,了解学生的学习状态。
3. 知识掌握:通过课后习题和课堂测试,检验学生对化学能与电能概念、电池种类等知识的掌握。
七、教学资源1. 教材:《化学能与电能》教材,提供基本的教学内容。
2. 课件:制作课件,辅助讲解化学能与电能的概念、电池工作原理等。
3. 视频资料:收集有关化学能与电能转化的实验或实例视频,增强学生直观感受。
4. 网络资源:查阅相关论文和资料,为课堂讨论提供更多实例。
八、教学进度安排1. 第1-2课时:讲解化学能与电能的概念、相互转化原理。
2. 第3-4课时:讲解电池的工作原理及常见电池的种类。
3. 第5-6课时:分析生活中的化学能与电能转化实例。
