化学:专题1《化学家眼中的物质世界》复习课件(苏教版必修1)
合集下载
2020年高中化学专题一化学家眼中的物质世界专题知识回顾课件苏教版必修1

5.(1)甲烷(CH4)的摩尔质量为________。 (2)3.2 g CH4 中约含有________个分子,含有________mol 电子,在标准状况下所占的体积约为________L。 (3)在标准状况下,测得 1.32 g 某气体的体积为 0.672 L,则 此气体的摩尔质量为________。
专题知识回顾
章末专题放送
小专题,大收获
专题一 以物质的量为中心的基本计算
一、四个基本公式
公式
公式适用的状况,状态
①n=NNA ②n=Mm
适用于任何状况和状态 适用于任何状况和状态
③n=22V.4
适用于标准状况下的气体
④c=Vnaq
适用于溶液
注:N—微粒个数 m—质量(g) V—气体体积(L) M—摩尔质量(g/mol) NA—阿伏加德罗常数(mol-1) Vaq—溶液的体积 【名师提示】 在运用四个基本公式时要注意,物质的量 所描述的微粒与 N,m,M,V 中所描述的微粒一定是相同的。
德罗常数可表示为( )
A.Wn
B.11.2n
C.11W.2n
D.22W.4n
解析:根据公式 n=22V.4=NNA可知,22.4WLL/mol×2=NnA, 则可求得 NA=11W.2n,故选 C。
答案:C
专题二 有关阿伏加德罗定律及推论的应用 一、定律及推论内容 1.阿伏加德罗定律 同温、同压下,相同体积的任何气体都具有相同数目的分 子。
同温、同压下,气体的密度与其相对 分子质量(或是摩尔质量)成正比
⑤T、p、V 相同
MM12=mm12
同温、同压下,体积相同的气体,其 相对分子质量与其质量成正比
⑥T、p、m 相同
VV12=MM21
苏教版高中化学必修一全册课件

1
专题1 化学家眼中的物质世界
第一单元 丰富多彩的化学物质 第1课时 物质的分类与转化
栏目导航
目标与素养:1.了解从不同的角度(如组成、性质)对物质分类。(宏 观辨识与微观探析)2.能依据物质的组成,预测物质的性质及属性。(证 据推理与模型认知)3.掌握常见物质之间的转化。(变化观念)4.举例说 明四种基本化学反应类型的分类,能够根据化合价变化判断氧化还 原反应和非氧化还原反应。(证据推理与模酸反应生成FeCl2和H2的反应是置换反应,但不
是氧化还原反应
( ×)
(4)2CO+O2=点==燃==2CO2既是化合反应,又是氧化还原反应( √ )
栏目导航
2.分类法是一种行之有效、简单易行的科学方法,人们在认
识事物时可以采取多种分类方法。下列关于“CH3COONa”的分类
栏目导航
2.物质分类的意义 同一类物质在组成和性能方面往往具有一定的相似性。对物质 进行合理的分类,有助于我们按物质的类别进一步研究物质的组 成、结构和性能。
栏目导航
二、物质的转化
1.化学反应的分类
(1)根据化学反应的特征,我们将化学反应分成四种基本反应类
型
反应形式
反应类型
实例
A+B===AB
__化__合__反应 2_H__2_+__O_2_=_点=_=_燃=_=_2_H__2_O_
栏目导航
(2)上述反应中,属于化合反应的是 ①②③ (填序号,下同),属
于复分解反应的是 ⑤⑥ ,属于氧化还原反应的是 ① 。
栏目导航
1.有单质参与的化学反应是否是氧化还原反应? [提示] 判断一个化学反应是否是氧化还原反应,其标准是根 据反应前后元素的化合价是否发生变化。若一个反应中同时既有单 质,又有化合物则一定是氧化还原反应;若一个反应中只有单质之 间的转化,则该反应是非氧化还原反应(例如:2O3 3O2)。
专题1 化学家眼中的物质世界
第一单元 丰富多彩的化学物质 第1课时 物质的分类与转化
栏目导航
目标与素养:1.了解从不同的角度(如组成、性质)对物质分类。(宏 观辨识与微观探析)2.能依据物质的组成,预测物质的性质及属性。(证 据推理与模型认知)3.掌握常见物质之间的转化。(变化观念)4.举例说 明四种基本化学反应类型的分类,能够根据化合价变化判断氧化还 原反应和非氧化还原反应。(证据推理与模酸反应生成FeCl2和H2的反应是置换反应,但不
是氧化还原反应
( ×)
(4)2CO+O2=点==燃==2CO2既是化合反应,又是氧化还原反应( √ )
栏目导航
2.分类法是一种行之有效、简单易行的科学方法,人们在认
识事物时可以采取多种分类方法。下列关于“CH3COONa”的分类
栏目导航
2.物质分类的意义 同一类物质在组成和性能方面往往具有一定的相似性。对物质 进行合理的分类,有助于我们按物质的类别进一步研究物质的组 成、结构和性能。
栏目导航
二、物质的转化
1.化学反应的分类
(1)根据化学反应的特征,我们将化学反应分成四种基本反应类
型
反应形式
反应类型
实例
A+B===AB
__化__合__反应 2_H__2_+__O_2_=_点=_=_燃=_=_2_H__2_O_
栏目导航
(2)上述反应中,属于化合反应的是 ①②③ (填序号,下同),属
于复分解反应的是 ⑤⑥ ,属于氧化还原反应的是 ① 。
栏目导航
1.有单质参与的化学反应是否是氧化还原反应? [提示] 判断一个化学反应是否是氧化还原反应,其标准是根 据反应前后元素的化合价是否发生变化。若一个反应中同时既有单 质,又有化合物则一定是氧化还原反应;若一个反应中只有单质之 间的转化,则该反应是非氧化还原反应(例如:2O3 3O2)。
化学家眼中的物质世界复习PPT课件 苏教版

选项 A B C D
需要分离的物质
CCl4和水的混合物 MgCl2溶液与Mg(OH)2的混合物 酒精的水溶液
KNO3-与NaCl混合溶液
分离方法 蒸馏 过滤 萃取 结晶、过滤
8、几种常见离子的检验
待检物质 碳酸盐 铵盐
检验方法
与稀盐酸反应,产生使澄清石灰水变浑浊 的无色、无味的气体
与强碱溶液加热反应,产生使湿润的红色 石蕊试纸变蓝色的气体
B.75 mL 2 mol·L-1的NH4Cl D.75 mL 1 mol·L-1的CaCl2
摩22尔.2质g量某是二_价1_1_金1_g_属/_m_氯o_l_化__物__(_A;ClA2的)中相含对有原0子.4质m量ol是C_l_-4_,0__则__A_C_l_2;的 ACl2的化学式是___C_a_C_l_2 ____。
练习2
1999年,世界重大科技成果之一是超铀元素的发现,它有力地
支持了“稳定岛”假说,原子293
之差为B:
118
X
A.0
B.57
C.118
的中子数与电子数 D.175
单元三: 人类对原子结构的认识
应知
应会
1: 构成原子的粒子有 质子、中子和电子。
2:
X ZA+- dce+-
符号的每个字母的含义
原子结构示意图和 离子结构示意图(另有专题)
•
15、所有的辉煌和伟大,一定伴随着挫折和跌倒;所有的风光背后,一定都是一串串揉和着泪水和汗水的脚印。
•
16、成功的反义词不是失败,而是从未行动。有一天你总会明白,遗憾比失败更让你难以面对。
•
17、没有一件事情可以一下子把你打垮,也不会有一件事情可以让你一步登天,慢慢走,慢慢看,生命是一个慢慢累积的过程。
高中化学专题1化学家眼中的物质世界第一单元丰富多彩的化学物质物质的量课件苏教必修1
温度对气体体积的影响
压强对气体体积的影响
当压强增大,气体分子间 距离变小,气体体积变小。
气体体积的微观分析
1、决定气体体积大小的主要因素有哪些?
分子间的平均距离和分子数目
2、分子间的平均距离(d)受哪些条件影响? 是怎样影响的?
温度和压强 升高温度,体积增大;增大压强,体积缩小。
3、为什么在标准状况下1mol任何气体所占 的体积都相同呢?
T.P相同 n相同
d相同 N相同
VV相=.同22.4L
体积
10 cm3 7.1 cm3 18 cm3
C2H5OH
1
46.07 0.789 g•cm-3 58.4 cm3
温度为273k,压强为1.01×105Pa
H2
1
2.016 0.0899 g•L-1 22.4L
N2
1
28.02
1.25 g•L-1 22.4L
CO
1
28.01
1.25 g•L-1 22.4L
固体干冰
分子间距离较小 与分子直径接近
分子C间O距2较气大体,约是分
子直径的10倍
探究:粒子大小和粒子间距 对物质体积的影响示意图
决定物质体积的主要因素
决定物质体积 决定固体和液体 决定气体体积 的可能因素 体积的主要因素 的主要因素
粒子的数目
粒子的大小
可以忽略
粒子的间距
可以忽略
相同条件下, 1mol不同固体、液体的体积一般 是不同的,而1mol不同气体的体积几乎相同。
空隙较小 微粒之间的
距离较大
微粒的运动 方式
宏观性质
在固定的位 有固定的形状,几 置上振动 乎不能被压缩
可以自由移 没有固定的形状,
高中化学专题1化学家眼中的物质世界专题整合课件苏教版必修

分解物质或除去结晶水合物的结晶水等。如除
去 Na2CO3 溶液中的 NH4HCO3。
6.萃取:利用溶质在互不相溶的两种液体中溶解
度差别很大,进行分离,如用苯或 CCl 4 从溴水中
提取溴。
高 考 考 点 易 错 点
抛砖引玉(老师教你如何整理)
1.物质检验时操作要规范,不许原瓶操作,防止造
成试剂污染,解答离子检验题目的一般思路:取
KNO3K2SO4MgSO4
悬浊液
滤液
KNO3 溶
液
(1)操作①为
。
(2)操作②~④加入的试剂顺序可以为
。
2(3)如何判断 SO4 已除尽?
。
(4)实验过程中产生的多次沉淀
(填“需要”或“不需要”)
多次过滤,其理由是
。
(5)该同学的实验设计方案是否严密,说明理由
。
专题一
专题二
解析:本题考查学生对中学常见物质分离和提纯的基本操作的掌
1.过滤:分离固体与液体互不相溶的混合物,如除
去 NaCl 溶液中的 BaCO3。
2.分液:分离互不相溶的两种液体,如水和四氯化
碳的分离。
3.蒸馏:根据沸点不同分离互溶的两种液体,如石
油的分馏。
物质的分离与 4.蒸发:加热使溶质从溶液中结晶分离出来,如从
提纯
NaCl 溶液中分离出 NaCl。
5.固体灼烧:除去固体物质中含有的易升华、易
可加入BaCl2、Na2CO3和NaOH溶液进行除杂,也不可用稀盐酸调
节溶液的pH,否则会引进Na+和Cl-杂质。
专题一
专题二
答案:(1)加水溶解 (2)Ba(NO3)2、K2CO3和KOH[或KOH、
Ba(NO3)2和K2CO3或Ba(NO3)2、KOH和K2CO3]
去 Na2CO3 溶液中的 NH4HCO3。
6.萃取:利用溶质在互不相溶的两种液体中溶解
度差别很大,进行分离,如用苯或 CCl 4 从溴水中
提取溴。
高 考 考 点 易 错 点
抛砖引玉(老师教你如何整理)
1.物质检验时操作要规范,不许原瓶操作,防止造
成试剂污染,解答离子检验题目的一般思路:取
KNO3K2SO4MgSO4
悬浊液
滤液
KNO3 溶
液
(1)操作①为
。
(2)操作②~④加入的试剂顺序可以为
。
2(3)如何判断 SO4 已除尽?
。
(4)实验过程中产生的多次沉淀
(填“需要”或“不需要”)
多次过滤,其理由是
。
(5)该同学的实验设计方案是否严密,说明理由
。
专题一
专题二
解析:本题考查学生对中学常见物质分离和提纯的基本操作的掌
1.过滤:分离固体与液体互不相溶的混合物,如除
去 NaCl 溶液中的 BaCO3。
2.分液:分离互不相溶的两种液体,如水和四氯化
碳的分离。
3.蒸馏:根据沸点不同分离互溶的两种液体,如石
油的分馏。
物质的分离与 4.蒸发:加热使溶质从溶液中结晶分离出来,如从
提纯
NaCl 溶液中分离出 NaCl。
5.固体灼烧:除去固体物质中含有的易升华、易
可加入BaCl2、Na2CO3和NaOH溶液进行除杂,也不可用稀盐酸调
节溶液的pH,否则会引进Na+和Cl-杂质。
专题一
专题二
答案:(1)加水溶解 (2)Ba(NO3)2、K2CO3和KOH[或KOH、
Ba(NO3)2和K2CO3或Ba(NO3)2、KOH和K2CO3]
苏教版高中化学必修一课件期末复习一

二、掌握物质的量的基本计算
比较同温同压下等质量的CO、CO2下列各量: 分子个数比 所含原子个数比 所含质子数之比 电子数之比 体积比 密度比
三、一定物质的量浓度溶液的配制及有关计算
实验室需 2.0mol/L H2SO4 450mL,现用质量 分数为98%,密度为1.84g/cm3浓硫酸来配制,
高中化学课件
灿若寒星整理制作
专题一化学家眼中的物质世界
一、物质的分类方法 把下列物质按组成进行分类:
铜 碳 盐酸 Al2O3 Na2O SO2 Na2O2 SO3 H2SO4NaOH NH3·H2O 熔融NaCl酒精 BaSO4
二、掌握物质的量的基本计算
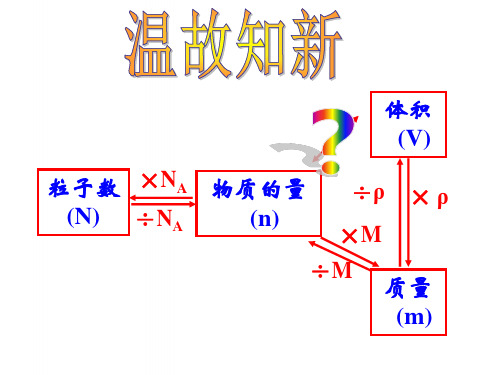
用公式表示下列各量之间的关系: 微粒个数(N) 物质的质量(m) 物质的量(n) 标准状况下气体的体积 (V) 溶液的物质的量浓度(c)
(1)选用容量瓶规格_______ (2)应量取硫酸的体积为_____
ቤተ መጻሕፍቲ ባይዱ
三、一定物质的量浓度溶液的配制及有关计算
标准状况下224L NH3溶于1L水中,所得溶液 密度为0.95g/cm3,求所得溶液的质量分数及 物质的量浓度。
四、常见物质的分离方法
蒸发 过滤 萃取 分液 蒸馏 洗汽
五、常见物质的检验方法
Na+ K+ NH4+Cl- SO42- CO32 实验室常见试纸及使用方法如何?
六、物质的分散系
什么是分散系? 常见三种分散系是什么?区分标准是什么?
高中化学专题一化学家眼中的物质世界第一单元丰富多彩的化学物质第1课时物质的分类与转化课件苏教版必修1
专题1 化学家眼中的物质世界
[课程标准] 1.知道化学是在分子层次上认识物质和合成新物质的一门科 学;了解物质的组成、结构和性质的关系;认识化学变化的 本质。 2.认识实验、假说、模型、比较、分类等科学方法对化学研 究的作用。 3.认识摩尔是物质的量的基本单位,能用于进行简单的化学 计算,体会定量研究的方法对研究和学习化学的重要作用。 4.体验科学探究的过程,学习运用以实验为基础的实证研究 方法。
已知Ba的活动性强于Mg。以Mg、MgO、Mg(OH)2、 MgCO3、MgSO4、BaCl2溶液和盐酸为原料,直接制取 MgCl2可有多种方法,其中运用复分解反应的有( ) A.二种 B.三种 C.四种 D.五种
[解析] 氯化镁是盐,生成盐的反应很多,可用金属与盐溶 液置换、金属与酸反应、金属氧化物与酸反应、碱与酸反 应、盐与酸反应、盐与盐反应等,但要注意反应发生的条 件。镁的活动性弱于钡,镁不能置换出氯化钡溶液中的钡。 氧化镁、氢氧化镁、碳酸镁均可与盐酸反应生成氯化镁,硫 酸镁与氯化钡反应也可生成氯化镁。同时还要注意题中限制 条件(运用复分解反应),反应方程式如下: MgO+2HCl===MgCl2+H2O(复分解反应), Mg(OH)2+2HCl===MgCl2+2H2O(复分解反应), MgCO3+2HCl===MgCl2+CO2↑+H2O(复分解反应), MgSO4+BaCl2===BaSO4↓+MgCl2(复分解反应)。 [答案] C
2KClO3=M=△=nO=2=2KCl+
3O2↑等 Fe+2HCl=== FeCl2+
H2↑等 Ba(OH)2+ MgSO4===BaSO4↓+ Mg(OH)2↓等
4.标出下列物质中各元素的化合价。 Na2O、Na2CO3、NH4NO3、AlCl3、MgCl2、MgO、H2O、 SO2、H2SO4 、Fe(OH)3。
[课程标准] 1.知道化学是在分子层次上认识物质和合成新物质的一门科 学;了解物质的组成、结构和性质的关系;认识化学变化的 本质。 2.认识实验、假说、模型、比较、分类等科学方法对化学研 究的作用。 3.认识摩尔是物质的量的基本单位,能用于进行简单的化学 计算,体会定量研究的方法对研究和学习化学的重要作用。 4.体验科学探究的过程,学习运用以实验为基础的实证研究 方法。
已知Ba的活动性强于Mg。以Mg、MgO、Mg(OH)2、 MgCO3、MgSO4、BaCl2溶液和盐酸为原料,直接制取 MgCl2可有多种方法,其中运用复分解反应的有( ) A.二种 B.三种 C.四种 D.五种
[解析] 氯化镁是盐,生成盐的反应很多,可用金属与盐溶 液置换、金属与酸反应、金属氧化物与酸反应、碱与酸反 应、盐与酸反应、盐与盐反应等,但要注意反应发生的条 件。镁的活动性弱于钡,镁不能置换出氯化钡溶液中的钡。 氧化镁、氢氧化镁、碳酸镁均可与盐酸反应生成氯化镁,硫 酸镁与氯化钡反应也可生成氯化镁。同时还要注意题中限制 条件(运用复分解反应),反应方程式如下: MgO+2HCl===MgCl2+H2O(复分解反应), Mg(OH)2+2HCl===MgCl2+2H2O(复分解反应), MgCO3+2HCl===MgCl2+CO2↑+H2O(复分解反应), MgSO4+BaCl2===BaSO4↓+MgCl2(复分解反应)。 [答案] C
2KClO3=M=△=nO=2=2KCl+
3O2↑等 Fe+2HCl=== FeCl2+
H2↑等 Ba(OH)2+ MgSO4===BaSO4↓+ Mg(OH)2↓等
4.标出下列物质中各元素的化合价。 Na2O、Na2CO3、NH4NO3、AlCl3、MgCl2、MgO、H2O、 SO2、H2SO4 、Fe(OH)3。
化学:专题1 化学家眼中的物质世界专题优化总结 课件(苏教版必修1)共35页PPT
化学:专题1 化学家眼中的物质世界 专题优化总结 课件(苏教版必修1)
11、不为五斗米折腰。 12、芳菊开林耀,青松冠岩列。怀此 贞秀姿 ,卓为 霜下杰 。
13、归去来兮,田蜀将芜胡不归。 14、酒能祛百虑,菊为制颓龄。 15、春蚕收长丝,秋熟靡王税。
ห้องสมุดไป่ตู้
41、学问是异常珍贵的东西,从任何源泉吸 收都不可耻。——阿卜·日·法拉兹
42、只有在人群中间,才能认识自 己。——德国
43、重复别人所说的话,只需要教育; 而要挑战别人所说的话,则需要头脑。—— 玛丽·佩蒂博恩·普尔
44、卓越的人一大优点是:在不利与艰 难的遭遇里百折不饶。——贝多芬
45、自己的饭量自己知道。——苏联
11、不为五斗米折腰。 12、芳菊开林耀,青松冠岩列。怀此 贞秀姿 ,卓为 霜下杰 。
13、归去来兮,田蜀将芜胡不归。 14、酒能祛百虑,菊为制颓龄。 15、春蚕收长丝,秋熟靡王税。
ห้องสมุดไป่ตู้
41、学问是异常珍贵的东西,从任何源泉吸 收都不可耻。——阿卜·日·法拉兹
42、只有在人群中间,才能认识自 己。——德国
43、重复别人所说的话,只需要教育; 而要挑战别人所说的话,则需要头脑。—— 玛丽·佩蒂博恩·普尔
44、卓越的人一大优点是:在不利与艰 难的遭遇里百折不饶。——贝多芬
45、自己的饭量自己知道。——苏联
高中化学(苏教版)必修1课件:专题1 化学家眼中的物质世界 1.1.3
化学 必修1
专题一
化学家眼中的物质世界
自主学习· 新知全 解 合作探究· 课堂讲练 课时作业
气体摩尔体积 1.影响物质体积的因素 (1)决定物质体积的三因素。
化学 必修1
专题一
化学家眼中的物质世界
自主学习· 新知全 解 合作探究· 课堂讲练 课时作业
[微点拨 ]
同温同压下,任何气体粒子之间距离相等。 2.气体摩尔体积 (1)气体摩尔体积。 在温度、压强一定时,任何具有相同微粒数的气体都具有大致相同的
化学 必修1
专题一
化学家眼中的物质世界
自主学习· 新知全 解 合作探究· 课堂讲练 课时作业
第 3 课时
物质的聚集状态
化学 必修1
专题一
化学家眼中的物质世界
自主学习· 新知全 解 合作探究· 课堂讲练 课时作业
1.了解物质的聚集状态。 2.理解气体摩尔体积的定义及相关计算。 3.理解阿伏加德罗定律及其推论,并且能够进行相关的计算。 4.理解物质的量在化学方程式计算中的应用。
自主学习· 新知全 解 合作探究· 课堂讲练 课时作业
解析:
有 6.02× 1023 个分子的物质的物质的量是 1 mol,在标准状况
下, 1 mol 气体物质的体积约是 22.4 L,但 A 选项中的 1 mol 分子不一定是 气体,错误;B 选项氢气虽是气体,但没有指明气体所处的状况,因此,0.5 mol H2 的体积也不一定就是 11.2 L 错误; C 选项中的水在标准状况下不是气 体而是固液混合物,所以也错误;D 选项中,虽是混合气体,但是 N2 和 CO 的摩尔质量相等,两者以任意比例混合,其摩尔质量数值不变,故 28 g N2 和 CO 的混合气体的物质的量是 1 mol,标准状况下其体积约为 22.4 L,正 确。
苏教版高中化学必修一课件高一化学专题1化学家眼中的物质世界.pptx
B. H2SO4、H2CO3 D. Na2SO3、KClO3
30
解析:C2O3 属于氧化物,故应归为 C 项,A 项中都属于单 质,B 项中都属于含氧酸,D 项中都属于含氧酸盐。
答案:C
31
[例2] 图中“——”表示相连的物质间在一定条件下可以 反应,“―→”表示丁在一定条件下可以转化为乙。下面四组
14
1.连连看。 (1)①钠 ②氯气 ③氯化铁溶液
[做一做·自我发现]
a.混合物 b.金属 c.非金属
15
(2)①硫酸 ②碳酸钙 ③氧化钙 ④氢氧化钠 ⑤葡萄糖
a.氧化物 b.酸 c.碱 d.盐 e.有机物
答案:(1)①-b ②-c ③-a (2)①-b ②-d ③-a ④-c ⑤-e
16
2.下列说法中,正确的是( ) A.含氧的化合物一定是氧化物 B.酸根中不一定含有氧元素 C.盐的组成中一定含有金属元素 D.酸中一定不含金属元素 答案:B
26
(一)精妙思路点拨 解答本题要注意以下两点: 关键点:(1)明确物质在元素组成、化合价、水溶性等方面 的特点。 (2)找出相同点或相似性。
27
(二)记录课堂精彩 (1)虽然都是MO2型化合物,但有金属氧化物与非金属氧化 物之分,MnO2是金属氧化物,其余为非金属氧化物。 (2)四种物质可以根据水溶性分,AgCl不溶于水,其余三种 均溶于水。 (3)四种物质均为黑色粉末,但只有Ag不溶于稀HCl或稀 H2SO4,其余三种均溶。
40
(三)精彩论语点评 四种基本反应类型是根据反应物和生成物的类别及反应前 后物质种类的多少来分类的;氧化还原反应和非氧化还原反应 则是依据反应中是否有元素化合价的变化来分类的。
41
(四)类题演练提升 下列反应属于氧化还原反应的是(多选)( ) A. CaCO3=高==温==CaO+CO2↑ B. 2KClO3=M=△n=O==22KCl+3O2↑ C. MnO2+4HCl(浓)==△===MnCl2+Cl2↑+2H2O D. NaCl(s)+H2SO4(浓)==△===NaHSO4+HCl↑
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题1: 化学家眼中的物质世界
单元一: 丰富多彩的化学物质 单元二: 研究物质的 实验方法
单元三: 人类对原子结构的认识
单元一: 丰富多彩的化学物质
应知 1 : 物质的分类方法 (任何分类都要有依据)
应会: 根据物质的组成对物质进行分类
练习1:
下列各物质的分类、名称(或俗名)、化学式都正确的是---( D ) A.碱性氧化物 氧化铝 Al2O3 B.酸性氧化物 干冰 CO C.酸 硫酸 H2SO3 D.盐 纯碱 Na2CO3
1 1H 35 17
,
2 1H
,
3 1H 37 17
氕(pie),氘(dao),氚(chuan)
12 6 C 18C
,
14 6 C
16 O 8
,
17 8 O
,
单元三: 人类对原子结构的认识
应知2:
ZX e
+ - dc+ A -
符号的每个字母的含义
原子结构示意图和离子结构示意图
练习2 1999年,世界重大科技成果之一是超铀元素的发现,它有力地 293 支持了“稳定岛”假说,原子 的中子数与电子数之差为: B 118 X A.0 B.57 C.118 D.175 返回主页
质量数(A)= 质子数(Z)+ 中子数(N)
质量数
A
Z
质子数(核电荷数)
X
元素符号
原子: 核电荷数(Z)= 核内质子数(Z) = 核外电子数
单元一: 丰富多彩的化学物质
应知3: 物质的量及其单位 应会: 以物质的量为核心的计算 m n=- M (1) 关于质量的换算 _________ N n=- NA (2) 关于粒子数目的换算 _______ 物理量的单位: n - mol
m- g
M - g/mol N- 个 NA - mol-1 V - L
4. 在使用物质的量时最好用化学式指明 粒子的种类。
5. 摩尔质量是指单位物质的量的物质所具
有的质量。 单位: g/mol
6. 摩尔质量(g/mol)、1mol物质的质量(g)、
物质的相对原子(或分子)质量之间的关系: 数值相等,单位不同 7.气体摩尔体积:单位物质的量气体所占的体积, 单位为L· mol-1。 在标准状况时 Vm= 22.4 L· mol-1
应知2: 几种常见离子的检验方法 应会: Cl- 、SO42-、CO32-、NH4+、Na+、K+离子的检验 练习2:
现有一种化合物Z,它的阳离子可能是Na+、K+、NH4+、Cu2+、Ag+,阴离 子可能是NO3-、SO42-、Cl-、CO32-,进行以下实验(填离子符号) ⑴做焰色反应,有黄色火焰,透过蓝色的钴玻璃观察,无紫色火焰. 肯定 有 Na+ 离子。 ⑵取少量固体Z放入水中,得到无色溶液肯定无 Cu2+ 离子。 2⑶向Z溶液中加入酸化的AgNO3溶液,无明显变化,肯定无 Cl- CO _ 3 离子 ⑷另取Z溶液,加入酸化的BaCl2溶液,无明显变化 ,肯定无SO42- Ag _+离子 ⑸另取Z溶液,加入NaOH溶液共热,无明显变化 , 肯定无 NH4+ 离子。 由上述实验事实,可推断化合物Z是 NaNO3 。
所带正负电荷数
A Z
X
n
阳离子:核电荷数(Z)= 核内质子数(Z)
= 核外电子数 + n
阴离子:核电荷数(Z)= 核内质子数(Z)
= 核外电子数 - n
返回
物质的分类
按 所 含 物 质 种 类 分
物 质
混 合 物
氧化物 酸
CO2 H2SO4 NaOH NaCl
纯 净 物
按 所 含 元 素 种 类 分
返回
1. 物质的量(n)是表示物质所含粒子多 少的物理量,它是一个专有名词,由固定字 数组成的一个整体,不可分割。 2. 摩尔(mol)是物质的量的单位,每摩尔 物质都含有阿伏伽德罗常数(NA)个粒子,阿 伏伽德罗常数是一个很大的数,等于0.012kgC12所含的碳原子数,近似值为6.02×1023 mol-1。 3. 物质的量和摩尔都只适用于微观粒子,不 能用于宏观物体。
电解质 化合物
(酸、碱、盐、水、活泼金属氧化物)
非电解质
(大多数有机化合物、非金属氧化物、氢化物等)
小结
待检物质 检验方法 与稀盐酸反应,产生使澄清石灰水变浑浊的 无色、无味的气体 与强碱溶液加热反应,产生使湿润的红色石 蕊试纸变蓝色的气体
与BaCl2溶液反应,生成不溶于稀盐酸的白色沉淀
碳酸盐
铵盐 硫酸盐
单元一: 丰富多彩的化学物质
溶液 、_____ 浊液 和______ 胶体 3 种. 应知4: 分散系有______ 电解质和非电解质的概念 应会: 会区别分散系的类型、会区别电解质和非电解质. 练习4:
用特殊的方法把固体加工到纳米级(1~100nm, 1nm=10-9m)的超细粉末 粒子,然后制得纳米材料。下列分散系中的分散质的粒子直径和这种粒子具 有相同的数量级的是 ----------------------------------------------------------------( C ) A. 溶液 B. 悬浮液 C. 胶体 D. 乳浊液 下列物质: ①氢氧化钠固体 ②水银 ③氯化氢气体 ④稀硫酸 ⑤二氧化碳气体 ⑥氨水 ⑦碳酸钠粉末 ⑧蔗糖晶体 ⑨熔融氯化钠 ⑩CuSO4· 5H2O晶体 ②④⑥⑨ ⑴上述状态下能导电的是:_____________ ①③⑦⑨⑩ ⑵属于电解质的是:________________ ⑤⑧ ⑶属于非电解质的是:______________
单元一: 丰富多彩的化学物质
应知2: 化学反应的分类方法 应会: 能区分四种基本反应类型和氧化还原反应
置 氧化还原反应换 反 应 化合反应
复 分 非氧化还原反应 解 反 应
分解反应
练习2: 下列反应中,不属于化合、分解、置换、复分解等四种基本 反应类型的是 ------------------------------------------------( C ) A.CuSO4+H2S = CuS↓+H2SO4 △ B.Cu2(OH)2CO3 = 2CuO+CO2↑+H2O C.2FeCl3+Cu=2FeCl2+CuCl2 D.4Fe(OH)2+O2+2H2O=4Fe(OH)3
下列溶液中的Cl-浓度与50 mL 1 mol· L-1的AlCl3溶液中Cl- 的浓度相等的是 ----------------------------------------------------( C ) A.150 mL 1mol· L-1的NaCl B.75 mL 2 mol· L-1的NH4Cl C.150 mL 3 mol· L-1的KCl D.75 mL 1 mol· L-1的CaCl2 22.2 g某二价金属氯化物(ACl2)中含有0.4 mol Cl-,则ACl2的摩 111g/mol 尔质量是______________ ;A的相对原子质量是__________ ; 40 ACl2的化学式是___________ 。 CaCl2
物质的量浓度
1、定义:以单位体积溶液里所含溶质的物质的 量来表示溶液组成的物理量。
2、表达式: cB= nB/V
注意:
单位: mol·L-1
(1)单位体积1L是溶液的体积,不是溶剂的 体积。
(2)溶液的物质的量浓度不受体积影响。
返回
电解质和非电解质
电解质:在水溶液中或熔融状态下能导电的化合物 非电解质:在水溶液中和熔融状态下都不能导电的化合物
化 合 物
碱
盐 单
质
金属单质
非金属单质
Al
C
返回
四种基本反应类型的特点
化合反应为两种或两种以上的物质参加反应 生成一种物质的反应类型 分解反应为一种物质在一定条件下反应生成 两种或两种以上的物质的反应类型 置换反应为一种单质与一种化合物反应生成 一种新的单质与新的化合物的反应类型 复分解反应为两种化合物相互交换成分生成 两种新的化合物的反应类型
返回主页
单元二: 研究物质的 实验方法
应知1: 物质的分离和提纯的方法有: ______ 过滤 、______ 结晶 、 ______ 6种 . 萃取 、______ 分液 、______ 蒸馏 、______ 层析
应会:
对不同的混合物能采用不同的分离方法 常用仪器的使用
练习1: 下列实验操作中错误的是 ------------------------------------- ( A ) A.蒸发操作时,应将溶液中的水分完全蒸干后,才能停止加热 B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从 上口倒出. D.萃取操作时,萃取剂与溶液中的溶剂不能互溶.
单元二: 研究物质的 实验方法
下面物质的分离方法不正确的是 ---------------- ( C ) 选项 A B C D 需要分离的物质 CCl4和水的混合物 MgCl2溶液与Mg(OH)2的混合物 酒精的水溶液 KNO3与NaCl混合溶液 分离方法 分液 过滤 萃取 结晶、过滤
单元二: 研究物质的 实验方法
V n = —— 22.4 (3) 关于气体体积的换算 _______
n c=- V (4) 关于物质的量浓度的计算 ______
以物质的量为核心的计算
气体体积(V)
÷Vm ×Vm
质量(m)
÷M ×M
物质的量(n) ÷V液 ×V液
×NA ÷NA
粒子数(N)
物质的量浓度(CB)
单元一: 丰富多彩的化学物质 练习3:
单元三: 人类对原子结构的认识
单元一: 丰富多彩的化学物质 单元二: 研究物质的 实验方法
单元三: 人类对原子结构的认识
单元一: 丰富多彩的化学物质
应知 1 : 物质的分类方法 (任何分类都要有依据)
应会: 根据物质的组成对物质进行分类
练习1:
下列各物质的分类、名称(或俗名)、化学式都正确的是---( D ) A.碱性氧化物 氧化铝 Al2O3 B.酸性氧化物 干冰 CO C.酸 硫酸 H2SO3 D.盐 纯碱 Na2CO3
1 1H 35 17
,
2 1H
,
3 1H 37 17
氕(pie),氘(dao),氚(chuan)
12 6 C 18C
,
14 6 C
16 O 8
,
17 8 O
,
单元三: 人类对原子结构的认识
应知2:
ZX e
+ - dc+ A -
符号的每个字母的含义
原子结构示意图和离子结构示意图
练习2 1999年,世界重大科技成果之一是超铀元素的发现,它有力地 293 支持了“稳定岛”假说,原子 的中子数与电子数之差为: B 118 X A.0 B.57 C.118 D.175 返回主页
质量数(A)= 质子数(Z)+ 中子数(N)
质量数
A
Z
质子数(核电荷数)
X
元素符号
原子: 核电荷数(Z)= 核内质子数(Z) = 核外电子数
单元一: 丰富多彩的化学物质
应知3: 物质的量及其单位 应会: 以物质的量为核心的计算 m n=- M (1) 关于质量的换算 _________ N n=- NA (2) 关于粒子数目的换算 _______ 物理量的单位: n - mol
m- g
M - g/mol N- 个 NA - mol-1 V - L
4. 在使用物质的量时最好用化学式指明 粒子的种类。
5. 摩尔质量是指单位物质的量的物质所具
有的质量。 单位: g/mol
6. 摩尔质量(g/mol)、1mol物质的质量(g)、
物质的相对原子(或分子)质量之间的关系: 数值相等,单位不同 7.气体摩尔体积:单位物质的量气体所占的体积, 单位为L· mol-1。 在标准状况时 Vm= 22.4 L· mol-1
应知2: 几种常见离子的检验方法 应会: Cl- 、SO42-、CO32-、NH4+、Na+、K+离子的检验 练习2:
现有一种化合物Z,它的阳离子可能是Na+、K+、NH4+、Cu2+、Ag+,阴离 子可能是NO3-、SO42-、Cl-、CO32-,进行以下实验(填离子符号) ⑴做焰色反应,有黄色火焰,透过蓝色的钴玻璃观察,无紫色火焰. 肯定 有 Na+ 离子。 ⑵取少量固体Z放入水中,得到无色溶液肯定无 Cu2+ 离子。 2⑶向Z溶液中加入酸化的AgNO3溶液,无明显变化,肯定无 Cl- CO _ 3 离子 ⑷另取Z溶液,加入酸化的BaCl2溶液,无明显变化 ,肯定无SO42- Ag _+离子 ⑸另取Z溶液,加入NaOH溶液共热,无明显变化 , 肯定无 NH4+ 离子。 由上述实验事实,可推断化合物Z是 NaNO3 。
所带正负电荷数
A Z
X
n
阳离子:核电荷数(Z)= 核内质子数(Z)
= 核外电子数 + n
阴离子:核电荷数(Z)= 核内质子数(Z)
= 核外电子数 - n
返回
物质的分类
按 所 含 物 质 种 类 分
物 质
混 合 物
氧化物 酸
CO2 H2SO4 NaOH NaCl
纯 净 物
按 所 含 元 素 种 类 分
返回
1. 物质的量(n)是表示物质所含粒子多 少的物理量,它是一个专有名词,由固定字 数组成的一个整体,不可分割。 2. 摩尔(mol)是物质的量的单位,每摩尔 物质都含有阿伏伽德罗常数(NA)个粒子,阿 伏伽德罗常数是一个很大的数,等于0.012kgC12所含的碳原子数,近似值为6.02×1023 mol-1。 3. 物质的量和摩尔都只适用于微观粒子,不 能用于宏观物体。
电解质 化合物
(酸、碱、盐、水、活泼金属氧化物)
非电解质
(大多数有机化合物、非金属氧化物、氢化物等)
小结
待检物质 检验方法 与稀盐酸反应,产生使澄清石灰水变浑浊的 无色、无味的气体 与强碱溶液加热反应,产生使湿润的红色石 蕊试纸变蓝色的气体
与BaCl2溶液反应,生成不溶于稀盐酸的白色沉淀
碳酸盐
铵盐 硫酸盐
单元一: 丰富多彩的化学物质
溶液 、_____ 浊液 和______ 胶体 3 种. 应知4: 分散系有______ 电解质和非电解质的概念 应会: 会区别分散系的类型、会区别电解质和非电解质. 练习4:
用特殊的方法把固体加工到纳米级(1~100nm, 1nm=10-9m)的超细粉末 粒子,然后制得纳米材料。下列分散系中的分散质的粒子直径和这种粒子具 有相同的数量级的是 ----------------------------------------------------------------( C ) A. 溶液 B. 悬浮液 C. 胶体 D. 乳浊液 下列物质: ①氢氧化钠固体 ②水银 ③氯化氢气体 ④稀硫酸 ⑤二氧化碳气体 ⑥氨水 ⑦碳酸钠粉末 ⑧蔗糖晶体 ⑨熔融氯化钠 ⑩CuSO4· 5H2O晶体 ②④⑥⑨ ⑴上述状态下能导电的是:_____________ ①③⑦⑨⑩ ⑵属于电解质的是:________________ ⑤⑧ ⑶属于非电解质的是:______________
单元一: 丰富多彩的化学物质
应知2: 化学反应的分类方法 应会: 能区分四种基本反应类型和氧化还原反应
置 氧化还原反应换 反 应 化合反应
复 分 非氧化还原反应 解 反 应
分解反应
练习2: 下列反应中,不属于化合、分解、置换、复分解等四种基本 反应类型的是 ------------------------------------------------( C ) A.CuSO4+H2S = CuS↓+H2SO4 △ B.Cu2(OH)2CO3 = 2CuO+CO2↑+H2O C.2FeCl3+Cu=2FeCl2+CuCl2 D.4Fe(OH)2+O2+2H2O=4Fe(OH)3
下列溶液中的Cl-浓度与50 mL 1 mol· L-1的AlCl3溶液中Cl- 的浓度相等的是 ----------------------------------------------------( C ) A.150 mL 1mol· L-1的NaCl B.75 mL 2 mol· L-1的NH4Cl C.150 mL 3 mol· L-1的KCl D.75 mL 1 mol· L-1的CaCl2 22.2 g某二价金属氯化物(ACl2)中含有0.4 mol Cl-,则ACl2的摩 111g/mol 尔质量是______________ ;A的相对原子质量是__________ ; 40 ACl2的化学式是___________ 。 CaCl2
物质的量浓度
1、定义:以单位体积溶液里所含溶质的物质的 量来表示溶液组成的物理量。
2、表达式: cB= nB/V
注意:
单位: mol·L-1
(1)单位体积1L是溶液的体积,不是溶剂的 体积。
(2)溶液的物质的量浓度不受体积影响。
返回
电解质和非电解质
电解质:在水溶液中或熔融状态下能导电的化合物 非电解质:在水溶液中和熔融状态下都不能导电的化合物
化 合 物
碱
盐 单
质
金属单质
非金属单质
Al
C
返回
四种基本反应类型的特点
化合反应为两种或两种以上的物质参加反应 生成一种物质的反应类型 分解反应为一种物质在一定条件下反应生成 两种或两种以上的物质的反应类型 置换反应为一种单质与一种化合物反应生成 一种新的单质与新的化合物的反应类型 复分解反应为两种化合物相互交换成分生成 两种新的化合物的反应类型
返回主页
单元二: 研究物质的 实验方法
应知1: 物质的分离和提纯的方法有: ______ 过滤 、______ 结晶 、 ______ 6种 . 萃取 、______ 分液 、______ 蒸馏 、______ 层析
应会:
对不同的混合物能采用不同的分离方法 常用仪器的使用
练习1: 下列实验操作中错误的是 ------------------------------------- ( A ) A.蒸发操作时,应将溶液中的水分完全蒸干后,才能停止加热 B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从 上口倒出. D.萃取操作时,萃取剂与溶液中的溶剂不能互溶.
单元二: 研究物质的 实验方法
下面物质的分离方法不正确的是 ---------------- ( C ) 选项 A B C D 需要分离的物质 CCl4和水的混合物 MgCl2溶液与Mg(OH)2的混合物 酒精的水溶液 KNO3与NaCl混合溶液 分离方法 分液 过滤 萃取 结晶、过滤
单元二: 研究物质的 实验方法
V n = —— 22.4 (3) 关于气体体积的换算 _______
n c=- V (4) 关于物质的量浓度的计算 ______
以物质的量为核心的计算
气体体积(V)
÷Vm ×Vm
质量(m)
÷M ×M
物质的量(n) ÷V液 ×V液
×NA ÷NA
粒子数(N)
物质的量浓度(CB)
单元一: 丰富多彩的化学物质 练习3:
单元三: 人类对原子结构的认识
