有机化学-立体化学
有机化学 第八章 立体化学

C2H5 Cl Cl
19
H
CH3 H Cl Cl H C2H5 Cl H
CH3 H Cl C2H5 Cl Cl
CH3 H H C 2H 5 H H
CH3 Cl Cl C2H5
CH3 Cl H Cl H C2 H5
CH3 H Cl Cl H C2H5
CH3 H Cl Cl H C2H5
CH3 Cl H Cl H C2 H5
20
注意: 注意
D,L是相对构型,与假定的 、 甘油醛相关联而确定的构型 甘油醛相关联而确定的构型。 D,L是相对构型,与假定的D、L甘油醛相关联而确定的构型。R,S 是相对构型 是绝对构型,能真实代表某一光活性化合物的构型( 、 ) 是绝对构型,能真实代表某一光活性化合物的构型(R、S) 。 两种标记法的依据: 两种标记法的依据:R/S法依据与*C相连的四个原子或基团 法依据与* 的大小顺序; 法依据与D 甘油醛的构型是否相同。 的大小顺序;D/L法依据与D-甘油醛的构型是否相同。 无论是D,L还是R,S标记方法, D,L还是R,S标记方法 无论是D,L还是R,S标记方法,都不能通过其标记的构型来判 断旋光方向。因为旋光方向使化合物的固有性质, 断旋光方向。因为旋光方向使化合物的固有性质,而对化合 物的构型标记只是人为的规定 人为的规定。 物的构型标记只是人为的规定。 目前从一个化合物的构型还无法准确地判断其旋光方向, 目前从一个化合物的构型还无法准确地判断其旋光方向,还 是依靠测定。 是依靠测定。
锲形式
COOH H OH CH3
Fischer投影式 投影式
项:
(1)不能离开纸面翻转;可以沿纸面旋转 )不能离开纸面翻转;可以沿纸面旋转180°,但不能旋转 ° ° 但不能旋转90° 或270°。 ° (2) 基团交换次数可以为偶数次,不能为奇数次;亦可以一基团 基团交换次数可以为偶数次 不能为奇数次; 偶数次, 不动,另三基团顺或逆时针轮换(相当于交换两次)。 不动,另三基团顺或逆时针轮换(相当于交换两次)。
有机化学基础知识点整理立体化学的基本概念与表示方法

有机化学基础知识点整理立体化学的基本概念与表示方法有机化学基础知识点整理——立体化学的基本概念与表示方法立体化学是有机化学中的重要分支,研究有机化合物中分子空间结构和立体异构体的性质与反应规律。
本文将对立体化学的基本概念与表示方法进行整理与介绍。
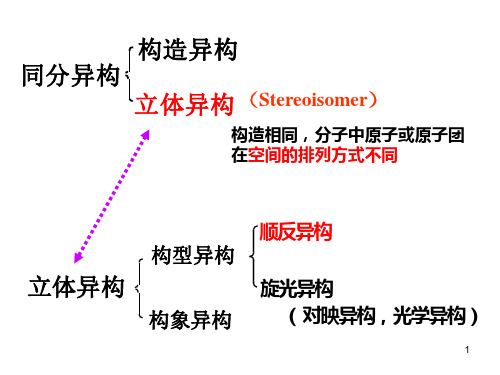
一、立体化学的基本概念1. 立体异构体:指在化学式相同、分子式相同的情况下,分子结构排列不同而具有不同性质的化合物,称为立体异构体。
立体异构体分为构象异构体和对映异构体两大类。
2. 立体异构体的原因:分子由于碳原子的四个价键都可以自由旋转,导致构象异构体的产生。
对映异构体则由于分子内部存在不对称碳原子或手性中心,使得它们的镜像体不能重合。
3. 立体异构体的性质:立体异构体在物理性质和化学性质上有所区别,例如物理性质如熔点、沸点、密度等差异明显,化学性质如对外界的反应、催化剂的选择等也有较大差异。
二、立体化学的表示方法1. 立体表示法:主要有盘状投影式、锥面式、楔面式和Fischer式等。
a. 盘状投影式:将分子按水平投影在纸面上,使用实线表示平面内的键,棱柱形状表示键在平面之上,圆圈表示键在平面之下。
b. 锥面式:将分子沿轴线向外投影,用三角形表示键在轴线上方,用带状表示键在轴线下方。
c. 楔面式:将分子通过楔形物理模型或立体图形展示,用楔形箭头表示键在垂直于纸面的方向上,用缺口箭头表示键在纸面下方。
d. Fischer式:以垂直于纸面的轴线为支架,将分子垂直展示,左右的羰基或羟基用垂直于轴线的线条表示。
2. 立体描述法:包括立体描述词、R/S命名法、E/Z命名法和Fukui-Liontelli规则等。
a. 立体描述词:用于描述分子中的任意一个手性中心或不对称碳原子的构型,一般为S、R两个字母的组合。
b. R/S命名法:适用于手性中心为单一物种构成的有机分子,根据规定的优先级顺序(按原子序数决定),通过相互对应的方式命名为R(草莓糖)或S(山梨糖)。
c. E/Z命名法:适用于存在双键的有机分子,根据优先级顺序,通过相互对应命名为E(德恩斯烯)或Z(沙通烯)。
有机化学9-立体化学

H
H
H
C
C
C
H
当第一和第三个碳原子分别连有不同基团时,分子内没有对称元素, 即分子为手性分子,因而有对映体存在,例如:
CH3 C H C C H H CH3 CH3 C C C H
18
CH3
联苯分子中两个苯环通过一个单键相连。当苯环邻位上连 有体积较大的取代基时,两个苯环之间的单键的自由旋转受 到阻碍,致使两个苯环不能处在同一个平面上。
图9.6 分子交替对称轴
4
非手性分子 凡具有对称面、对称中心、或交替对称轴的分子,都能与 其镜像重合,都是非手性分子。 手性分子 没有对称面,又没有对称中心,也没有交替对称轴的分子, 不能与其镜像重合,都是手性分子。 连有四个各不相同基团的碳原子称为手性碳原子(或手性 中心)用C*表示,凡是含有一个手性碳原子的有机化合物分 子不含有任何对称因素,因此具有手性,是手性分子。 分子的构造 指分子中原子的连接次序和连接方式。 构造异构 包括:碳链异构、官能团异构。 立体异构 分子中原子的空间排列方式不同所产生的异构。 对映体 互为镜像的两种构型的异构体,对映异构体属于立 体异构的一种异构。
COOH
COOH H OH H CH3 OH OH CH3 COOH H
HO
编号最小指和是命名 时序数最小
COOH
H
CH 3
CH 3
图9.9 乳酸对映体的透视式和费舍尔投影式
9
9.4.2 D/L标记法
旋光性物质的旋光方向、旋光角度可通过旋光仪测定。 但由于分子的构型与其旋光性无关,在过去的很长时间内, 人们无法确定手性分子的真实构型(绝对构型)。 D/L标记法 费舍尔提出了以(+)-甘油醛的构型为标准来标 记其它与甘油醛相关联的手性化合物相对构型的一种方法, 称为:D/L标记法。
有机化学中的立体化学

有机化学中的立体化学立体化学是有机化学中的重要分支,研究有机化合物中分子的空间结构和立体构型。
在有机化学中,分子的立体结构对于物质的性质和反应具有重要影响。
本文将介绍有机化学中的立体化学的基本概念、立体异构体、手性化合物以及应用等方面。
1. 立体化学的基本概念立体化学研究的是物质的三维结构,即分子中原子的排列方式。
分子的立体结构包括空间位置、原子的相对位置和键的属性。
有机化学中的立体化学是基于分子之间键的空间取向,包括空间立体异构体和手性化合物等。
2. 空间立体异构体空间立体异构体是指分子在空间中排列方式不同而化学性质相同的化合物。
其中最常见的是构象异构体和构型异构体。
构象异构体是由于分子的单键和双键的自由旋转而形成的异构体。
例如,正丁烷和异丁烷就是一对构象异构体,它们的分子式相同,但空间结构不同。
构型异构体是由于化学键的旋转或键的断裂而形成的异构体。
常见的构型异构体包括顺式异构体和反式异构体。
例如,顺式-1,2-二氯乙烷和反式-1,2-二氯乙烷就是一对构型异构体。
3. 手性化合物手性化合物是指分子在镜像超格操作下非重合的分子。
具有手性的化合物称为手性化合物(或不对称化合物),而没有手性的化合物称为非手性化合物(或称为对称化合物)。
手性是指一个物体不能与其镜像重合的性质。
在有机化学中,手性的原因除了分子的立体构型之外,还包括碳原子上的手性中心。
手性中心是指一个碳原子上连接着四个不同基团的情况。
手性化合物具有光学活性和对映体的特性。
同一手性化合物存在两个对映体,即左旋和右旋对映体。
这两种对映体的化学和物理性质相同,但旋光性质和酶的催化性质等却不同。
4. 应用立体化学在有机合成、药物设计和生物活性研究中具有重要应用。
一方面,立体化学可以指导合成路线的设计,提高合成产率和选择性。
另一方面,对药物的立体构型进行研究可以优化药物的活性、选择性和毒性。
例如,拟肽药物的立体构型对于其相互作用的特异性和选择性很关键。
有机化学中的立体化学

有机化学中的立体化学立体化学是有机化学中的重要分支,研究有机化合物中分子的空间结构和立体构型的相关规律。
随着分析仪器和实验技术的发展,立体化学在有机合成和药物研发等领域中具有重要的应用价值。
一、立体化学的基本概念立体化学关注有机分子中的空间结构和分子的各个部分的排列方式。
在立体化学中,我们关注的主要是手性和立体异构体。
1. 手性:手性是指一个分子无法与其镜像重叠的特性。
具有手性的分子称为手性分子,两个互为镜像的手性分子称为对映异构体。
例如,氨基酸和糖类等有机分子都有手性。
2. 立体异构体:立体异构体是指拥有相同分子式但不同立体结构的化合物。
立体异构体分为构象异构体和对映异构体两种。
构象异构体是由于分子的旋转或扭曲而产生的不同构型,它们在空间结构上有一定的自由度。
例如,环状化合物的立体异构体就是构象异构体,如环己烷的椅式和船式异构体。
对映异构体是由于分子的立体中心存在不对称而产生的异构体。
对映异构体在物理和化学性质上通常非常相似,但与其他对映异构体之间的相互作用却往往存在巨大差异。
拥有对映异构体的有机分子是手性分子,也是立体化学中研究的重点。
二、立体化学的研究方法立体化学的研究方法主要包括实验方法和理论方法。
实验方法主要包括X射线衍射、核磁共振(NMR)光谱、圆二色光谱、旋光度测量和质谱等技术。
这些技术通过测量和分析分子的物理性质来确定其立体结构,为揭示分子构形提供了重要的实验依据。
理论方法主要包括量子化学、分子力学和分子动力学等。
量子化学通过计算分子在不同构型下的能量和性质来预测和解释分子的立体结构、反应机理和性质。
分子力学和分子动力学通过计算机模拟方法模拟和预测分子的构型和动态行为。
三、立体化学的应用立体化学广泛应用于有机合成、药物研发和生物化学等领域,并取得了重要的研究成果。
1. 有机合成:立体化学对于有机合成的研究具有重要的指导意义。
在合成有机化合物的过程中,了解分子的立体结构能够预测和解释反应的立体选择性和对称性。
有机化学中的立体化学

有机化学中的立体化学有机化学是研究含碳化合物的化学性质和反应机理的一个重要分支领域。
在有机化学中,立体化学是一个至关重要的概念,它研究的是有机分子中空间构型的特征以及由此带来的化学性质和反应特点。
立体化学的研究不仅深化了对有机化合物结构与性质之间关系的理解,也为合成有机化合物提供了重要的理论指导。
本文将从有机化学中的立体化学角度出发,探讨立体化学的基本概念、立体异构体的分类、手性分子的性质以及立体化学在药物合成和生物活性研究中的应用等方面展开阐述。
立体化学是研究有机分子空间构型的科学,它关注的是分子中不同原子或基团之间的空间排布关系。
在有机化学中,分子的立体构型对其化学性质和反应具有重要影响。
立体异构体是指分子结构相同但空间排布不同的异构体,主要包括构象异构体和对映异构体两种。
构象异构体是由于键的旋转或双键构型不同而导致分子整体结构不同的异构体,如环状分子的椅式和船式构象;而对映异构体则是镜像对称的立体异构体,它们在物理性质上几乎完全相同,但在化学性质和生物活性上却可能有着截然不同的表现。
手性分子是立体化学中一个重要的概念,它是指不能与其镜像重合的分子,即具有手性的分子。
手性分子由手性中心或手性轴引起,具有左右旋性质。
手性分子的对映异构体是非重叠的,它们在化学性质和生物活性上表现出截然不同的特点。
手性分子的研究不仅在有机合成领域有着广泛的应用,还在药物合成和生物活性研究中发挥着重要作用。
许多药物分子都是手性的,对映异构体可能具有不同的药理活性,因此在药物设计和合成过程中需要考虑手性对药效的影响。
立体化学在有机合成中有着重要的应用价值。
通过合理设计手性诱导剂或催化剂,可以有效地控制反应的立体选择性,实现对映选择性合成。
立体选择性合成不仅可以提高合成反应的产率和选择性,还可以减少废弃物的生成,具有重要的环境保护意义。
立体选择性合成在药物合成、天然产物合成以及材料化学等领域都有着广泛的应用,为有机合成化学提供了重要的理论基础和方法支持。
高等有机化学第三章立体化学

contents
目录
• 立体化学基本概念 • 碳原子立体化学 • 手性分子结构与性质 • 立体化学在有机合成中应用 • 立体化学在药物设计中的应用 • 实验方法与技巧
01
立体化学基本概念
立体异构现象
立体异构体
分子式相同,但空间排列不同的化合 物,具有不同的物理和化学性质。
碳原子手性判断
对称面与对称中心
若一个分子中存在一个对称面或对称中心,则该分子不具有旋光性。对称面是指能将分子分为两个互为镜像的部 分的平面;对称中心是指能将分子中任意一点与另一点重合的点。
潜手性与非对映异构体
潜手性是指分子中某些基团可以围绕单键旋转而产生手性的现象。非对映异构体是指具有相同分子式、不同结构 且不能通过旋转操作相互转化的立体异构体。
感谢观看
。
化学性质差异
手性分子在化学反应中可能表 现出不同的反应速率和选择性
。
生物活性差异
许多生物活性物质都是手性的 ,其生物活性与手性密切相关 ,不同手性分子的生物活性可
能存在显著差异。
手性识别与拆分方法
手性识别
通过对手性分子的结构和性质进行分析,确定其手性特征。常见的方法包括X射线晶体学、圆二色光 谱、核磁共振等。
构型与构象
构型
分子中原子或基团在空间中的相 对位置关系,是固定的空间排列
。
构象
由于单键旋转而产生的不同空间排 列,是动态的空间排列。
构型与构象的关系
构型是构象的基础,构象是构型的 动态表现。不同的构型可能产生不 同的构象,而同一构型也可能产生 多种不同的构象。
02
碳原子立体化学
碳原子杂化类型
sp杂化
03
有机化学立体化学课件
(c)和(d)之间是何种关系?
30
将 (d) 在纸平面上旋转180,就和 (c) 完全相同。
CCOOOOHH
COCOOHOH
COOH
HH OOHH HHOO H H
H OH H
HHO OHH
HHO OHH
H OH H
CCOOOOHH
COCOOHOH
COOH
(c)
(d)
象 (c) 这种构型的分子, 虽然有两个手性中心, 但作 为分子整体来说是非手性的。 (c) 称为内消旋化合 物 (meso compound)。
8
问题:下列化合物哪些含手性碳原子?
1. CH3CHCH2CH3
*CH3
2.CH3CHClCH2CH3
**
3. CH3-CH-CH-CH2CH3 OH OH
有对称因素的分
有手性碳就一定有手性吗?
子没有手性
三、对称面和非手性分子
有对称面的分子与它的镜像能重合,因此没有对 映异构现象,称为非手性分子
对称因素
透视式是书写立体结构式常见的方法之一。
应注意它的书写方法,通常实线 “” 代表位 于纸平面上的键;虚线 “ ” (或“ ”) 代表 伸向纸平面后方的键,楔形线 “ ” 代表伸 向纸平面前方的键。
CO2H
CO2H
Cl
Cl
CH HC
I C Br Br C I
H3C OH
HO
CH3
H
H
13
(三) 费歇尔投影式 横前竖后
纯液体为密度 通常还要注明溶剂
比例常数 [α] 称为比旋光度。它是单位长度和单 位浓度下的旋光度。
如:[α]D20 = +98.3o (C, 0.05, CH3OH)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
顺反异构:
双键、环的邻位
沸点:偶极矩越大极性越大(顺式)分子间作用力越强沸点越高
熔点:越对称(反式)晶体排列越紧密熔点越高
反式一般稳定性大于顺式
光学异构;四个不同基团,累积二烯(丙二烯)、联苯型
※DL构型:与左旋右旋没有关系:
(-H在横键上,一位的在最上面【例如羧基等】取最下面的手性碳判断)
右旋(+):最初定义甘油醛羟基在右边(D)
左旋(-):最初定义甘油醛羟基在左边(L)
判断RS构型:H在横键上反过来读!!!
Fisher转90度:转换
180度:等同
任意对调两个基团:转换
固定一个转另外三个:等同
环:
两个手性碳:
四个同分异构体,六对关系:两对对映异构体,四对非对映异构体(差向异构体)一对对映异构体内消旋体
三个碳:
特殊:桥连会阻止一些的反转从而有手性
联苯——位阻越大,共面越不好——紫外吸收波长越小;;越难以分离有光学异构
应用:
空间位阻影响,使未产生外消旋体
反式加成:顺式烯烃的外消旋体,反式烯烃得内消旋体;炔烃得反式烯烃
环正离子中间体:X2,HOX:
碳正离子中间体:得外消旋体:H2O,HX,醇酚酸,Cl2
羟汞化还原
环氧乙烷的开环(酸性、碱性)
顺式加成:顺式烯烃的内消旋体,反式烯烃得外消旋体;炔烃得顺式烯烃
自由基反应:H2(催化加氢)
氧化反应:稀冷高锰酸钾、OsO4(顺式邻二醇),过酸环氧化反应(开环反式邻二醇)
硼氢化氧化
DA反应
离子对中间体:顺式加成(碳正离子来不及旋转):Cl2
E2:反式共平面
小环醚开环:SN2(酸性带有SN1性质,但不会形成完全的碳正离子,不是外消旋体):反式开环产物
Cram规则
包括羰基的还原:NaBH4、LiAlH4
其他的影响因素:空间位阻:
外侧位阻小
影响因素:空间位阻>反应产物稳定性(a、e键)
LiAlH4、NaBH4位阻影响不大
叔丁基铝锂空间位阻大
(1)空间位阻影响为主(2)空间位阻小,故以产物稳定性为主。
