第七章 电化学1
物化 第七章 电化学ppt课件

2. 电极过程
电化学过程必须在电化学池中实现,总是伴随着电化学反应和 化学能和电能相互转换发生。
原电池: 化学能转化为电能的装置;干电池,蓄电池,燃料电池等
系统对外做电功
G T,P 0
上一内容
下一内容
回主目录
返回
2. 电极过程
电解池: 电能转化为化学能的装置;电镀装置,电抛光装置等
Q m n M M z F
M-物质的摩尔质量
上一内容 下一内容 回主目录
返回
3. 法拉第定律
已知元电荷电量为
1 . 6 0 2 21 0C
1 9
F=L· e =6.022×1023 mol-1×1.6022×10-19 C
=96484.6 C· mol-1
≈96500 C· mol-1
上一内容
下一内容
回主目录
返回
2018/11/25
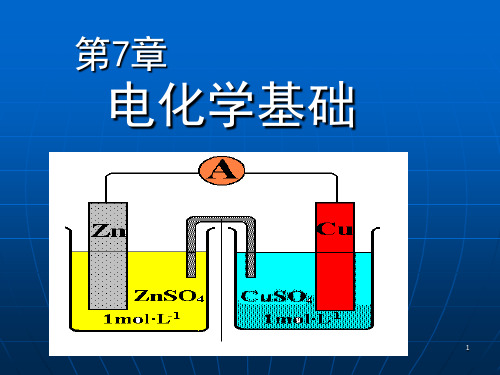
2. 电极过程 原电池 将化学能转化 为电能的装置
阳极(负极):
Zn(s)= Zn2+ (aq)+ 2e(氧化反应)
Zn
Cu
阴极(正极):
Cu2+(aq)+ 2e- = Cu(s) (还原反应)
上一内容
下一内容
回主目录
返回
2018/11/25
回主目录
返回
2018/11/25
3. 法拉第定律
Faraday’s Law
⒈ 在电极界面上发生化学变化物质的质量 与通入的电量成正比。 Q m 或 Q n
Michael Faraday ⒉ 通电于若干个电解池串联的线路中,当 (l791-1867) 所取的基本粒子的荷电数相同时,在各个 英国著名的自 学成才的科学家
第7章-电化学基础
标准电极电势的测定
例5 简述测定Pt | Fe3+(1.0), Fe2+(1.0)的标准电极电势的方法及结果。 解 将Pt | Fe3+(1.0), Fe2+(1.0)与标准氢电极组成电池。从实验电流的方向确定此待测电极为正极,标准氢电极为负极。 测得电动势为0.771V,则 EΘ= E+Θ - E- Θ = EΘFe3+ /Fe2+ - EΘH+/H2
2.电极反应
任何氧化还原反应都可拆分为两个氧化还原电对的半反应(半电池反应,电极反应): Fe3+ + e → Fe2+ Sn2+ → Sn4+ + 2e 氧化-还原反应的实质: 两个共轭电对之间的电子转移反应。
3.电对拆分:
2MnO4-+5H2C2O4 + 6H+ → 2Mn2+ + 10CO2 + 8H2O MnO4- + 8H+ + 5e → Mn2+ + 4H2O ① H2C2O4 → 2CO2 + 2H+ + 2e ② MnO4- / Mn2+; CO2 /H2C2O4
例1 用离子-电子法配平下列氧化还原反应: K2Cr2O7 + KI + H2SO4 →K2SO4 + Cr2(SO4)3+I2+H2O 解:先写成离子反应式: Cr2O72- + I- + H+→ Cr3+ + I2 + H2O 将离子反应式分成两个半反应: I- → I2(电对:I2 /I- ) Cr2O72- + H+ → Cr3+ + H2O(电对:Cr2O72- /Cr3+) 分别配平两个半反应: 2I- = I2 + 2e Cr2O72- + 14 H+ + 6e = 2Cr3+ +7 H2O
第七章 电化学

的量=(1.007+0.723-1.390)mmol=0.340mmol
Ag 迁出阳极区物质的量 0.340m m ol t ( Ag ) 0.470 发生电极反应的物质的 量 0.723m m ol
摩尔电导率(Λm ):
k m c
单位为 S. m2.mol-1
3. 电导、电导率和摩尔电导率
电导的测定
测定方法: 惠斯通(Wheatstone)电桥法
测定原理:
R3 R1 Rx R4 R3 1 1 Gx Rx R4 R1
电导池系数 Kcell
l 1 l 1 k Gx K cell As Rx As Rx
0.06997 S .m 1 2 1 0 . 02799 S . m . m ol 0.0025 m ol.dm3
m ( K 2 SO4 )
k K 2 SO4 cK 2 SO4
3. 电导、电导率和摩尔电导率
摩尔电导率与浓度的关系
1. 强电解质溶液
柯尔劳施(Kohlrausch)公式:
绪论 电化学(electrochemistry) 的定义: 电化学是研究化学现象和电现象之间的
关系及化学能和电能之间相互转 化规律的一门科学。
绪论
电解池(electrolytic cell)的定义: 电解池是将电能转变为化学能的装置
-
e
+
i 2+ Zn +2e → i
Zn
Cu → Cu2+ +2ei 2+ Zn +Cu →Zn+Cu2+
第七章 电化学

=
Asv+z+c+F Asv+z+c+F + Asv−
z−
c−F
因为溶液为电中性,所以 z+c+ = |z– |c– ,代入上式可得
t+
=
v+ v+ + v-
t-
=
vv+ + v-
t+,t–⎯⎯ 只与离子的运动速度有关, 与离子的价数及浓度无关。
但实际上凡能影响离子运动速度的因素均有可能影响迁移数
,如离子本性、溶剂性质、温度、浓度及电场强度等。
t+∞
=
ν
Λ∞
+ m,+
Λm∞
,
t-∞
=
ν
−
Λ∞ m,
-
Λm∞
25℃无限稀释水溶液中离子的摩尔电导率
阳离子 H+ Li+ Na+ K+
NH4+ Ag+ 1/2Mg2+ 1/3La3+
( ) Λ∞ m,+
S ⋅ m2 ⋅ mol−1
349.65×10-4
38.66×10-4
50.08×10-4
73.48×10-4
5. 电导测定的应用 (1) 计算弱电解质的解离度及解离常数
解离前 解离平衡时
解离常数
c
c(1−α )
0
0
cα
cα
( ) K\
=
cα c\
(1 − α )c c\
=
α2
(1−α )
⋅
c c\
κ
Λm = κ c
Λm α = Λm Λm∞ α
关于物理化学习题七章电化学

第七章电化学一•基本要求1. 理解电化学中的一些基本概念,如原电池和电解池的异同点,电极的阴、阳、正、负的定义,离子导体的特点和Faraday定律等。
2. 掌握电导率、摩尔电导率的定义、计算、与浓度的关系及其主要应用等。
了解强电解质稀溶液中,离子平均活度因子、离子平均活度和平均质量摩尔浓度的定义,掌握离子强度的概念和离子平均活度因子的理论计算。
3. 了解可逆电极的类型和正确书写电池的书面表达式,会熟练地写岀电极反应、电池反应,会计算电极电势和电池的电动势。
4. 掌握电动势测定的一些重要应用,女口:计算热力学函数的变化值,计算电池反应的标准平衡常数,求难溶盐的活度积和水解离平衡常数,求电解质的离子平均活度因子和测定溶液的pH等。
5 .了解电解过程中的极化作用和电极上发生反应的先后次序,具备一些金属腐蚀和防腐的基本知识,了解化学电源的基本类型和发展趋势。
二•把握学习要点的建议在学习电化学时,既要用到热力学原理,又要用到动力学原理,这里偏重热力学原理在电化学中的应用,而动力学原理的应用讲得较少,仅在电极的极化和超电势方面用到一点。
电解质溶液与非电解质溶液不同,电解质溶液中有离子存在,而正、负离子总是同时存在,使溶液保持电中性,所以要引入离子的平均活度、平均活度因子和平均质量摩尔浓度等概念。
影响离子平均活度因子的因素有浓度和离子电荷等因素,而且离子电荷的影响更大,所以要引进离子强度的概念和Debye-Hu ckel极限定律。
电解质离子在传递性质中最基本的是离子的电迁移率,它决定了离子的迁移数和离子的摩尔电导率等。
在理解电解质离子的迁移速率、电迁移率、迁移数、电导率、摩尔电导率等概念的基础上,需要了解电导测定的应用,要充分掌握电化学实用性的一面。
电化学在先行课中有的部分已学过,但要在电池的书面表示法、电极反应和电池反应的写法、电极电势的符号和电动势的计算方面进行规范,要全面采用国标所规定的符号,以便统一。
第七章_电化学汇总

第七章 电化学 (一)在298.2K时,以Pt为电极电解CuSO4溶液。在阴极有Cu析出,阳极上放出O2。若以0.2000A的电流通电30min于CuSO4溶液,试计算: ⑴在阴极上析出多少铜? ⑵阳极上放出O2的体积。 已知此温度时水的饱和蒸气压为23.76mmHg。 分析 该题主要讨论在电池中发生电极反应的物质的量与通过的电量之间的定量关系,应通过法拉第定律加以解决。 解题 ⑴ 阴极上析出铜
⑵阳极上析出O2。
=0.02984g 则氧气的体积为 讨论 应用法拉第定律解题时应注意式中M及z的取值。如对于阳极反应,则z=2;若取,则z=4,两种取法M/z的比值是相同的,即M和z的取值必须和相对应的电极反应相一致。 (二)已知25℃时,0.02mol·dm-3KCl溶液的电导率为0.2768S·m-1。—电导池中充以此溶液,在25℃时测得其电阻为453Ω。在同一电导池中,装入同样体积的浓度为0.555g·dm-3的CaCl2溶液,测得的电阻为1050Ω,试计算: ⑴ 电导池常数; ⑵ CaCl2溶液的电导率; ⑶ CaCl2溶液的摩尔电导率。 分析 本题重点考查有关电导、电导率、摩尔电导率、电导池常数等物理量之间的定量关系,要求能熟练运用公式,实现几个物理量之间的互求。 解题 ⑴ 求电导池常数
则
⑵ 求CaCl2溶液的电导率 由于电导池不变,故仍采用上述电导池常数数据
⑶ 求CaCl2溶液的摩尔电导率 查表得 则
(三)在25℃时CO2的压力为101.325kPa时,1dm3水中能溶解0.8226 dm3的CO2。如果空气中的CO2的含量为0.50%(体积百分数),且CO2溶于水后仅产生H+和。已知碳酸的一级电离标准平衡常数为4.7 × 10-7,,。试求25℃时,与101.32kPa空气完全平衡时的蒸馏水的电导率。 分析 根据题意可知,如能求得与101.325kPa空气呈平衡时蒸馏水中C02(即H2CO3)的浓度以及摩尔电导率。
第七章 电化学
第一次课: 课程名称:物理化学 本课内容: §7.1 离子的迁移 §7.2 电解质溶液的电导 授课时间:90 分钟 一、教学目的 通过本节 90 分钟的教学,使学生了解电解质溶液的导电机理、熟练掌握法拉第定 律、离子的迁移数以及电导、电导率、摩尔电导率的概念,掌握电导和电导率的测定方 法,使学生对电化学基本知识具有初步的认识。 二、教学意义 在日常生活和生产实际中经常用到电化学知识,本节课是电化学部分的理论基础, 通过本节基本概念和基本理论的讲述,能够为学生在后面几节的理论学习打下基础,使 后面的知识更易被接受。 三、教学重点 (1)离子的迁移数; (2)电导、电导率、摩尔电导率; (3)电导的测定; (4)电导率和摩尔电导率随浓度的变化; (5)离子独立运动定律及离子摩尔电导率; 四、教学难点 (1)离子的迁移数; (2)离子独立运动定律及离子摩尔电导率; 五、教学方式 以电子课件为主的课堂讲授。 六、讲授内容 (1)离子的迁移 ① 电解质溶液的导电机理 ② 法拉第定律 ③ 离子的迁移数 (2)电解质溶液的电导 ① 电导、电导率、摩尔电导率 ② 电导的测定 ③ 电导率和摩尔电导率随浓度的变化 ④ 离子独立运动定律及离子摩尔电导率 七、讲授方法 §7.1 离子的迁移 首先从原电池和电解池的构造和原理入手,引出以下内容: (1)电解质溶液的导电机理
5
I
d e f
=
1 2
∑
m
B
z
2 B
B
γ±与I 的经验关系为
ln γ ± = − A ' I
由上式看出,在稀溶液中,影响电解质离子平均活度系数γ±的,不是该电解质离子 的本性,而是与溶液中所有离子的浓度及价数有关的离子强度。 §7.5 强电解质溶液理论简介 本部分知识作为简单介绍,使学生了解一些基本的理论规律。 (1)离子氛模型及德拜-尤格尔极限公式 强电解质溶液与理想溶液的偏差,主要是由于正、负离子之间的静电引力所引起的。 他们分析离子间静电引力和离子热运动的关系,提出了强电解质溶液中的“离子氛”模 型。 导出了离子活度系数的公式, 极限公式能适用的范围是离子强度大约为 0.01mol·kg-1 以下的稀溶液。当溶液的离子强度加大时,虚线与实线偏离渐趋明显,需要对德拜—尤 格尔极限公式加以修正,或提出新的理论。 (2)不对称离子氛及德拜-尤格尔-盎萨格电导公式。 1927 年,盎萨格(Onsager)将德拜—尤格尔理论应用到有外加电场下的电解质溶液, 从理论上推导出了摩尔电导率Λm与浓度平方根的线性关系,形成了德拜-尤格尔-盎萨格 电导公式。 八、时间分配 本次课程全部用时 90 分钟,分配如下: §7.3 电导测定的应用示例 30 分钟 §7.4 强电解质的活度和活度系数 40 分钟 §7.5 强电解质溶液理论简介 20 分钟 九、讨论、思考与作业 讨论、思考: 奥斯特瓦尔德(Ostwald)稀释定律是否适用于强电解质溶液?为什么? 作业:习题:9、13 十、参考资料 《物理化学简明教程》 (第四版) ,印永嘉、奚正楷等,高等教育出版社 《物理化学简明教程例题与习题》印永嘉、奚正楷等 《物理化学》 (第五版) ,傅献彩等编(南京大学) 《物理化学》 胡英主编(华东理工大学) Physical Chemistry. 5th ed., P. W. Atkins.,Oxford University Press 物理化学解题指南,李文斌 主编,天津大学出版社 十一、教学后记 电导测定的应用和强电解质的活度和活度系数是本次课的重点内容,这充分体现了 物理化学课不仅是一门理论性很强的课程,同时也是一门实验课程的特点。在这节课中 理解强电解质的活度和活度系数概念是一大难点,在授课中应多根据实际讲解,使学生 熟练的掌握这些概念。
物理化学第七章电化学
第七章 电化学7.1 电极过程、电解质溶液及法拉第定律原电池:化学能转化为电能(当与外部导体接通时,电极上的反应会自发进行,化学能转化为电能,又称化学电源)电解池:电能转化为化学能(外电势大于分解电压,非自发反应强制进行) 共同特点:(1)溶液内部:离子定向移动导电(2)电极与电解质界面进行的得失电子的反应----电极反应(两个电极反应之和为总的化学反应,原电池称为电池反应,电解池称为电解反应)不同点:(1)原电池中电子在外电路中流动的方向是从阳极到阴极,而电流的方向则是从阴极到阳极,所以阴极的电势高,阳极的电势低,阴极是正极,阳极是负极;(2)在电解池中,电子从外电源的负极流向电解池的阴极,而电流则从外电源的正极流向电解池的阳极,再通过溶液流到阴极,所以电解池中,阳极的电势高,阴极的电势低,故阳极为正极,阴极为负极。
不过在溶液内部阳离子总是向阴极移动,而阴离子则向阳极移动。
两种导体:第一类导体(又称金属导体,如金属,石墨);第二类导体(又称离子导体,如电解质溶液,熔融电解质)法拉第定律:描述通过电极的电量与发生电极反应的物质的量之间的关系 F z Q ξ==F n 电F -- 法拉第常数; F = Le = 96485.309 C/mol = 96500C/mol Q --通过电极的电量;z -- 电极反应的电荷数(即转移电子数),取正值; ξ--电极反应的反应进度;结论: 通过电极的电量,正比于电极反应的反应进度与电极反应电荷数的乘积,比例系数为法拉第常数。
依据法拉第定律,人们可以通过测定电极反应的反应物或产物的物质的量的变化来计算电路中通过的电量。
相应的测量装置称为电量计或库仑计coulometer,通常有银库仑计和铜库仑计 。
7.2 离子的迁移数1. 离子迁移数:电解质溶液中每一种离子所传输的电量在通过的总电量中所占的百分数,用 tB 表示1=∑±=-++t 或显然有1:t t离子的迁移数主要取决于溶液中离子的运动速度,与离子的价数无关,但离子的运动速度会受到温度、浓度等因素影响。
物理化学 第七章 电化学
§7-1 电解质溶液的导电性质
一、电解质溶液的导电机理 1.导体: 能够导电的物体叫导体。 第一类: 靠导体内部自由电子的定向运动而导电的物体
如
金属导体
石墨
性质:
A.自由电子作定向移动而导电
B.导电过程中导体本身不发生变化 C.温度升高,电阻也升高
D.导电总量全部由电子承担
第二类
靠离子的定向运动而导电物体 如 性质: A.正、负离子作反向移动而导电 B.导电过程中有化学反应发生 C.温度升高,电阻下降 电解质溶液 熔融电解质
第七章
电 化 学
研 究
电现象 电 能
→ ←
→ ←
化学现象
化学能
电化学装置有两种
电解池 原电池
电解池: 电能转化为化学能的装置
原电池: 化学能转化为电能的装置 电化学装置的组成
电解质溶液:实现转化的物质基础 电极:实现转化的地点(界面处)
电化学在工业上的应用:
★电解 精炼和冶炼有色金属和稀有金属; 电解法制备化工原料;电镀法保护和美化 金属;还有氧化着色等。 ★电池 汽车、宇宙飞船、照明、通讯、 生化和医学等方面都要用不同类型的化学 电源。 ★ ⒊电分析 ★ ⒋生物电化学
令:K为电导池常数
GK
l K A
l G A
l:导体的长度或电解质溶液中两极间的距离; A:导体的截面积或电解质溶液中电极的极面积 ρ:电阻率,Ω·m 影响电导率的因素: 电解质的种类 电解质的浓度 温度
2.摩尔电导率
m
定义: 将一摩尔电解质溶液置于相距一米的两 平衡电极之间,此时,电解质溶液的导电能力 为摩尔电导率。 摩尔电导率相当于固定了电解质的量都是 1mol,对于浓度不同的电解质,当物质量都 是1mol时,在相距一米的两平衡电极之间, 溶液的体积是不同的
电化学原理-第七章-气体电极过程
则: H 平
常数
RT F
ln
c OH
1
RT
F
ln
jc
减小59mV
pH值增大 一个单位
不变时
(7.21)
与实验结果吻合
2、迟缓放电机理的实验依据
当酸浓度很低时,由于 1效应,使酸的浓度 变化时, 不H 随之改变。(图7.2现象)
H
常数 1
RT F
ln
c H
1
1
RT
F
ln
jc
两项影响抵消
低过电位金属:
c 0.001mol / L
(3)溶液组成的影响
在浓的纯酸溶液中, 析氢过电位随氢离子 浓度升高而降低。
高过电位金属:
c 0.5 ~ 1.0mol / L
低过电位金属:
c 0.001mol / L
(3)溶液组成的影响
同一过电位下,高浓 度对应的电流密度 (反应速度)比低浓 度高很多。
析氢过电位 a b log j (7.1)
0.1~ 0.14V 电流密度
j 1A / cm2时的析氢过电位 与金属材料的性质、表面状态、 溶液组成、温度有关
二、析氢过电位及其影响因素
在很低的电流密度下有:
析氢过电位
j (7.2)
电流密度
j 1A / cm2时的析氢过电位 与金属材料的性质、表面状态、 溶液组成、温度有关
1
常数
2RT F
ln( a)
RT F
ln
cH
(3.50)
2、迟缓放电机理的实验依据
当酸浓度较高时,可忽略 效1 应,使 随H cH 升高而降低。(图7.2现象)
H
常数 1
