工程热力学第四章理想气体热力过程..
工程热力学(第五版)第4章练习题

第4章 理想气体热力过程及气体压缩4.1 本章基本要求熟练掌握定容、定压、定温、绝热、多变过程中状态参数p 、v 、T 、∆u 、∆h 、∆s 的计算,过程量Q 、W 的计算,以及上述过程在p -v 、T -s 图上的表示。
4.2 本章重点结合热力学第一定律,计算四个基本热力过程、多变过程中的状态参数和过程参数及在p -v 、T -s 图上表示。
本章的学习应以多做练习题为主,并一定注意要在求出结果后,在p -v 、T -s 图上进行检验。
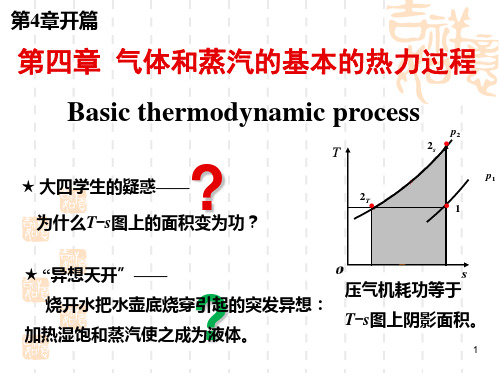
4.3 例 题例1.2kg 空气分别经过定温膨胀和绝热膨胀的可逆过程,如图4.1,从初态1p =9.807bar,1t =300C ο膨胀到终态容积为初态容积的5倍,试计算不同过程中空气的终态参数,对外所做的功和交换的热量以及过程中内能、焓、熵的变化量。
图4.1解:将空气取作闭口系对可逆定温过程1-2,由过程中的参数关系,得bar v v p p 961.151807.92112=⨯==按理想气体状态方程,得111p RT v ==0.1677kg m /3 125v v ==0.8385kg m /312T T ==573K 2t =300C ο气体对外作的膨胀功及交换的热量为1211lnV V V p Q W T T ===529.4kJ 过程中内能、焓、熵的变化量为12U ∆=0 12H ∆=0 12S ∆=1T Q T=0.9239kJ /K 或12S ∆=mRln12V V =0.9238kJ /K 对可逆绝热过程1-2′, 由可逆绝热过程参数间关系可得kv v p p )(211'2= 其中22'v v ==0.8385kg m /3 故 4.12)51(807.9'=p =1.03barRv p T '''222==301K '2t =28C ο气体对外所做的功及交换的热量为)(11)(11'212211T T mR k V p V p k W s --=--==390.3kJ 0'=s Q过程中内能、焓、熵的变化量为kJ T T mc U v 1.390)(1212''-=-=∆或kJ W U 3.390212'-=-=∆kJ T T mc H p 2.546)(1212''-=-=∆ '12S ∆=0例2. 1kg 空气多变过程中吸取41.87kJ 的热量时,将使其容积增大10倍,压力降低8倍,求:过程中空气的内能变化量,空气对外所做的膨胀功及技术功。
第四章 理想气体的热力过程

对象:1) 参数( p , T , v , u , h , s ) 变化2) 能量转换关系, q , w , w t 方法1)抽象分类2) 可逆过程(不可逆再修正)pv sTn基本过程第四章气体和蒸汽的基本热力过程研究热力学过程的依据2) 理想气体ppv v() ()c pv RTc c R k c u f T h f T =−====3)可逆过程t w pdv w vdp ==−∫∫q Tds=∫1) 热一律tq du w dh w δδδ=+=+sw z g c h q +Δ+Δ+Δ=221稳流研究热力学过程的步骤1) 确定过程方程------该过程中参数变化关系() , () , ()p f v T f p T f v ===5) 计算w ,w t ,q4) 求s h u ΔΔΔ , , 3) 用T -s 与p -v 图表示2) 根据已知参数及过程方程求未知参数一、气体的基本热力过程§4-1理想气体可逆多变热力过程9定容过程9定压过程9定温过程9定熵过程理想气体的多变过程(Polytropic process)过程方程constpv n=n 是常量,每一过程有一n 值nnv v p p )(2112=12112)(−=n v v T T nn p p T T 11212)(−=二、理想气体可逆多变过程三、多变指数;2112nnv v p p const pv ⎟⎟⎠⎞⎜⎜⎝⎛=⇒=⎟⎠⎞⎜⎝⎛⎟⎠⎞⎜⎝⎛=2112lnv v p p n12()1Rw pdv T T n ==−−∫t w nw=v 2121()()1Rq u w c T T T T n =Δ+=−−−−四、理想气体n w ,w t ,q 的计算v 21v 21n 21()()()(11R n -kc T T c T T c T T n n =−−=−=−−−nc 多变过程比热容constpv n=(1)当n = 0C p const pv =⇒=0n v p c kc c ==(2)当n = 1CT const pv =⇒=1n c =∞多变过程与基本过程的关系(3)当n = k kpv const s C =⇒=n 0c =(4)当n = ∝1np v const v C=⇒=n vc c =n v1n -k c c n =−p Ts v nconst pv n =p T s vpv RT =n v 111k -n c c n=−基本过程是多变过程的特例isothermal isentropicisobaricisochoricn =p ()?dTds=T斜率上凸?下凹?p Tds c dT vdp=−sTv pp T c =n =ppn =v ()?dT ds=T 斜率上凸?下凹?v Tds c dT pdv =+sTv ppv T c =n =pp v c c >n =∞n =∞vvp p()dT Tds c =0n =T ()?dp dv =p 斜率理想气体过程的p -v ,T -s 图上凸?下凹?pv C =sTv p ppv =−n =pT 0pdv vdp +=n =∞n =∞vv1n =TT n =0n =理想气体过程的p -v ,T -s 图sTvp pn =ps n =∞n =∞vv1n =TT n =n k=s n k=s ?sdp dv ⎛⎞=⎜⎟⎝⎠C pv k=kp v −0)(=kpv d 10k kkpv dv v dp −+=T ()dp p dv v =−0n =理想气体基本过程的p -v ,T -s 图sTvp pn =pn =∞n =∞vv1n =TT n =n k=sn k=s kk p p T T 11212)(−=Tq ds Rδ=(2) 不仅, s 处处相等0=Δs 0=ds 绝热可逆0=ds s说明:(1) 不能说绝热过程就是等熵过程,必须是可逆绝热过程才是等熵过程。
第四章理想气体的基本热力过程解析

J 由实验确定
焦耳和汤姆逊分别做实验
焦汤实验
保持p1,T1不变 ,改变开度,得到 不同出口状态,连 成定焓线,表示在 p-T图上,曲线的 斜率就是焦汤系数 T J p h
焦汤实验
保持p1,T1不变 ,改变开度,得到 不同出口状态,连 成定焓线,表示在 pT图上,曲线的 斜率就是焦汤系数
三、冷却去湿过程
d1 h1 d4 h4 q d -d h 1 4 水
h1 h4 d1 d4 h水 q q h1 h4 d1 d4 h水
2
h
1
2 1 2'
2’ 1 3
4 d
§4.3 湿空气的热力过程
四、绝热混合过程 d1 d3 d2 ma2 ma1h1 ma 2 h2 ma3h3
T2
已知p1,T1,T2 , 求p2 若是空气,查附表6
p2 p1exp(
0 0 sT s T1 2
R
)
理想气体变比热 s 过程
p2 p1exp(
0 0 sT s T1 2
R
)
p2 p1
exp( exp(
0 sT 2
R 0 sT 1 R
) )
p R (T2 ) p R (T1 )
T
T J p h
h=Const p
焦汤实验曲线
T
最大转变温度 Tmax Maximum inversion temperature 转变曲线 Inversion line
J 0
h=Const
J 0
最小转变温度
Tmin
J 0
p
焦汤系数的表达式
工程热力学第4章气体和蒸汽的基本热力过程
(isothermal process; constant temperature process)
n pv const. 定熵(可逆绝热)过程
(isentropic process; reversible adiabatic process)
n v const. 定容过程
1
1
T1 p1 T2 p2
理想气体,定比热,可逆绝热过程。
13
二、过程的 p – v 图及T - s 图
p v
p v
cp cV
p v
(n 0) 0
p n p v n v
p
(n 1)
(n )
n
p v
p
v
.
n=0
n↑
n=1
n=±∞ n=κ
o
v
T T s cs
h cp
T2 T1
T2 T1
2
Tds
1
w
2
pdv
1
2 1
pvdv v
RgT1 ln
v2 v1
wt
2
vdp
1
2 1
vpdv p
RgT1
ln
p2 p1
q u w h wt q w wt 12
4–3 理想气体等比熵(可逆绝热)过程
一、过程方程
Tds δq dh vdp 0 vdp dh cpdT
4–1 研究热力过程的目的及一般方法
一、基本热力过程 (fundamental thermodynamic process)
近似直线
在ln p-lnV 图上有 ln p = -nlnV + c pvn 常数 4
第4章-理想气体的热力性质和热力过程

m
pRgVT1w
1
Ts
0.098MPa36m3 0.28[7kJ/(kgK)]
2
1 73K
1 308K
5.117kg
9
第二节 理想气体的比热容
10
• 热容:指工质温度升高1K所需的热量。
C Q dT
• 比热容:1kg(单位质量)工质温度升高1K所
k
nn1n2n3 ni nk ni i 1
• 第 i 种组元气体的摩尔分数 (mole fraction of a mixture):
xi
ni n
(433)
xi nni nni 1
各组元摩 尔分数之
和为1
37
换算关系
mnM
mi niMi
• 根据热力学第一定律,任意准静态过程:
q d u p d v d h v d p
u是状态参数: uf(T,v)
du(T u)vdT(uv)Tdv
q( T u)vdT[p( u v)T]dv
单位物量的物质 在定容过程中温 度变化1K时热 力学能的变化值
q u
• 定容: dv0 cv (dT)v (T)v 12
3
第一节 理想气体及其状态方程
4
• 理想气体 ideal gas定义:
– 遵循克拉贝龙(Clapeyron)状态方程的气体,
即基本状态参数 p、v、T 满足方程
pv 常数 T 的气体称为理想气体。
理想气体的基本假设:
• 分子为不占体积的弹性质点 uu(T)
• 除碰撞外分子间无作用力
理想气体是实际气体在低压高温时的抽象
工程热力学第四章

2、研究热力过程的一般方法
实际过程是一个复杂过程,很难确定其变化 规律,一般需要作些假设: (1) 根据实际过程的特点,将实际过程近似地概括为 几种典型过程:定容、定压、定温和绝热过程; (2)不考虑实际过程中不可逆的耗损,视为可逆过程; (3)工质视为理想气体; (4)比热容取定值。
3、分析热力过程的一般步骤
1 可知在p 由过程方程得 p ∝ κ 可知在p-v图上是一高次双曲线 v
定熵过程曲线的斜率是 ∂p = −κ p v ∂v s 定温过程曲线的斜率是
p ∂p =− v ∂v T
为什么? 为什么?
问题: 问题:定熵过程曲线 和定温过程曲线哪根 更陡? 更陡?
如
二、多变过程分析
1.多变过程的p 图和T 1.多变过程的p—v图和T-s图 p
n=+∞ n= —∞
T
n=1 n=0 n=0
n=1
n= —∞
v
s
2.内能、 2.内能、焓的变化量 内能 内能变化量 焓的变化量 3. 功和热 量 容 积 功
多变过程中容积功的计算
∆u = u2 − u1 = cv ∆T ∆h = h2 − h1 = c p ∆T
p
T2 T1
T2 > T1
pv = R T
1
2
T2 v2 = T1 v1
v
在p-v图上,等温 线的右上侧为温 度升高的方向。
4、在p-v图上熵增加的方向
p
s1
s2
s2 > s1
p2 v2 ∆s = cv ln + c p ln p1 v1 v2 ∆s = c p ln v1
1
2
v
在p-v图上,等熵 线的右上侧为熵 线的右上侧为熵增 加的方向。
热力学-理想气体的热力过程
pv p1v1 RgT 常量
P-v,d-s图
熵
ds R dv R dp
v
p
s2
s1
Rg
ln
v2 v1
Rg ln
p1 p2
理想气体T 过程能量转换
容积变化功
w12
2 1
pdv
RgT1
ln
v2 v1
RgT1 ln
p1 p2
轴功 热量
2
2
ws 1 vdp 1 pdv
绝热
adiabatic isentropic
说明: (1) 不能说绝热过程就是等熵过程,
必须是可逆绝热过程才是等熵过程。
Reversible adiabatic
(2) 不仅 s 0 , ds 0
s 处处相等
理想气体 s 的过程方程
ds 0
理想气体
k cp cv
当 k const
pT sv
T
sv
p T p
v
s
p-v,T-s图练习(3)
膨胀、升温、吸热的过程,终态在哪个区域?
pT s v
T
sv
p T p
v
s
思考题
在u-v图上画出 v 加热, p 加热, T 加热
s 膨胀,定比热,理想气体
u
q=u+w
v 加热
v
思考题
p
加热
du dv p
c?v
cv=常量
稳定流动
wk,wp=0
q12 u2 u1 cv (T2 T1)
2
ws 1 vdp v( p1 p2 )
第四章 理想气体的热力过程
(T1
T2 )
wt nw
n( n 1
p1v1
p2v2 )
n n 1
Rg
(T1
T2 )
q
u
w
c
Rg
(T1
T2
)
nk n 1 cV (T2 T1)
➢ 多变比热容及多变指数
q cn (T2 T1)
q
nk n 1
cV
(T2
T1)
cn
nk n 1
cV
n cn cp cn cv
p const.
pv
RgT
p2 p1,
v2 T2 v1 T1
u cV (T2 T1)
h cp (T2 T1)
s p
cp
ln
T2 T1
Rg ln
p2 p1
cp
ln
T2 T1
cp ln
v2 v1
➢ 能量转换
dp 0
wt
p2 vdp 0
p1
w
v2 v1
pdv
p(v2
v1)
➢初、终态参数的关系
n
p2 p1
v1 v2
n1
T2 T1
v1 v2
n1
T2 T1
p2 p1
n
u cV (T2 T1)
h cp (T2 T1)
s
c
p
ln
T2 T1
Rg ln
p2 p1
➢能量转换
w
2
pdv
1
p1v1n
2 dv 1 vn
1( n 1
p1v1
p2v2 )
1 n 1
Rg
第四章 理想气体的热力过程
热工流体第四章 理想气体的基本热力过程
第一节定容过程
气体比体积保持不变的热力过程称为定容过程。
1、过程方程式
v=c(4-1)
2、状态方程
或 (4-2)
3、过程曲线
图4-1
4、 、 的计算
理想气体的热流学能,焓是温度的单值函数
(4-3)
(4-4)
5、容积变化功与传热量
定容过程比体积变化量Δv=0,所以定容过程体积变化功为
及q=0(4-19)
根据熵的定义,可逆绝热过程有
(4-20)
即
s=c(4-21)
所以可逆绝热过程为定熵过程。
1、过程方程式
(4-22)
κ---绝热指数,理想气体绝热指数,也等于理想气体比热容比。
2、状态方程
(4-23)
(4-24)
(4-25)
3、过程曲线
图4-4
4、 、 的计算
(4-26)
(4-27)
当n=0时, ,为比定压热容;
当n=1时, ,为比定温热容;
当n=κ时, ,为比定熵热容;
当n= 时, ,为比定容热容。
例空气在压气机中被压缩,初始状态为V1=0.052m3,p1=0.1Mpa,t1=40°c,可逆多变压缩至p2=0.565Mpa,V2=0.013 m3,然后排到储气罐,求多变过程的多变指数n,压缩终温t2,容积变化功与换热量,以及压缩过程中气体热力学能、焓的变化值。
当n=1时, ;
当n=κ时, ;
当n= 时, 。
2、状态方程
(4-32)
(4-33)
(4-34)
3、过程曲线
图4-5
4、 、 的计算
(4-35)
(4-36)
5、多变过程容积变化功与传热量
第四章 理想气体的热力过程课件
k dv dp vp
两边积分
k
dv v
dp p
k ln(v) ln( p) c
k ln(v) ln( p) c ln(vk ) ln( p) c
ln( pvk ) c pvk c
显然:
k
p2 p1
v2 v1
代入 pv=RT 得:
1 k (T2 T1)
因为 cv=R/(k-1),所以这个式子 也可以变为
w=cv(T1 -T2 )
R k 1 (T1
T2 )
RT1 k 1
1
T2 T1
k 1
RT1 k 1
1
p2 p1
k
关于热量q 因为绝热所以热量为零
dv dp dT vpT
得: dp p
dv T
v
4.u,h,s变化量
5.功与热
Δu=Δh=0
s
R ln
v2 v1
R
ln
p1 p2
①闭口系
2
w pdv
1
2 RT dv 1v
2
RT
1
dv v
RT
ln
v2 v1
q wt
四、绝热过程
1.过程方程 绝热就必然有:dq= 0 则: δq /T= 0 因 ds=δq/T 所以 ds= 0 s=const 故又称定熵过程。 2.状参关系式 根据熵的计算式:
因Δs= 0
ds
cp
dv v
