工程热力学复习参考题-第四章
工程热力学沈维道第4章 习题提示和答案

题 4-12 附图
提示和答案: 在 p − v 图和 T − s 图上, 随顺时针移动, n 增大。 可逆绝热膨胀 Δs1− 2s = 0 , 定温膨胀 Δs = 0.462kJ/(kg ⋅ K) ,多变膨胀 Δs = 0.1923kJ/(kg ⋅ K) 。 4-14 试证明理想气体在 T − s 图(如图 4-20)上的任意
可见温度变化范围很大时按定值比热容计算误差太大。
23
第四章 气体和蒸汽的热力过程
4-10
一体积为 0.15 m 3 的气罐,内装有 p1 = 0.55 MPa,t1 = 38 °C 的氧气,今对氧气
加热,其温度、压力都将升高,罐上装有压力控制阀,当压力超过 0.7 MPa 时阀门自动打 开,放走部分氧气,使罐中维持最大压力 0.7 MPa 。问当罐中氧气温度为 285 ℃时,共加 入多少热量?设氧气的比热容为定值, cV = 0.667 kJ/(kg ⋅ K) , c p = 0.917 kJ/(kg ⋅ K) 。 提示和答案: 初终态氧气氧气的质量 m1 =
wt , s =
4-6
1 M
( H m,1 − H m,2 ) = −138.21 × 103 J/kg 。
3 kg 空气从 p1 = 1 MPa 、 T1 = 900 K ,可逆绝热膨胀到 p2 = 0.1 MPa 。设比热
容为定值,绝热指数 κ =1.4,求: (1)终态参数 T2 和 v2 ; (2)过程功和技术功; (3) ΔU 和
的技术功
wt = − ∫ vdp = ∫ pdv + ( p1v1 − p2 v2 ) ,将过程功 ∫ pdv 的各关系式代入, p v v
v2
1
p2
1
v2
工程热力学(第五版)第4章练习题

第4章 理想气体热力过程及气体压缩4.1 本章基本要求熟练掌握定容、定压、定温、绝热、多变过程中状态参数p 、v 、T 、∆u 、∆h 、∆s 的计算,过程量Q 、W 的计算,以及上述过程在p -v 、T -s 图上的表示。
4.2 本章重点结合热力学第一定律,计算四个基本热力过程、多变过程中的状态参数和过程参数及在p -v 、T -s 图上表示。
本章的学习应以多做练习题为主,并一定注意要在求出结果后,在p -v 、T -s 图上进行检验。
4.3 例 题例1.2kg 空气分别经过定温膨胀和绝热膨胀的可逆过程,如图4.1,从初态1p =9.807bar,1t =300C ο膨胀到终态容积为初态容积的5倍,试计算不同过程中空气的终态参数,对外所做的功和交换的热量以及过程中内能、焓、熵的变化量。
图4.1解:将空气取作闭口系对可逆定温过程1-2,由过程中的参数关系,得bar v v p p 961.151807.92112=⨯==按理想气体状态方程,得111p RT v ==0.1677kg m /3 125v v ==0.8385kg m /312T T ==573K 2t =300C ο气体对外作的膨胀功及交换的热量为1211lnV V V p Q W T T ===529.4kJ 过程中内能、焓、熵的变化量为12U ∆=0 12H ∆=0 12S ∆=1T Q T=0.9239kJ /K 或12S ∆=mRln12V V =0.9238kJ /K 对可逆绝热过程1-2′, 由可逆绝热过程参数间关系可得kv v p p )(211'2= 其中22'v v ==0.8385kg m /3 故 4.12)51(807.9'=p =1.03barRv p T '''222==301K '2t =28C ο气体对外所做的功及交换的热量为)(11)(11'212211T T mR k V p V p k W s --=--==390.3kJ 0'=s Q过程中内能、焓、熵的变化量为kJ T T mc U v 1.390)(1212''-=-=∆或kJ W U 3.390212'-=-=∆kJ T T mc H p 2.546)(1212''-=-=∆ '12S ∆=0例2. 1kg 空气多变过程中吸取41.87kJ 的热量时,将使其容积增大10倍,压力降低8倍,求:过程中空气的内能变化量,空气对外所做的膨胀功及技术功。
《工程热力学》第四章 总结及例题
U13 Q13 W13 649.4kJ 316.62kJ 965.52kJ
H13 nCpm T3 T1 U pV 965.52kJ 299.855 619.393 kPa 2m3 1604.6kJ
S13
n CVm
ln
T3 T1
R ln V3 V1
500mol 3 4.1868J/(mol K) ln 144.26K 4.56kJ/K 298K
Pa
10
1-2过程:由25 ℃,2m3 可逆绝热膨胀到1 atm 2-3过程:定温可逆压缩回到2 m3
理想气体等温过程 :热量=膨胀功=技术功
Q
Q12
Q23
Q23
WT 23
nRT
ln
V3 V2
500
mol 8.314
5
J/(mol K) 144.26
K ln
2 m3 5.906 m3
649.4 kJ
7
q h wt wt q h wt q (ha hb )
考虑过程等压 c a
a
q h c vdp
q ha hc
技术功:
wt q (ha hb )
8
例2 0.5 kmol某种单原子理想气体 ,由25 ℃,2m3 可逆绝热膨 胀到1 atm,然后在此状态的温度下定温可逆压缩回到2 m3。1) 画出各过程的p-v图及T-s图;2)计算整个过程的Q,W,ΔU, Δ H 及ΔS。
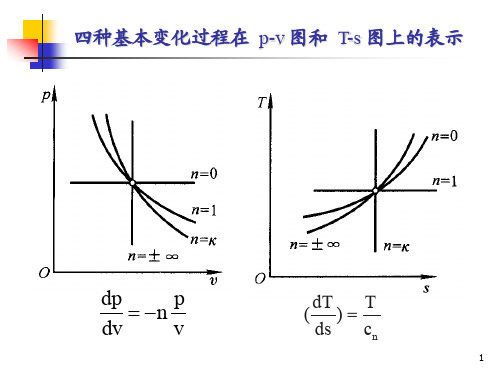
四种基本变化过程在 p-v 图和 T-s 图上的表示
dp n p dv v
dT T ( )
ds cn
1
p-v图和T-s图上的曲线簇
2
u,h,w,wt,q在p-v,T-s图上的变化趋势
u↑,h ↑(T ↑) w ↑(v ↑) wt ↑(p ↓) q ↑(s ↑)
工程热力学思考题参考答案,第四章

第四章气体和蒸汽的基本热力过程4.1试以理想气体的定温过程为例,归纳气体的热力过程要解决的问题及使用方法解决。
答:主要解决的问题及方法:(1) 根据过程特点(及状态方程)——确定过程方程 (2) 根据过程方程——确定始、终状态参数之间的关系 (3) 由热力学的一些基本定律——计算,,,,,t q w w u h s ∆∆∆(4) 分析能量转换关系(P —V 图及T —S 图)(根据需要可以定性也可以定量) 例:1)过程方程式:T =常数(特征)PV =常数(方程) 2)始、终状态参数之间的关系:12p p =21v v 3)计算各量:u ∆=0、h ∆=0、s ∆=21p RInp -=21v RIn v 4)P ?V 图,T ?S 图上工质状态参数的变化规律及能量转换情况4.2对于理想气体的任何一种过程,下列两组公式是否都适用答:不是都适用。
第一组公式适用于任何一种过程。
第二组公式21()v q u c t t =∆=-适于定容过程,21()p q h c t t =∆=-适用于定压过程。
4.3在定容过程和定压过程中,气体的热量可根据过程中气体的比热容乘以温差来计算。
定温过程气体的温度不变,在定温过程中是否需对气体加入热量?如果加入的话应如何计算? 答:定温过程对气体应加入的热量4.4过程热量q 和过程功w 都是过程量,都和过程的途径有关。
由理想气体可逆定温过程热量公式2111v q p v Inv =可知,故只要状态参数1p 、1v 和2v 确定了,q 的数值也确定了,是否q 与途径无关? 答:对于一个定温过程,过程途径就已经确定了。
所以说理想气体可逆过程q 是与途径有关的。
4.5在闭口热力系的定容过程中,外界对系统施以搅拌功w δ,问这v Q mc dT δ=是否成立? 答:成立。
这可以由热力学第一定律知,由于是定容过2211v v dvw pdv pvpvIn RTIn v v v ====⎰⎰为零。
《工程热力学》第四章 习题

Tp11(v1vv12)n0.10584k4g2=Kp2v2
RgT1
RgT2
T2
p2v2 Rg m
0.565106 0.013 287 0.058
441.25K
8
③
Q
mq
m
n
n 1
cv
(T2
T1)
3.21kJ
W
mw
2
pdV
1
n
1 1
(
p1V1
p2V2
)
8.58kJ
④ U mcv (T2 T1) 5.36kJ
3、初态为p1=0.1MPa,t1=40℃的空气,V1=0.052立 方米,在气缸中被可逆多变地压缩到p2=0.565MPa, V2=0.013立方米,试求该多变过程的多变指数n,压 缩后的温度t2,过程中空气和外界交换的功量和热 量,压缩过程中气体热力学能、焓和熵的变化。 1
1、在p-v图和T-s图上画出定比热容理想气体的可逆 定容加热过程、可逆定压加热过程、可逆定温加热 过程和可逆绝热膨胀过程。 1)可逆定容加热过程、可逆定压加热过程
v2n
T1v1n1
T2v2n1
T1 T2
vn1 2
vn1 1
1
vn1 2
vn1 1
,已知v2
v1
0 n1
5
3)n=1.6的膨胀过程,并判断q、w、△u的正负
此过程为放热,对外做功,内能减少
6
4) n=1.3的压缩过程,并判断q、w、△u的正负;
此过程为放热,外界对空气做功,内能增加。
7
3、初态为p1=0.1MPa,t1=40℃的空气,V1=0.052m3,
在气缸中被可逆多变地压缩到p2=0.565MPa, V2=0.013m3,试求该多变过程的多变指数n,压缩后 的温度t2,过程中空气和外界交换的功量和热量, 压缩过程中气体热力学能、焓和熵的变化。
工程热力学-第四章 习题

1、在p-v图和T-s图上画出定比热容理想气体的(1) 可逆定容加热过程、可逆定压加热过程;(2)可逆 定温加热过程和可逆绝热膨胀过程。
2、将满足空气下列要求的多变过程表示在p-v图和T-s 图上:1)空气升压、升温,又放热;2)空气膨胀、 升温,又吸热;3)n=1.6的膨胀过程,并判断q、 w、△u的正负;4) n=1.3的压缩过程,并判断q、 w、△u的正负;
W
mw
2
pdV
1
1 n 1
(
p1V1
p2V2
)
8.58kJ
④ U mcv (T2 T1) 5.36kJ
H mcp (T2 T1) 7.51kJ
S
m(cvIn
T2 T1
Rg In
v2 v1
)
0.0087kJ/K
9
v2n
T1v1n1
T2v2n1
T1 T2
v n 1 2
vn1 1
1
v n 1 2
v1n1,已知v2
v1
0 n1
5
3)n=1.6的膨胀过程,并判断q、w、△u的正负
此过程为放热,对外做功,内能减少
6
4) n=1.3的压缩过程,并判断q、w、△u的正负;
此过程为放热,外界对空气做功,内能增加。
3、初态为p1=0.1MPa,t1=40℃的空气, V1=0.052立方米,在气缸中被可逆多变地压缩到 p2=0.565MPa,V2=0.013立方米,试求该多变 过程的多变指数n,压缩后的温度t2,过程中空气和 外界交换的功量和热量,压缩过程中气体热力学能、1
1、在p-v图和T-s图上画出定比热容理想气体的可 逆定容加热过程、可逆定压加热过程、可逆定温加 热过程和可逆绝热膨胀过程。 1)可逆定容加热过程、可逆定压加热过程
工程热力学第四章 习题解答

第四章 习题解答4-1 多变指数:()()2112ln ln 0.1250.9ln ln 0.1p p n v v ===()210.9 1.4110.91v n n q c T T u u n n κκ---=-=∆=∆---∴11408 kJ/kg 55u q ∆==⨯=40832 kJ/kg w q u =-∆=-=()21 1.4811.2 kJ/kg p h c T T u κ∆=-=⋅∆=⨯= 4011.228.8 kJ/kg s w q h =-∆=-=2211ln ln 1.01ln100.732ln 0.1250.822 kJ/kg Kp v v ps c c v p ∆=+=⨯+⨯=⋅ 4-2 ⑴1 1.4112 1.410.287423110.21 1.41 111.9 kJ/kg RT p w p κκκ--⎡⎤⎛⎫⎛⎫⨯⎢⎥=-=- ⎪ ⎪⎢⎥--⎝⎭⎝⎭⎢⎥⎣⎦= 0s ∆=⑵ ()()120.72342330088.25v w u c T T =-∆=-=⨯-=kJ/kg22113000.1lnln 1.0045ln 0.287ln 4230.5 0.117 kJ kg p T p s c R T p ∆=-=⋅-⋅=⑶1120.5ln 0.287ln195.4 kJ kg 0.2p w RT p ==⋅= 120.5ln 0.287ln 0.462 kJ kg K 0.2p s R p ∆==⨯=⋅⑷1112210.287423110.267.1121n n RT p w n p -⎡⎤⎡⎤⎛⎫⨯⎢⎥=-=-= ⎪⎢⎥⎢⎥--⎝⎭⎣⎦⎢⎥⎣⎦kJ/kg2221ln ln 1.005ln 0.723ln 0.20.35 kJ kg Kp v v ps c c v p ∆=+==-⋅4-3 ⑴ 21ln8.314373ln107140.6 kJ kmol v w RT v ==⨯= 21ln8.314ln1019.14 kJ K v s R v ∆==⨯=⋅ ⑵ 0w =21ln8.314ln1019.14 kJ K v s R v ∆==⨯=⋅ 4-4 210.12ln 50.2598ln 2.091 kJ K 0.6v S mR v ∆==⨯=-()303 2.091633.6 kJ Q W T S ==∆=⨯-=-0, 0H U ∆=∆=4-5 2211201.3286568.3 K 101.3p T T p ⎛⎫==⨯= ⎪⎝⎭()()210.287568.3286202.6 kJ kg 1.41v u c T T ∆=-=-=-()()21 1.40.287568.3286283.6 kJ kg 1.41p h c T T ⨯∆=-=-=-210.287586.3ln ln 0.493 kJ kg K 1.41286v T s c T ∆===⋅-4-6 ⑴ 21303 K T T ==120.3ln 60.287303ln 573.2 kJ 0.1p Q W mRT p ===⨯⨯⨯=⑵ 1 1.411.422110.1303221.4 K 0.3p T T p κκ--⎛⎫⎛⎫==⨯= ⎪ ⎪⎝⎭⎝⎭ , 0Q = ()()120.2876303221.4351.3 kJ 1 1.41R W m T T κ=-=⨯-=--⑶ 1 1.211.222110.1303252.3 K 0.3n np T T p --⎛⎫⎛⎫==⨯= ⎪ ⎪⎝⎭⎝⎭()()120.2876303252.3436.5 kJ 1 1.21R W m T T n =-=⨯-=--()()21 1.2 1.40.2876252.33031 1.21 1.41 218.3 kJv n Q m c T T n κ--=-=⨯⨯⨯----=4-7 ()()()()1221ln ln 0.60.12 1.30ln ln 0.8150.236p p n v v ===1116000.236493.4 K 0.287p v T R ⨯===2221200.815340.8 K 0.287p v T R ⨯===()()120.287493.4340.8146 kJ 1 1.31R w T T n =-=-=--()()21 1.3 1.40.287340.8493.411 1.31 1.4136.5 kJ/kgn R q T T n κκ--=⋅-=⋅⋅-----= ()()210.723340.8493.8109.5 kJ kg v u c T T ∆=-=⨯-=- ()()21 1.01340.8493.4154.1 kJ kg p h c T T ∆=-=⨯-=-22120.8150.12ln ln 1.01ln 0.723ln0.2360.6 0.089 kJ kg Kp v v p s c c v p ∆=+=⋅+⋅=⋅4-8 40200160 kJ kg u q w ∆=-=-=-211600.533 kJ kg K 373673v u c T T ∆-===⋅--()()()()()2121122112ln ln ln 16 1.491673ln ln ln 6373p p p p n v v p T p T ====⎛⎫⋅ ⎪⎝⎭()()121 1.4912000.327 kJ/kg K 673373n w R T T --⨯===⋅-- 0.5330.3270.86 kJ kg K p v c c R =+=+=⋅4-9 10.412122933454.7 K v T T v κ-⎛⎫==⨯= ⎪⎝⎭()()1120.287293454.7116 kJ 1 1.41R w T T κ=-=-=---2221ln 0.287454.7ln 3143.4 kJ vw RT v ==⨯⨯=12116143.427.4 kJ w w w =+=-+=4-10 ⑴ 333100 1.73583 K 0.2968p v T R ⨯=== 11.413232 1.735831265 K 0.25v T T v κ--⎛⎫⎛⎫=== ⎪ ⎪⎝⎭⎝⎭22120.296812651.5 MPa 0.25RT p p v ⨯====11227730.250.153 MPa 1265T v v T ==⨯=⑵ 定压过程:()()210.29681265773365 kJ kg 1 1.41R u T T κ∆=-=-=--()()210.29681265773146 kJ kg w R T T =-=⨯-=定熵过程:()()320.29685831265506 kJ kg 1 1.41R u T T κ∆=-=-=---506 kJ kg w u =-∆=4-11 ⑴ 31110.2875730.274 m 600RT v p ⨯===321330.2740.822 m kg v v ==⨯=11.4112121573369 K 3v T T v κ--⎛⎫⎛⎫=== ⎪ ⎪⎝⎭⎝⎭2220.2873690.129 MPa 0.822RT p v ⨯===310.274 v v ==3m kg223330.1290.387 MPa p v p v ==⨯= 32369T T ==K⑵ ()()1120.287573369146.41 1.41R w T T κ=-=-=--kJ kg32221ln 0.287369ln 116.43v w RT v ==⨯⨯=-kJ kg()1.293146.4116.438.8 kJ W mw ==⨯-=4-12 1112101.3ln101.3150ln 59250 kJ 5000p Q pV p ==⨯⨯=- 4-13 101.3256000.21550.2872733600pV mRT ⨯===⨯⨯ kg/s 1,120.1ln 0.21550.287293ln 37.8 kW 0.8s T p W mRTp ==⨯⨯=- 112,1 1.411.4111.40.2872930.8 0.2155151.3 kW 1.410.1s SRT p W m p κκκκ--⎡⎤⎛⎫⎢⎥=- ⎪⎢⎥-⎝⎭⎢⎥⎣⎦⎡⎤⨯⨯⎛⎫⎢⎥=⨯-=-⎪⎢⎥-⎝⎭⎣⎦4-14 1600 kg/h kg/s 6m== ⑴定温压缩11210.1ln 0.287293ln 25.1 kW 60.6s T p W mRTp ⋅==⨯⨯=- ⑵定熵压缩112,1 1.411.4111 1.40.2872930.6 132.8 kW 6 1.410.1s SRT p W m p κκκκ--⎡⎤⎛⎫⎢⎥=- ⎪⎢⎥-⎝⎭⎢⎥⎣⎦⎡⎤⨯⨯⎛⎫⎢⎥=⨯-=-⎪⎢⎥-⎝⎭⎣⎦⑶多变压缩 112,1 1.2211.22111 1.220.2872930.6 129.6 kW 6 1.2210.1n n s nnRT p W m n p --⎡⎤⎛⎫⎢⎥=- ⎪⎢⎥-⎝⎭⎢⎥⎣⎦⎡⎤⨯⨯⎛⎫⎢⎥=⨯-=- ⎪⎢⎥-⎝⎭⎣⎦4-15 压缩比2160.160p p ==,应采用二级压缩20.775 MPa p == ∵13322n nT p T p -⎛⎫= ⎪⎝⎭,2120T T '==℃ (冷却至初温)∴1 1.2511.2533226293441.90.775n np T T p --'⎛⎫⎛⎫==⨯= ⎪⎪⎝⎭⎝⎭K3168.8t =℃ 4-16 ()()()()()2121122112ln ln ln 0.50.1 1.130.5289ln ln ln 0.1348p p p p n v v p T p T ====⎛⎫⋅ ⎪⎝⎭111100400482.3 kg/min 8.04 kg/s 0.287289p V mRT ⨯====⨯ ()()12 1.130.2878.042893481 1.1311183 kWs nR W mnwm T T n ⨯==-=⨯---=- ()()21 1.13 1.48.040.7233482891 1.131 712.3 kW 42738 kJ/minv n Q m c T T n κ--=-=⨯⨯⨯---=-= 4-17 12111v p c p λ⎡⎤⎛⎫⎢⎥=-- ⎪⎢⎥⎝⎭⎣⎦⑴ n =1.4,11.40.510.0610.870.1v λ⎡⎤⎛⎫=--=⎢⎥ ⎪⎝⎭⎢⎥⎣⎦⑵ n =1.25,11.250.510.0610.840.1v λ⎡⎤⎛⎫=--=⎢⎥ ⎪⎝⎭⎢⎥⎣⎦ ⑶ n =1.0,11.00.510.0610.760.1v λ⎡⎤⎛⎫=--=⎢⎥ ⎪⎝⎭⎢⎥⎣⎦4-18 ()21w pw a n m c t m c T T ∆=--111100250297.3 kg/h 0.08258 kg/s 0.287293a p V m RT ⨯====⨯ ()()()2112 4.186846514297.3293423 0.705 kJ/kg Kw pw w pw n a a m c t m c t c m T T m T T ∆∆⨯⨯=-==--⨯-=-⋅111n v n n Rc c n n κκκ--==--- 1.40.2870.7051.411 1.200.2870.7051 1.41nn Rc n R c κκκ⨯+---===-+--1.211.2122114230.10.905 MPa 293n n T p p T --⎛⎫⎛⎫==⨯= ⎪⎪⎝⎭⎝⎭()()1211.20.2870.0825829342318.48 kW1.21s a s a anRW m w m nw m T T n ===--⨯=⨯-=-。
工程热力学第4章习题答案

4-12 一个气缸活塞系统如图 4-19 所示,活塞的截面积为 40cm2,活塞离气缸底部 10cm, 重物 20kg,初始状态温度 300K,大气压力 101325Pa。求
(1)如果使缸内空气温度升高 5℃的同时使重物升高 2cm 需要加入多少热量; (2)然后当可逆绝热情况下使活塞回到原位置,需要再加上多少重物。
4-6 空气的初参数为 p1=0.5MPa 和 t1=50℃,此空气流经阀门发生绝热节流作用,并使空 气容积增大到原来的 2 倍。求节流过程中空气的熵增,并求其最后的压力。
解:对于理想气体 ∆h = cp∆T ,可得 h2 − h1 = cp (T2 − T1 ) ,绝热节流前后焓值相等,因此
T1 = T2 ,因此对于理想气体绝热节流前后温度也相等
4-3 某理想气体动力循环由这样 4 个过程构成,先从状态 a 定温膨胀到状态 b,后绝热 膨胀到状态 c,再定压放热到状态 d,最后绝热压缩回到状态 a,在 p-v 图、T-s 图上表示该 循环。已知吸热量 q1 和各点的焓,列出放热量、功和循环热效率的计算式。
解:由 T-s 图,c-d 过程是定压放热过程,放热量 q2 = ∆h + wt = ∆h = hd − hc < 0
= 0.789kJ/ (kg ⋅ K)
由理想气体状态方程可得
p1V1 T1
=
p2V2 T2
,而V2
= 2V1 ,可得
p2 p1
= 0.379
κ −1
绝热过程 T2 T1
=
⎛ ⎜ ⎝
p2 p1
⎞ ⎟ ⎠
κ
,可得绝热指数κ = 1.4
因此 cp = κ cV = 1.4× 0.789 = 1.105kJ/ (kg ⋅ K )
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四章 理想气体热力过程
一、选择题
1.在定容过程中,理想气体的内能变化Δu =D A .⎰2
1
dT c p B .⎰2
1
pdv
C .⎰2
1
vdp
D .⎰2
1dT c v
2.在定熵过程中,理想气体的内能变化Δu =BD
A .⎰2
1
dT c p B .-⎰2
1
pdv C .-⎰2
1
vdp D .⎰2
1
dT c v
3. 在定压过程中,理想气体的内能变化Δu =D A .⎰2
1
dT c p B .⎰2
1
pdv
C .⎰2
1
vdp
D .⎰2
1
dT c v
4.在定熵过程中,理想气体的焓的变化Δh =AC A .⎰2
1
dT c p B .⎰2
1
pdv
C .⎰2
1
vdp
D .⎰2
1
dT c v
5.理想气体定容过程中,焓的变化Δh =B A .c v ΔT B .c p ΔT C .u+pv D .w t
6.理想气体定温过程的热量q 等于BCD A .c n ΔT B .w t C .T Δs D .w 7.理想气体等温过程中,q ,w ,w t 间的关系为
D
A .q> w t >w
B .q=w< w t
C .q>w= w t
D .q=w= w t
8.理想气体绝热过程初终态温度,压力的关系为A A .
1
2T T =κ
κ112-⎪⎪⎭
⎫ ⎝⎛p p
B . 21T T = κ
κ112-⎪
⎪⎭
⎫ ⎝⎛p p
C .1
2
p p = κκ112-⎪⎪⎭⎫ ⎝⎛T T D .21p p = κ
κ112-⎪⎪⎭
⎫
⎝⎛T T
9.理想气体多变过程内能变化Δu 等于B A .c n ΔT B .c v ΔT C .c p ΔT D .R ΔT 10.理想气体多变过程焓的变化Δh 等于C A .c n ΔT B .c v ΔT C .c p ΔT
D .R ΔT
二、填空题
1.Rg=0.297kJ/(kgK)的1kg 双原子理想气体在定压下吸热3349kJ ,其内能变化Δu = 。
2.Rg=0.26kJ/(kgK)、温度为T =500K 的1kg 理想气体在定容下吸热3349kJ ,其熵变Δs = 。
3.绝热指数k=1.4的理想气体在绝热过程中输出技术功4500kJ ,其内能变化 ΔU = 。
4.Rg=0.26kJ/(kgK)、绝热指数k=1.4的理想气体在定压下吸热5000kJ ,做容积变化功W = 。
5.Rg=4.16kJ/(kgK)、绝热指数k=1.4的理想气体在定容下吸热10000kJ ,做技
术功W t = 。
6.C p =5.40kJ/(kgK)、T =600K 的1kg 理想气体在定温下压力由p 1=1Mpa 变为p 2=0.2MPa ,做容积变化功w = 。
7.Rg=0.26kJ/(kgK)、绝热指数k=1.4的理想气体在定压下做容积变化功1500kJ ,其内能变化ΔU = 。
8.Rg=4.16kJ/(kgK)、绝热指数k=1.4的2kg 理想气体在n=1.2的多变过程中温度由500K 变到1000K,其吸热量Q = 。
9. 在不变的温度600K 下,可逆地把理想气体的体积由初态减少一半需要一定数量的功。
那么在温度T = K 下,消耗同量的功能把气体容积定温压缩到体积为初容积的四分之一。
10. 0.2kg 空气由初态为0.3MPa 、325K 定温地膨胀到体积增加一倍。
过程中外界传给空气 kJ 热量。
三、简述题
1.T-s 图上理想气体的定容过程线为什么比定压过程线陡?
在温熵图上,过程线的斜率是(S T
∂∂)。
对于定容过程,(S
T
∂∂)v =dT/ CvdT T =T/ c v
对于定压过程(S
T
∂∂)p =dT/CpdT T =T/c p
因c p > c v ,所以 (S T ∂∂)v >(S
T
∂∂)p ,即定容线比定压线陡。
2.在T---s 图上如何用面积表示理想气体定熵过程的技术功?
根据能量方程q =Δh+w t ,绝热时w t =-Δh =h 1-h 2=c p (T 1-T 2) 可见,定压下工质由T 2变化到T 1过程中所需的热量正好在数值上等于工
质绝热地从T 1变化到T 2的技术功。
在T---s 图上,定压线从T 2到T 1下的面积就是技术功。
3.在T---s 图上如何用面积表示理想气体定熵过程的容积变化功?
根据能量方程q =Δu+w ,绝热时w =-Δu =u 1-u 2=c v (T 1-T 2) 可见,定容下工质由T 2变化到T 1过程中所需的热量正好在数值上等于工
质绝热地从T 1变化到T 2的容积变化功。
在T---s 图上,定容线从T 2到T 1下的面积就是容积变化功。
4.为什么理想气体在p -v 面上的绝热线比定温线陡? 由等温线方程pv =常数 得 pdv+vdp =0
(dv dp )T =-v p
由绝热线pv κ
=常量得 p 〃κv κ-1dv+v κ〃dp =0
κpdv+vdp =0 (dv
dp
)s =-κp/v
所以绝热线比等温线陡。
5.分析说明为什么双原子理想气体在n=1.2的多变膨胀过程中温度是下降的?6.分析说明为什么双原子理想气体在n=0.8的多变膨胀过程中温度是上升的?7.分析说明为什么双原子理想气体在n=1.7的多变过程中边膨胀边放热?四、计算题
1.在一个具有可移动活塞的圆筒中储有0.3 m3的氧气,温度t
1=4.5℃,压力p
1
=102.6kPa。
在定压下对氧气加热,再在定容下冷却到初温45℃。
假定在定容冷却终了时氧气的压力p
3
=60kPa,试求这两个过程的热量、焓的变化和所作的功,并在p-v和T-s图上定性画出这两个过程。
2.若p
1=10MPa、t
1
=1000℃的空气,从初态开始,一次作可逆定温膨胀,一次作
可逆绝热膨胀,两次膨胀的终态比体积相同,而在绝热膨胀中终态温度t
2
=0℃。
试确定空气的定温膨胀功是绝热膨胀功的多少倍?
3.将初温为523K的理想气体可逆定温的压缩到原来容积的1/2时,需消耗一定量的功。
试问:在多高的温度下,消耗同量的功而能将气体可逆定温的压缩到原来的1/4。
