乙炔法生产聚氯乙烯概要
天然气乙炔法生产聚氯乙烯
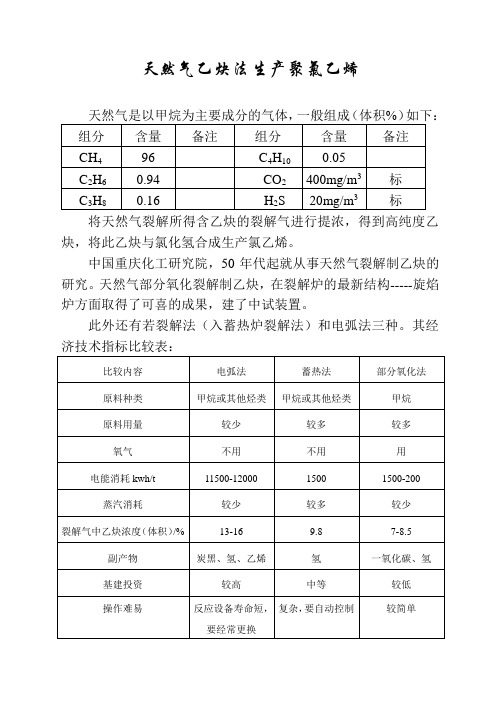
天然气乙炔法生产聚氯乙烯天然气是以甲烷为主要成分的气体,一般组成(体积%)如下:将天然气裂解所得含乙炔的裂解气进行提浓,得到高纯度乙炔,将此乙炔与氯化氢合成生产氯乙烯。
中国重庆化工研究院,50年代起就从事天然气裂解制乙炔的研究。
天然气部分氧化裂解制乙炔,在裂解炉的最新结构-----旋焰炉方面取得了可喜的成果,建了中试装置。
此外还有若裂解法(入蓄热炉裂解法)和电弧法三种。
其经济技术指标比较表:一、天然气氧化裂解制乙炔天然气裂解制乙炔由如下工序组成:甲烷氧化裂解;裂解气压缩;乙炔回收(提浓);溶剂回收;废物脱除和焚烧;循环水冷却系统。
各主要工序之间的关系如图所示。
—→↑∣乙炔尾气(H2、CO、)∣∣∣∣∣∣∣∣∣——∣∣∣∣(丁二炔、甲基乙炔、丙二炔∣∣∣∣∣图天然气部分裂解生产乙炔工艺示意图二、过程的化学反应机理甲烷按如下热分解反应生成乙炔1400—1500 0C2CH4——————→ C2H2 + 3H2—401.7kj (1)此反应所需要的热量又部分甲烷直接氧化来提供CH4 +2O2——→ CO2 + H2O + 545.6kj (2)反应式(1)、(2)即构成甲烷氧化裂解过程。
与此同时还发生如下几种反应:甲烷不完全氧化反应:CH4 +1/2O2——→ CO + H2 + 23.4kj (3)一氧化碳变换反应:CO + H2O ——→CO2 + H2 + 34.6kj (4)乙炔分解反应:C2H2——→2C + H2—Q (5)除了上述生成裂化气主要成分H2、CO、CH4、CO2和炭黑的那些反应外,尚有一些转化速率低的其他反应发生,其生成的副产物有:乙烯、丙炔、丙二烯、丁二炔、乙烯基乙炔、1,3-丁二烯、环戊二烯、乙烯基联乙炔、三联乙炔、二乙烯基乙炔、苯和萘等。
在上述条件下,乙炔产率取决于乙炔生成反应式(1)和分解反应式(5)之间的反应速率差异。
在连续负荷下,这些反应速率的比例可通过改变过程温度来调节。
电石乙炔法生产聚氯乙烯节能措施

电石乙炔法生产聚氯乙烯节能措施电石乙炔法是目前生产聚氯乙烯的主要方法之一,但其过程中存在着能源消耗高、环境污染等问题。
为了解决这些问题,可以采取一系列的节能措施,从而提高生产过程的能源利用效率,减少对环境的影响。
可以从原料选择上进行优化。
电石生产过程中,乙炔是最关键的原料。
目前大部分的乙炔是通过石蜡炉加热石蜡来产生的,而石蜡的生产需要大量的能源。
可以考虑替代原料,例如使用天然气制取乙炔,这样既可以减少能源消耗,又可以减少环境污染。
可以优化反应过程中的能量利用。
电石乙炔法中的关键反应是乙炔的水解反应,这个过程需要大量的热量。
目前常用的方法是采用蒸汽加热,但是蒸汽加热效率低下,能量损失较大。
可以考虑采用高效的热交换设备,将反应过程中产生的热量进行回收利用,从而提高能源利用效率。
可以通过技术改进来减少能源消耗。
可以采用高效的反应催化剂,提高反应速率,从而减少反应时间,降低能源消耗。
可以优化产品分离工艺,减少能源消耗,提高产品的纯度。
还可以采用废热回收技术,将反应过程中产生的废热用于蒸汽产生、供暖等方面,从而减少额外的能源消耗。
可以考虑引入可再生能源,例如太阳能、风能等,来替代部分传统能源的使用,从而降低对环境的影响。
还可以通过管理措施来提高能源利用效率。
建立科学合理的生产计划,优化设备运行模式,减少设备的闲置时间,从而提高设备的利用率,降低能源消耗。
可以加强能源管理,推行能源管理制度,对能源使用情况进行监控和评估,及时发现问题并采取相应的措施进行改进。
通过优化原料选择、优化反应过程、技术改进、废热回收、引入可再生能源以及加强能源管理等多种节能措施的综合应用,可以有效降低电石乙炔法生产聚氯乙烯的能源消耗,减少对环境的污染,实现节能减排的目标。
聚氯乙烯生产工艺简介

聚氯乙烯生产工艺简介PVC树脂是氯乙烯单体经聚合制得的一类热塑性高分子聚合物,分子式为:[ CH2—CHCl ]n,其中n表示聚合度,一般n=590~1500。
一、氯乙烯单体的制备工业上制备氯乙烯的方法主要有:乙炔法、联合法、乙烯氧氯化法、乙烯平衡氧氯化法等。
1、乙炔法:乙炔与氯化氢反应生成氯乙烯是最早实现工业化的方法,乙炔可由电石(碳化钙)与水作用制得。
此法能耗大,目前用此法生产氯乙烯制造PVC树脂主要集中在我国,占我国PVC树脂总量的一半以上。
2、联合法:由石油裂解制得的乙烯经氯化后生成二氯乙烷,然后在加压条件下将其加热裂解,脱去氯化氢后得到氯乙烯,副产品氯化氢再与乙炔反应又制得氯乙烯。
3、乙烯氧氯化法:使用乙烯、氯化氢和氧气反应得到二氯乙烷和水,二氯乙烷再经裂解,生成氯乙烯。
副产的氯化氢在回收到氧氯化工段,继续反应。
4、乙烯平衡氧氯化法:是将直接氯化和氧氯化工艺相结合。
乙烯与氯反应生成二氯乙烷,二氯乙烷裂解产生氯乙烯和氯化氢。
氯化氢与乙烯和氧气反应又生成二氯乙烷,二氯乙烷裂解再产生氯乙烯和氯化氢。
氯化氢回收后,继续参与氧氯化反应。
进入90年代以后,国外先后开发了一些生产氯乙烯单体的新工艺。
例如开发出不产生水的直接氯化/氯化氢氧化工艺;使用最便宜的乙烷作原料,直接氧氯化生产氯乙烯单体的技术;二氯乙烷/纯碱工艺生产氯乙烯单体的新技术路线等。
二、氯乙烯的聚合在工业化生产氯乙烯均聚物时,根据树脂应用领域,一般采用5种方法生产,即本体聚合、悬浮聚合、乳液聚合、微悬浮聚合和溶液聚合。
1、本体聚合:一般采用“两段本体聚合法”,第一段称为预聚合,采用高效引发剂,在62~75℃温度下,强烈搅拌,使氯乙烯聚合的转化率为8%时,输送到另一台聚合釜中,再加入含有低效引发剂的等量新单体,在约60℃温度下,慢速搅拌,继续聚合至转化率达80%时,停止反应。
本体聚合氯乙烯单体中不加任何介质,只有引发剂。
因此,此法生产的PVC树脂纯度较高,质量较优,其构型规整,孔隙率高而均匀,粒度均一。
聚氯乙烯的合成

五 氯乙烯工段1 基本生产原理:乙炔与氯化氢的反应,反应式如下:22223HgCl HCl C H C H Cl+−−−→反应温度为80~180℃,催化剂为2HgCl ,活性炭是催化剂的载体,转化率为90%左右。
2 生产工艺流程乙炔与氯化氢反应之前要通过热水预热,以提高反应的反应速率和转化率。
预热后进入反应器进行氯乙烯合成反应,反应后含有未反应的乙炔、氯化氢气体及二氯乙烷气体等的混合气体进入冷却器,一次冷凝温度为5℃,冷凝下的气体去低沸塔除去乙炔气体回收氯化氢。
二次冷凝温度为-30℃,高沸塔除杂质和二氯乙烷.残余的氯化氢通过三层组合水洗塔除去,底层得到浓酸,中层得到稀酸,上层进一步用水稀释。
之后经过碱洗彻底进一步除去氯化氢。
最终产物气体通过内装有胶玻璃的除雾器过滤水分子和氯化氢而得到合格的产品氯乙烯。
3主要设备介绍(1)转化器为乙炔与氯化氢反应的场所,内装有活性炭和HgCl2作为催化剂,反应温度为90~180℃. (2)组合水洗塔经分离后的混合气体仍含有部分HCl,通过组合水洗塔除去。
组合水洗塔分三层,底层得到浓酸,中层得到稀酸,上层进一步用水稀释。
(3)碱洗塔碱洗塔作用为进一步除去少量的HCl杂质。
(4)除汞器HCl和C2H2反应是以HgCl2作为催化剂,HgCl2常温下即会微量挥发,为防止HgCl2在转化温度下挥发离开反应器造成污染,用装有活性炭的除汞器吸附挥发出的HgCl2。
除汞器内活性炭每两年换一次。
(5)石墨冷却器列管式,降低温度(6)除雾器网状列管式,列管外面包裹硅胶纤维棉,外壳走水,除去气体中酸雾4主要操作工艺参数合成气含乙炔<=1.0% 合成气含氯化氢3—7%水洗塔出酸浓度28.03—32.03% 水洗塔浓酸液位30—80%碱液含碳酸钠<10% 碱液含氢氧化钠<5—10%单体含乙炔<=10ppm 单体含高沸物 <=200ppm水洗塔循环酸进塔温度<=25摄氏度稀酸循环槽液位30—80%精馏转化率>97%六聚合工段1基本生产原理2CH CH HCl CH CHCl ≡+→=2C nCH CHCl +−−−−→加聚反应2(H -CHCl )氯乙烯在引发剂的作用下的聚合反应。
电石乙炔法生产氯乙烯—粗氯乙烯的合成

氯化氢 吸湿性,可吸收乙炔气中的绝大部分水,生成40%左
右的盐酸,降低混合气中的水分。 脱水原理:
HgCl2 + H2S → HgS + 2HCl 3HgCl2 + PH3 → (HgCl)3P + 3HCl C2H2 + HgCl2 → Hg + Cl-CH=CH-Cl
铁和锌的存在会降低催化剂对合成反应的选择性
②遮盖 炭、树脂状聚合物、酸雾等黏结在催化剂表面,遮盖活性 中心而失活。
③活性结构改变 由于过热破坏催化剂活性结晶表面而活 性下降,催化剂活性分子移动,使催化剂表面松弛。
• 氯化氢和乙炔混合冷冻脱水 • 氯化氢和乙炔浓硫酸脱水工艺 • 变温变压吸附解吸工艺 • 氯化氢用浓硫酸干燥和乙炔用分子筛干燥组合干燥工艺
• 活性组分:氯化汞HgCl2(升汞、氯化高汞),易升华,溶于水, 单独使用无催化作用 ;
• 载体:活性炭,单独使用活性低。
• 组合:氯化汞吸附于活性炭表面后则具有很强的催化活性
以下 • 原料气中惰性气体含量低于2%
水存在
+ C H 22 H 2 O C H 3 C - H O
反应温度:100~180℃ 高温有利于反应进行
但温度过高副反应增多,催化剂升华 反应压力 :0.12~0.15Mpa
空速:空速过高,气体停留时间减少,乙炔转化率降低。 空速减小,乙炔转化率提高, 过小,高沸点副产物量也增多,生产能力减小。
④升华 温度升高,HgCl2更易升华,催化剂的活性组分 量逐渐减少,活性下降。
乙炔制氯乙烯方程式

乙炔制氯乙烯方程式乙炔制氯乙烯是一种重要的化学反应,其反应方程式如下:C2H2 + Cl2 → C2H3Cl在这个反应中,乙炔(C2H2)与氯气(Cl2)发生反应,生成氯乙烯(C2H3Cl)。
乙炔制氯乙烯是通过将乙炔和氯气在适当的条件下反应而得到的。
具体来说,乙炔和氯气在加热的条件下通过添加催化剂进行反应。
催化剂可以是金属或非金属,如铜、镍、铁、铂等。
催化剂的作用是降低反应的活化能,促进反应的进行。
乙炔制氯乙烯的反应过程是一个复杂的化学反应,涉及多个步骤和中间产物。
首先,乙炔的碳-碳三键被氯气氧化,生成氯乙烯和盐酸。
这个步骤是一个放热反应,产生大量的热量。
然后,氯乙烯和氯气继续反应,生成二氯乙烯。
最后,二氯乙烯通过加热分解,生成氯乙烯和氯气。
乙炔制氯乙烯是一种重要的工业反应,它在聚氯乙烯的生产中起到关键作用。
聚氯乙烯是一种广泛应用的塑料,用于制造各种产品,如管道、电线、塑料袋等。
乙炔制氯乙烯的工艺经过了长期的研究和改进,以提高产率和降低能耗。
乙炔制氯乙烯的反应机理和催化剂的选择是该反应研究的重要方向之一。
通过理解反应机理,可以优化反应条件,提高产率和选择性。
同时,合理选择催化剂可以降低反应温度和能耗,提高催化活性和稳定性。
乙炔制氯乙烯反应的研究还涉及反应动力学、热力学和工艺优化等方面。
研究人员通过实验和模拟计算等手段,探索反应的速率常数、反应热、反应平衡等参数,以指导实际生产中的操作和优化。
总结起来,乙炔制氯乙烯是一种重要的化学反应,其反应方程式描述了乙炔和氯气的反应过程。
这个反应在聚氯乙烯的生产中起到关键作用,对工业生产和环境保护都具有重要意义。
通过深入研究反应机理和优化反应条件,可以提高产率和选择性,降低能耗,推动乙炔制氯乙烯工艺的发展和改进。
乙炔氯化制氯乙烯PPT课件

精选
主要影响因素
原料配比 温度 空间流速
精选
影响因素—原料乙炔与氯化氢的配比
在反应中乙炔可与催化剂氯化汞反应生成氯化亚 汞和单质汞,所以在实际生产中要使原料气中氯化氢 过量以避免催化剂中毒,减少副反应的发生。在气体 纯度稳定的情况下,乙炔和氯化氢摩尔配比一般应保 证在1.05~1.10 之间。
精选
Good-bye
精选
乙炔法合成氯乙烯工艺
制作人:阳斌
精选
总纲
概述 电石乙炔精选
概述—氯乙烯(VCM)生产简介工艺
氯乙烯是1835年由法国人V.Regnault首先在实验 室中制得,他用氢氧化钾的乙醇溶液处理二氯乙烷得 到了氯乙烯。1902年,Biltz 将二氯乙烷进行热分解 也可制得氯乙烷。1911年,kiatte和Rollett 利用乙 炔和氯化氢催化加成反应合成了氯乙烯。1913年, Griesheim -Elektron用氯化汞作催化剂,使氯乙烯 合成技术进一步发展。1931年,德国首先实现了氯乙 烯的工业化生产,原料是乙炔和氯化氢,催化剂是氯 化汞。
精选
工艺流程—乙炔加氯化氢制氯乙烯工艺流程图
精选
工艺流程—流程说明
乙炔加氯化氢是放热反应,局部过热会影响 催化剂的寿命,因此必须及时地移出反应热。工 业上常采用多管式的固定床氯化反应器,管内盛 放催化剂,干燥和已净化的乙炔和氯化氢的混合 气自上而下地通过催化剂层进行反应。管外用加 压热水循环进行冷却。由于受到热点温度的限制 ,乙炔空速也受到限制。要充分发挥床层催化剂 的效率,就必须使整个床层温度都接近最佳的允 许温度。采取分段进气、分段冷却和适当调整催 化剂活性等方法,可使床层温度分布得到改善, 乙炔空速可以提高,因而催化剂的生产能力也可 以显著提高。
(聚)氯乙烯生产—电石乙炔法生产氯乙烯的工艺流程

3、电石乙炔法生产氯乙烯的原理
Step2: 4NaClO+H2S→H2SO4+4NaCl 4NaClO+PH3→H3PO4+4NaCl 4NaClO+AsH3→H3AsO4+4NaCl
一定的浓度时,可发生爆炸性灾害。与酸类物质能发生剧烈反应。
2、乙炔
乙炔:C2H2 结构简式和模型如图所示: 分子里有C ≡ C(其中含两个不牢固的共价键),键 与键之间的夹角是180°,是直线型分子。
2、乙炔
无色芳香气味的易燃气体。 电石制的乙炔因混有H2S、PH3、 AsH3而有毒,并带有特殊的臭味 。 和水的相对密度(水=1)为:0.6208 。 微溶于水、乙醇,溶于丙酮、氯仿、苯 。 在空气中爆炸极限为 2.1%-80.0%,在液态和固态下或在气态和一定压力 下有猛烈爆炸的危险,受热、震动、电火花等因素都可以引发爆炸,因此不 能在加压液化后贮存或运输。
电石乙炔法生产氯乙烯的工艺流程
电石乙炔法最早实现了氯乙烯的工业化生产,在氯乙烯和聚氯乙烯 生产史上有重要意义。本节主要从
认识电石; 认识乙炔; 电石法生产氯乙烯的原理; 电石法生产氯乙烯的工艺流程。 等四个方面学习电石乙炔法生产氯乙烯的工艺流程组织。
1、电石
碳化钙 ,CaC2,M=64.10。 由生石灰和焦炭石乙炔法生产氯乙烯的原理
CaC2 Cl2、H2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、工业生产方法、原理和发展历程聚氯乙烯(PVC)是全球五大热塑性合成树脂之一,产量仅次于聚乙烯,约占世界合成树脂总消费的30%。
PVC树脂价格低廉,其制品广泛应用于工农业建设和人民的日常生活。
从整个世界PVC市场的地区分布情况来看,当前,北美洲和亚洲是世界最大的PVC消费市场;未来十几年间,拉美和中国将成为PVC消费增长最快的地区、因此,伴随我国经济的长期持续发展,PVC生产企业降存在着较大的利润空间。
1.1 PVC的发展历程1835年法国人V.勒尼奥用氢氧化钾在乙醇溶液中处理二氯乙烷首先得到氯乙烯。
20世纪30年代,德国格里斯海姆电子公司基于氯化氢与乙炔加成,首先实现了氯乙烯的工业生产。
初期,氯乙烯采用电石,乙炔与氯化氢催化加成的方法生产,简称乙炔法。
以后,随着石油化工的发展,氯乙烯的合成迅速转向以乙烯为原料的工艺路线。
1940年,美国联合碳化物公司开发了二氯乙烷法。
为了平衡氯气的利用,日本吴羽化学工业公司又开发了将乙炔法和二氯乙烷法联合生产氯乙烯的联合法。
1960年,美国陶氏化学公司开发了乙烯经氧氯化合成氯乙烯的方法,并和二氯乙烷法配合,开发成以乙烯为原料生产氯乙烯的完整方法,此法得到了迅速发展。
乙炔法、混合烯炔法等其他方法由于能耗高而处于逐步被淘汰的地位。
氯乙烯可发生加成反应。
在引发剂(如有机的过氧化物或偶氮化合物)作用下发生加聚反应,生成聚氯乙烯(PVC)塑料。
还可以与某些不饱和化合物共聚成为改善某些性能的改性品种。
如与醋酸乙烯酯的共聚物,用于制造薄膜、涂料、塑料地板、唱片、短纤维等;又如与偏二氯乙烯CCl2=CH2的共聚物具有无毒、透明、防腐等特性,可用于制渔网,座垫织物、滤布、包装薄膜等,商品名莎纶、合成1,1,2-三氯乙烷等。
工业上用乙炔与氯化氢于汞盐作用下加成,或由乙烯氯化后热解生成氯化氢和氯乙烯、二氯乙烷热裂解等方法制得。
1.2 PVC生产方法及原理PVC的生产工艺有多种,根据其单体氯乙烯的不同,生产工艺主要分为电石法制PVC和乙烯法制PVC两种。
电石法制PVC是一条煤化工路线,首先用生石灰和以焦炭为主的碳素原料生产电石,在利用电石与水反映生成乙炔,乙炔与氯化氢加成反应生成氯乙烯,最终进行加聚反应得到PVC。
主要原理如下:CaO + 3C =CaC2 + COCaC2 + 2H2O =Ca(OH)2+CH≡CHCH≡CH + HCL = CH2=CHCLnCH2=CHCL = [CH2-CHCL]n二、原料的制备制备方法:1.电石法由电石(碳化钙)与水作用制得。
2.天然气制乙炔法预热到600-650℃的原料天然气和氧进入多管式烧嘴板乙炔炉,在1500℃下,甲烷裂解制得8%左右的稀乙炔,再用N-甲基吡咯烷酮提浓制得99%的乙炔成品。
三、原料及产品性质和用途3.1 乙炔分子式:C2H2分子量:26.040CAS号:74—86—23.1.1 性质:纯乙炔为无色芳香气味的易燃、有毒气体。
熔点(118.656kPa)-80.8℃,沸点-84℃,相对密度0.6208(-82/4℃),折射率1.00051,折光率1.0005(0℃),闪点(开杯)-17.78℃,自燃点305℃。
在空气中爆炸极限2.3% ~ 72.3%(vol)。
微溶于水,溶于乙醇、苯、丙酮。
在15℃和1.5MPa时,乙炔在丙酮中的溶解度为237g/L,溶液是稳定的。
性质活泼,能发生加成反应和聚合反应,在氧气中燃烧可发生高温(3500℃)和强光。
工业品乙炔带轻微大蒜臭。
由碳化钙(电石)制备的乙炔因含磷化氢等杂质而有恶臭。
3.1.2 用途:乙炔在高温下分解为碳和氢,由此可制备乙炔炭黑。
一定条件下乙炔聚合生成苯,甲苯,二甲苯,,萘,蒽,苯乙烯,茚等芳烃。
通过取代反应和加成反应,可生成一系列极有价值的产品。
例如乙炔二聚生成乙烯基乙炔,进而与氯化氢进行加成反应得到氯丁二烯;乙炔直接水合制取乙醛;乙炔与氯化氢进行加成反应而制取氯乙烯;乙炔与乙酸反应制得乙酸乙烯;乙炔与氰化氢反应制取丙烯腈;乙炔与氨反应生成甲基吡啶和2-甲基-5-乙基吡啶;乙炔与甲苯反应生成二甲笨基乙烯,进一步催化剂裂化生成三种甲基苯乙烯的异构体:乙炔与一分子甲醛缩合为丙炔醇,与二分子甲醛缩合为丁炔二醇;乙炔与丙酮进行加成反应可制取甲基炔醇,进而反应生成异戊二烯;乙炔和一氧化碳及其他化合物(如水,醇,硫醇)等反应制取丙烯酸及其衍生物。
3.2 氯乙烯化学式:C2H3Cl结构式:CHCl=CH2分子量:62.4987CAS:75—01—43.2.1 性质:无色易液化的气体。
液体的密度0.912lg/cm3。
沸点-13.9℃。
凝固点-160℃。
自燃点472℃。
临界温度142℃。
临界压力55.2Pa。
难溶于水,溶于乙醇、乙醚、丙酮和二氯乙烷。
易聚合,能与丁二烯、乙烯、丙烯、丙烯腈、醋酸乙烯、两烯酸酯和马来酸酯等共聚。
能与空气形成爆炸性混合物,爆炸极限3.6-26.4%。
遇明火、高温有燃烧爆炸的危险。
3.2.2 用途:用于制造聚氯乙烯树脂,还能与醋酸乙烯、偏氯乙烯、丁二烯、丙烯腈、丙烯酸酯等单体生成共聚物。
致冷工业用作冷冻剂。
医药工业作制造医药的原料。
3.3 聚氯乙烯3.3.1 结构式:┿CH2-CH┿n|Cl3.3.1 性质聚氯乙烯具有阻燃(阻燃值为40以上)、耐化学药品性高(耐浓盐酸、浓度为90%的硫酸、浓度为60%的硝酸和浓度20%的氢氧化钠)、机械强度及电绝缘性良好的优点。
聚氯乙烯对光、热的稳定性较差。
软化点为80℃,于130℃开始分解。
在不加热稳定剂的情况下,聚氯乙烯100℃时即开始分解,130℃以上分解更快。
受热分解出放出氯化氢气体,使其变色,由白色→浅黄色→红色→褐色→黑色。
阳光中的紫外线和氧会使聚氯乙烯发生光氧化分解,因而使聚氯乙烯的柔性下降,最后发脆。
从这里不难理解,为什么一些PVC塑料时间久了就会变黄、变脆的原因。
具有稳定的物理化学性质,不溶于水、酒精、汽油,气体、水汽渗漏性低;在常温下可耐任何浓度的盐酸、90%以下的硫酸、50—60%的硝酸和20%以下的烧碱溶液,具有一定的抗化学腐蚀性;对盐类相当稳定,但能够溶解于醚、酮、氯化脂肪烃和芳香烃等有机溶剂。
工业聚氯乙烯树脂主要是非晶态结构,但也包含一些结晶区域(约5%),所以聚氯乙烯没有明显的溶点,约在80℃左右开始软化,热扭变温度( 1.82MPa 负荷下)为70-71℃,在加压下150℃开始流动,并开始缓慢放出氯化氢,致使聚氯乙烯变色(由黄变红、棕、甚至于黑色)。
工业聚氯乙烯重均相对分子质量在 4.8-4.8万范围内,相应的数均相对分子质量为2-1.95万。
而绝大多数工业树脂的重均相对分子质量在10-20万,数均相对分子质量在4.55-6.4万。
硬质聚氯乙烯(未加增塑剂)具有良好的机械强度、耐候性和耐燃性,可以单独用做结构材料,应用于化工上制造管道、板材及注塑制品。
硬质聚氯乙烯可以用增强材料。
3.32 用途(1)聚氯乙烯异型材型材、异型材是我国PVC消费量最大的领域,约占PVC总消费量的25%左右,主要用于制作门窗和节能材料,目前其应用量在全国范围内仍有较大幅度增长。
在发达国家,塑料门窗的市场占有率也是高居首位,如德国为50%,法国为56%,美国为45%。
(2)聚氯乙烯管材在众多的聚氯乙烯制品中,聚氯乙烯管道是其第二大消费领域,约占其消费量的20%。
在我国,聚氯乙烯管较PE管和PP管开发早,品种多,性能优良,使用范围广,在市场上占有重要位置。
(3)聚氯乙烯膜PVC膜领域对PVC的消费位居第三,约占10%左右。
PVC与添加剂混合、塑化后,利用三辊或四辊压延机制成规定厚度的透明或着色薄膜,用这种方法加工薄膜,成为压延薄膜。
也可以通过剪裁,热合加工包装袋、雨衣、桌布、窗帘、充气玩具等。
宽幅的透明薄膜可以供温室、塑料大棚及地膜之用。
经双向拉伸的薄膜,所受热收缩的特性,可用于收缩包装。
(4)PVC硬材和板材PVC中加入稳定剂、润滑剂和填料,经混炼后,用挤出机可挤出各种口径的硬管、异型管、波纹管,用作下水管、饮水管、电线套管或楼梯扶手。
将压延好的薄片重叠热压,可制成各种厚度的硬质板材。
板材可以切割成所需的形状,然后利用PVC焊条用热空气焊接成各种耐化学腐蚀的贮槽、风道及容器等。
(5)PVC一般软质品利用挤出机可以挤成软管、电缆、电线等;利用注射成型机配合各种模具,可制成塑料凉鞋、鞋底、拖鞋、玩具、汽车配件等。
(6)聚氯乙烯包装材料聚氯乙烯制品用于包装主要为各种容器、薄膜及硬片。
PVC容器主要生产矿泉水、饮料、化妆品瓶,也有用于精制油的包装。
PVC膜可用于与其它聚合物一起共挤出生产成本低的层压制品,以及具有良好阻隔性的透明制品。
聚氯乙烯膜也可用于拉伸或热收缩包装,用于包装床垫、布匹、玩具和工业商品。
(7)聚氯乙烯护墙板和地板聚氯乙烯护墙板主要用于取代铝制护墙板。
聚氯乙烯地板砖中除一部分聚氯乙烯树脂外,其余组分是回收料、粘合剂、填料及其它组分,主要应用在机场候机楼地面和其它场所的坚硬地面。
(8)聚氯乙烯日用消费品行李包是聚氯乙烯加工制作而成的传统产品,聚氯乙烯被用来制作各种仿皮革,用于行李包,运动制品,如篮球、足球和橄榄球等。
还可用于制作制服和专用保护设备的皮带。
服装用聚氯乙烯织物一般是吸附性织物(不需涂布),如雨披、婴儿裤、仿皮夹克和各种雨靴。
聚氯乙烯用于许多体育娱乐品,如玩具、唱片和体育运动用品,目前聚氯乙烯玩具增长幅度大,由于聚氯乙烯玩具和体育用品生产成本低,易于成型而占有优势。
四、生产工艺4.1乙炔、HCl的生产4.1.1 乙炔的生产3C + CaO CaC2 + CoCaC2 + H2O CH≡CH + Ca(OH)24.1.2 HCl的生产H2 + Cl2 2HCl4.2 乙炔加HCl反应CH≡CH + HCl CH2=CHClCH≡CH + HgCl2 CH=CH—HgCl¦ClCH=CH—HgCl + HCl CH2=CHCl + HgCl2¦Cl副反应:HCl过量:CH2=CHCl—HCl CH3CHCl2乙炔过量:CH=CH—HgCl + HgCl2 ClHg —CH—CH—HgCl¦¦C l Cl4.3反应条件的选择反应温度:T=130 ~ 180 度反应压力:P<300mmHg催化剂:HgCl2 / 活性炭原料纯度:(1)原料中有毒杂质:H2S,H3PHgCl2 + H2S HgS + 2HCl(2)含水:H2O + HCl 盐酸H2O +C2H2 CH3CHO控制在小于0.03%(3)含O2:导致乙炔含量减少。
(4)含Cl2:与乙炔反应,降低乙炔含量,必须控制在小于0.02%。
4.4 原料配比:C2H2 + HCl C2H3Cl (放热反应)理论配比:1:1实际配比:1:1.05 ~ 1.14.6空速适宜空速:30 ~ 50 M^3五、发展现状、前景5.1发展现状聚氯乙烯( PVC)是五大热塑性合成树脂之一,塑料制品是最早实现工业化的品种之一。
