化学反应过程ppt课件
合集下载
第七篇-化学反应工程PPT课件

解:一级反应, ( rA )kA c kA 0 c (1xA )
t1ln1 1 ln1 99 .( 8s6 ) k 1xA 0.0021 3 0.9 1
-
18
反应器体积:
V R q V 0(t t') 1 2m h 4 3 4 (9 3.9 6 8 6 3 6 0)0 0 0 .4m 533
-
9
活塞流模型-理想排挤流动模型(平推流) 反应器内任一截面上无速度梯度;物料在反 应器内的停留时间完全相同。(连续操作管 式反应器)
-
10
非理想流动模型-介于上两 种理想模型之间 a.轴向扩散模型-活塞流+轴 向扩散
将对活塞流的偏离情况通过轴 向扩散(轴向返混)速率来描 述 b.多。级费全克混定流律模:型u (D多l d釜dCl串联 流动模型)
(rA)VRdA n /dt (rA)dA c/dt d tdAc/ (rA)
基本方程:
tcA cA0
( d rAA )ccA0
xA 0
dA x (rA)
-
等容过程,液相反应
15
简单一级反应: ( rA )kA c kA 0 c (1xA )
t c A 0 0 x Ak A 0 d ( 1 c A x A x ) k 1 0 x Ad 1 ( 1 x x A A ) k 1 l1 n 1 x A k 1 lc c n A A 0
按操作 方法分
间歇 连续 半连续
5
7 基本反应器 间歇操作搅拌釜式反应器
特点:分批操作;所有物料 的反应时间相同;反应物的 浓度是时间的函数。
连续操作管式反应器
特点:连续进料;T、P、q
一定时,反应器内任一截面
的物料浓度不随时间变化;
t1ln1 1 ln1 99 .( 8s6 ) k 1xA 0.0021 3 0.9 1
-
18
反应器体积:
V R q V 0(t t') 1 2m h 4 3 4 (9 3.9 6 8 6 3 6 0)0 0 0 .4m 533
-
9
活塞流模型-理想排挤流动模型(平推流) 反应器内任一截面上无速度梯度;物料在反 应器内的停留时间完全相同。(连续操作管 式反应器)
-
10
非理想流动模型-介于上两 种理想模型之间 a.轴向扩散模型-活塞流+轴 向扩散
将对活塞流的偏离情况通过轴 向扩散(轴向返混)速率来描 述 b.多。级费全克混定流律模:型u (D多l d釜dCl串联 流动模型)
(rA)VRdA n /dt (rA)dA c/dt d tdAc/ (rA)
基本方程:
tcA cA0
( d rAA )ccA0
xA 0
dA x (rA)
-
等容过程,液相反应
15
简单一级反应: ( rA )kA c kA 0 c (1xA )
t c A 0 0 x Ak A 0 d ( 1 c A x A x ) k 1 0 x Ad 1 ( 1 x x A A ) k 1 l1 n 1 x A k 1 lc c n A A 0
按操作 方法分
间歇 连续 半连续
5
7 基本反应器 间歇操作搅拌釜式反应器
特点:分批操作;所有物料 的反应时间相同;反应物的 浓度是时间的函数。
连续操作管式反应器
特点:连续进料;T、P、q
一定时,反应器内任一截面
的物料浓度不随时间变化;
电化学反应过程ppt课件

生。
发展历程:有机电化学合成始于1949年的“柯尔贝反应”。
由于种种原因,直到20世纪60年代中期,有机电化合成才有了新的进展; 20世纪80年代以来,由于新技术、新工艺的不断研究和开发,使得电化学 过程的工业应用不断扩展,反应器设计更合理,能耗进一步降低。
图9-1 几种典型的电有机合成反应示意图
流程简单、设备投资少、能耗低,其相对成本可减少40%左右,故发展前景 是非常美好的。
天然碱的加工精制方法最常用的是一水碱法,倍半碳酸钠法次之,此外还有一 些其他加工方法。
烧碱的工业生产简介
工业生产方法主要是通过电解食盐水溶液来制取,同时副产氯气和氢气。
电解方法有三种:
第一种是隔膜法(Diaphragm Proess,简称D法);
2.生产方法
①目前纯碱的工业生产方法主要有氨碱法和联碱法两种; ②烧碱的工业生产方法主要是食盐水溶液电解法,其中包括水银电解法、隔
膜电解法和离子膜电解法三种。
纯碱工业生产过程简介
1.发展过程: 纯碱的工业生产始于1787年,法国人路布兰首先由硫酸钠和石灰石制得碳酸
钠; 1861年比利时人索尔维提出了以食盐、石灰石等为原料制纯碱的氨碱法 优点:原料来源方便、生产连续、产量大、成本低,曾被广泛采用; 缺点:食盐利用率低(<30%)、副产氯化钙废渣,造成一定的环境污染。 1942年我国的化学家侯德榜提出了联合制碱法,在生产纯碱的同时,副产氯
分为直接电有机合成和间接电有机合成两大类。
直接电有机合成:指有机合成反应直接在电极表面上完成,这一类反应居多 数,包括氧化、还原反应、裂解、偶联、缩合、卤代等;
间接电解合成:指有机物的氧化还原反应仍采用氧化剂或还原剂,使用化学 方法进行,反应后的氧化剂或还原剂通过电解氧化或还原方法使之再生, 反复使用。
发展历程:有机电化学合成始于1949年的“柯尔贝反应”。
由于种种原因,直到20世纪60年代中期,有机电化合成才有了新的进展; 20世纪80年代以来,由于新技术、新工艺的不断研究和开发,使得电化学 过程的工业应用不断扩展,反应器设计更合理,能耗进一步降低。
图9-1 几种典型的电有机合成反应示意图
流程简单、设备投资少、能耗低,其相对成本可减少40%左右,故发展前景 是非常美好的。
天然碱的加工精制方法最常用的是一水碱法,倍半碳酸钠法次之,此外还有一 些其他加工方法。
烧碱的工业生产简介
工业生产方法主要是通过电解食盐水溶液来制取,同时副产氯气和氢气。
电解方法有三种:
第一种是隔膜法(Diaphragm Proess,简称D法);
2.生产方法
①目前纯碱的工业生产方法主要有氨碱法和联碱法两种; ②烧碱的工业生产方法主要是食盐水溶液电解法,其中包括水银电解法、隔
膜电解法和离子膜电解法三种。
纯碱工业生产过程简介
1.发展过程: 纯碱的工业生产始于1787年,法国人路布兰首先由硫酸钠和石灰石制得碳酸
钠; 1861年比利时人索尔维提出了以食盐、石灰石等为原料制纯碱的氨碱法 优点:原料来源方便、生产连续、产量大、成本低,曾被广泛采用; 缺点:食盐利用率低(<30%)、副产氯化钙废渣,造成一定的环境污染。 1942年我国的化学家侯德榜提出了联合制碱法,在生产纯碱的同时,副产氯
分为直接电有机合成和间接电有机合成两大类。
直接电有机合成:指有机合成反应直接在电极表面上完成,这一类反应居多 数,包括氧化、还原反应、裂解、偶联、缩合、卤代等;
间接电解合成:指有机物的氧化还原反应仍采用氧化剂或还原剂,使用化学 方法进行,反应后的氧化剂或还原剂通过电解氧化或还原方法使之再生, 反复使用。
人教版化学必修一氧化还原反应ppt33张课件
单质还原性逐渐减弱:K>Ca>Na>Mg>Al>Zn>Fe…
2.元素处于最低价态时,只能做还原剂:Cl-、S2-、I- 元素处于最高价态时,只能做氧化剂:KMnO4、 FeCl3、H2SO4、HNO3
阳离子氧化性逐渐增强: K+<Ca2+<Na+<Mg2+<Al3+<Zn2+<Fe 2+…
3.归中规律 同种元素不同价态间发生氧坏反应时,高价+ 低价 中间价态,即“只靠拢,不交叉。”
例:在KClO3+6HCl(浓)===KCl+3Cl2+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为 。
3、这是从电子得失的角度看(也是氧化还原反应的实质):
因此,有电子转移(得失或电子对偏移)的反应都是氧化还原反应。
Fe + 2HCl = FeCl2 + H2 ↑
2e-
CH4 + 2O2 = CO2 + 2H2O
8e-
-4 0 +4 -2
0 +1 +2 0
有单质参加的
有单质生成的
三、氧还反应中电子转移的表示方法
1.双线桥法:
(1)标出反应中化合价发生变化的元素的化合价,判断其升降。
(2)画线条,箭头由反应物指向生成物中同种元素。
(3)在桥上标明电子“得”“失”电子,同时用a×b e-形式表示得、失电子数。 a—得、失电子的原子总数 b—每个原子得失电子数(a,b为1时可省略)
如: 2Fe+3Cl2 =2FeCl3 Fe+S= FeS 则氧化性:Cl2 > S
化学反应工程课件-PPT

k/
k
K
1/ p
E
E
1
H
r
ln
k
ln
k
1
ln
K
p
d ln k dT
d ln k dT
1
d ln K p dT
1
H r 1R4T 2
E
E
1
H r
对于吸热反应,ΔHr>0 对于放热反应,ΔHr<0
EE
EE
●反应 速率与 温度的 关系
r k f (X A) k g(X A)
r
dk
dk
( T ) xA f ( X A ) dT g( X A ) dT
kcA0 (1 X A ) (cB0
B A
cA0 X A )
(2.48)
XA——t
● 变
AA BB PP
ci
ni V
XA
容
过 程
* rA kcAcB
1 V
dnA dt
kcA cB
30
AA BB PP
组分
A B
反应前(XA=0)
nA0
1 j A1 2 j A2 ij Ai 0 rj
1M A1 2M A2 iM Ai 0 rM
M
i ij r j (*) j 1
rj
?
i
●忽略次要反应,确定独立反应数M;
●测M个组分的 i
●对每个组分按(*)式,建立M个线 性方程;
●求解代数方程组,得 rj.
22
例:乙苯催化脱氢反应可以用下列方程式表示
不受其他反应的反应组分浓度的影响。
特殊 情况
●多相催化反应; ●变容气相反应.
化学动力学-对峙反应PPT课件

浓度相等时需要多少时间?(2) 经100 min后,A和
B的浓度各为多少?达到平衡时,又为多少?
解: (2) 达到平衡时,速率为零
dx
3
dt k1cA0 (k1 k1 )xe 0 xe 4 cA0
cB xe 0.75 mol dm3 cA (1 0.75) mol dm3 =0.25 mol dm3
ln
xe xe
x
(k1
k1 )t
ln{xe – x}与 t 呈线性关系,直线斜率的负 值即 (k1+k-1)
ln 2
反应完成一半所需时间为
k1 k1
k1(cA0 xe ) k1 xe
Kc
xe cA0
xe
k1 k1
不是半衰期!
一级对峙反应的特征
ln
xe xe
x
(k1
k1 )t
ln{xe – x}与 t 呈线性关系 反应完成一半所需时间为 ln 2
1
t
dx dt
0 k1cA0 (k1 k1 ) x
0
ln cA0 ln cA0
k1 k1 k1
x (k1 k1 )t
一级对峙反应
k1
AB
k1
dx dt
0
k1 (cA0
xe )
k1 xe
cA0
k1
k1 k1
xe
ln
xe xe
x
(k1
k1 )t
一级对峙反应的特征
(characteristics of first order opposite reactions)
基元反应 复合反应 简单反应
复杂反应
v=kcA cB cC
《丙酮碘化反应》课件

丙酮碘化反应简介
丙酮碘化反应的定义
01
丙酮碘化反应是指在酸催化下, 丙酮与碘发生取代反应,生成碘 代丙酮和氢气的过程。
02
该反应是一种有机化学中的重要 反应,也是有机合成中常用的方 法之一。
丙酮碘化反应的发现和历史
丙酮碘化反应最早由德国化学家拜耳 于1826年发现。
此后,该反应在有机化学中得到了广 泛的应用和发展,成为有机合成中常 用的方法之一。
主要产物的性质和用途
主要产物
丙酮碘化物(CH3COCH2I)
性质
易溶于有机溶剂,具有特殊气味。
用途
用于合成其他有机碘化物,也可作为有机合成中的中 间体。
副产物的生成和处理
副产物
氢气、碘化氢、水等。
生成原因
丙酮与碘在反应过程中会发生脱水和脱氢反应。
处理方法
通过冷凝、吸收、干燥等方法将副产物分离出去 ,以获得纯度较高的主要产物。
配制一定浓度的硫酸、乙醇和氢氧化 钠溶液。
实验仪器
烧杯、磁力搅拌器、滴定管、温度计 、离心机等。
实验操作步骤
步骤二
缓慢滴加硫酸,并 保持搅拌,观察反 应变化。
步骤四
用乙醇和氢氧化钠 溶液洗涤有机相, 再次离心分离。
步骤一
在烧杯中加入一定 量的丙酮和碘,搅 拌均匀。
步骤三
将反应混合物进行 离心分离,收集上 层有机相。
对实际生产的潜在影响和价值
有利于化工生产
丙酮是重要的化工原料,通过丙酮碘化反应可以合成多种有机碘化合物,这些化合物在医 药、农药、染料等领域有广泛应用。
有利于环保和可持续发展
开发绿色、高效的丙酮碘化反应方法有助于减少环境污染和资源浪费,符合可持续发展的 要求。
丙酮碘化反应的定义
01
丙酮碘化反应是指在酸催化下, 丙酮与碘发生取代反应,生成碘 代丙酮和氢气的过程。
02
该反应是一种有机化学中的重要 反应,也是有机合成中常用的方 法之一。
丙酮碘化反应的发现和历史
丙酮碘化反应最早由德国化学家拜耳 于1826年发现。
此后,该反应在有机化学中得到了广 泛的应用和发展,成为有机合成中常 用的方法之一。
主要产物的性质和用途
主要产物
丙酮碘化物(CH3COCH2I)
性质
易溶于有机溶剂,具有特殊气味。
用途
用于合成其他有机碘化物,也可作为有机合成中的中 间体。
副产物的生成和处理
副产物
氢气、碘化氢、水等。
生成原因
丙酮与碘在反应过程中会发生脱水和脱氢反应。
处理方法
通过冷凝、吸收、干燥等方法将副产物分离出去 ,以获得纯度较高的主要产物。
配制一定浓度的硫酸、乙醇和氢氧化 钠溶液。
实验仪器
烧杯、磁力搅拌器、滴定管、温度计 、离心机等。
实验操作步骤
步骤二
缓慢滴加硫酸,并 保持搅拌,观察反 应变化。
步骤四
用乙醇和氢氧化钠 溶液洗涤有机相, 再次离心分离。
步骤一
在烧杯中加入一定 量的丙酮和碘,搅 拌均匀。
步骤三
将反应混合物进行 离心分离,收集上 层有机相。
对实际生产的潜在影响和价值
有利于化工生产
丙酮是重要的化工原料,通过丙酮碘化反应可以合成多种有机碘化合物,这些化合物在医 药、农药、染料等领域有广泛应用。
有利于环保和可持续发展
开发绿色、高效的丙酮碘化反应方法有助于减少环境污染和资源浪费,符合可持续发展的 要求。
有机化学基本反应类型ppt课件

有不对称消去的情况,由信息定产物 消去反应的条件:醇类是浓硫酸+加热;
卤代烃是NaOH醇溶液+加热
2021精选ppt
38
有机反应类型——氧化反应
原理:有机物得氧或去氢 包括:
燃烧反应、被空气(氧气)氧化、(醇是去氢氧化) 被酸性KMnO4溶液氧化, 醛基的银镜反应和被新制Cu(OH)2悬浊液氧化 烯烃被臭氧氧化 (O3,Zn/HCl,双键断裂,原双键碳变为C=O)
一元羧酸和一元醇反应生成普通酯
二元羧酸和二元醇
○ 部分酯化生成普通酯和1分子H2O, ○ 或生成环状酯和2分子H2O, ○或生成高聚酯和2n H2O 羟基羧酸自身反应既可以部分酯化生成普通酯, 也可以生成环状酯,还可以生成高聚酯。如乳 酸分子
2021精选ppt
27
有机反应类型——酯化反应拓展
类型(联系书上提到的高分子材料):
乙烯型加聚 聚丙烯、聚苯乙烯、聚氯乙烯、
聚丙烯腈、聚甲基丙烯酸甲酯(有机玻璃)
1,3-丁二烯型加聚(破两头,移中间) 天然橡胶(聚异戊二烯)
氯丁橡胶(聚一氯丁二烯)
含有双键的不同单体间的共聚 乙丙树脂(乙烯和丙烯共聚),
丁苯橡胶(丁二烯和苯乙烯共聚)
2021精选ppt
种有机物相当于化合反应),只进不
出。
④加成前后的有机物的结构将发生变化,
烯烃变烷烃,结构由平面形变立体形;
炔烃变烯烃,结构由直线形变平面形;
⑤加成反应是不饱和化合物的较特有反应,
另外,芳香族化合物也有可能发生加成
反应。
2021精选ppt
14
有机反应类型——加成反应
和H2加成的条件一般是催化剂(Ni)+加热 和水加成时,一般在一定的温度、压强和催化剂
卤代烃是NaOH醇溶液+加热
2021精选ppt
38
有机反应类型——氧化反应
原理:有机物得氧或去氢 包括:
燃烧反应、被空气(氧气)氧化、(醇是去氢氧化) 被酸性KMnO4溶液氧化, 醛基的银镜反应和被新制Cu(OH)2悬浊液氧化 烯烃被臭氧氧化 (O3,Zn/HCl,双键断裂,原双键碳变为C=O)
一元羧酸和一元醇反应生成普通酯
二元羧酸和二元醇
○ 部分酯化生成普通酯和1分子H2O, ○ 或生成环状酯和2分子H2O, ○或生成高聚酯和2n H2O 羟基羧酸自身反应既可以部分酯化生成普通酯, 也可以生成环状酯,还可以生成高聚酯。如乳 酸分子
2021精选ppt
27
有机反应类型——酯化反应拓展
类型(联系书上提到的高分子材料):
乙烯型加聚 聚丙烯、聚苯乙烯、聚氯乙烯、
聚丙烯腈、聚甲基丙烯酸甲酯(有机玻璃)
1,3-丁二烯型加聚(破两头,移中间) 天然橡胶(聚异戊二烯)
氯丁橡胶(聚一氯丁二烯)
含有双键的不同单体间的共聚 乙丙树脂(乙烯和丙烯共聚),
丁苯橡胶(丁二烯和苯乙烯共聚)
2021精选ppt
种有机物相当于化合反应),只进不
出。
④加成前后的有机物的结构将发生变化,
烯烃变烷烃,结构由平面形变立体形;
炔烃变烯烃,结构由直线形变平面形;
⑤加成反应是不饱和化合物的较特有反应,
另外,芳香族化合物也有可能发生加成
反应。
2021精选ppt
14
有机反应类型——加成反应
和H2加成的条件一般是催化剂(Ni)+加热 和水加成时,一般在一定的温度、压强和催化剂
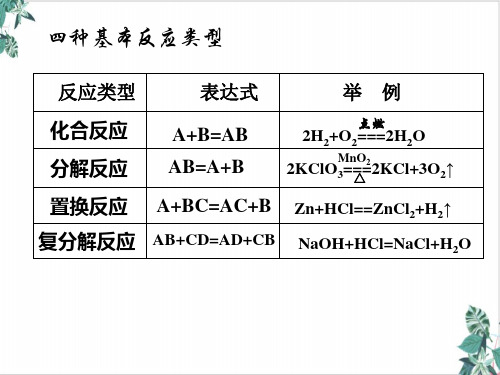
初中化学_化学反应四种基本类型 PPT课件 图文

本节课你有哪些收获?
1.化学反应的基本类型:化合反应、分解反应、置换 反应、复分解反应(能够对典型反应分类)。
2.能根据化学反应解释与日常生活相关的一些现象。 3.能用金属活动性表对有关的置换反应进行简单的
判断。 4了解人们如何利用化学反应改善和提高生活质量。
1、最灵繁的人也看不见自己的背脊。——非洲 2、最困难的事情就是认识自己。——希腊 3、勇猛、大胆和坚定的决心能够抵得上武器的精良。——达·芬奇 4、与肝胆人共事,无字句处读书。——周恩来 5、一个人即使已登上顶峰,也仍要自强不息。——罗素·贝克 6、一切节省,归根到底都归结为时间的节省。——马克思 7、自知之明是最难得的知识。——西班牙 8、勇气通往天堂,怯懦通往地狱。——塞内加 9、有时候读书是一种巧妙地避开思考的方法。——赫尔普斯 10、阅读一切好书如同和过去最杰出的人谈话。——笛卡儿 11、有勇气承担命运这才是英雄好汉。——黑塞 12、只有把抱怨环境的心情,化为上进的力量,才是成功的保证。——罗曼·罗兰 13、知人者智,自知者明。胜人者有力,自胜者强。——老子 14、意志坚强的人能把世界放在手中像泥块一样任意揉捏。——歌德
新 课 标 要 求
1.化合反应:“多变一”型
( 1 )单质和氧气的反应:
如:Fe、Mg、Cu、Al、C、S、P、H2
(2 CO
)C一O2氧2_C化_O碳_+_O和_=2点_燃二_2_C氧O,化2 C碳O的2 转C化O:—C+—CO—2高 =温2CO
(3)氧化物和水的反应:
如:CO2+H2O=H2CO3,类似的反应还有SO2、 SO3;同学们可自己完成 Na2O+H2O=2NaOH,类似的还有K2O、CaO 可自己完成
身体健康,学习进步! 15、最具挑战性的挑战莫过于提升自我。——迈克尔·F·斯特利
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
nAnA0(1xA) 当反应体积不变时: CACA0(1xA) 用转化率表示反应速率: rAV 1ddA ntV 1nA0 ddtA x 用转化率表示反应进度: nA0 xA
A
.
2. 连续系统:反应物和产物在整个反应器内处于连续 流动状态,系统达到定态后,物料在反应器内没有积累, 系统中的浓度、温度等参数在一定位置处是定值,即不 随时间而变化,但在反应器中不同位置这些参数是不同 的。因此,对连续系统,物系中各参数是空间位置的函 数 连。续系统中反应速率可以表示为单位反应体积中某一反 应物或产物的摩尔流量的变化。即:
为ni,则定义反应进度为: ξni ni0
m ol
νi
或写成:
nini0 ni iξ
则:
dd A n A d B n B d S n S
用反应进度表示反应速率: r d
V dt 所有反应物和产物的反应进度都是相等的。
.
转化率:组分A反应掉的物质的量与其开始时物质的量nA,0之比。
xAnAn 0 A0nA nn A0 AnA A0
ri
dqn,i dVR
[mo/(m l 3s)]
对于均相反应,反应体积指反应混合物在反应器中所占据的体积; 对于气-固相催化反应,反应体积指反应器中催化剂床层的体积。
.
化学反应速率的表示方式
也可以表示为单位反应表面积上某一反应物或产物的摩尔 流量的变化。即:
ri dd qS n,i [m/o(m l2s)]
h3
CrO3,MoO2,TiCl4-Al(C2H5)3 AlCl3,FeCl3,CuCl2,HgCl2 SiO2-Al2O3,SiO2-MgO,沸石分子筛,活性白土 H2SO4,H3PO4,HgSO4,分子筛,离子交换树脂 H3PO4/硅藻土,AlCl3,BF3,SiO2-Al2O3,沸石分子筛
.
按反应机理进行分类
.
3.4.4 催化剂的性能指标
• 催化剂的活性 • 催化剂的选择性 • 催化剂的寿命 • 催化剂的稳定性
.
催化剂的活性 1
反应速率表示法
rm
dn A mdt
dn P mdt
[ mol
g 1 h 1]
rV
dn A Vdt
dn P Vdt
[ mol
L1 h 1]
rS
dn A Sdt
dn P Sdt
.
3.4 催化剂的性能及使用
• 催化剂是化工技术的核心, 80%化学工业过程(石油 加工、传统化学工业、食品工业、建材工业、精细化 学品工业、环保产业等)是采用催化过程来实现的。 催化剂的销售额在100-200亿美元。与催化剂相关的 工艺设备销售收入可达数千亿美元
3.4.1 催化剂在化学工业中的作用
.
(4) 反应速率
化学反应速率:单位时间内单位反应混合物体积中反应 物的反应量或产物的生成量。其表示方法因反应在间歇或 连续系统中进行而不同。
1. 间歇系统:反应物一次加入反应器,经历一定的反应时间达 到所要求的转化率后,产物一次卸出,生产是分批进行的。 若搅拌系统效果良好,则反应物系的组成,温度,压力等参 数在每一瞬间都是一致的,但随反应的进行,其值随时间而 变,故独立变量为时间。
ri
1 dni B dt
(定A组 义分 用生 的成 基的 准摩 )间 尔 () 数 时
这里的B可以是面积S或是质量W。
当用于液相反应时,反应过程中反应混合物的体积变化可忽略,
因此:
riV 1d din td d c ti [m/o m (3ls)]
.
对于多组分反应系统: A A B B L L M M
均裂
自旋不饱和的物种(自 由基型物种) 自旋不饱和分子或固体 物质 过渡金属,过渡金属氧 (硫)化物,过渡金属 盐,金属有机络合物 加氢,脱氢,氧化,氨 氧化
催化剂的表示方法
通常: • 1、用“/” 来区分载体与活性组分
如:Ru/Al2O3,Pt/Al2O3,Pd/SiO2 Au/C
• 2、用“-”来区分各活性组分及助剂 Pt-Sn/Al2O3,Fe-AL2O3-K2O
.
3.2 有关化学反应过程的理论
• 化学反应原理包括的理论体系:
1)化学热力学(chemical thermodynamics)
1.判断化学反应能否发生以及进行的方向 2.化学反应过程进行的最大限度 3.热效应
.
• 2)化学动力学(chemical kinetics)
• 1.化学反应过程进行的机理 • 2.确定化学反应速率与其影响因素的函数关系
反应类型
常用催化剂
加氢 脱氢 氧化
羰基化
聚合 卤化 裂解 水合 烷基化,异构化
Ni,Pt,Pd,Cu,NiO,MoS2,WS2,Co(CN)63Cr2O3,Fe2O3,ZnO,Ni,Pd,Pt V2O3,MoO3,CuO,Co3O4,Ag,Pd,Pt,PdCl2 Co2(CO)8,Ni(CO)4,Fe(CO)3,PdCl(Pph3)3*,RhCl2(CO)Pp
• 因此,在选择或研制催化剂时要充分考虑到操作 条件的影响,并选择适宜的配套装置和工艺流程。 此外,催化剂的价格也是要考虑的。
.
3.5 反应器的基本类型
.
酸碱型催化反应
酸碱型催化反应的反应机理 可认为是催化剂与反应物分子 之间通过电子对的授受而配位, 或者发生强烈极化,形成离子 型活性中间物种进行的催化反 应。
氧化还原型催化反应
氧化还原型催化反应机理可 认为是催化剂与反应物分子间 通过单个电子转移,形成活性 中间物种进行催化反应。
.
酸碱型及氧化还原型催化反应比较
应和个别三分子反应;零级反应、一级反应、二 级反应和分数级反应;
.
• 按反应过程控制的温度条件,分为等温反 应过程、绝热反应过程和非绝热变温反应 过程;
• 依据压力条件,分常压、负压、加压(高 压、中压、低压)反应过程;
• 依据操作方式的不同分类,分为间歇反应 过程、连续反应过程和半连续反应过程;
按催化反应系统物相的均一性进行分类
均相催化反应
非均相(又称多 相)催化反应
酶催化反应
均相催化反应是指 反应物和催化剂居 于同一相态中的反 应。
非均相催化反应是 指反应物和催化剂 居于不同相态的反 应。
.
酶催化反应同时 具进行的特定反应的选择催化作用
3 化学反应过程
化工生产的核心
.
3.1 化学反应过程的分类
• 按反应特性分类,有氧化、还原 、加氢、脱氢、 歧化、异构化、烷基化、羟基化、水解、水合、 偶合等;
• 按反应机理,分简单反应和复杂反应; • 按反应的方向,分可逆和不可逆反应; • 按反应物系的相态,分均相和非均相; • 是否催化反应; • 热效应,分吸热和放热反应; • 化学动力学角度分类,分单分子反应、双分子反
比较项目
酸碱型催化反应
催化剂与反应物之 电子对的接受或电荷密度
间作用
的分布发生变化
反应物化学变化 非均裂或极化
生成活性中间物种
自旋饱和的物种(离子型 物种)
催化剂
自旋饱和分子或固体物质
催化剂举例 反应举例
酸,碱,盐,氧化物,分 子筛
裂解,水合,脂化,烷基 化,歧化,异构化
.
氧化还原型催化反应
单个电子转移
[ mol
m 2 h 1]
rV rm S g rS
2
3
反应速度常数表示法
r k f (c) R k f ( p)
转化率表示法
CA%=反应物A转化 掉的量/流经催化床 层进料中反应物A 的总量×100%
.
催化剂的选择性
选择性(S%)
选择性因素(选择度)
.
催化剂的稳定性 化学稳定性 热稳定性 机械稳定性 耐毒稳定性
同一反应,不同反应组分的转化率在数值上可能 不 同。
关键反应物是反应物中价值最高的组分,为 使其尽可能转化,常使其他组分过量。
.
• 单程转化率:表示反应物一次通过反应器,参加反 应的某种原料量站通入反应器的反应物总量的百 分数。
XA反 组应 分 A在 器反 进应 口器 物中 料 A的的 中量 转 组 10化 分 % 0 量
• 研究工业化学反应过程,不仅要考虑微观动力 学因素,还同时需要考虑设备结构、传递过程 等宏观动力学因素
• 过程传递理论:动量传递、热量传递、质量传 递。
.
3.3 化学反应过程的主要技术指标
(1) 转化率:指某一反应物参加反应转化的数量占 该反应物起始量的百分数,用符号x表示。
某一反应物的转化量 X 该反应物的起始 1量 00% 转化率是表示反应物反应程度的指标。
• 提高反应速率和选择性 • 改变操作条件 • 有助于开发新的反应过程 • 能源开发、治理污染
.
3.4.2 催化剂的基本特征
• 催化剂本身在化学反应中化学性质和数量 均未发生变化
• 催化剂缩短达到化学平衡的时间,不能改 变平衡
• 催化剂具有明显的选择性,特定的催化剂 只能催化特定的反应
.
3.4.3 催化剂的分类
.
3.4.5 工业催化剂的使用
• 工业催化剂是指具有工业生产实际意义,可以用 于大规模生产过程的催化剂。
• 一种好的工业催化剂应具有适宜的活性、高选择 性和长寿命。
• 工业催化剂的活性、选择性和寿命除决定于催化 剂的组成结构外,与操作条件也有很大关系。这 些条件包括原料的纯度、生产负荷、操作温度和 压力等。
有:
r A :r B :r L :r M A :B :L :M
或写成:
1 Ad dAc t1 Bd dBc t1 Ld dLc t1 Md dM ct
以不同组分表示的反应速率受化学计量方程式的约束。
.
反应进度:对于间歇系统中的某反应,若反应混合物中
A
.
2. 连续系统:反应物和产物在整个反应器内处于连续 流动状态,系统达到定态后,物料在反应器内没有积累, 系统中的浓度、温度等参数在一定位置处是定值,即不 随时间而变化,但在反应器中不同位置这些参数是不同 的。因此,对连续系统,物系中各参数是空间位置的函 数 连。续系统中反应速率可以表示为单位反应体积中某一反 应物或产物的摩尔流量的变化。即:
为ni,则定义反应进度为: ξni ni0
m ol
νi
或写成:
nini0 ni iξ
则:
dd A n A d B n B d S n S
用反应进度表示反应速率: r d
V dt 所有反应物和产物的反应进度都是相等的。
.
转化率:组分A反应掉的物质的量与其开始时物质的量nA,0之比。
xAnAn 0 A0nA nn A0 AnA A0
ri
dqn,i dVR
[mo/(m l 3s)]
对于均相反应,反应体积指反应混合物在反应器中所占据的体积; 对于气-固相催化反应,反应体积指反应器中催化剂床层的体积。
.
化学反应速率的表示方式
也可以表示为单位反应表面积上某一反应物或产物的摩尔 流量的变化。即:
ri dd qS n,i [m/o(m l2s)]
h3
CrO3,MoO2,TiCl4-Al(C2H5)3 AlCl3,FeCl3,CuCl2,HgCl2 SiO2-Al2O3,SiO2-MgO,沸石分子筛,活性白土 H2SO4,H3PO4,HgSO4,分子筛,离子交换树脂 H3PO4/硅藻土,AlCl3,BF3,SiO2-Al2O3,沸石分子筛
.
按反应机理进行分类
.
3.4.4 催化剂的性能指标
• 催化剂的活性 • 催化剂的选择性 • 催化剂的寿命 • 催化剂的稳定性
.
催化剂的活性 1
反应速率表示法
rm
dn A mdt
dn P mdt
[ mol
g 1 h 1]
rV
dn A Vdt
dn P Vdt
[ mol
L1 h 1]
rS
dn A Sdt
dn P Sdt
.
3.4 催化剂的性能及使用
• 催化剂是化工技术的核心, 80%化学工业过程(石油 加工、传统化学工业、食品工业、建材工业、精细化 学品工业、环保产业等)是采用催化过程来实现的。 催化剂的销售额在100-200亿美元。与催化剂相关的 工艺设备销售收入可达数千亿美元
3.4.1 催化剂在化学工业中的作用
.
(4) 反应速率
化学反应速率:单位时间内单位反应混合物体积中反应 物的反应量或产物的生成量。其表示方法因反应在间歇或 连续系统中进行而不同。
1. 间歇系统:反应物一次加入反应器,经历一定的反应时间达 到所要求的转化率后,产物一次卸出,生产是分批进行的。 若搅拌系统效果良好,则反应物系的组成,温度,压力等参 数在每一瞬间都是一致的,但随反应的进行,其值随时间而 变,故独立变量为时间。
ri
1 dni B dt
(定A组 义分 用生 的成 基的 准摩 )间 尔 () 数 时
这里的B可以是面积S或是质量W。
当用于液相反应时,反应过程中反应混合物的体积变化可忽略,
因此:
riV 1d din td d c ti [m/o m (3ls)]
.
对于多组分反应系统: A A B B L L M M
均裂
自旋不饱和的物种(自 由基型物种) 自旋不饱和分子或固体 物质 过渡金属,过渡金属氧 (硫)化物,过渡金属 盐,金属有机络合物 加氢,脱氢,氧化,氨 氧化
催化剂的表示方法
通常: • 1、用“/” 来区分载体与活性组分
如:Ru/Al2O3,Pt/Al2O3,Pd/SiO2 Au/C
• 2、用“-”来区分各活性组分及助剂 Pt-Sn/Al2O3,Fe-AL2O3-K2O
.
3.2 有关化学反应过程的理论
• 化学反应原理包括的理论体系:
1)化学热力学(chemical thermodynamics)
1.判断化学反应能否发生以及进行的方向 2.化学反应过程进行的最大限度 3.热效应
.
• 2)化学动力学(chemical kinetics)
• 1.化学反应过程进行的机理 • 2.确定化学反应速率与其影响因素的函数关系
反应类型
常用催化剂
加氢 脱氢 氧化
羰基化
聚合 卤化 裂解 水合 烷基化,异构化
Ni,Pt,Pd,Cu,NiO,MoS2,WS2,Co(CN)63Cr2O3,Fe2O3,ZnO,Ni,Pd,Pt V2O3,MoO3,CuO,Co3O4,Ag,Pd,Pt,PdCl2 Co2(CO)8,Ni(CO)4,Fe(CO)3,PdCl(Pph3)3*,RhCl2(CO)Pp
• 因此,在选择或研制催化剂时要充分考虑到操作 条件的影响,并选择适宜的配套装置和工艺流程。 此外,催化剂的价格也是要考虑的。
.
3.5 反应器的基本类型
.
酸碱型催化反应
酸碱型催化反应的反应机理 可认为是催化剂与反应物分子 之间通过电子对的授受而配位, 或者发生强烈极化,形成离子 型活性中间物种进行的催化反 应。
氧化还原型催化反应
氧化还原型催化反应机理可 认为是催化剂与反应物分子间 通过单个电子转移,形成活性 中间物种进行催化反应。
.
酸碱型及氧化还原型催化反应比较
应和个别三分子反应;零级反应、一级反应、二 级反应和分数级反应;
.
• 按反应过程控制的温度条件,分为等温反 应过程、绝热反应过程和非绝热变温反应 过程;
• 依据压力条件,分常压、负压、加压(高 压、中压、低压)反应过程;
• 依据操作方式的不同分类,分为间歇反应 过程、连续反应过程和半连续反应过程;
按催化反应系统物相的均一性进行分类
均相催化反应
非均相(又称多 相)催化反应
酶催化反应
均相催化反应是指 反应物和催化剂居 于同一相态中的反 应。
非均相催化反应是 指反应物和催化剂 居于不同相态的反 应。
.
酶催化反应同时 具进行的特定反应的选择催化作用
3 化学反应过程
化工生产的核心
.
3.1 化学反应过程的分类
• 按反应特性分类,有氧化、还原 、加氢、脱氢、 歧化、异构化、烷基化、羟基化、水解、水合、 偶合等;
• 按反应机理,分简单反应和复杂反应; • 按反应的方向,分可逆和不可逆反应; • 按反应物系的相态,分均相和非均相; • 是否催化反应; • 热效应,分吸热和放热反应; • 化学动力学角度分类,分单分子反应、双分子反
比较项目
酸碱型催化反应
催化剂与反应物之 电子对的接受或电荷密度
间作用
的分布发生变化
反应物化学变化 非均裂或极化
生成活性中间物种
自旋饱和的物种(离子型 物种)
催化剂
自旋饱和分子或固体物质
催化剂举例 反应举例
酸,碱,盐,氧化物,分 子筛
裂解,水合,脂化,烷基 化,歧化,异构化
.
氧化还原型催化反应
单个电子转移
[ mol
m 2 h 1]
rV rm S g rS
2
3
反应速度常数表示法
r k f (c) R k f ( p)
转化率表示法
CA%=反应物A转化 掉的量/流经催化床 层进料中反应物A 的总量×100%
.
催化剂的选择性
选择性(S%)
选择性因素(选择度)
.
催化剂的稳定性 化学稳定性 热稳定性 机械稳定性 耐毒稳定性
同一反应,不同反应组分的转化率在数值上可能 不 同。
关键反应物是反应物中价值最高的组分,为 使其尽可能转化,常使其他组分过量。
.
• 单程转化率:表示反应物一次通过反应器,参加反 应的某种原料量站通入反应器的反应物总量的百 分数。
XA反 组应 分 A在 器反 进应 口器 物中 料 A的的 中量 转 组 10化 分 % 0 量
• 研究工业化学反应过程,不仅要考虑微观动力 学因素,还同时需要考虑设备结构、传递过程 等宏观动力学因素
• 过程传递理论:动量传递、热量传递、质量传 递。
.
3.3 化学反应过程的主要技术指标
(1) 转化率:指某一反应物参加反应转化的数量占 该反应物起始量的百分数,用符号x表示。
某一反应物的转化量 X 该反应物的起始 1量 00% 转化率是表示反应物反应程度的指标。
• 提高反应速率和选择性 • 改变操作条件 • 有助于开发新的反应过程 • 能源开发、治理污染
.
3.4.2 催化剂的基本特征
• 催化剂本身在化学反应中化学性质和数量 均未发生变化
• 催化剂缩短达到化学平衡的时间,不能改 变平衡
• 催化剂具有明显的选择性,特定的催化剂 只能催化特定的反应
.
3.4.3 催化剂的分类
.
3.4.5 工业催化剂的使用
• 工业催化剂是指具有工业生产实际意义,可以用 于大规模生产过程的催化剂。
• 一种好的工业催化剂应具有适宜的活性、高选择 性和长寿命。
• 工业催化剂的活性、选择性和寿命除决定于催化 剂的组成结构外,与操作条件也有很大关系。这 些条件包括原料的纯度、生产负荷、操作温度和 压力等。
有:
r A :r B :r L :r M A :B :L :M
或写成:
1 Ad dAc t1 Bd dBc t1 Ld dLc t1 Md dM ct
以不同组分表示的反应速率受化学计量方程式的约束。
.
反应进度:对于间歇系统中的某反应,若反应混合物中
