金属及其化合物章末小结
高一化学第三章金属及其化合物

高一化学第三章金属及其化合物《高一化学第三章金属及其化合物》嘿呀,说起高一化学第三章的金属及其化合物,那可真是个有趣又有点小复杂的部分呢。
咱先说说金属钠吧。
钠这玩意儿可调皮啦,就像个小捣蛋鬼。
它在自然界里可不会乖乖地自己待着,总是跟其他元素凑在一起。
你要是把钠放在水里呀,那可不得了,就像一场小闹剧开场了。
钠会在水面上到处乱窜,还发出嘶嘶的响声,就好像它特别兴奋地在跟水打招呼,“嗨,水啊,我来啦!”然后呢,溶液还会变成碱性,这都是因为钠和水反应生成了氢氧化钠。
这氢氧化钠可也是个厉害的角色,它的碱性可强着呢,在生活里都能派上大用场,像去除油污之类的。
再看看铝。
铝看起来普普通通的,但是它可有着大本事呢。
铝很轻,但是又很结实,就像那种看起来小小的但是能量满满的小精灵。
铝表面有一层氧化膜,这层膜就像它的小铠甲一样,保护着它。
不过呢,要是你想让铝发挥其他作用,有时候就得想办法把这层膜去掉。
而且铝还能和酸反应,也能和碱反应,感觉就像是个两面派,在不同的化学环境里都能混得开。
铁也是金属里的大明星啦。
铁到处都是,我们生活里好多东西都离不开铁呢。
铁容易生锈,这生锈的过程就像是铁在慢慢变老变丑。
其实就是铁和空气中的氧气还有水发生了反应,生成了铁锈。
不过人们也有办法对付这个,比如给铁涂上油漆啊,或者用一些其他的方法来阻止它生锈。
铁还能形成各种各样的化合物,像氯化铁、硫酸亚铁之类的。
氯化铁溶液是那种棕黄色的,看起来就像一杯特殊的果汁,当然可不能喝啦。
硫酸亚铁呢,还能用来给植物补充铁元素,让植物茁壮成长。
金属及其化合物在生活里的应用那也是超级广泛的。
比如镁,镁燃烧的时候会发出耀眼的白光,所以在烟花里就会用到它,就像在夜空中绽放的魔法火花。
还有铜,铜是那种有着漂亮颜色的金属,电线里很多都用铜,因为它导电性好呀,就像一个超级电导体小能手。
在学习这一章的时候,可不能死记硬背那些化学方程式。
要像交朋友一样去了解这些金属和它们的化合物。
完整版)高中化学知识点总结:金属元素及其化合物

完整版)高中化学知识点总结:金属元素及其化合物高中化学知识点总结:金属元素及其化合物一、金属元素概述1.金属元素在周期表中的位置及原子结构特征金属元素分布在周期表的左下方,目前已知的112种元素中有90种金属元素。
金属元素最外层电子数一般小于4个,仅有Ge、Sn、Pb有4个,Sb、Bi有5个,Po有6个。
金属原子半径较同周期非金属原子半径大。
金属元素形成的金属单质固态时全是金属晶体。
2.金属的分类1)按冶金工业上的颜色分:黑色金属有Fe、Cr、Mn (其主要氧化物呈黑色),有色金属则是除Cr、Mn以外的所有金属。
2)按密度分:轻金属密度小于4.5g/cm³,如Na、Mg、Al;重金属密度大于4.5g/cm³,如Fe、Cu、W。
3)按存在丰度分:常见金属如Fe(4.75%)、Al(7.73%)、Ca(3.45%)等;稀有金属如锆、铪、铌等。
3.金属的物理性质1)状态:除汞外,其他金属通常为固态。
2)金属光泽:多数金属具有金属光泽。
3)易导电和导热:由于金属晶体中自由电子的运动,使金属易导电、导热。
4)延展性:金属可以压成薄片,也可以抽成细丝。
5)熔点及硬度:金属晶体中金属离子和自由电子的作用强弱决定其熔点和硬度,最高的是钨(3413℃),最低的是汞(-39℃)。
4.金属的化学性质1)与非金属单质作用。
2)与H2O作用。
3)与酸作用。
4)与碱作用,只有Al、Zn可以。
5)与盐的作用。
6)与某些氧化物的作用。
5.金属的冶炼1)热分解法(适用于不活泼金属):2HgO=2Hg+O²,2Ag2O=4Ag+O²。
2)热还原法(常用还原剂CO、H2、C活泼金属等):Fe2O3+3CO=2Fe+3CO2,Cr2O3+2Al=2Cr+Al2O3.3)电解法(适用于非常活泼的金属):2Al2O3=4Al+3O2,2NaCl=2Na+Cl2.二、碱金属元素1.钠及其化合物1)钠的物理性质:钠是一种柔软、银白色,有金属光泽的金属,具有良好的导电、导热性,密度比水小,比煤油大,熔点较低。
金属及其化合物知识点梳理

金属及其化合物知识点梳理金属及其化合物是化学中的重要研究领域,它涵盖了广泛的知识点。
本文将对金属及其化合物的一些重要知识点进行梳理,以帮助读者全面了解金属及其化合物的特性和应用。
以下是本文的主要内容:一、金属的特性金属是一类具有特殊性质的化学元素,在自然界中广泛存在。
金属的特性主要包括良好的导电性、良好的导热性、良好的延展性和塑性、金属光泽等。
金属还具有较高的熔点和沉重的密度。
常见的金属包括铁、铜、铝、锌等。
二、金属的结构和晶格金属具有特殊的晶体结构,即金属的原子在空间中排列成一种有序的几何图形。
金属的晶体结构可分为三种类型,分别是体心立方结构 (BCC)、面心立方结构 (FCC) 和密充堆积结构 (HCP)。
不同金属的晶体结构决定了它们的物理和化学性质。
三、金属的氧化反应金属与氧气反应会产生金属的氧化物。
金属的氧化反应是一种氧化还原反应,即金属原子失去电子,被氧气原子接受电子形成氧化物。
例如,铁与氧气反应会生成铁的氧化物 (FeO)。
金属的氧化反应常见于金属的腐蚀现象。
四、金属的离子化和常见金属离子金属能够失去电子形成带正电荷的离子,即金属离子。
金属离子的形成可通过金属原子失去外层电子而达到稳定电子结构。
常见金属离子包括铁离子 (Fe2+)、铜离子 (Cu2+)、锌离子 (Zn2+) 等。
金属离子在化学反应和生物过程中起着关键的作用。
五、金属与非金属的化合物金属与非金属元素的化合物称为金属化合物。
金属与非金属的化合物有多种类型,包括金属氧化物、金属氯化物、金属硫化物等。
金属化合物具有特殊的化学性质和应用,比如金属氧化物常用于陶瓷材料的制备,金属氯化物常用于水处理和催化剂的制备。
六、金属的合金合金是由两种或多种金属元素组成的材料。
合金具有优越的物理和化学性质,比纯金属有更广泛的应用领域。
常见的合金包括钢、铜合金、铝合金等。
合金的特性取决于组成合金的金属元素、元素的配比和晶体结构。
七、金属及其化合物的应用金属及其化合物在工业生产和日常生活中有广泛的应用。
《金属及其化合物》全章复习
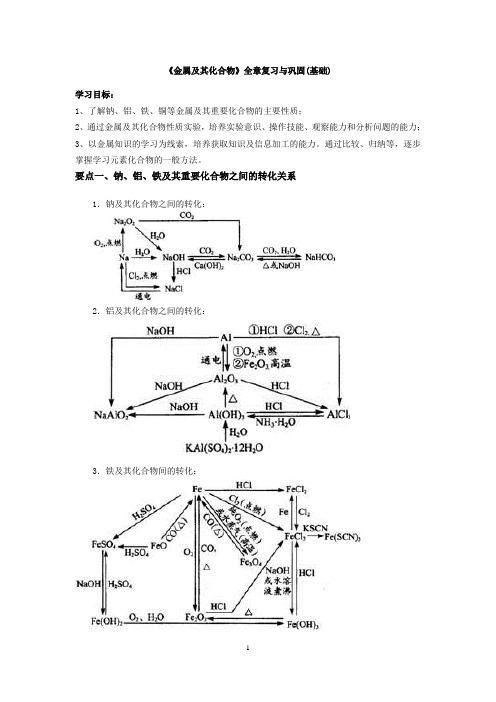
《金属及其化合物》全章复习与巩固(基础)学习目标:1、了解钠、铝、铁、铜等金属及其重要化合物的主要性质;2、通过金属及其化合物性质实验,培养实验意识、操作技能、观察能力和分析问题的能力;3、以金属知识的学习为线索,培养获取知识及信息加工的能力。
通过比较、归纳等,逐步掌握学习元素化合物的一般方法。
要点一、钠、铝、铁及其重要化合物之间的转化关系1.钠及其化合物之间的转化:2.铝及其化合物之间的转化:3.铁及其化合物间的转化:要点诠释:金属活动性顺序及其应用6.除杂(括号内为杂质)Na2CO3(NaHCO3):加热即可。
NaHCO3(Na2CO3):将混合物溶于水后通入足量CO2气体(Na2CO3+CO2+H2O=2NaHCO3),然后将溶液低温蒸干即得NaHCO3晶体。
要点三、铝三角中的图像及其相互转化问题铝元素有三种存在形式:它们之间的转化关系可用铝三角表示为:在Al3+、Al(OH)3、AlO2-的相互转化反应中,都有特定的数量关系。
用坐标图形式可把其中的定量关系概括如下。
1.向AlCl3溶液中滴加氨水至过量,离子方程式为:Al3++3NH3·H2O=Al(OH)3↓+3NH4+图像如下图所示2.向AlCl3溶液中滴加NaOH至过量,离子方程式为:Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O图像如下图所示3.KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至过量。
离子方程式为:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O(3)有色固体红色:Cu、Fe2O3(红棕色)红褐色:Fe(OH)3绿色:Cu2(OH)2CO3、FeSO4·7H2O 蓝色:Cu(OH)2、CuSO4·5H2O黑色:CuO、FeO、MnO2、炭黑浅黄色:Na2O2、AgBr白色:Fe(OH)2、CaCO3、BaSO4、AgCl、Al(OH)3、Mg(OH)2、无水CuSO4 2、特殊性质(1)在一定条件下能漂白有色物质的淡黄色固体只有Na2O2。
高中化学_金属及其化合物复习教学设计学情分析教材分析课后反思

教学设计1、线索设计:①知识素材线索:前置作业---学考真题再现,以价类二维图为载体,引导学生学习元素化合物应从类别通性和氧化还原两个角度展开,构建学习元素化合物知识的方法模型;②认识发展线索:通过每课一题构建思维方法模型,金属及其化合物的性质从类别通性和氧化还原两个角度认识,结合初中所学金属活动性顺序表,利用价类二维图的形式拓展提升,归纳总结复习金属及其化合物的一般规律,便于应用于非金属及其化合物的复习。
考察学生掌握情况,及时高效。
情感育人,润物细无声。
2、教学过程设计:每课一题(2018夏季合格考真题节选)27.利用下图可以从不同角度研究含铁物质的性质及其转化关系。
图中甲~己均含铁元素。
回答下列问题:(1)K2FeO4常用作杀菌消毒剂,从铁元素化合价的角度分析是因其具有________性;下列关于乙的说法正确的是________(填序号)。
a.属于酸性氧化物,能与碱反应b.属于碱性氧化物,能与酸反应c.属于两性氧化物,既能与酸反应,又能与碱反应(3)戊与烧碱溶液反应生成丙,放置一段时间后丙转化为丁。
丙转化为丁的化学方程式为____________________________,现象为 _________________________。
学考真题再现,让学生真切感受学考题目的难度和出题形式。
更重要的是,通过对该题价类二维图的分析,得出研究和学习金属及其化合物的思维方法和模型,即看物质→判类别→据通性→测性质,看物质→判价态→据升降→测性质。
建立模型的目的是为了应用模型,指导学生科学、高效的复习金属及其化合物。
展示金属活动性顺序表,并分析顺序表中各金属性质的相同和不同。
金属活动性顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 证据来验证推测,形成从宏观辨识→微观探析→证据推理的思维模型。
培养学生宏观辨识与微观探析的意识,运用方法模型进行物质性质学习,即为模型认知和证据推理。
最新人教版初三化学下册知识点归纳总结(按章节)

人教版初中化学下册知识点归纳总结第八单元金属和金属材料课题1金属材料一、几种重要的金属1、金属材料包括纯金属和合金。
2、人类使用最多的金属材料:Cu、Fe、Al及其合金。
注:Al与Fe相比的优点:密度小、耐腐蚀。
3、金属的物理性质:除汞外,均为固体;有金属光泽;易导电、导热;有延展性。
二、合金1、合金:在金属中加热熔合某些金属或非金属而形成的具有金属特性的混合物。
2、合金是混合物,而不是化合物。
形成合金的过程不是混合,也不是化合,是熔合。
合金中至少含一种金属。
3、合金的特性:比形成合金的金属硬度大、强度高、更耐腐蚀。
但熔点比形成合金的金属熔点低。
注:鉴别黄铜和黄金的方法:取样品放入稀盐酸或稀硫酸中,若有气泡产生,则为黄铜,反之为黄金。
(反应原理:Zn+2HCl==ZnCl2+H2↑或Zn+H2SO4==ZnSO4+H2↑)课题2金属的化学性质一、金属的化学性质1、Mg与Al常温下就能与O2反应。
2、Fe与Cu在高温时才与能反应。
结论:Mg、Al比较活泼,Fe与Cu次之,3、Au、Pt在高温时也不与O2反应。
Au、Pt最不活泼。
注:Mg、Al具有很好的抗腐蚀性的原因:因为Mg或Al在空气中与氧气反应生成了致密的氧化膜,阻止里面的金属进一步氧化。
二、金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au1、常见金属在溶液里的活动性顺序。
K→Au,金属活动性由强到弱。
①判断金属能否与酸(HCl、H2SO4)反应。
2、金属活动性顺序的应用:②判断金属与酸(HCl、H2SO4)反应的剧烈程度。
③判断金属能否与盐溶液发生反应。
3、设计实验证明金属活动性顺序的方法:方法一:利用金属能否与酸反应以及与酸反应的剧烈程度来证明。
方法二:利用金属于盐溶液之间的反应来证明。
◆例1:设计实验证明Fe比Cu活泼。
方法一:将铁片和铜片分别放入相同浓度的盐酸,铁片上有气泡,铜片无。
第三章金属及其化合物知识复习最简单
第三章 金属及其化合物一、金属的化学性质多数金属的化学性质比较活泼,具有较强的还原性,在自然界多数以化合态形式存在。
二、金属及其化合物之间的相互转化1、钠及其重要化合物之间的转化关系,写出相应的化学(离子)反应方程式。
3④①2Na + O 2 Na 2O 2 ②2Na + 2H 2O =2Na + + 2OH -+H 2 ↑③2Na 2O 2 + 2H 2O = 4Na ++4OH -+O 2↑ ④2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 2⑤CO 2+2OH -=CO 32-+H 2O ⑥OH -+ CO 2= HCO 3-⑦Na 2CO 3 + Ca(OH)2= CaCO 3 ↓+2NaOH ⑧HCO 3-+ OH - = H 2O + CO 32-⑧2NaHCO 3Na 2CO 3 +H 2O +CO 2 ↑ ⑨CO 32-+H 2O+ CO 2= 2HCO 3-2、铝及其重要化合物之间的转化关系,写出相应的化学(离子)反应方程式。
3△①4Al+ 3O 22Al 2O 3 ②2Al + 6H + = 2Al 3++3H 2↑③2Al + 2OH - +2H 2O = 2AlO 2- + 3H 2↑ ④Al 2O 3+6H +=2Al 3++3H 2O⑤Al 2O 3 + 2OH - = 2AlO 2- + H 2O ⑥Al(OH)3 + 3H += Al 3++ 3H 2O⑦Al(OH)3 + OH - = AlO 2- +2 H 2O ⑧2Al(OH)3Al 2O 3+3H 2O⑨Al 3+ + 3 NH 3·H 2O = Al(OH)3↓+ 3NH 4+ ⑩AlO 2-+ CO 2 + 2H 2O = Al(OH)3 ↓+ HCO 3- 3、铁及其重要化合物之间的转化关系,写出相应的化学(离子)反应方程式。
①③⑥Fe 3O 4 Fe FeCl 2 Fe(OH)3⑩①3Fe +2O 2 Fe 3O 4 ②2Fe + 3Cl 2 3FeCl 3③Fe + 2H += Fe 2++H 2↑ ④Fe 2++2OH -= Fe (OH)2↓⑤Fe(OH)2 + 2H += Fe 2++2H 2O ⑥4Fe(OH)2 + O 2 + 2H 2O = 4Fe(OH)3⑦Fe(OH)3 + 3H += Fe 3++ 3H 2O ⑧Fe 3++3OH - = Fe(OH)3↓⑨2Fe 2++ Cl 2 = 2Fe 3++ 2Cl - ⑩2Fe 3+ + Cu = 2Fe 2+ + Cu2+2Fe 3+ + Fe = 3Fe 2+4、其它相关方程 2Na + Cl 22NaCl 2Na + S = Na 2S 研磨爆炸 Cu + Cl 2CuCl 2澄清石灰水通入 少量CO 2+Ca 2++2OH -=CaCO 3↓+H 2O 继续过量CO 2 + CaCO 3+H 2O = Ca 2++2HCO 3-Mg+2H 2O(热水)=Mg(OH)2+H 2↑ 2Fe 2++ 2H ++ H 2O 2 = 2Fe3++ 2H 2OFe 2O 3 + 6H += 2Fe 3++ 3H 2O Fe 3O 4 + 8H += Fe 2++ 2Fe 3++ 4H 2O FeO + 2H += Fe 2++ H 2O 钠投入硫酸铜溶液中 2Na+2H 2O+Cu 2+= Cu(OH)2↓+2Na ++ H 2↑ 三、用途广泛的金属材料合金:由两种或两种以上的金属(或者金属与非金属)融合而成的具有金属特性的物质。
2024年金属及其化合物知识点汇总.docx
金属及其化合物知识点1.金属原子的最外层电子排布特点(金属原子最外层电子数较少.易失去被外层电子,)2.在的理M质上金属有哪些共性?(常JSi下除末外均为晶体.有金属光泽.是热、电的良导体,大多有良好的延展性.)3.金属的化学性成△(1)金属与女"的反应①辆与氧气反应-常温:4Na+O?==2NaQ加热:2Na+O1=Na j O1;②铝与氧气反应:一假与5(气易反应,生成较密的氧化物起保护作用4AI+3O2=2AI2O.加热铝箔时,由于外层轨化膜的端点比铝的熔点高,故焙化的液态福并不滴落.除去班化腴的缶箔加热很快生成新的钏化腴,焙化的液态铭并也不滴落.一向愕λ③铁-与氧气反应:3Fe+2O:=三=FeQa(FeQuFeO)(2)金属与水的反应①钠与水反应:2Na+2I1.0==2NaOH+H";试验现象:钠浮在水面±.熔成小球,在水面上游动,有哧哧的声音,最终消失,在反应后的溶液中滴加的散.溶液变红.②铭与水反应:加热时微加反应③秩与水反应:高温与水蒸气反应3Fc+4H2O(g)=驾R1θ4+4H2t-<3)金属与侬的反应①•钠与酸反应:⅛1.2Na♦2IIC1-2NaC1.∙H,f,如放入稀盐酸中.是先与酸反应,酸局限性再与水反应,因此Xa放入到酸中Na是不也许过胡的。
比钠与水的反应剧烈多。
②与酸反应:强氯化性酸,如浓硫酸和浓硝酸在常M下,使铝发生钝化现象:加热时,能反应,但无乳气放出:非郎制化性酸反应时放出氧气.③与酸反应:强氧化性酸:常温卜浓硫酸和浓硝酸使铁钝化。
加热时.与强辄化性反应,但无氮气放出.非强辄化性酸:铁1.j酸反应有乳气放出.<4)某些金属与城反应:和覆被溶液反应:2AI+2NaOH+2H9==2NaAQ+3H,1.<5)金属与殳溶液反应:①钠与盐的溶液反应:钠不能置换出溶液中的金属,钠是自接与水反应,反应后的碱再与溶液中的其他物质反应.如钠投入到或酸俩溶液的反应式:2Na+CυSO.+2H-0=Cu<OH⅛I+Na2SO4+比1。
重点高中化学知识点总结:金属元素及其化合物
高中化学知识点总结:金属元素及其化合物(一)金属元素概述1.金属元素在周期表中的位置及原予结构特征(1)金属元素分布在周期表的左下方,目前已知的112种元素共有90种金属元素。
(2)金属元素最外层电子数一般小于4个。
(Ge、Sn、Pb4个Sb、Bi5个,Po6个)原子半径较同周期非金属原子半径大。
(3)金属元素形成的金属单质固态时全是金属晶体。
2.金属的分类(1)冶金工业上黑色金属:Fe、Cr、Mn(其主要氧化物呈黑色)。
有色金属:除Fe、Cr、Mn以外的所有金属。
(2)按密度分轻金属:ρ<4.5g·cm–3(如Na、Mg、A1)重金属:ρ>4.5g·cm–3(如Fe、Cu、W)(3)按存在丰度分常见金属:如Fe(4.75%)、Al(7.73%)、Ca(3.45%)等稀有金属:如锆、铪、铌等。
3.金属的物理性质(1)状态:通常情况下,除汞外其他金属都是固态。
(2)金属光泽:多数金属具有金属光泽。
(3)易导电一导热:由于金属晶体中自由电子的运动,使金属易导电、导热。
(4)延展性:可压成薄片,也可抽成细丝。
(5)熔点及硬度:由金属晶体中金属离子和自由电子的作用强弱决定。
最高的是钨(3413℃),最低的是汞(–39℃)。
4.金属的化学性质(1)与非金属单质作用(2)与H2O作用(3)与酸作用(4)与碱作用(仅Al、Zn可以)(5)与盐的作用(6)与某些氧化物作用5.金属的冶炼(1)热分解法(适用于不活泼金属)2HgO=2Hg+O2↑2Ag2O=4Ag+O2↑(2)热还原法(常用还原剂CO、H2、C活泼金属等)Fe2O3+3CO=2Fe+3CO2Cr2O3+2Al=2Cr+A12O3(3)电解法(适用于非常活泼的金属)2A12O3=4Al+3O2↑2NaCl=2Na+Cl2↑(二)碱金属元素1.钠及其化合物(1)钠的物理性质钠是一种柔软、银白色,有金属光泽的金属,具有良好的导电、导热性,密度比水小,比煤油大,熔点较低。
第三章 金属及其化合物
第三章金属及其化合物第一节金属的化学性质第1课时学习目标:1、了解钠、铝、铁、铜等与氧气、水、酸、碱、盐溶液的反应情况2、掌握钠的化学性质3、通过有关实验及科学探究活动,提高独立思考、分析问题的能力和总结表达能力。
活动一:探究金属具有共同的化学性质1.画出Na Mg Al的原子结构示意图,分析其结构特点,判断它们与其他物质发生反应时做氧化剂还是还原剂?为什么?2.课本P46图3-2有关金属化学性质的一些实验:分别写出四幅图中反应的化学方程式指出①、②反应中的氧化剂和还原剂。
将③、④反应的化学方程式改成离子方程式。
①铝丝与硫酸铜反应形成铜树、②镁条燃烧、③铜丝与硝酸银溶液反应形成银树、④镁条与盐酸反应。
归纳:金属共同的物理性质有金属共同的化学性质是:通常能与等发生反应。
活动二、实验探究金属钠、铝与氧气的反应1.探究钠在常温和加热条件下与氧气反应【实验3—1】切开金属钠前先观察钠的表面,以便与切后进行比较。
切割金属钠在玻璃片上进行。
记录观察的现象:该反应化学方程式:【实验3—2】把一块绿豆大小的金属钠放在坩埚里,加热。
记录观察的现象:该反应化学方程式:2.探究铝在常温和加热条件下与氧气的反应①将未打磨和已经打磨的铝箔分别在在酒精灯火焰上加热至熔化,轻轻晃动,仔细观察实验现象?为什么会产生这种现象?思考:铝在常温下能与氧气反应,日常使用的铝制餐具为何经久耐用?活动三、实验探究金属钠、铁与水的反应1.探究钠与水的反应【实验3—3】在烧杯中加一些水,滴入几滴酚酞溶液,然后把一小块绿豆大的钠放到水中记录观察的现象:该反应化学方程式:该反应离子方程式:2.探究高温下铁与水的反应实验装置见课本P50图3-8,实验装置包括几部分。
写出反应的化学方程式活动四、实验探究金属铝与氢氧化钠反应【实验3—3】在2支小试管中分别加入5mL盐酸和5mL氢氧化钠溶液,再分别加入一小段铝片。
一段时间后,将点燃的木条分别放在两支小试管口。
