铜副族和锌副族
知识总结——铜族元素和锌族元素
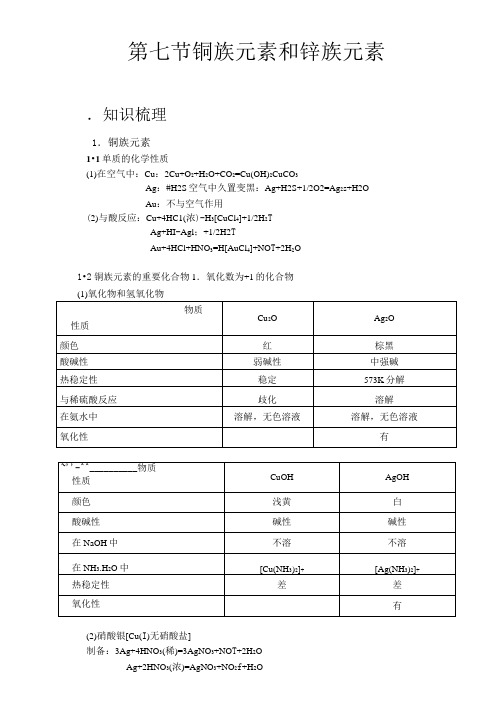
第七节铜族元素和锌族元素.知识梳理1.铜族元素1•1单质的化学性质(1)在空气中:Cu:2Cu+O2+H2O+CO2=Cu(OH)2CuCO3Ag:#H2S空气中久置变黑:Ag+H2S+1/2O2=Ag2s+H2OAu:不与空气作用(2)与酸反应:Cu+4HC1(浓)-H3[CuCl4]+1/2H2TAg+HI-Agl;+1/2H2TAu+4HCl+HNO3=H[AuCl4]+NO T+2H2O1•2铜族元素的重要化合物1.氧化数为+1的化合物(2)硝酸银[Cu(I)无硝酸盐]制备:3Ag+4HNO3(稀)=3AgNO3+NO T+2H2OAg+2HNO3(浓)=AgNO3+NO2f+H2O遇蛋白质生成黑色蛋白银,对有机组织有破坏作用,使用时勿使皮肤接触,在医药上用作消毒剂和腐蚀剂。
大量AgNO3用于制造照相底片上的卤化银,是重要的化学试剂。
(3)卤化物:①CuX2Cu2++2X-+SO2+2H2O-CuX;+4H++SO42-Cu2++2Cl-+Cu-2CuCl-2H[CuCl2]2Cu2++4I-=2CuI;+I2;CuX主要性质:在潮湿含氧环境下稳定性差:4CuCl+O2+4H2O=3CuOCuCl2^3H2O+2HCl8CuCl+O2=2Cu2O+4Cu2++8Cl-在相应卤化物中形成较稳定的卤配离子:CuX+X-=^CuX2-(无色)有一定氧化性:4CuI+Hg=Cu2[HgI4]+2Cu白暗红此反应用于检验实验室空气中的汞含量。
②AgX性质:见光分解:AgBr-Ag+Br因此AgBr用作感光材料。
(4)硫化物:Cu2S,Ag2S:黑色;难溶于水;溶于热浓硝酸3Cu2s+16HNO3(浓)一6Cu(NO3)2+3s;+4NO f+8H2O3Ag2s+8HNO3(浓)一6Ag(NO3)2+3S;+2NO f+4H2O2.氧化数为+2的化合物(1)氢氧化铜和氧化铜CuSO4+2NaOH=Cu(OH)2J+Na2SO4Cu(OH)2O①氧化铜热稳定性:在高温时明显分解2CuO1237K>Cu2O+1/2O2加热可被H2、CO、NH3还原3CuO+2NH3=3Cu+3H2O+N2②氢氧化铜(浅蓝色)微显两性(以碱性为主),可溶于浓强碱:Cu(OH)2+2OH-[Cu(OH)4]2-溶于氨水Cu(OH)2+4NH3^^[Cu(NH3)4](OH)2(2)氯化铜CuCl2无水CuCl2为共价化合物,结构为链状,其中Cu采取dsp2杂化方式。
元素周期表——精选推荐

元素周期表折叠元素表顺⼝溜我是氢,我最轻,⽕箭靠我运卫星;我是氦,我⽆赖,得失电⼦我最菜;我是锂,密度低,遇⽔遇酸把泡起;我是铍,耍赖⽪,虽是⾦属难电离;我是硼,电⼦穷,我和本族⼤不同;我是碳,反应慢,既能成链⼜成环;我是氮,我阻燃,加氢可以合成氨;我是氧,不⽤想,离开我就憋得慌;我是氟,最恶毒,抢个电⼦就满⾜;我是氖,也不赖,通电红光放出来;我是钠,脾⽓⼤,遇酸遇⽔就⽕⼤;我是镁,最爱美,摄影烟花放光辉;我是铝,常温⾥,浓硫酸⾥把澡洗;我是硅,⾊⿊灰,信息元件把我堆;我是磷,害⼈精,剧毒列表有我名;我是硫,来历久,沉淀⾦属最拿⼿;我是氯,⾊黄绿,⾦属电⼦我抢去;我是氩,活性差,霓虹紫光我来发;我是钾,把⽕加,超氧化物来当家;我是钙,⾝体爱,⾻头⽛齿我都在;我是钪,耐温⼴,⾼温合⾦我来帮;我是钛,过渡来,航天飞机我来盖;我是钒,酸碱烦,如虎添翼钢加钒;我是铬,正六铬,酒精过来变绿⾊;我是锰,价态⼴,七氧化物爆炸猛;我是铁,多⽤也,不锈钢喊我叫爷;我是钴,蓝⾊母,癌症要⽤六⼗钴;我是镍,⽆锈铁,镍钛合⾦能记忆;我是铜,⾊紫红,投⼊硝酸⽓棕红;我是锌,⼈必需,体内我⽴⼤功勋;我是镓,易熔化,六⼗七镓是奇葩;我是锗,可晶格,红外窗⼝能当壳;我是砷,颜⾊深,三价元素夺你魂;我是硒,补⼈体,⼝服液⾥有⽞机;我是溴,挥发臭,液态⾮⾦我来秀;我是氪,很耐克,通电就显橘红⾊;我是铷,碱⾦属,沾⽔烟花钾不如;我是锶,天青⽯,⼋⼗七锶帮医师;我是钇,难分离,我在特种合⾦⾥;我是锆,熔点⾼,⽯头⾥⾯很多锆;我是铌,能吸⽓,⽹络让我当NB;我是钼,像⽯墨,提⾼再结晶温度;我是锝,能放射,地壳⾥⾯我没得;我是钌,量很少,王⽔我也应得了;我是铑,光泽好,抗腐蚀性我很好;我是钯,把氢拉,吸氢我就破裂啦;我是银,不是⼈,只有硝酸氟化溶;我是镉,污染的,当年⽇本痛痛得;我是铟,软如⾦,轻微放射宜⼩⼼;我是锡,五⾦⾥,与铅熔合成焊锡;我是锑,⾮SB,虽说锑锅那是铝;我是碲,毒性低,⼜是⾦属⼜⾮⾦;我是碘,升华烟,遇到淀粉蓝点点;我是氙,很陌⽣,太阳灯啊我来填;我是铯,⾦黄⾊,⼊⽔爆炸容器破;我是钡,硫酸钡,可以⽤来检查胃;我们是镧系,个个都很稀;镧!铈!镨!⼯业维⽣素;钕能⽤来造磁铁;钷有放射性;钐!铕!钆!铽!合⾦很奇特;还有镝钬铒铥镱镥;我是铪,笑哈哈,我和锆矿是⼀家;我是钽,能抗酸,我遇强酸⽐⾦懒;我是钨,⾼温度,其他⾦属早呜呼;我是铼,催化爱,我把氢⽓吸过来;我是锇,和铱合,保持百年很耐磨;我是铱,做钢笔,只有千万分之⼀;我是铂,很贵重,含量⽐⾦还淡薄;我是⾦,很稳定,扔进王⽔影⽆形;我是汞,吸⼊痛,温度⾼低我能懂;我是铊,能脱发,投毒出名看清华;我是铅,能储电,⼦弹头⾥也出现;我是铋,半衰期,⼤于宇宙的年纪;我是钋,核能破,α粒⼦我有很多;我是砹,极少在,要找到我很难哎;我是氡,放射中,三天我就造真空;我是钫,⼈造上,廿三分钟我就亡;我是镭,千年累,我把癌细胞变没;我们是锕系,个个会放粒;锕!钍!镤!航飞做热源;铀造原⼦弹很⽜;镎也造炸弹;钚!镅!锔!锫!做核反应堆;还有锎锿镄钔锘铹;我们超锕系,我们都超重;鑪,钅杜,钅喜,钅波,钅⿊,钅麦,鐽,錀,鎶,Uut,鈇,Uup,鉝,Uus,Uuo。
讲座十五、ds区金属-锌副族

讲座十五、ds区金属-锌副族(王振山,2016.2.20,2中)[要求]:1、掌握锌族元素单质的性质及用途。
2、掌握锌、汞的氧化物、氢氧化物、重要盐类以及配合物的生成与性质。
3、掌握Hg(I)、Hg(II)之间的相互转化。
4、掌握IIA和IIB族元素的性质对比。
[重点]:1、锌、汞的氧化物、氢氧化物、重要盐类以及配合物的生成与性质。
2、Hg(I)、Hg(II)之间的相互转化。
(二)、锌族元素(ⅡB族包括锌、镉、汞三种元素,又称锌副族。
)一个d区与p区元素交界的族,锌族元素在某些性质上,与第四、五、六周期的P区金属元素有些相似,如熔点都较低、水合离子都无色等,而不像其他过渡元素。
后过渡金属元素突出的抗氧化性在这里突然消失,φӨ(Zn2+/Zn)低至-0.76V。
Zn,Cd,Hg的升华焓比其他过渡金属低得多,甚至比同周期的碱土金属还要低。
这是由于d轨道不参与成键(或参与成键较弱)引起金属-金属键较弱。
Hg:人类发现最早的金属之一,人类发现的第一个超导体金属,在Hg22+中发现的第一个金属-金属键。
一、锌副族元素的通性1与IIA族相同,但性质上却没有多少共同之处。
IIB族的次外层为18电子构型,Z*(有效核电荷Z-ó)高,故第一电离能(I1)比IIA族元素的高得多、半径小。
(这是因为n s电子穿透了(n-1)d10电子的屏蔽。
18 电子组态对原子核的屏蔽作用较小,因此锌族元素原子作用在最外层s 电子上的有效核电荷较大,原子核对最外层电子吸引力较强。
与同周期碱金属元素相比较,锌族元素的原子半径和离子半径都较小,所以锌族元素的电负性和电离能都比碱土金属元素大,锌族元素的活泼性比碱土金属元素差。
)(从Zn到Cd第一电离能降低是因为Cd有较高的主量子数,价电子离核远,较易失去价电子;而Hg的第一电离能却更大,这是由于Hg的6s电子不仅穿透5d而且还穿透4f电子的屏蔽。
)ⅡB族与ⅡA族比较:锌族元素活泼性不如碱土金属。
21 铜锌副族习题

1、在焊接金属时,用ZnCl2浓溶液清除金属表面上的氧化物(以FeO为例),写出其化学反应方程式。
解:ZnCl2(浓) + H2O = H[ZnCl2OH] (有显著的酸性)FeO + 2H[ZnCl2OH] = Fe[ZnCl2OH]2+ H2O2、试说明为什么加热HgO,会由黄色变为红色?解:加热增强了Hg2+ 对O2- 的极化3、电烙铁在长期使用后,铜制烙铁头常常有红色的粉末状物质脱落出来,请说明原因。
解:2Cu + O2== 2CuO2CuO(s) == Cu2O(s) + 1/2 O2(g)Cu2O:红色CuO分解反应属于熵推动反应,所以高温下Cu2O更为稳定4、为什么从ZnS和CdS提取Zn、Cd需经过焙烧和碳还原两步:2ZnS + 3O2== 2ZnO + 2SO2ZnO + C = Zn + CO而从HgS 提取Hg 仅灼烧即可,其反应式是HgS + O2== Hg(l) + SO2?解:HgO的热稳定性比ZnO和CdO小得多。
5、写出下列反应式:(1)向硫酸铜和氯化钠的混和浓溶液中通入二氧化硫气体;(2)将Cu片放入NaCN溶液中,当与空气隔绝时所发生的反应,当与空气接触时,所发生的反应;(3)在含CuSO4的溶液中逐渐加入氨水至过量;(4)氧化亚铜与过量盐酸反应;(5)在硝酸亚汞溶液中加入过量碘化钾溶液(6)金溶解于王水中。
解:(1)2CuSO4 + 2NaCl + SO2 + 2H2O =2CuCl↓+ Na2SO4 + 2H2SO4或2Cu2+ + 2Cl- + SO2 + 2H2O =2CuCl↓+ -24SO+ 4H+(2)Cu + 2CN- + H2O = Cu(CN)2-+21H2 + OH-4Cu + 8CN- + O2 + 2H2O = 4 Cu(CN)2-+ 4OH-(3)2Cu2+ + 2NH3·H2O + SO42-= Cu2(OH)2SO4↓+ 2NH4+Cu2(OH)2SO4 + 8NH3·H2O = 2+243)Cu(NH+ 2OH-+ 8H2O +-2SO4(4) Cu2O + 6HCl = 2H2CuCl3+ H2O、(5)Hg22++ 4I-= [HgI4]2- + Hg(灰黑)↓(6)Au + HNO3 + 4HCl = HAuCl4+ NO↑+ 2H2O6、从角银矿(AgCl)和硫化银矿(Ag2S)如何提取金属银?用化学反应方程式表示。
第16章 铜锌族元素

[Ti(H2O)6
]3+的吸收光谱
可见光互补图
14
§16.2 水溶液体系不同氧化态物种 的氧化-还原性质 的氧化 还原性质
见教材p.196图7-1,△Gθ /F-Z图 图 , 见教材 图
△Gθ /F-Z图: 有关的 φθA / V 图 Cu+/Cu Ag+/Ag Au+/Au (Cu2+/Cu +0.522 +0.80 +1.68 +0.34) Zn2+/Zn Cd2+/Cd Hg2+/Hg (Hg22+/Hg -0.76 -0.40 +0.85 +0.789) M 还 原 性 降 Mn+ 氧 化 性 升
8
主族(除 族金属性、 主族 除IIIA外)和IIIB族金属性、非金 外和 族金属性 因素占主导地位) 因素占主导地位 属性递变规律性 ( r因素占主导地位) IA IIA IIIB……IVA VA VIA VIIA 金 非 属 金 活 属 泼 活 性 泼 渐 性 强 渐 弱
9
4. 熔沸点与升华热 熔沸点与
dx2-y2和 d z2 统称 eg 轨道 群论 ,或dγ 轨道 (晶体场理论), 轨道(群论 群论) 晶体场理论), 晶体场理论
dxy ,dxz 和 dyz 统称 t2g 轨道 群论 ,或dε 轨道 (晶体场理论)。 轨道(群论 群论), 晶体场理论)。 晶体场理论
13
例. [Ti(H2O)6]3+的颜色
o
自由离子 的d 轨道
假想的球型场中 假想的球型场中 球型场 离子的d 例中心离子的 轨道
正八面体场中 正八面体场中 中心离子的d 中心离子的 轨道
无机化合物颜色大全

无机颜色表含部分元素化合物常温下物态、颜色、形态等物理化学性质卤族(英VIIA):Solid:I2 紫黑;ICl 暗红;IBr 暗灰;IF3 黄色;ICl3 橙;I2O5 白;I2O4 黄(离子晶体);I4O9 黄(离子晶体). Liquid:Br2 红棕;BrF3 浅黄绿;IBr3 棕;Cl2O6暗红;Cl2O7 无色油状;HClO4 无色粘稠状;(SCN)2 黄色油状.Gas:F2 浅黄;(CN)2无色;Cl2 黄绿;I2(g) 紫;BrF 红棕;BrCl 红;Cl2O 黄红;ClO2 黄色;Br2O 深棕;(SCN)n 砖红色固体.氧族(英VIA):Solid:S 淡黄;Se 灰,褐;Te 无色金属光泽;Na2S,(NH4)2S,K2S,BaS 白,可溶;ZnS 白↓;MnS 肉红↓;FeS 黑↓;PbS 黑↓;CdS 黄↓;Sb2S3 橘红↓;SnS 褐色↓;HgS 黑(沉淀),红(朱砂);Ag2S 黑↓;CuS 黑↓;Na2S2O3 白;Na2S2O4 白;SeO2 白,易挥发;SeBr2 红;SeBr4 黄;TeO2 白加热变黄;H2TeO3 白;TeBr2 棕;TeBr4 橙;TeI4 灰黑;PoO2 低温黄(面心立方),高温红(四方);SO3 无色;SeO3 无色易潮解;TeO3 橙色;H6TeO6 无色.Liquid:H2O 无色;纯H2O2 淡蓝色粘稠;CrO(O2)2(aq) 蓝;纯H2SO4 无色油状;SO32-(aq) 无色;SO42-(aq) 无色;SeO2(l) 橙;TeO2(l) 深红.Gas:O2 无色;O3 低浓度无色,高浓度淡蓝(鱼腥味);S2(g) 黄,上浅下深;H2S 无色;SO2 无色;H2Se 无色;H2Te 无色.卤化硫(未注明者均为无色):Liquid:SF6;S2F10;SCl4 淡黄;SCl2 红籗2Cl2 无色;S2Br2 红.Gas:SF4;SF2;S2F2.卤砜、卤化亚砜、卤磺酸:Liquid:SOCl2 白色透明;SO2Cl2 无色发烟.氮族(英VA):Solid:铵盐无色晶体;氮化金属白;N2O3 蓝色(低温);N2O5 白;P 白,红,黑;P2O3 白;P2O5 白;PBr3 黄;PI3 红;PCl5 无色;P4Sx 黄;P2S3 灰黄;P2S5 淡黄;H4P2O7 无色玻璃状;H3PO2 白;As 灰;As2O3 白;As2O5 白;AsI3 红;As4S4 红(雄黄);As4S6 黄(雌黄);As2S5 淡黄;Sb 银白;Sb(OH)3 白↓;Sb2O3 白(锑白,颜料);Sb2O5 淡黄;SbX3(XI) 白;SbI3 红;Sb2S3 橘红↓;Sb2S5 橙黄;Bi 银白略显红;Bi2O3 淡黄;Bi2O5 红棕;BiF3 灰白;BiCl3 白;BiBr3 黄;BiI3 黑↓;Bi2S3 棕黑.Liquid:N2H4 无色;HN3 无色;NH2OH 无色;发烟硝酸红棕;NO3^-(l)无色;王水浅黄,氯气味;硝基苯黄色油状;氨合电子(液氨溶液) 蓝;PX3 无色;纯H3PO4 无色粘稠状;AsX3(XI) 无色;.Gas:N2 无色;NH3 无色;N2O 无色甜味;NO 无色;NO2 红棕;PH3 无色;P2H6 无色;AsH3 无色;SbH3 无色;BiH3 无色.卤化氮(未注明者均为无色):Solid:NBr3•(NH3)6 紫,爆炸性;NI3•(NH3)6 黑,爆炸性;Liquid:NCl3;无色Gas:NF3;无色碳族(英IVA):Solid:C(金刚石) 无色透明;C(石墨) 黑色金属光泽;Si 灰黑色金属光泽;Ge 灰白;Sn 银白;Pb 暗灰;SiO2 无色透明;H2SiO3 无色透明胶状↓;Na2SiF6 白晶;GeO 黑;GeO2 白;SnO 黑;SnO2 白;Sn(OH)2 白↓;PbO黄或黄红;Pb2O3 橙;Pb3O4 红;PbO2 棕;CBr4 淡黄;CI4 淡红;GeI2 橙;GeBr2 黄;GeF4 白;GeBr4 灰白;GeI4 黄;SnF2 白;SnCl2 白;SnBr2 淡黄;SnI2 橙;SnF4 白;SnBr4 无色;SnI4 红;PbF2 无色↓;PbCl2 白↓;PbBr2 白;PbI2 金黄;PbF4 无色;GeS 红;GeS2 白;SnS 棕↓;SnS2 金黄(俗称“金粉”)↓;PbS 黑↓;PbS2 红褐;Pb(NO3)2 无色;Pb(Ac)2•3H2O 无色晶体;PbSO4 白↓;PbCO3 白↓;Pb(OH)2 白↓;Pb3(CO3)2(OH)2 铅白↓;PbCrO4 亮黄↓.Liquid:CCl4 无色;CS2 无色;GeCl4 无色;SnCl4 无色;PbCl4 无色.Gas:CO CO2 CH4 CF4 SiF4 SiH4 均为无色.硼族(英IIIA):Solid:B(无定型) 棕色粉末;B(晶体) 黑灰;Al 银白;Ga 银白(易液化);In 银灰;Tl 银灰;B2O3 玻璃状;H3BO3 无色片状;BN 白;Na2B4O7•10H2O 白色晶体;Cu(BO2)2 蓝↓;Ni(BO2)2 绿↓;NaBO2•Co(BO2)2 蓝↓;NaBO2•4H2O 无色晶体;无水NaBO2 黄晶;Al2O3 白晶;AlF3 无色;AlCl3 白;AlBr3 白;AlI3 棕;Al(OH)3 白↓;Ga2O3 白↓Ga(OH)3 白↓;GaBr3 白;GaI3 黄;In2O3 黄;InBr3 白;InI3 黄;TlOH 黄;Tl2O 黑;Tl2O3 棕黑;TlCl 白↓;TlBr 浅黄↓;TlI 黄↓(与银相似);TlBr3 黄;TlI3 黑.Liquid:BCl3 无色发烟.Gas:硼烷无色;BF3 无色(有窒息气味).碱土(英IIA):单质:银白焰色:Ca 砖红;Sr 洋红;Ba 绿.氧化物:均为白色固体.氢氧化物:白色固体Be(OH)2↓,Mg(OH)2↓.盐:多为无色或白色晶体;BeCl2 浅黄;BaCrO4 黄↓;CaF2 白↓.碱金属(英IA):单质:银白焰色:Li 红;Na 黄;K 紫;Rb 紫红;Cs 紫红.氧化物、过氧化物、超氧化物、臭氧化物:Li2O 白;Na2O 白;K2O 淡黄;Rb2O 亮黄;Cs2O 橙红;Na2O2 淡黄;KO2橙黄;RbO2深棕;CsO2 深黄;KO3 橘红.氢氧化物:白色,LiOH白↓.盐:多为无色或白色晶体且易溶于水.不溶盐↓(未注明者皆为白色晶体):LiF Li2CO3 Li3PO4 LiKFeIO6 Na[Sb(OH)6] NaZn(UO2)3(A c)9•6H2O 黄绿;M=K,Rb,Cs M3[Co(NO2)6] 亮黄;MBPh4 MClO4 M2PtCl6 淡黄;CsAuCl4.铜副族(英IB):单质:Cu 紫红或暗红;Ag 银白;Au 金黄.铜化合物:焰色绿;CuF 红;CuCl 白↓;CuBr黄↓;CuI 棕黄↓;CuCN 白↓;Cu2O 暗红;Cu2S 黑;CuF2 白;CuCl2 棕黄(溶液黄绿);CuBr2 棕;Cu(CN)2 棕黄;CuO 黑↓;CuS黑↓;CuSO4 无色;CuSO4•5H2O 蓝;Cu(OH)2 淡蓝↓;Cu(OH)2•CuCO3 墨绿;[Cu(H2O)4]2+ 蓝;[Cu(OH)4]2- 蓝紫;[Cu(NH3)4]2+ 深蓝;[CuCl4]2- 黄;[Cu(en)2]2+ 深蓝紫;Cu2[Fe(CN)6] 棕红;炔铜红↓.银化合物:AgOH 白(常温分解);Ag2O 黑;新制AgOH 棕黄(混有Ag2O);蛋白银(AgNO3滴手上) 黑↓;AgF 白;AgCl 白↓;AgBr 淡黄↓;AgI 黄↓(胶体);Ag2S 黑↓;Ag4[Fe(CN)6] 白↓;Ag3[Fe(CN)6] 白↓;Ag+,[Ag(NH3)2]+,[Ag(S2O3)2]3-,[Ag(CN)2]- 无色.金化合物:HAuCl4•3H2O 亮黄晶体;KAuCl4•1.5H2O 无色片状晶体;Au2O3 黑;H[Au(NO3)4]•3H2O 黄色晶体;AuBr 灰黄↓;AuI 柠檬黄↓.锌副族(I英IB):单质:均为银白,Hg在水溶液中的沉淀为黑色.锌化合物:ZnO 白(锌白颜料)↓;ZnI2 无色;ZnS 白↓;ZnCl2 白色晶体(溶解度极大,水溶液酸性);K3Zn3[Fe(CN)6] 白;Zn3[Fe(CN)6]2 黄褐.镉化合物:CdO 棕灰↓;CdI2 黄;CdS 黄(镉黄颜料)↓;HgCl2(升汞) 白色;HgNH2Cl 白↓;Hg2Cl2(甘汞) 白↓.汞化合物:HgO 红(大晶粒)或黄(小晶粒)↓;HgI2 红或黄(微溶);HgS 黑或红↓;Hg2NI•H2O 红↓;Hg2(NO3)2 无色晶体.ZnS荧光粉:Ag 蓝;Cu 黄绿;Mn 橙.钪副族(英IIIB):略.钛副族(英IVB):钛化合物:Ti3+ 紫红;[TiO(H2O2)2]2+ 橘黄;H2TiO3 白色↓;TiO2 白(钛白颜料)或桃红(金红石)↓;(NH4)2TiCl6 黄色晶体;[Ti(H2O)6]Cl3 紫色晶体;[Ti(H2O)5Cl]Cl2•H2O 绿色晶体;TiCl4 无色发烟液体. 锆、铪:MO2,MCl4 白.钒副族(英VB):钒化合物:V2+ 紫;V3+ 绿;VO2+ 蓝;V(OH)4^- 黄;VO4^3- 黄;VO 黑;V2O3 灰黑;V2S3 棕黑;VO2 蓝色固体;VF4 绿色固体;VCl4 暗棕色液体;VBr4 洋红色液体;V2O5 黄或砖红;水合V2O5 棕红;饱和V2O5溶液(微溶) 淡黄;[VO2(O2)2]3- 黄;[V(O2)3]3- 红棕.钒酸根缩聚:随着钒氧原子数之比的减少的,由浅黄~深红~淡黄.铌、钽:略.铬副族(英VIB):铬化合物:Cr2+ 蓝;Cr3+ 紫;Cr2O72- 橙红;CrO42- 黄;Cr(OH)4- 亮绿;Cr(OH)3灰蓝;Cr2O3 绿;CrO3 暗红色针状;[CrO(O2)2]OEt2 蓝;CrO2Cl2 深红色液体;Na2Cr2O7,K2CrO7 橙红;Ag2CrO4 砖红↓;BaCrO4 黄↓;PbCrO4 黄↓.紫红Cr2(SO4)3•18H2O——〉绿色Cr2(SO4)3•6H2O——〉桃红Cr2(SO4)3暗绿[Cr(H2O)4Cl2]Cl—冷却HCl—〉紫色[Cr(H2O)6]Cl3—乙醚HCl—〉淡绿[Cr(H2O)5Cl]Cl2[Cr(H2O)6]3+ 紫;[Cr(H2O)4(NH3)2]3+ 紫红;[Cr(H2O)3(NH3)3]3+ 浅红;[Cr(H2O)2(NH3)4]3+ 橙红;[Cr (NH3)5H2O]3+ 橙黄;[Cr(NH3)6]3+ 黄.钼、钨:MoO3 白;棕色MoCl3;绿色MoCl5;MoS3 棕色↓;(NH4)3[P(Mo12O40)]•6H2O 黄色晶状↓;WO3 深黄;H2WO4•xH2O 白色胶体.锰副族(英VIIB):锰化合物:Mn2+ 肉红;Mn3+ 紫红;MnO42- 绿;MnO4- 紫;MnO3+ 亮绿;Mn(OH)2 白↓;MnO(OH)2 棕↓;MnO2 黑↓;无水锰盐(MnSO4) 白色晶体;六水合锰盐(MnX2•6H2O, X=卤素,NO3,ClO4) 粉红;MnS•nH2O 肉红↓;无水MnS 深绿;MnCO3 白↓;Mn3(PO4)2 白↓;KMnO4 紫红;K2MnO4 绿;K2[MnF6] 金黄色晶体;Mn2O7 棕色油状液体.锝、铼:略.铁系(第四周期VIII族):铁化合物:Fe2+ 浅绿;[Fe(H2O)6]3+ 浅紫;[Fe(OH)(H2O)5]2+ 黄;FeO42- 紫红;FeO 黑;Fe2O3 暗红;Fe(OH)2 白↓;Fe(OH)3 棕红↓;FeCl3 棕红晶体;无水FeSO4 白;FeSO4•7H2O 绿;K4[Fe(CN)6](黄血盐) 黄色晶体;K3[Fe(CN)6](赤血盐) 红色晶体;Fe2[Fe(CN)6] 普鲁士蓝↓;Fe[Fe(CN)6] 黑↓;Fe(C5H5)2(二茂铁) 橙黄色晶体;M2Fe6(SO4)4(OH)12(黄铁矾,M=NH4,Na,K) 浅黄色晶体;Fe(CO)5 黄色液体.钴化合物:Co2+ 粉红;CoO 灰绿;Co3O4 黑;Co(OH)3 棕↓;Co(OH)2 粉红↓;Co(CN)2 红;K4[Co(CN)6] 紫色晶体;Co2(CO)8 黄色晶体;[Co(SCN)6]4- 紫;氯化钴脱水变色:粉红CoCl2•6H2O—325K—〉紫红CoCl2•2H2O—3l3K—〉蓝紫CoCl2•H2O—393K—〉蓝CoCl2.镍化合物:Ni2+ 亮绿;[Ni(NH3)6]2+ 紫;Ni(OH)2 绿↓;Ni(OH)3 黑↓;无水Ni(II)盐黄;Na2[Ni(CN)4] 黄;K2[Ni(CN)4] 橙;Ni(CO)4 无色液体.铂系元素(第五、六周期VIII族):Os 蓝灰色易挥发固体;Pd↓(aq) 黑;OsO4 无色有特殊气味气体;H2PtCl6 橙红色晶体;Na2PtCl6 橙黄色晶体;M2PtCl6(M=K,Rb,Cs,NH4) 黄色↓.镧系锕系元素:暂无.稀有气体元素:单质:He、Ne、Ar、Kr、Xe、Rn 无色,微溶于水;氪化合物:KrF2 无色,25℃分解;氙化合物:XeF2,XeF4,XeF6无色,熔沸点依次降低;XeOF4,XeO2F2,XeO2无色;XeO3 黄色,0℃爆炸;氙-金属配合物:XeF[RuF6],[Xe2F3][AsF6],XeF3[SbF6],XeF3[Sb2F11] 黄绿色固;XeF[Sb2F11]黄;XeF5[AsF6] 白固;XeF5[RuF6] 绿固。
d-ds-f区元素
精品课件
Cu2+ +0.17V Cu+ +0.52V Cu
2C u C uC u2
微溶于水,两性化合物,能溶于酸,也溶于浓的强碱。
4Cr 3O2 Δ 2Cr2 O 3
紫色
灰蓝
绿色
C r3 O H H C r ( O H Δ) 3 (s ) O H H C r ( O H ) - 4
Ag2CrO4。
精品课件
氯化汞和氯化亚汞
氯化汞和氯化亚汞均为直线型共价化合物
Cl Hg Hg Cl 直线型分子
1)氯化汞(HgCl2)
HgCl2易升华,俗称升汞。极毒,内服0.2~0.4g 可致死,微溶于水,在水中很少电离,主要以HgCl2分子形 式存在 。在医学上用它的稀溶液做消毒剂。
精品课件
Hg24Cl[HgCl4]2 Hg24SCN[Hg(SCN)4]2
配离子的组成同配体的浓度密切相关,在0.1mol /L Cl-离子溶液中,HgCl2、[HgCl3]-和[HgCl4]2-的浓度大致相等; 在1 mol/L Cl-离子的溶液中主要存在的是[HgCl4]2-离子。
精品课件
Hg2+与过量的KI反应,首先产生红色碘化汞沉淀, 然后沉淀溶于过量的KI中,生成无色的碘配离子:
性 增 强
Y(OH)3 中强碱
Zr(OH)4 Nb(OH)5 两性偏碱 两 性
H2MoO4 弱酸性
HTcO4 酸性
ds元素
第十一章副族元素化学第十章ds区元素第节素概述第一节ds区元素概述ds 区元素是指元素周期表中的ⅠB 、ⅡB 两族元素包括族元素,包括铜、银、金、锌、镉、汞等6种自然形成的金属元素及两种人工合成元素。
ds 区的名称是因为它们的外层电子构型:ⅠB : (n-1)d 10s 1或ⅡB :(n-1)d 10s 2从广义的角度看,ds区实际上是d区的一部分。
因本区元素次外层(n-1)d轨道已填满电子,而最外电子层构型和区相同,所以满电子,而最外电子层构型和s区相同,所以将此区域元素称为ds区元素。
ds区元素都是过渡金属。
但由于其d层电子是全充满的,所以体现的性质与其他过渡金属有所不同。
如:最高氧化态只能达到+3如:最高氧化态只能达到+3。
3第二节铜族元素(一)铜族元素的单质1.物理性质(1) 特征颜色:Cu(紫红),Ag(白),Au(黄)(2) 溶、沸点较其它过渡金属低(3) 导电性、导热性好,且Ag>Cu>Au(3)导电性导热性好且(4)延展性好铜族元素2.化学性质(1)与O 2作用)2CuO(O 2Cu 2黑⎯→⎯+∆)(CO (OH)Cu CO O H O 2Cu 322222绿⎯→⎯+++∆碱式碳酸铜Au 、Ag O 发生反应,当有沉淀剂或g 不与2发生反应,有沉淀剂或配合剂存在时,可发生反应。
5=铜族元素−−−+⎯→⎯+++4OH]4[M(CN)8CN O 2H O 4M AuAg Cu M 222,,−++⎯→⎯+++OH)(])4[Cu(NH 8NH O 2H O 4Cu 23322无色)(])[Cu(NH 243蓝+不可用铜器盛氨水O 2→O2H S 2Ag O S 2H 2Ag 2222+⎯→⎯++6银器年久变黑(2) 与酸作用铜族元素c Cu、Ag、Au不能置换稀酸中的H +d 若生成难溶物或配合物,单质还原能力则增强()2A I 2A (g)H S(s)Ag S H 2Ag 222+⎯→⎯+(g)H 2AgI 4I 2H 2Ag 2-2+⎯→⎯++−+③Cu 、Ag 、Au 可溶于氧化性酸7(二)铜的重要化合物Cu 2O CuO颜色暗红色黑色溶解性难溶于水,易溶于酸热稳定性稳定,1235熔化也不分解高C 加入氨水[Cu(NH 3)2]+(无色)微溶Cu 2O + 2H +→Cu 2++ Cu + H 2OC O +2HCl 2C Cl +H Cu 2O + 2HCl →2CuCl + H 2O 10004CuO Cu O +O C (白色)CuO + 2H +→Cu 2++ H 2O4CuO Cu 2O + O 28(二)铜的重要化合物Cu 2O CuO颜色暗红色黑色溶解性难溶于水,易溶于酸热稳定性稳定,1235 熔化也不分解高C 加入氨水[Cu(NH 3)2]+(无色)微溶Cu 2O+4NH 3+H 2O →2[Cu(NH 3)2]++2OH -在空气中被氧化4[Cu(NH 3)2]++O 2+8NH 3+2H 2O →蓝94[Cu(NH 3)4]2+(深蓝)+4OH -CuOH 不稳定,至今尚未制得为浅蓝色难溶于水2-Cu(OH)2为浅蓝色,难溶于水1.受热易脱水2[Cu(OH)4]+C 6H 12O 6(葡萄糖)→Cu 2O +C 6H 12O 7+4OH -+2H 2O Cu(OH)2 CuO + H 2O 80~90C 两性以碱性为主(葡萄糖酸)2.两性:以碱性为主+2H + →2+ O (用此反应可检查尿糖Cu(OH)2+ 2H Cu +H 2O (浅兰色)Cu(OH)2+ 2OH -→[Cu(OH)4]2-(亮兰色)3. 溶于氨水2++2OH-10Cu(OH)2+4NH 3→[Cu(NH 3)4]2 + 2OH制取:1.,Cu 2+ + Cu + 4Cl -→2[CuCl 2]-1. 在热、浓HCl 溶液中, 用Cu 粉还原CuCl 2(无色)2. 用水稀释-→2CuCl ()+2Cl -总反应:Cu 2+ + Cu + 2Cl -→ 2CuCl2[CuCl 2]2CuCl (白色) + 2Cl 应用:CuCl + CO + HCl →[CuCl(CO)] ·H 2O 11(测CO )2无水CuCl 2为棕黄色固体,是共价化合物易溶于水和有机溶剂(如乙醇、丙酮)CuCl 2溶液随c (Cl -)不同而呈不同颜色[C Cl 24H O [C (H 2+4Cl [CuCl 4]2-+ 4H 2O [Cu(H 2O)4]2+ + 4Cl -)(12(黄色) (浅蓝色)无水CuSO4为白色粉末,易溶于水,吸水性强,吸水后呈蓝色,可检验有机液体中的微量水分。
元素周期表口诀歌
元素周期表口诀歌元素周期表口诀歌元素周期表是学习化学必须掌握的一个知识点,接下来店铺搜集了元素周期表口诀歌,仅供大家参考,希望帮助到大家。
元素周期表口诀歌我是氢,我最轻,火箭靠我运卫星;我是氦,我无赖,得失电子我最菜;我是锂,密度低,遇水遇酸把泡起;我是铍,耍赖皮,虽是金属难电离;我是硼,有点红,论起电子我很穷;我是碳,反应慢,既能成链又成环;我是氮,我阻燃,加氢可以合成氨;我是氧,不用想,离开我就憋得慌;我是氟,最恶毒,抢个电子就满足;我是氖,也不赖,通电红光放出来;我是钠,脾气大,遇酸遇水就火大;我是镁,最爱美,摄影烟花放光辉;我是铝,常温里,浓硫酸里把澡洗;我是硅,色黑灰,信息元件把我堆;我是磷,害人精,剧毒列表有我名;我是硫,来历久,沉淀金属最拿手;我是氯,色黄绿,金属电子我抢去;我是氩,活性差,霓虹紫光我来发;我是钾,把火加,超氧化物来当家;我是钙,身体爱,骨头牙齿我都在;我是钛,过渡来,航天飞机我来盖;我是铬,正六铬,酒精过来变绿色;我是锰,价态多,七氧化物爆炸猛;我是铁,用途广,不锈钢喊我叫爷;我是铜,色紫红,投入硝酸气棕红;我是砷,颜色深,三价元素夺你魂;我是溴,挥发臭,液态非金我来秀;我是铷,碱金属,沾水烟花钾不如;我是碘,升华烟,遇到淀粉蓝点点;我是铯,金黄色,入水爆炸容器破;我是钨,高温度,其他金属早呜呼;我是金,很稳定,扔进王水影无形;我是汞,有剧毒,液态金属我为独;我是铀,浓缩后,造原子弹我最牛;我是镓,易融化,沸点很高难蒸发;我是铟,软如金,轻微放射宜小心;我是铊,能脱发,投毒出名看清华;我是锗,可晶格,红外窗口能当壳;我是硒,补人体,口服液里有玄机;我是铅,能储电,子弹头里也出现。
元素周期表相关记忆技巧1、化合价实质之歌化合价实质要记准,金正非负单质零;氢一氧二应记住,正负总价和为零;许多元素有变价,条件不同价不同。
注:“金正”指金属的化合价通常显正价:“非负”指非金属的化合价通常显负价。
副族元素性质归纳及解题分析
沉淀性与配位性:
杀菌性: 硝酸银遇到蛋白质即生成蛋白银,使用时请勿接触。
(3)卤化银 氟化银可溶,可由氢氟酸和氧化银或碳酸银反应而得: Ag2O+2HF=2AgF+H2O 氯化银、溴化银和碘化银都不溶于稀硝酸。
氯化银、溴化银和碘化银都具有感光性,常用于照相术。 如照相底片、印相纸上涂有一薄层含有细小溴化银的明胶。
13 铜族元素的主要化合物 一、铜的化合物 1、氧化态为+I的化合物
(1)氧化物 硫酸铜碱性溶液用葡萄糖还原,可以制得Cu2O: 其化学反应方程式为: 2[Cu(OH)4]2+CH2OH(CHOH)4CHO== 3OH+CH2OH(CHOH)4COO+3H2O+Cu2O↓
(2)卤化物
2Cu2++4I=2CuI↓+I2;定量测定铜。
2、锌与稀的非氧化性酸(盐酸、硫酸)发应较快,与氧化 性酸(硝酸)反应产物较复杂。 44ZZnn++1100HHNNOO33((稀极)稀=4)=Z4nZ(Nn(ON3O)2+3)N2+2NOH↑+4N5HO23O+3;H2O
3、锌与镉、汞不同,具有两性,可溶于强碱溶液。
Zn+2NaOH+2H2O=Na2[Zn(OH)4]+H2↑ 4、锌与铝不同,可溶于氨水,形成配离子。
下小心操作,可得到白色氢氧化银AgOH沉淀。氧化银不稳 定,加热到573K时,就完全分解。 Ag22↑ 氧化性:Ag2O+CO=2Ag+CO2↑; Ag2O+H2O2= 2Ag+O2↑+H2O 可用于防毒面具
配位性:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2)卤化铜
颜色 随着阴离子的不同而变化
结构 无限长链
•在含氯离子水溶解中 颜色 •有机溶剂 共价性
•水合物受热分解 碱式 •无水物受热分解 CuCl
白色 CuF2、黄褐色 CuCl2 和黑色 CuBr2,带有 结晶水的蓝色 CuF2·2H2O 和蓝绿色 CuCl2·2H2O。
卤化铜的颜色随着阴离子的不同而变化。
4 [Cu(NH3)2]+ + O2 + 8 NH3 + 2 H2O 4 [Cu(NH3)4]2+ + 4 OH-
由于 Cu+ 的价电子构型为 d10,所以配位化 合物不会由于 d-d 跃迁而产生颜色。
[Cu(NH3)2]Ac 溶液吸收能使催化剂中毒的 CO 气体。
[Cu(NH3)2]+ + CO + NH3 [Cu(CO)(NH3)3] +
在热的Cu(II) 溶液中加入KCN,得白色 CuCN 沉淀:
2 Cu 2+ + 4CN- CuCN + (x-1) CN-
2CuCN ↓ + (CN) 2 ↑ [Cu(CN)x]1-x (x=2∼4)
Cu 是还原剂,Cl- 是沉淀剂
CuCl 的生成使得溶液中游离的 Cu+ 浓度大大降 低,平衡向生成 Cu+ 的方向移动。
∼1.41
Au+ ∼1.68 Au
1.49
EBӨ /V
-0.222
Cu(OH)2 -0.08 Cu2O -0.360 Cu
Ag2O3 0.739 AgO 0.607 Ag2O 0.342 Ag Au(OH)3 1.45 Au
19.1.1 铜族元素的单质
1
铜副族元素单质的性质
2 铜副族元素的提取
1.铜副族元素单质的性质
在水溶液中,Cu+易发生歧化反应生成 Cu2+和 Cu:
2Cu+
Cu2+ + Cu↓
EθA / V Cu2+ 0.153 Cu+ 0.521 Cu
在 298 K时
Kθ = 1.7 × 106
Eθ右 < Eθ左,故 Cu2+ 将 Cu 氧化为 CuCl:
2 Cu 2+ + Cu + 2 Cl -
2 CuCl↓
由于 Cu+浓度的降低,使得 Eθ(Cu+/Cu) 下降, 而 Eθ( Cu2+/Cu+) 升高
EAθ / V Cu2+ 0.552 CuCl 0.122 Cu
9
Cu(III) 的化合物很少,氯化铜3 F2
K3CuF6 + 2 KCl
CuSO4 在 650 ℃下部分发生分解。
CuSO4 具有杀菌能力,被用于蓄水池、游泳池以防止 藻类生长。与石灰乳混合配制的 “波尔多”液,农业上
用来消灭植物病虫害。
(4) 配位化合物
颜色 配位数 4 缩二脲实验
•肽键
8
Cu2+ 为 d9 构型,具有顺磁性。由于可以发生 d- d 跃迁,化合物都有颜色
下面的反应也可以得到 Cu(III) 的化合物:
2 CuO + 2KO2
KCuO2 + O2
19.1.3 银的化合物
1 氧化物和氢氧化物
2 其他简单化合物
3
配位化合物
1 氢氧化物与氧化物
制备
•Ag2O •AgOH
与单齿配体一般能形成配位数 4 的正方形配 位 单 元 , 如 [Cu(NH3)4]2 + 、 [Cu(H2O)4]2 + 、 [CuCl4]2-等。
Cu2+还可以与一些有机配体,如乙二胺等,在碱 性溶液中生成配位化合物。
3.Cu(I) 和 Cu(II) 的相互转化
3 Cu3+
• 制备
2 Cu2+
• 溶液 稳定
Cu ( OH ) 2 不稳定,加热分解:
Cu(OH)2
353-363
K CuO
+ H2 O↑
在有铵根离子存在时 Cu(OH)2 + 4 NH3·H2O NH4+ [Cu(NH3)4]2+ + 4 H2O + 2OH-
氢氧化铜略显两性
Cu(OH)2 + H2SO4 Cu(OH)2 + 2 NaOH
CuSO4 + 2H2O Na2[Cu(OH)4]
4 Cu2++ 8 OH- + N2H4 2 Cu2O↓ + N2↑+ 6 H2O
Cu2+和酒石酸根 C4H4O62-的配位化合物,其溶液呈深蓝 色 有机化学中称为 Fehling (斐林) 溶液, 用来鉴定醛基,
其现象是生成红色的 Cu2O 沉淀。
Cu2O 十分稳定,在 1235 ℃ 熔化但不分解。 Cu2O 基本属于共价化合物,不溶于水。
② 与酸的反应
铜、银、金都不能与稀盐酸或稀硫酸作用而放出氢气 铜和银可溶于硝酸或热的浓硫酸:
Cu + 4HNO3 (浓) = Cu(NO3)2+ 2NO2↑ + 2H2O 3Cu + 8HNO3 (稀) = 3Cu(NO3)2 + 2NO↑ + 4H2O Cu + 2H2SO4 (浓) = CuSO4 + SO2↑ + 2 H2O
Cu (CN)43-+ OH- + 1/2 H2↑ Cu 与配位能力较弱的配体作用时,要在氧气存在 2 Cu + 8 NH3+O2 +2 H2O =
2 [Cu(NH3)4]2+ + 4 OH-
Ag,Au 也可以在有氧气存在下,与强配体作用:
4 Ag + 8 CN―+O2 +2 H2O
—— 4 [Ag(CN)2]― + 4 OH-
2. 氧化数为 +2 的化合物
1
氧化物和氢氧化物
2
卤化铜
3
含氧酸的铜盐
4
配位化合物
(1)氧化物和氢氧化物
CuO
•制备 •与酸作用 •热稳定性 •氧化性
Cu(OH)2 •制备 •热稳定性 •与氨作用 •两性
CuO
2Cu (NO3 ) 2 —— 2CuO + 4 NO2 ↑+ O2↑
2Cu + O2 —— 2 CuO
物理性质 •导电 •延展性 •合金
化学性质
(2)化学性质
1
在空气中的反应
2
与酸的反应
3
与氧气的反应
4
配位反应
1
铜副族元素的氧化态有 +1,+2,+3 三种 (n-1)d 和 ns 轨道能量相近 铜副族元素的金属性随着原子序数的增加而减弱
从 Cu 到 Au,原子半径虽增加但并不明显, 而核电荷对最外层电子的吸引力增大了许多
(3) 硫化物
制备
•直接与单质作用 •与硫化物作用
颜色 极化作用
溶解
•热浓硝酸 •氰化物
制备 用金属单质与 S 直接化合生成硫化物, 向 Cu(I) 溶液中通入 H2S 制备相应的硫化物。
颜色 硫化亚铜比氧化亚铜的颜色深 S2-的离子半径比 O2- 的大,极化作用更强。
硫化亚铜在水中的溶解度比氧化亚铜小。 Cu2S 只能溶于浓、热硝酸或氰化钠(钾)溶液中
3 Cu2S + 16 HNO3 (浓)
6 Cu(NO3 )2 +3 S+4 NO↑+8 H2O
Cu2S + 4 CN -
2 [Cu(CN) 2]- +S2-
5
(4) 配位化合物
配位数 2/3/4 被空气中氧所氧化 除氧 吸收 CO
Cu+可与单齿配体形成配位数为 2、3、4 的配位化 合物
[Cu(NH3)2]+不稳定,遇到空气变成深蓝色的 [Cu(NH3)4]2+
2 [Cu(OH)4]2- + CH2OH(CHOH)4CHO 4OH- + CH2OH(CHOH)4COOH + 2H2O + Cu2O↓
桔黄、鲜红或深棕色,帮助诊断糖尿病
实验室里,Cu2O 可由 CuO 热分解得到:
高温
4 CuO
2 Cu2O ↓ + O2 ↑
Cu2+ 盐的碱性溶液与其它还原剂反应
CuCl2 也易溶于一些有机溶剂,说明 CuCl2 具有 较强的共价性。
CuCl2·2H2O 受热时,按下式分解 2 CuCl2·2H2O Cu(OH)2·CuCl2 + 2 HCl↑ + 2H2O
用脱水方法制备无水 CuCl2时,要在 HCl 气流中进行。
无水 CuCl2 进一步受热
2 CuCl2
4 Au + 8 CN―+O2 +2 H2O
—— 4 [Au(CN )2]― + 4 OH-
19.1.2 铜的化合物
1 氧化数为 +1 的化合物
2 氧化数为 +2 的化合物
3
Cu(I) 和 Cu(II) 的相互 转化
Cu(Ⅰ) 的化合物呈白色或无色,Cu+ 价电 子构型为 d10,不发生 d-d 跃迁。
6
CuO 属于碱性氧化物,难溶于水
可溶于酸:
CuO + 2 H+
Cu2+ + H2O
CuO 的热稳定性较好,加热到1000 ℃时分解。
△
4 CuO
2 Cu2O + O2 ↑
CuO 具有氧化性,在高温下可被一些还原剂还原
可溶性的 Cu (Ⅱ) 盐中加入强碱,得到蓝 绿色的氢氧化铜:
CuSO4 + 2 NaOH —— Cu ( OH ) 2 ↓ + Na2SO4
1 Cu+
• 水合热大
• 气态 稳定
• 溶液 歧化
• 溶液 沉淀剂/络合剂
气态时,Cu+ 的化合物较稳定:
2 Cu +(g)
Cu2+ (g) + Cu(s)
△rHmθ = 866.5 kJ·mol-1
在水溶液中,电荷高、半径小的 Cu2+,其水合热 (2121 kJ·mol-1)比 Cu+ 的(582 kJ·mol-1)大得多。
•还原剂
¾物理性质 ¾制备
•葡萄糖, •稳定性
•菲林, •与稀酸
醛基
•与氨水
¾鉴定 ¾化学反应
Cu2O
Cu2O 由于晶粒大小不同呈 现出不同的颜色,如黄、桔黄、 鲜或深棕色。
