第二十章 铜族和锌族综述
知识总结——铜族元素和锌族元素
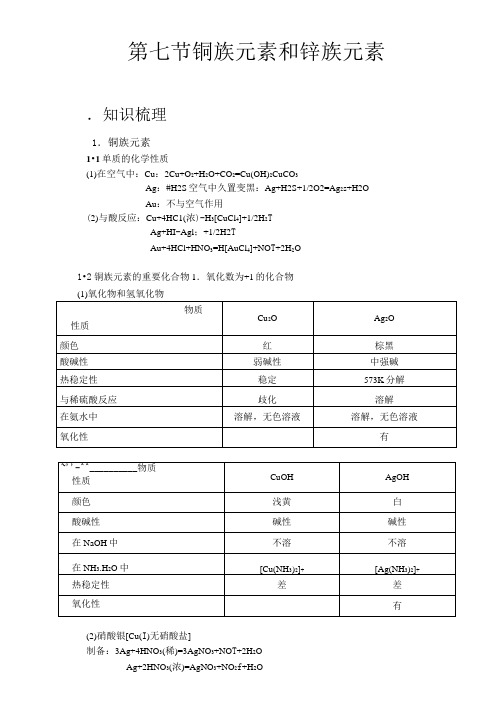
第七节铜族元素和锌族元素.知识梳理1.铜族元素1•1单质的化学性质(1)在空气中:Cu:2Cu+O2+H2O+CO2=Cu(OH)2CuCO3Ag:#H2S空气中久置变黑:Ag+H2S+1/2O2=Ag2s+H2OAu:不与空气作用(2)与酸反应:Cu+4HC1(浓)-H3[CuCl4]+1/2H2TAg+HI-Agl;+1/2H2TAu+4HCl+HNO3=H[AuCl4]+NO T+2H2O1•2铜族元素的重要化合物1.氧化数为+1的化合物(2)硝酸银[Cu(I)无硝酸盐]制备:3Ag+4HNO3(稀)=3AgNO3+NO T+2H2OAg+2HNO3(浓)=AgNO3+NO2f+H2O遇蛋白质生成黑色蛋白银,对有机组织有破坏作用,使用时勿使皮肤接触,在医药上用作消毒剂和腐蚀剂。
大量AgNO3用于制造照相底片上的卤化银,是重要的化学试剂。
(3)卤化物:①CuX2Cu2++2X-+SO2+2H2O-CuX;+4H++SO42-Cu2++2Cl-+Cu-2CuCl-2H[CuCl2]2Cu2++4I-=2CuI;+I2;CuX主要性质:在潮湿含氧环境下稳定性差:4CuCl+O2+4H2O=3CuOCuCl2^3H2O+2HCl8CuCl+O2=2Cu2O+4Cu2++8Cl-在相应卤化物中形成较稳定的卤配离子:CuX+X-=^CuX2-(无色)有一定氧化性:4CuI+Hg=Cu2[HgI4]+2Cu白暗红此反应用于检验实验室空气中的汞含量。
②AgX性质:见光分解:AgBr-Ag+Br因此AgBr用作感光材料。
(4)硫化物:Cu2S,Ag2S:黑色;难溶于水;溶于热浓硝酸3Cu2s+16HNO3(浓)一6Cu(NO3)2+3s;+4NO f+8H2O3Ag2s+8HNO3(浓)一6Ag(NO3)2+3S;+2NO f+4H2O2.氧化数为+2的化合物(1)氢氧化铜和氧化铜CuSO4+2NaOH=Cu(OH)2J+Na2SO4Cu(OH)2O①氧化铜热稳定性:在高温时明显分解2CuO1237K>Cu2O+1/2O2加热可被H2、CO、NH3还原3CuO+2NH3=3Cu+3H2O+N2②氢氧化铜(浅蓝色)微显两性(以碱性为主),可溶于浓强碱:Cu(OH)2+2OH-[Cu(OH)4]2-溶于氨水Cu(OH)2+4NH3^^[Cu(NH3)4](OH)2(2)氯化铜CuCl2无水CuCl2为共价化合物,结构为链状,其中Cu采取dsp2杂化方式。
第二十章 铜族 锌族综述

第二十章铜族锌族铜锌族处于ds区副族元素是不是过渡元素呢?一、关于过渡元素的区分1.只有ⅧB族早期使用的元素周期表是短式的,每个长周期有两行。
ⅧB为过渡位置强调的是从第一行到第二行之间过渡2.d区元素是过渡元素但d区有两种方法d区Sc Ti V Cr Mn Fe Co Ni Cu ZnY Zr Nb Mo Tc Ru Rh Pd Ag CdLa Hf Ta W Re Os Ir Pt Au HgAcd区ds区(1)(n-1)d1-10ns1-2副族除La系Ar 系以外(2)有空d电子ⅢB~ⅧB强调的是s区与p区间的过渡(3)ⅣB族~ⅠB族是过渡元素它不包括Sc副族,因为Sc3+和I1的变化Zn族最高正价为+2和Cu族不同(+1、+2、+3)不用d电子用d电子熔沸点低,金属键弱一家之说∴目前较普遍的看法是第二种其中又以ⅢB~ⅧB说法为多第一节铜锌分族的通性和单质§1-1 通性(见书P779 、P801页表)投影人们总是习惯于B ⅡB之间A---B之间进行比较一、书P800 ⅠA---ⅠB之间性质比较无一不是来源于结构二、Cu族和Zn族间性质有何不同?1.还原性Cu族< Zn族Cu族和3d和4s能量近,偶合作用强,不易失电子,而又易失去d电子,所以最高氧化态>族数周期表中除La系Ac系外独一无二的现象Zn 3d104s2全充满,偶合作用小,最高正价+2价§1-2 存在和提取人类历史上发现最早的三种金属:金、铜、银可能顺序黄铜矿CuFeS2XZ 闪锌矿ZnS 辉铜矿Cu2S 展砂HgS闪银矿Ag2S 孔雀石Cu(OH) 2CO3蓝铜矿Cu(OH) 2(CO)3角银矿AgCl甘肃铅锌矿(Ag)陕西汞锑矿一、CuFeS2Cu(本章中主要为)二、ZnS Zn三、粗汞Hg一、黄铜矿(CuFeS2) 精富集浮选矿除去脉石冰铜 粗Cu 精铜焙烧:2CuFeS 2 + O 2 Cu 2S + 2FeS +SO 22FeS + 3O 2 2FeO + 2SO 2 除渣 FeO + SiO 2 FeSiO 3顶吹 2Cu 2S(s) + 3O 2 (g) 2CuO(s) +2SO 2 (g)ΔH 0 =116.8KJ·mol ΔG 0 =78.6KJ·mol 精炼铜时 阳极泥 主要提炼贵金属的原料工业、工厂中的铜粗铜二、ZnS Zn (CdS Ca 2S 3)1.2MS(s) + 3O 2 (g) 2(MO) +2SO 2 (g)焙烧 砂子 1273K转炉 顶吹电解ΔG 0(Zn) = - 840.6 KJ·molΔG 0(Cd) = - 769.8 KJ·mol2.MO(s) + C(s) M(g) + CO(g) M = Zn ΔH 0 = 368KJ·molΔS 0 = 0.295KJ·molM = Cd ΔH 0 = 257.3KJ·molΔS 0 = 0.305KJ·mol反应温度 ~ 1100 0CCd(bp. 765 0C) Zn(907 0C)Cd 先蒸出 粗Cd 纯Cd Zn 用分级蒸馏 99.9%的ZnOr2’ ZnO Zn 2+ 电解Zn99.97%区域熔炼法 6个93.HgS HgHgS+ Fe Hg + FeSΔG 0 = - 46.7 KJ·molHgS + O 2 Hg + SO 2ΔG 0 = - 251.6 KJ·mol4HgS +4CaO 4Hg+ 3CaS + CaSO 4ΔG 0 = - 140.5 KJ·mol实验室制Hg 粗汞(Cu)H 2SO 4 Zn 除渣Cu + Hg2(NO3)2Cu(NO3)2 + 2Hg §1-3 物性(投影)书P783 804 1.Hg为液态惰性电子对效应2.ⅡB族熔点都低,且从上到下降低3.硬度小4.Ag器盛水可杀菌5.汞齐6.Hg蒸气为唯一(除稀有气体)单元子分子§1-4 化学性质(提问的方式)一、Zn + O2氧化层保护1. O2 ZnO空气(潮) Zn2(OH)2CO3 2.H2O ZnO +H↑H2O(室温) Zn(OH)2层3.Cl2 Br2 I 2表面反应,高于ZnX2沸点时完全反应S 很慢反应4. H2S ZnS层SO2ZnS + ZnO5. NH3ZnNNO NO x ZnO层HCl(g) 低于ZnCl2熔点时反应很慢HCl(稀) 2+ + H26. H2SO4 (浓) SO2+S+H2S+H2HNO3NO2 NO N2 NH4+ H2NaOH Zn(OH)42-H27. 金属氧化物置换金属卤化物置换二、Au + 王水H[AuCl4] + NOHNO3+4HCl三、2Cu + 6HCl(浓) 2H2CuCl3 + H2求算它的平衡常数Cu + e Cu E0Cu+/Cu = 0.52VCuCl + e Cu + Cl-K稳=2.0×1052H + 2e H2↑E Cu+/Cu=E0Cu+/Cu- lgQE0CuCl32-/Cu=E0Cu+/Cu - lgK稳=0.52-0.05916lg(2.0×105)V即E0CuCl32-/Cu > E0H+/H2不能反应?为什么?10.0591610.059160.21V<0.24V只要加浓HCl的浓度,即可反应推论:如何让Ag也还原出H2来?2Ag + H2S AgS + H22Ag + 2H+2Ag+ + H2↑εK HS 2H + S2-Ka1Ka22Ag+ + S2-Ag2S Ksp-1ε=-0.799V lgK=K=KKa1Ka2ksp-1=9.74×10-28×1.3×10-7×7.1×10-15×(2×10-49)-1有H2放出加快了这个反应例二.计算并判断2Ag + HI 2AgI +H2能否发生?2Ag + 2H+2Ag++ H2↑2Ag+ + 2I-2AgI Ksp=8.9×10-7向右进行作业:计算1)Cu + 4CN-+ H2O Cu(CN)43-2)2 Cu + 8NH3 + O2 + 2H2O2Cu(NH3)42+ + 4OH-第二节化合物氢氧化物氧化物硫化物卤化物§2-1氢氧化物Cu(OH)2Zn(OH)2Cd(OH)2 80~900C分解1250C 2000CΔ其他不稳定AgOH -450C稳定AgO 其中Zn(OH)2两性Cu(OH)2加40% NaOH也溶解[演示实验] Cu(OH)4- 葡萄糖§2-2氧化物有颜色的原因:极化作用 和碱金属氧化物相比Cu O∵极化作用 ∴向共价键过渡电荷迁移能↓吸收光波向长波移动一、制备(氧化物)1. 直接反应2M + O 2 2MO (Zn Cd )Cu + O 2 CuO , Cu 2OHg + O 2 HgO2.M n+和OH -反应1)Cu 2+ Zn 2+ Cd 2+2)其他Hg 2+ Ag +3.热分解含氧酸盐 Δ Δ Δ Δ2M(NO 3)2 2MO + 4NO 2 + O 2二、性质 1. 氧化性 Ag 2O +H 2O 2Ag +H 2O +O 22. CuO Cu 2O + O 2∴实验 CuSO 4·5H 2O CuSO 4CuO Cu 2O另外的例子Fe 2O 3·H 2O Fe 2O 3 Fe 3O 4 FeO 常温点燃 炼钢演示实验1)Zn 2+ + OH - Zn(OH)2不溶 why?1)Zn + NH 3 2)Zn + OH - + NH 33)ZnO + NH 3 4)Cu§2-3 硫化物ZnS 白色 CdS 黄色 其它为黑色 天然HgS 白色根据软硬酸碱规则 1)硫化物稳定2)很小一、制备:1)可直接化合制得2)阳离子 + H 2S 制得Δ Δ Δ NH 3其中ZnS Ksp 最大 可溶于强酸HCl0.1mol·l -1CdS 溶于浓盐酸 CuS 可溶于HNO 3 HgS Ksp 最小 王水将H 2S 通入M 2+溶液中M 2+ + H 2S MS + 2H + 起 0.1 0.1平 10-5 0.1 K 1K 2K= = = Ksp=2.3×10-26Ksp ZnS =2×10-22>10-26可溶于HCl K=4.6而 CuS 不溶考虑CdS 溶于HCl 的反应设[Cd 2+]=[HS]=0.1mol·l -1 求平衡时[H +]CdS + 2 H + Cd 2+ + H 2SX 0.1 0.1K=2Ka 1Ka Ksp =8.7×10-6 X=34 mol·l -1而实际浓HCl 12 mol·lCdS 不溶于HCl [H 2S] [Mn 2+] [H +]2 0.202 10-5·0.1 9.2×10-22 Ksp而实际上CdS 溶于的2 mol·l -1的HCl why?Cd 2+ + 2Cl2 CdCl 2 K 稳=3.2×10 2K=Ksp·K 稳/Ka 1·Ka 2=2.8×10-3[H +]=1.4 mol·l (如何计算,见下)CdS + 2H + + 2Cl - CdCl 2 + H 2S[]422.0X 10--=2.8×10-3 X=1.57(mol·l -1)同理 PbS 可溶于2.5 mol·l -的HCl 中若不考虑其Pb 2+ + Cl -的络合作用[H +]=30.0 mol·l -(用书上数据45.05)二、HgS + 王水 溶解HCl + KI HgI 42-Na 2S Na[HgS 2]三、ZnS + 4OH - Zn(OH)42- + S 2-§2-4卤化物Cu(ⅠⅡ) Ag(Ⅰ) Zn(Ⅱ) Hg(ⅠⅡ)一、CuX制备: 2CuCl 2 + SnCl 2 2CuCl ↓+ SnCl 42CuCl 2 + SO 2 + 2H 2O 2CuCl ↓ + H 2SO 4 + 2HCl CuCl 2 + Cu 2CuCl (并非溶液)2Cu 2+ + 5I - 2CuI + I 3-干燥CuCl 稳定 潮湿CuCl 不稳定 4CuCl + O 2 + 4H 2O 3CuO·CuCl 2·3H 2O8CuCl + O 2 2Cu 2O + 4Cu 2+ + 8Cl -可用于检测空气中含量,将涂有CuI 的纸条悬挂于空气中,如3小时(150C)不变色则达标4CuI + Hg Cu 2HgI 4 + 2Cu从亮黄至暗红色二、CuX 2 CuF 2 CuCl 2 CuBr 2白 棕 黑 极化作用问题:CuCl 2(0.1 mol·l 中有CuCl + 25%)颜色为天蓝色CuCl 2在HCl 中为黄绿色 why?生成配离子1. 制备CuCl 2·2H 2O CuCl 2 ? CuCl + 21Cl 2 100 0C 100 0C2. 磁性CuX 抗磁性CuX2顺磁性3.CuF中Cu--F键最弱(副族)可作氟化剂CuF2 + Mn MnF2 + CuTa TaF5三、AgXAg+ + X-- CN-AgO + 2HF 2AgF + H2OAgF AgCl AgBr AgI 极化作用上升1.感光材料AgX Ag +21X2(Cl Br I)显影曝光部分形成银核2AgX + + OH-2Ag + +2H2O对苯二酚显影剂其关键是含有Ag的才反应,不含Ag不反应曝光多的颜色深,少的颜色浅不曝光的:AgX + S2O32-Ag(S2O3)3-+X-定影液回收银:Ag(S2O3)3- + Fe Ag* Ag价贵,工业上、科研一直想法以Cu 代AgAgX不溶,但在X-中溶解度增大AgX2-hγAgX32- AgX43-AgCN + CN Ag(CN) 2-AgCl + Cl- 溶解度上升,不溶四、ZnX2 (ZnCl2)1.制备Zn + X2ZnX2 (Cl Br I)ZnO + 2HX ZnX2 + H2O ZnCl2极易溶于水ZnCl·H2O常见化合物有最高溶解度2.酸性ZnCl2 + H2O H[ZnCl2(OH)] FeO + 2H[ZnCl2 (OH)]Fe[ZnCl2(OH)]2 + H2O 电焊时用溶液清除氧化物3.ZnCl2溶液浓缩成Zn(OH)Cl ZnCl2·xH2O + xSOCl2ZnCl2+二氯亚砜2xHCl + xSO2如何由含水卤化物制备无水物?1)直接加热ΔMCl2·xH2O MCl2 + xH2O (M=Ca Sr Ba) M2+的水解能力极弱2)在HCl气氛下和NH4Cl一起加热,适用于有中等离解力的M2+ΔMgCl 2·6H 2O(s)Mg(OH)Cl(s) + HCl(g)+ 5H 2O(g)提问对于 Hg Hg Hg2Hg 2+ + 2e Hg 22+ 0.905V -2F ·0.905 Hg 22+ + 2e Hg 0.7986V -2F ·0.7986Hg 2+ + Hg Hg 22+ ε=0.1064V -F ·0.7986而 Hg 2+ + 2e Hg 22+ 0.8518V -2F ·0.8518Hg 22+ + 2e 2Hg 0.7986V -2F ·0.7986Hg 2+ + Hg Hg 22+ε=0.0602V -2F ·0.0602 3)M 2+水解力强的 + SOCl 2SOCl 2 + H 2O SO 2 + HCl (吸去了水又造成了HCl 气氛)五、Hg 2X 2X Hg Hg XHg 2X 2甘汞(甜的)SnCl 2SO 2 + HgCl 2 Hg 2Cl 2Hg适量 SnCl 2 + 2HgCl 2 Hg 2Cl 2 + SnCl 4 0.7986 0.905 0.8518适量Hg2Cl2 + SnCl22Hg + SnCl4HgCl2 + Hg Hg2Cl2↓升汞易升华1.甘汞电极Hg2Cl2 + 2e 2Hg(l) + 2Cl- E0=0.2682参比电极Reference electrodeHg2Cl2(s) Hg(s) + HgCl2(s)ΔG=-185.77+210.66=24.89KJ·mol>0后<40 甘汞有可能分解,由于∴甘汞有可能分解,由于ΔS>0 T↑分解越多∴含Hg2Cl2的要应放于干燥处条件变化时Hg2Cl2 + 2OH-Hg + HgO + 2Cl- + H2OHg2Cl2 + NH3Hg + Cl-Hg-NH + HCl氯化氨基汞NHCl 问:以上什么条件发生了变化?六、HgCl2Hg + X2HgX2HgO + 2HX HgX2 + H2OHg2+ + 2I-HgI2↓3000CHgSO + 2NaCl HgCl2↑+ NaSO4利用它易升华1. 溶解度 HgF 2HgCl 2 HgBr 2 HgCl 2 降低 离子化合物 共价 ∴水解 HgF + HO HgO + 2HF (80%水解)2. HgCl 2水解很弱,导电能力低HgCl 2 HgCl + + Cl - K=3.3×10-7HgCl + Hg 2+ + Cl - K=1.8×10-7说明HgCl + Cl - HgCl 3- Hg 2+ HgCl 42-少 极少易溶于有机溶剂 甲醇、丙酮试解释下列现象软硬酸碱规则演示实验 Hg 2+ + KI HgI 2 HgI 42-+KOH 和NH 4+ 红色方程式:Hg 2+ + 2I - HgI 2↓ 红色HgI + 2I - HgI 42- 无色 + KOH奈斯勒试剂NH 4Cl + 2K 2[HgI 4] + 4KOH KI Hg HgONH 2 I ↓KCl + 7KI + 3H 2O卤化物总结:1. Cu 族 Zn 族 极化作用和附加极化作用大 共价性强2. 都易挥发 HgCl 2升汞3. 氯化物溶解度和卤化物差别大 易溶 难溶 4. 易形成卤络离子,且Cl -<Br -<I -<CN -如无外加的X -时,如在CdCl 2中有CdCl + CdCl 3-等(由于软硬酸碱规则)§2-5其他化合物一、Cu(Ⅱ) CuSO 4·5H 2O 结构,见书Cu(NO 3) 2·3H 2OCu(Ac)2·H 2OCu 2[Fe(CN)6] 红棕色 Cu 2+的鉴定H H O H H O OSO 3 O OOS OO H H Cu O H H H H O H H O OSO 3 O O O S O O HH CuOH H H O HCu2+ + OH- + SO42-xCu(OH)2·yCuSO4↓生成氢氧化铜沉淀时带硫酸铜(碱式盐) 二、Ag(Ⅰ)AgNO3AgF易溶Ag + 2HNO3 (浓) AgNO3 + NO2 + H2O 快3Ag + 4HNO3 (稀) 3AgNO3 +NO +2H2O 慢权衡利弊1:3的HNO3银盐见光都分解,但AgX分解最快2Ag3PO4 + H3PO43Ag2HPO4问题:欲求3Ag2HPO42Ag3PO4 +H3PO4的平衡常数,应将上方程如何分开?3Ag2HPO46Ag+ + 3HPO4-Ksp3(Ag2HPO4)=K3sp12HPO4-2H+ + 2PO43-Ka322H+ + HPO4-H3PO4(Ka1Ka2)6Ag+ + 2PO4-2Ag3PO4Ksp-2(Ag3PO4)=Ksp2-2K=Ksp13Ka32/Ka1Ka2Ksp23三、Hg(Ⅰ)Hg 2(NO 3)2 Hg 2(ClO 4)21.制备 Hg + HNO 3 Hg 2(NO)2·nH 2O 过量 中等浓度2. 性质 水解 Hg 2(NO 3)2 + H 2O配它时应加HNO 3 Hg 2(OH)NO 3 +四、Hg(Ⅱ) Hg(NO 3)2 HgCl 2 水解,故应加HNO 3 无水Hg(NO 3)2的制法HgO + N 2O 4 Hg(NO 3)2N 2O 4 Hg(NO 3)2这又是制无水硝酸盐的方法有机化合物 Hg(CH 3)2第三节 配合物§3-1 铜(Ⅰ) Cu(NH 3)2+ CuCl 32-Cu(CN)43-Cu + + 2NH 3 Cu(NH)2+ β2=6.3×1010Cu + + 4NH 3 Cu(NH)4+ β4=4.7×1012一、演示实验Cu + NH 3水 Cu(NH 3)42+ 兰色 n 天 真空Cu + Cu(NH 3)42+ 2Cu(NH 3)2+ 求此K 稳Cu + Cu 2+ 2Cu +Cu(NH 3)42+ Cu 2+ + 4NH 3 (4.7×1012)-12Cu + + 4NH 3 Cu(NH 3)2+ (6.3×1010)2ε= 0.16-0.52 = -0.36V 8.22×10-7二、2Cu(NH 3)42+ + S 2O 5 + 4OH -2Cu(NH 3)2+ + 2SO 32- (此实验亦可演示)三、[Cu(NH 3)2]Ac + CO + NH 3[Cu(NH 3)]Ac·COΔH=-35KJ·mol 故低温有利四、以前我们讲过Cu 2+ + I - CuI + I 3-Cu 2+ + CN - CuCN + (CN)2更软硬 43-(2.5×10-50)极稳定,通入H 2S 也不沉淀Cu 2S如何分离Cu 2+和Cd 2+? (2×1030)Cu 2+ Cu(CN)43- Cd 2+ Cd(CN)42- CdS ↓(8×1016)CN -CN - H 2S五、Cu(CN)43- + e Cu + 4CN- E0=-1.27V Zn(CN)42- + 2e Zn + 4CN-=-1.26V 镀黄铜时用Cu(CN)43- Zn(CN)42-混合液§3-2Cu(Ⅱ) 配位数4 顺磁CuCl42-Cu(H2O) 2+dsp2dsp2Cu(NH3)42+Cu(en)22+CuY2-一、NaCl(s) NH3·H2OCu(H2O)42+CuCl42-Cu(NH3) 2+浅蓝绿深蓝1.1×105 4.7×1012∴Cu2+是什么颜色:以前答蓝或绿,如今绿案是配离子色§3-3 Ag(Ⅰ) Ag(NH3)2+ Ag(S2O3)3- Ag(CN) 2-其最重要的是它们之间的转换注意:Ag(NH3)2+会转化为Ag2NH和AgNH2易爆炸§3-4 Zn配合物配位数4,6(sp3 sp3d2)价键,晶体场理论都外轨型ZnCl42-Zn(NH3 2+Zn(NH3)62+一、Zn(OH)2Zn2+ + 2OH-Ksp=1.2×10-17 Zn2+ + 4NH3Zn(NH3)42+ β=6.3×1010 Zn(OH)2 + 4NH3Zn(NH3)42+ + 2OH-K=3.5×10-8别以为该反应不发生,只是因为中碱性不大,可反应,不完全如加入NH4+降低OH-的浓度Zn(OH)2 + 4NH3Zn(NH3)42++ 2OH-3.5×10-82NH4+ + 2OH-2NH3·H2O (1.8×10-5)2 Zn(OH)2 + 2NH3 + 2NH4+Zn(NH3)42+ + 2H2O K=1.1×102推论有NH4+时K增大(1.8×10-5)2=3.1×109倍对MOH型(1.8×10-5)-1=5.6×104M(OH)3 (1.8×10-5)-3=1.7×1014§3-5汞(Ⅱ)配合物 配位数4Nessler 试剂已讲过HgCl 2 + NH 4SCN (NH 4)2[Hg(SCN)4] (无色) Co[Hg(SCN)4]↓(兰色)第四节 Cu(Ⅰ) Cu(Ⅱ) 相互转化 Hg(Ⅰ) Hg(Ⅱ)Cu(Ⅰ) Cu(Ⅱ)一、Cu 2O CuO(s) + Cu ΔG 0=19.2KJ·mol -1说明Cu 2O 很稳定 而CuO ΔG 0>0也稳定 二、2CuO(s) Cu 2O(s) +21O 2(g) ΔH 0=143.7 KJ·mol -1 ΔG 0=108 KJ·mol -1 ∴在高温下ΔS>0 T Δ较大,使ΔG 0<0 在温度不太高时,可发生,向左反应三、Cu 2+ Cu + Cu由上可知2Cu + Cu + Cu 2+ ε=0.36VK= 1.3×106∴ Co 2+ 0.52 0.16 0.34Cu 2+/mol -11.3×10-2 1.3×10-4 1.3×10-6 1.3×10-8 Cu +/mol -110-4 10-5 10-6 10-7 ∴当[Cu 2+]>10-6mol·l -1 [Cu 2+]>[ Cu +]当[Cu 2+]<10-6mol·l -1 [Cu 2+]<[ Cu +]a.试解释Cu 2SO 4在水中极不稳定Cu 2SO 4CuSO 4 + Cub.如生成难溶盐或配离子使[Cu +]则可稳定存在Ksp 小 (CuI Cu 2S)K 稳大 (Cu(CN)43-越易生成Cu(Ⅰ)四、水溶液中生成Cu(Ⅰ)盐1.CuClCu + CuCl 2 + HCl(浓) CuCl 32-CuCl 32- CuCl ↓+ 2Cl -Or 2CuCl 2 + SO 2 + H 2O 2CuCl ↓+ H 2SO 4 + HCl2.CuICu 2+ + I - + e CuI(s) ΔG 0= -82.72KJ·mol -1E 0=0.86V∴E 0Cu 2+,I -/CuI > E 0I 2/I 3-∴2Cu 2+ + 5I - CuI +I 3-分析化学中Cu 2+将加入3~5倍量的I -然后水用Na2S2O3滴定五、Cu(Ⅰ)配离子如CuCl3-由于CuCl3-不够稳定∴同上2Cu2+ +6CN-2Cu(CN)2- +(CN)2Cu(CN)33-总之,生成难溶盐,配离子可使Cu(Ⅰ)存在§4-2 Hg() Hg()HgCl(s) + Hg(s) HgCl(s)ΔG0=-24.9KJ·mol-1这与Cu正好相反问题:Cu为ⅠB反而+1价不稳定Hg为ⅡB反而+2价不稳定这是因为Cu为3d104s1 , 3d和4s间偶合作用大使能级相差不大如I1I2I3 Cu 7.73ev 20.29ev 36.83ev 从电离能中也看不出明显的不同所以不象K那样为+1价而Hg 由于多谢电子对效应:Hg 22+有6s 电子 何去何从 Hg 2+无6s 电子水溶液中 Hg(NO 3)2 + Hg Hg 2(NO 3)2 更易生成Hg 2+ Hg 22+ Hg Hg 2+ + Hg Hg 22+ ε=0.131V K=166Cu +反应(歧化)平衡常数106 故逆转难 Hg 2+ + Hg Hg 22+反应K=166 逆转易一、 生成Hg(Ⅱ)难溶盐1.Hg 2Cl 2 + 2NH 3 NH 2Hg 2 NH 4ClNH 2Hg 2Cl NH 2HgCl ↓+ Hg ↓ 2.Hg 2(NO 3)2 Hg 2S HgS + S10-45 4×10-53二、 生成Hg(Ⅱ)配离子Hg 2(NO 3)2 + 2HCl Hg 2Cl 2↓+ 2HNO 3 Hg 2Cl 2 + 2HCl(浓) Hg 2[HgCl 4] + HgHgBr 42- HgI 42- Hg(SCN)42- Hg(CN)42-比HgCl 42-还稳定故Hg 22+ + Br -(I - SCN - CN -)亦反应,生成 0.920 0.789 H 2SHg2X2↓然后X -过量时HgX42-三、其他方法(氧化还原)2HgCl2 + SnCl2Hg2Cl2↓+ SnCl4Hg2Cl2 + SnCl22Hg↓+ SnCl4反之Hg2(NO3)2 + 4HNO32Hg(NO3)2 + 2NO2 + 2H2O第五节化学反应系统比化学反应,千千万万,要想将它们一一记住是不可能的如Cu Ag Hg的酸碱反应,沉淀反应,络合反应以Ag为例(1)对Ag的难溶(强酸制弱酸)AgAc + HNO3AgNO3 + HAc2Ag2CrO4 + 4HNO34AgNO3 +H2Cr2O4 + H2O (why Ag2S不反应?)(2)K稳不大的配合物可用浓度积小的沉淀Ag(NH3)2+ + Br-AgBr↓+ 2NH3Ag(S2O3)23+ + I-AgI↓+ 2S2O3 2-(3)沉淀间的转化Ag2O + H2O + 2I-2AgI + 2OH-如何确定它们之间的关系呢?见表(投影)[解释]我们以前的顺序是:同类比Ksp K稳那么,不同类呢?比E0注意1.Ag2C2O4 + CO32-Ag2CO3+ C2O42-K=1.4Ag2CO3 + CrO42-Ag2CrO4+ CO32- K=4.0反应进行不完全注意2. Ag(CN)-不可以生成AgCl 但如向其中加HCl则Ag(CN)- + 2H+ + Cl-AgCl↓+ HCN 问题:金属活动性顺序表K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au以前此顺序颠倒,后因电极势才改过来而Cu2+ + 2e Cu E0=0.34VHg2+ + 2e Hg E0=0.845VAg + + e Ag E 0=0.799V 怎么回事? 为什么没有改过来提示:以前 Fe + 2HCl FeCl 2 + H 2 2Fe + 6HCl 2FeCl 3 + 3H 2 老师是怎么讲的?故 Hg 2+ Hg 22+ Hg是不是只生成低价的 那为什么以Cu 2+ Cu而不以Cu + Cu 呢?Cu 2+ Cu + Cu 其关键是看哪一个稳定Fe 3+ Fe 2+ Fe 0.920 0.789 0.8450.158 0.522 0.34020.77 -0.44 -0.44。
铜族和锌族元素

金Au
二、金属冶炼
富集用浮选法 铜矿石 富集
沸腾炉 焙烧 铜的冶炼
923-1073K 反射炉 制冰铜 1773-1823K
有关冶炼反应
电解精炼
转炉 制粗铜
高温吹入空气
焙烧:2CuFeS2+O2 === Cu2S+2FeS+SO2 比铜活泼的金属 制冰铜: 2FeS+3O2 === 2FeO+2SO2 杂质溶解于溶液中 FeO+SiO2 ===FeSiO3 mCu2S+nFeS ==Cu2S·nFeS (冰铜) 制粗铜:2Cu2S+3O2 === 2Cu2O+2SO2 2Cu2O+Cu2S === 6Cu+SO2↑ 比铜不活泼 电解精炼 阳极(粗铜):Cu=Cu2++2e 的金属杂质沉 阴极(纯铜):Cu2++2e=Cu 8 于阳极泥中 电解反应 Cu(粗铜)===Cu(纯铜)
12
氧化铜或氢氧 化铜与氢卤酸 反应可得到卤 化铜。
无水盐强热分解 卤化铜的性质 为氯化亚铜:
与Cu2O类似, 卤化亚铜溶于 773K 氨水而容易被空气氧化: 2CuCl ====2CuCl+Cl ↑
2 2
CuCl+2NH3·H2O[Cu(NH3)2]++Cl-+2H2O
4[Cu(NH3)2]++8NH3·H2O+O2=4[Cu(NH3)4]2++4OH-+6H2O CuCl2为链状共 价物,溶于水、 乙醇和丙酮 Cl Cu Cl 溶液中结晶出来的 氯化铜含有两个结 晶水,加热分解成 为碱式盐,所以无 水物应在氯化氢气 流中干燥 Cl Cl Cu Cl Cl Cu Cl Cl Cu Cl Cl
酸 铜 的 用 途
生 液配 :CuSO4·5H2O:CaO:H2O=1:1:100 16 制 ,加 溶液,用于 水 中可
铜副族和锌副族优秀课件

前言
铜副族(I B): 原子核外价层电子的构型 :(n-1)d10ns1 常见氧化态:
铜 (+1,+2 ) 银 (+1) 金 (+1,+3)
铜、银、金被称为“货币金属”。 在自然界中,铜、银、金可以以单质状态、也可以以化 合态存在。
铜储量居世界第三位。以三种形式于自然界:
Cu(OH)2 -0.08 CuO2 -0.360 Cu
Ag2O3 0.739 AgO 0.607 Ag2O 0.342 Ag Au(OH)3 1.45 Au
Zn2+ -0.7618 Zn
Cd2+ >-0.6 Cd22+ <-0.2 Cd
-0.4030
Hg2+ 0.92
Hg22+ 0.789 Hg
自然铜:又称游离铜,很少;
硫化物矿:辉铜矿Cu2S、黄铜矿CuFeS2 等; 含氧矿物:赤铜矿Cu2O、黑铜矿CuO、
孔雀石CuCO3·Cu(OH)2、 胆矾CuSO4·5H2O等。
银主要是以硫化物形式存在的,除了较少的闪银矿Ag2S 外,硫化银常与方铅矿共存。
金矿主要是以自然金形式存在,包括散布在岩石中的岩 脉金和存在于沙砾中的冲积金两大类。
而Cu与配位能力较弱的配体作用时,要在氧气存在 下方能进行:
2 Cu + 8 NH3+O2 +2 H2O 2 [Cu(NH3)4]2+ + 4 OH-
铜在生命系统中起着重要作用,人体有30多种含 有铜的蛋白质和酶。血浆中的铜几乎全部结合在 铜蓝蛋白中,铜蓝蛋白具有亚铁氧化酶的功能, 成CuO。在高温下 CuO又分解为Cu2O。
银和金没有铜活泼,高温下在空气中也是稳定的。 与卤素作用,与硫作用,都反映出铜、银、金的活泼 性是逐渐减弱的。 铜与一些强配体作用放出H2,如CN-
铜族和锌族

3、活泼性顺序 Au3++3e-==Au =1.42V Ag2++e-==Ag+ =1.987V Ag++e-==Ag =0.7996V Cu++e-==Cu =0.52V K++e-==K =-2.925V 化学活泼性远小于碱金属; 从上到下,金属活泼性递减;与碱金属的变化 规律相反。 4、氢氧化物的碱性和稳定性 氢氧化物的碱性较弱,且极易脱水形成氧化物, 而碱金属氢氧化物是强碱,对热非常稳定。
化学与生命科学学院
专业基础课
无机化学
-----铜族和锌族
目
铜 族 元 素 锌 族 元 素
录
本 章 要 求 作 业
基本要求
1.了解铜、银、锌、汞单质的性质和用途
2.掌握铜、银、锌、汞氧化物及盐的性质
3.掌握Cu(I)Cu(II)Hg(I)Hg(II)之间的相互转化
4.掌握IA与IB、IIA和IIB族元素的对比
2 H2O+ 2Cu + 8 NH3 + O2
+ 4OH 2[Cu(NH3)4]
2+
所以在合成氨工厂不能用铜阀门或管道
Cu能直接溶于KCN溶液(生成[Cu(CN)2]-):
2 Cu+ 8 CN + 2 H2O
-
-
2 [Cu(CN)4] +H 2 +2OH
-
3-
-
在有氧时Ag和Au也能溶于KCN中,金还能溶 于王水
(3 )硫化物 Cu2S是黑色化合物溶解度很小,不溶于水和非氧 化性酸。如可溶于氧化性的硝酸: Cu2S+HNO3=== Ag2S+HNO3=== Cu2S可溶于KCN生成[Cu(CN)2]在硫酸铜溶液中,加入硫代硫酸钠溶液共热生成 硫化亚铜沉淀,在分析化学中以此反应除去铜,相应 的化学反应方程式:
《铜锌副族教学》课件

2
锌的应用
锌用于镀层、防腐剂和电池。它还是合金制备和冶金工艺中的重要成分。
3
铜和锌的合金
铜和锌可以形成黄铜合金,它具有抗腐蚀性和良好的加工性能,广泛用于制作钟 表、乐器和装饰品等。
结语
通过本课程,您了解了铜锌副族的概述、铜和锌的化学性质以及它们的应用。希望本课程能够加深您对铜锌副 族的认识,为您学习和工作提供参考。
周期趋势
铜锌副族的元素在周期表中具有递增的原子半径和离子半径,以及递减的电负性。
铜的化学性质
物理性质
铜是一种具有良好导电性和导 热性的金属,常见的铜的形态 包括固体、线和片。
化学性质
铜与氧气反应生成黑色的氧化 铜,可以通过还原来获得纯铜。
化合物
铜可以形成多种化合物,如硫 酸铜、氯化铜和氨合铜等。
锌的化学性质
《铜锌副族教学》PPT课 件
铜锌副族教学课程涵盖了铜锌副族的概述、化学性质和应用。通过本课程, 您将深入了解这两种元素的重要性及其在实际应用中的多样化。
铜锌副族的概述
特点
铜锌副族的特点包括高导电性、良好的韧性和电子外层的1个和2个电子结构。
元素
铜锌副族的主要元素包括铜、锌、镍和银,它们在周期表中具有相似的性质。
1 物理性质
锌是一种具有金属光泽的 蓝白色金属,可以在空气 中形成一层保护性的氧化 层。
2 化学性质3 化合物锌与盐酸反应会产生氢气, 可以通过电解还原来获得 纯锌。
锌可以形成多种化合物, 如氯化锌、硫酸锌和氧化 锌等。
铜和锌的应用
1
铜的应用
铜广泛用于电子设备、建筑材料和制作艺术品。它还是制作导线和管道的重要材 料。
铜族元素和锌族元素
Cu2O 不溶于水,对热稳定,在潮湿空气中缓慢被氧化成 CuO。它具 有半导体性质,曾用作整流器的材料。 Cu2O 的制备有干法和湿法: Cu2O 的干法制备在密闭容器中煅烧铜粉和 CuO 的混合物,即 得暗红色的 Cu2O: Cu+CuO→Cu2O Cu2O 的湿法制备在水溶液中,以硫酸铜为原料,亚硫酸钠为还 原剂,陆续加入适量氢氧化钠,反应过程中溶液维持微酸性 (pH=5) ,Cu2O 即按以下反应析出: 2CuSO4+3Na2SO3→Cu2O↓+3Na2SO4+2SO2↑ Cu2O 溶于稀硫酸,之后立即歧化: Cu2O+H2SO4→CuSO4+Cu+H2O Cu2O 溶于氨水和氢卤酸时,仍保持+的氧化值,分别形成稳定 的无色配合物,例如[Cu(NH3)2]+、[CuX2]-、[CuX3]2-等。 Cu2O+4NH3·H2O→2[Cu(NH3)2]OH+3H2O 可见 Cu+在水溶液中不稳定会发生岐化反应,而 Cu(I)在固相或 配位状态下可以稳定存在。 (2)氯化亚铜(CuCl) CuCl 为白色固体物质,属于共价化合物,其熔体导电性差。通 过测定其蒸气的相对分子质量,证实它的分子式应该是 Cu2Cl2,通 常将其化学式写为 CuCl。CuCl 是重要的亚铜盐,在有机合成中用 作催化剂和还原剂,在石油工业中作为脱硫剂和脱色剂,肥皂、脂
13.1.1 过渡元素的电子构型
过渡元素的原子结构特点是它们的原子最外层大多有 2 个 s 电 子(少数只有 1 个 s 电子,Pd 无 5s 电子),次外层分别有 l~10 个 d 电子,其价层电子构型为(n-1)d1-10ns1-2,其中ⅠB 和ⅡB 族为(n- 1)d10ns1-2。由于过渡元素原子最外层只有 1~2 个电子,较易失 去,故过渡元素都是金属元素。
铜族和锌族
铜族元素与碱金属元素的比较
1、与同周期的IA相比,铜族元素的原子半径较小,
第一电离能较大,最外层的电子难失去,故活泼性
不如IA; 2、铜族元素有+1、+2、+3三种氧化态,而碱金属 元素则只有+1氧化态; 3、IB的标准电极电势比IA的要大,故IB在水溶液中
的化学活泼性远小于IA的。
一、
1、
铜族元素
b、 卤化物 CuCl 、CuBr和CuI都是难溶化合物,且溶解度依次 减小。
均为白色。
都可以通过二价铜离子在相应的卤离子存在的条件 下被还原得到,如: Cu2+ + Cu + 4 Cl - 2 Cu2+ + 4 I- 2 [CuCl2]- (土黄色) 2 CuI ↓ + I2
CuCl不溶于硫酸、稀硝酸,但可溶于氨水、浓盐酸
一些黄金矿山多是先用汞齐法,再用氰化法,两种方
法联合使用。 金的精制是通过电解 AuCl3 的盐酸溶液完成的,纯度 可达 99.95% - 99.98%。
2、
铜的化合物
铜的常见氧化数为 +1、+2,本节重点介绍常见的
Cu(I)、Cu(II)化合物,以及两种价态之间的转换。
(1) 氧化数为 +1 的化合物 a、 氧化物和氢氧化物 Cu2O由于晶粒大小不同呈现出 不同的颜色,如黄、桔黄、鲜红或
但是,由于 ds 区元素原子的次外层有18 个电子, 而 IA与IIA元素原子次外层有8个电子,因此,无论是 单质还是化合物都表现出显著的差异。
如氯化钠易溶,而氯化银难溶;氧化镁和氧化锌
都难溶,但氧化镁呈碱性,而氧化锌呈两性。
希望通过学习,相互比较,加深理解。
铜族和锌族的元素电势图 EA
Ө /V
硫化物矿:辉铜矿Cu2S、黄铜矿CuFeS2 等;
铜和锌
铜族与碱金属元素的对比
原因在于它们电子构型的不同。铜族元素次外层 比碱金属多10个d电子。由于d电子屏蔽核电荷的 作用较小,致使铜族元素的有效核电荷比相应的 碱金属元素增大,核对价电子吸引力增强,第一 电离能增大,活泼性比碱金属差。
与主族元素相反
§1 铜族元素
Cu 价电子层结构 主要氧化数 ψθ(M+/M) r(M)/pm 升华热 电负性 金属活性 3d104s1 +1,+2 0.521 127.8 340 1.90 Ag 4d105s1 +1,(+2) 0.799 144.4 285 1.93 逐渐降低 Au 5d106s1 +1,+3 1.68 144.2 385 2.54 0.98~0.97 逐渐增强 IA ns1 +1 -2.7~-2.9
I2+2Na2S2O3→Na2S4O6+2NaI
CuCl的氨溶液或盐酸溶液能吸收CO,形成配合物 [Cu(CO)Cl]H2O-测气体混合物中CO含量。 CuCl:难溶于H2SO4,稀HNO3,但能溶于氨水、浓盐 酸及碱金属氯化物的浓溶液形成Cu(NH3)2+,CuCl2(CuCl32-,CuCl43-)
铜族元素的(n-1)d 轨道与ns 轨道能级差较小
一、铜族元素的单质
物理性质:
⑴ 特征颜色 Cu(紫红),Ag(银白),Au(金黄)
⑵ 熔、沸点较其它过渡金属低,比IA金属高
⑶ 导电性、导热性好,且Ag>Cu>Au
⑷ 延展性好 ⑸ 易形成合金 黄铜(Cu-Zn)
金的质量分数用 “K”表示,1 K 表示金的质量分数为 4.166%,纯金为 24 K 金。
?
比碱土金属单质低,也比铜族元素 单质低,由于锌族元素原子的最外 层 s 电子成对后稳定性增大的缘故。
常见金属元素及其化合物—铜族和锌族元素及其化合物的性质识用
它们都可形成许金多合金。
2. 物理性质
(1) 特征颜色:Cu(紫红),Ag(白), Au(黄) (2) 溶、沸点较其它过渡金属低 (3) 导电性、导热性良好,且Ag>Cu>Au (4) 延展性良好
3.化学性质
铜族元素的化学活性从Cu至Au降低,主要表现 在与空气中氧的反应和与酸的反应。
425℃熔化约 1000℃沸腾
1.5(25℃),难溶 于水。在空气中吸 湿后变绿,溶于氨
水
(1) Cu(Ⅰ)的化合物: 通常为无色。 Cu(Ⅰ)的化合物在固态时稳定性高于Cu(Ⅱ),但在溶液
中容易被氧化为Cu(Ⅱ)。 几乎所有的Cu(Ⅰ)化合物都难溶于水,其溶解度顺序为:
CuCl>CuBr>CuI>CuSCN>CuCN>Cu2S
2Cu + 2H2SO4(浓) 2Ag + 2H2SO4(浓) 金只能与王水作用:
2CuSO4 + SO2↑+ 2H2O Ag2SO4 + SO2↑+ 2H2O
Au + 4HCl + HNO3 HAuCl4 + NO↑+ 2H2O
(5)Cu、Ag、Au溶于含氧的碱性氰化物中。
4Au+O2+8CN-+2H2O
Cr
3d54s1
Mn
3d54s2
Fe
3d64s2
Co
3d74s2
Ni
3d84s2
Cu
3d104s1
Zn
3d104s2
表3-3 过渡元素的一般性质
熔点 /℃
沸点 /℃
原子半 径
pm
第一离解 能
kJ·mol-1
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
西 昌 学 院
西昌学院
(2)、硫化物 Cu2S和Ag2S两种黑色化合物溶解度很 小,不溶于水和非氧化性酸。如可溶于氧 化性的硝酸: Cu2S+HNO3===? Ag2S+HNO3===? Cu2S可溶于KCN生成[Cu(CN)4]3-
(3)、AgNO3 Cu(I)不形成硝酸盐,AgNO3是一种重 要试剂。
西 昌 学 院
西昌学院
1、活泼性 IB族的最外层电子的Z*(有效核电荷 Z-)高,故第一电离势比碱金属的高。
由于d电子也包含在金属键中,故它 们的升华热和熔点也比碱金属的高得多。 其较惰性的特点与这些因素有关。结果是 其化合物有较多的共价性和较高的晶格能。
2、氧化数 铜、银、金三个元素,每一个元素都 有+1、+2和+3三种氧化数。最常见的氧化 数:铜为+2、银为+1、金为+3。
(5)、配合物 二价铜离子有较强的配合性。 [Cu(H2O)4]2+、[Cu(NH3)4]2+等,但实际上它们的 应该是[Cu(H2O)6]2+、[Cu(NH3)4(H2O)2]2+离子,原因 是因它们的结构是一种特殊的变形八面体结构。
西 昌 学 院
西昌学院
二价铜离子与CN-形成配合物时比较特殊: 2Cu2++4CN-===(CN)2↑+2CuCN↓(白色) 继续加入CN-则有: CuCN+3CN-===[Cu(CN)4]3用此方法可分离Cu2+和Cd2+离子,也说明Cu2+与 CN-不能共存。另外Cu2+还能形成螯合物。
西 昌 学 院
西昌学院
3、标准电极电势 Zn2++2e-==Zn =-0.786V Cd2++2e-==Cd =-0.4026V Hg22++2e-==2Hg =0.7986V 2Hg2++2e-==2Hg22+ =0.905V Ca2++2e-==Ca =-2.76V 化学活泼性远于碱土金属; 从上到下,金属活泼性递减;与碱土 金属的变化规律相反。 4、氢氧化物的碱性和稳定性 IIB族氢氧化物属弱碱,且易脱水形成 氧化物。 Be(OH)2和Zn(OH)2为两性氢氧化物。
OH2
OH2
O N
-
O Cu 2+ N
-
H2O H2O
西 昌 学 院
西昌学院
Cu
OH2 OH2
H3N H3N
Cu
NH3 NH3
A A 一 种 Cu(II) 螯 合 物 的 结 构
H2O
H2O
(6)、一价铜与二价铜的相互转化
思考题:由电势图看下列反应似乎不能进行,但 实际上却能反应,这是为什么?Ksp(CuI)=5.06×10-12 Cu2++I-===CuI↓+I2
(2)、CuCl2 CuCl2的很浓的溶液呈黄绿色、浓溶液呈绿色 {[CuCl4]2-和[Cu(H2O)4]2+的混合色}、稀溶液呈蓝色, 无水CuCl2呈棕黄色,共价化合物,结构为:
西 昌 学 院
西昌学院
Cl Cl Cu Cu Cu Cu Cu Cl Cl Cl Cl Cl Cl
CuCl2能溶于乙醇和丙酮。 CuCl2加热可分解: 500K 2CuCl2 ====2CuCl+Cl2↑
西昌学院
性。 它们用于货币、装饰品和电器工业等。 它们易形成合金,如黄铜(Cu60%Zn40%)、
白铜(Cu50~70%Ni18~20%Zn13~15%)、青铜
(Cu80%Sn15%Zn5%)。
四、单质的化学性质
铜和银易溶于硝酸或热的浓硫酸中,有氧时Cu 能溶于氨水(生成[Cu(NH3)4]2+)中,Cu能直接溶 于KCN溶液(生成[Cu(CN)4]3-)。(试写方程式)。
四、单质的化学性质
锌在加热时能与绝大多数非金属化合,汞只 能与少数非金属化合。 Zn2++2e-==Zn =-0.786V
西 昌 学 院
西昌学院
Hg22++2e-==2Hg =0.7986V 2Hg2++2e-==2Hg22+ =0.905V 锌能与非氧化性酸反应制氢气,汞只能与氧 化性酸反应。如: 3Hg+8HNO3(热)===3Hg(NO3)2+2NO↑+4H2O 6Hg(过量)+8HNO3===3Hg2(NO3)2+2NO↑+4H2O
西 昌 学 院
西昌学院
(3)、硫酸铜 CuSO4· 5H2O—胆矾,最重要的二价铜盐。 水解显微酸性,可与较活泼金属反应、与碱或氨 水反应。 (4)、CuS 黑色,Ksp=8.5×10-45只能溶于热的硝酸中: 3CuS+8HNO3===3Cu(NO3)2+2NO↑+3S↓+4H2O
可溶于NaCN溶液中: 10NaCN+2CuS===2Na3[Cu(CN)4]+2Na2S+(CN)2↑ 因CN-与I-相似,具有还原能力但又有配合能力。
银主要以金属、硫化物、砷化物、氯
西 昌 学 院
西昌学院
化物的形式广泛分布,常由铅矿、铜矿的
加工过程中来回收。 金以单质形式存在。 它们都可形成许多合金。
三、单质的物理性质
铜为紫红色、银为银白色、金为黄色。
在常温下铜银金都是晶体,密度大、熔点高、
沸点高,有良好的延展性和优良的导电性与导热
西 昌 学 院
Cu + NH3
西 昌 学 院
西昌学院
[Cu(NH3)2] [Cu(NH3)4]2+ - -1.12V [Cu(CN)4]3Cu + CN
-0.12V
+ -0.01V
银和金能溶于KCN中,金还能溶于王水(试写 方程式) - -0.31V
[Ag(CN)2] Ag + 2 CN - -0.6V [Au(CN)2] Au + 2 CN- 1.00V [AuCl4] Au + 4 Cl
2、铜(II)的化学性质 (1)、氢氧化铜和氧化铜 Cu(OH)2+2NaOH(6mol/L)===Na2[Cu(OH)4]
Cu(OH)2+4NH3===[Cu(NH3)4](OH)2
此溶液能溶纤维,遇酸后又析出,用来制人 造丝。
西 昌 学 院
西昌学院
Cu(OH)2===CuO+H2O
900℃ 4CuO===2Cu2O+O2 CuO可以被H2、CO、C、NH3等还原为Cu。 CuO+H2===Cu+H2O
5、配合能力 有很强的配合能力,而碱土金属却通常不形成 配合物。 6、盐的溶解性 硝酸 盐 碳酸 盐 硫酸盐 水解性
西 昌 学 院
西昌学院
IIA
IIB易溶易溶难溶难溶微溶或难 溶
易溶
钙锶钡的盐不水 解
有一定程度的水 解
7、单质的物理性质 IIB族金属熔沸点比IIA族低,IIA和IIB族金属 的导电、导热性都差。
锌可溶于氨水。 Zn+4NH3+2H2O===[Zn(NH3)4](OH)2+H2↑
五、锌族化合物
IIB族的离子都是无色的,所以它们的化合物 一般是无色的。但因它们的极化作用及变形性较大, 当与易变形的阴离子结合时往往有较深的颜色。 1、氧化物和氢氧化物 在它们的可溶性盐的溶液中加碱。 Hg2++OH-===HgO+H2O Zn2+加碱得Zn(OH)2,加热脱水得ZnO它们是共 价型两性化合物。 Cd2+加碱得Cd(OH)2,加热脱水得CdO它们是 共价型弱碱性化合物。 Zn(OH)2和Cd(OH)2都可溶于氨水。形成 [M(NH3)4](OH)2化合物。
二、单质的存在和制备
锌汞主要以硫化物形式存在如ZnS闪 锌矿、HgS辰砂。镉主要是锌矿提锌后的 副产品。 HgS+O2===Hg+SO2↑
西 昌 学 院
西昌学院
2ZnS+3O2===2ZnO+2SO2↑
2C+O2===2CO ZnO+CO===Zn↑+CO2↑ 得到易挥发的锌,可蒸馏出来。 也可用焙烧ZnS所得的ZnO用稀硫酸 溶解,电解所得的硫酸锌亦可得到锌。
0.153V + 0.52V Cu Cu2+ Cu I2 0.535V I
-
西 昌 学 院
西昌学院
从结构上看Cu+为3d10应该比Cu2+的3d9稳定, 并且铜的第二电离势(1990kJ/mol)较高,但特殊的 是Cu2+的水合能(2125kJ/mol)却很大。 因此在干态下Cu(I)的化合物是稳定的,而在 有水存在下Cu(II)化合物是稳定的。 2Cu+(水)Cu+Cu2+(水) K=1.2×106 如果要使Cu2+转化为Cu+,一方面要有还原剂 存在,另一方面要使Cu+形成难溶化合物。
西 昌 学 院
西昌学院
(7)、Ag(II)化合物 AgO、AgF2 Ag2++e-==Ag+ =1.987V Ag++e-==Ag =0.7996V Ag2+一般不稳定,是极强的氧化剂。 3、氧化数为(III)的化合物 Au(III)是较常见的化合态。 有氧化剂时,如:王水可溶解金 Au+HNO3+4HCl=H[AuCl4]+NO↑+2H2O Au3++3e-==Au =1.42V [AuCl4]-+3e-==Au+4Cl-=0.994V 还原型的还原能力增强。
西 昌 学 院
