铜族与锌族元素
【冶金精品文档】ds区元素(铜、锌)

CuCl 的盐酸溶液能吸收 CO,形成氯化羰基 铜(Ⅰ) [CuCl(CO)] ·H2O,此反应在气体中用于测 定混合气体中 CO 的含量。
2. 氯化铜
无水氯化铜为棕黄色晶体,在空气中潮解,它
易溶于水,也易溶于乙醇和丙酮。从溶液中结晶出
的二水合氯化铜为蓝色晶体。
Cu2O 主要用作玻璃、搪瓷工业的红色颜料。 CuOH 极不稳定,至今尚未制得 CuOH。
(二) 盐类
1. 氯化亚铜 氯化亚铜是一种白色晶体,熔点为 430 ℃,
难溶于水,吸湿后变为绿色,溶于氨水。
无机化学 在热的浓盐酸溶液中,用铜粉还原 CuCl2,
生成无色的 [CuCl2]-,用水稀释即可得到难溶于 水的 CuCl 白色沉淀:
[Ag(CN2)-] 作为镀银电解液的主要成分,电镀效 果很好,但因氰化物有剧毒,近年来逐渐被无毒镀银 液所代替。
第二节 锌族元素
一、锌族元素概述 二、锌的重要化合物 三、汞的重要化合物
Cd
一、锌族元素
第 12 族元素包括锌、镉、汞三种元素,通常 称为锌族元素。
(一) 锌族元素的通性
无机化学 锌族元素的价层电子组态为(n-1)d10ns2。锌族
Ag2O + H2O2
2Ag + H2O + O2↑
Ag2O 和 MnO2、Co2O3、CuO 的混合物在室温 下就能将 CO 迅速氧化成 CO2,因此常用于防毒面 具中。
(二) 硝酸银
硝酸银是最重要的可溶性银盐。将银溶于硝酸
溶液中,蒸发、结晶,得到硝酸银晶体。
AgNO3 加热到 713 K 时,按下式分解:
无机化学 成的配位个体的稳定性较差。 Cu2+ 还能与一些有机配体形成稳定的螯合物。
第二十章 铜族和锌族综述

西 昌 学 院
西昌学院
(2)、硫化物 Cu2S和Ag2S两种黑色化合物溶解度很 小,不溶于水和非氧化性酸。如可溶于氧 化性的硝酸: Cu2S+HNO3===? Ag2S+HNO3===? Cu2S可溶于KCN生成[Cu(CN)4]3-
(3)、AgNO3 Cu(I)不形成硝酸盐,AgNO3是一种重 要试剂。
西 昌 学 院
西昌学院
1、活泼性 IB族的最外层电子的Z*(有效核电荷 Z-)高,故第一电离势比碱金属的高。
由于d电子也包含在金属键中,故它 们的升华热和熔点也比碱金属的高得多。 其较惰性的特点与这些因素有关。结果是 其化合物有较多的共价性和较高的晶格能。
2、氧化数 铜、银、金三个元素,每一个元素都 有+1、+2和+3三种氧化数。最常见的氧化 数:铜为+2、银为+1、金为+3。
(5)、配合物 二价铜离子有较强的配合性。 [Cu(H2O)4]2+、[Cu(NH3)4]2+等,但实际上它们的 应该是[Cu(H2O)6]2+、[Cu(NH3)4(H2O)2]2+离子,原因 是因它们的结构是一种特殊的变形八面体结构。
西 昌 学 院
西昌学院
二价铜离子与CN-形成配合物时比较特殊: 2Cu2++4CN-===(CN)2↑+2CuCN↓(白色) 继续加入CN-则有: CuCN+3CN-===[Cu(CN)4]3用此方法可分离Cu2+和Cd2+离子,也说明Cu2+与 CN-不能共存。另外Cu2+还能形成螯合物。
西 昌 学 院
西昌学院
3、标准电极电势 Zn2++2e-==Zn =-0.786V Cd2++2e-==Cd =-0.4026V Hg22++2e-==2Hg =0.7986V 2Hg2++2e-==2Hg22+ =0.905V Ca2++2e-==Ca =-2.76V 化学活泼性远于碱土金属; 从上到下,金属活泼性递减;与碱土 金属的变化规律相反。 4、氢氧化物的碱性和稳定性 IIB族氢氧化物属弱碱,且易脱水形成 氧化物。 Be(OH)2和Zn(OH)2为两性氢氧化物。
知识总结——铜族元素和锌族元素
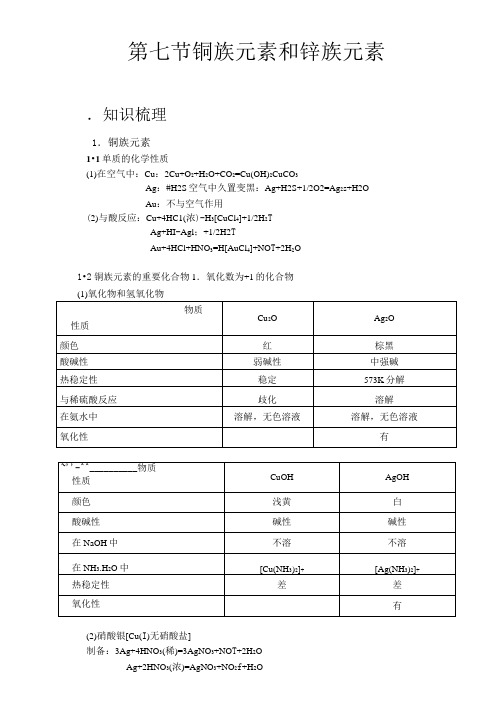
第七节铜族元素和锌族元素.知识梳理1.铜族元素1•1单质的化学性质(1)在空气中:Cu:2Cu+O2+H2O+CO2=Cu(OH)2CuCO3Ag:#H2S空气中久置变黑:Ag+H2S+1/2O2=Ag2s+H2OAu:不与空气作用(2)与酸反应:Cu+4HC1(浓)-H3[CuCl4]+1/2H2TAg+HI-Agl;+1/2H2TAu+4HCl+HNO3=H[AuCl4]+NO T+2H2O1•2铜族元素的重要化合物1.氧化数为+1的化合物(2)硝酸银[Cu(I)无硝酸盐]制备:3Ag+4HNO3(稀)=3AgNO3+NO T+2H2OAg+2HNO3(浓)=AgNO3+NO2f+H2O遇蛋白质生成黑色蛋白银,对有机组织有破坏作用,使用时勿使皮肤接触,在医药上用作消毒剂和腐蚀剂。
大量AgNO3用于制造照相底片上的卤化银,是重要的化学试剂。
(3)卤化物:①CuX2Cu2++2X-+SO2+2H2O-CuX;+4H++SO42-Cu2++2Cl-+Cu-2CuCl-2H[CuCl2]2Cu2++4I-=2CuI;+I2;CuX主要性质:在潮湿含氧环境下稳定性差:4CuCl+O2+4H2O=3CuOCuCl2^3H2O+2HCl8CuCl+O2=2Cu2O+4Cu2++8Cl-在相应卤化物中形成较稳定的卤配离子:CuX+X-=^CuX2-(无色)有一定氧化性:4CuI+Hg=Cu2[HgI4]+2Cu白暗红此反应用于检验实验室空气中的汞含量。
②AgX性质:见光分解:AgBr-Ag+Br因此AgBr用作感光材料。
(4)硫化物:Cu2S,Ag2S:黑色;难溶于水;溶于热浓硝酸3Cu2s+16HNO3(浓)一6Cu(NO3)2+3s;+4NO f+8H2O3Ag2s+8HNO3(浓)一6Ag(NO3)2+3S;+2NO f+4H2O2.氧化数为+2的化合物(1)氢氧化铜和氧化铜CuSO4+2NaOH=Cu(OH)2J+Na2SO4Cu(OH)2O①氧化铜热稳定性:在高温时明显分解2CuO1237K>Cu2O+1/2O2加热可被H2、CO、NH3还原3CuO+2NH3=3Cu+3H2O+N2②氢氧化铜(浅蓝色)微显两性(以碱性为主),可溶于浓强碱:Cu(OH)2+2OH-[Cu(OH)4]2-溶于氨水Cu(OH)2+4NH3^^[Cu(NH3)4](OH)2(2)氯化铜CuCl2无水CuCl2为共价化合物,结构为链状,其中Cu采取dsp2杂化方式。
[理学]铜族元素和锌族元素by啥子一家
![[理学]铜族元素和锌族元素by啥子一家](https://img.taocdn.com/s3/m/5d7bcac604a1b0717fd5ddd5.png)
硫酸铜
CuSO4·5H2O—胆矾, 最重要的二价铜盐。
水解显微酸性,可与 较活泼金属反应、与碱 或氨水反应,还可作农 药。如:波尔多液
将CuSO4·5H2O、CaO 及水按1:1:100配制的乳 液。
③ Cu2+ 和Cu+的互相转化:
疑问????
从离子电子构型看:Cu+ :3d10,Cu2+ :3d9 等价轨道达到全充满要比没有充满稳定,应该 Cu+比Cu2+稳定;但是为什么在水溶液中Cu2+ 比Cu+ 稳定?
② Cu(Ⅱ)的化合物: 特点:
Cu(Ⅱ)为d9构型,有一个成单电子, 顺磁性,它的化合物或配合物因 Cu2+可发生d-d跃迁而呈现颜色。 Cu(Ⅱ)的化合物在固态或水溶液中 都稳定,且易溶于水。
氧化铜:
• 性质:碱性氧化物、具有一定的氧化性(能被还 原)、热稳定性高(1273K以上分解成Cu2O)。
(一)、存在和冶炼 (1)存在
铜主要银以金属、硫化物、砷化物、氯化物和
碳酸盐的形式广泛分金布铲,银最锅常见的矿物有黄铜矿 (CuFeS2)、孔雀石[CuCO3·Cu(OH)2]和碱式砷酸 铜铝(Ceruleite)Cu2Al7(AsO4)4(OH)13.12H2O等。
银主要以金属、硫化物、砷化物、氯化物的
Cu2++I-=CuI↓+I2
Cu2+ 0.153V Cu+ 0.52V Cu
I2 0.535V I-
假设溶液中[Cu2+]和[I-]浓度为1mol/L,则溶液中[Cu+]为:
[Cu ]
K sp [I]
1.27 1012 1
1.27 1012 mol
第二十章铜族和锌族元素ds区

第19章 铜族和锌族元素§19-1铜族元素19-1-1铜族元素的通性铜族元素即ⅠB 的Cu 、Ag 、Au 三个元素。
1.价电子层结构(n-1)d 10s 1 最外层均只有1个s 电子,次外层18e 。
2.氧化数铜族元素具有+Ⅰ、+Ⅱ、+Ⅲ三种氧化态,而碱金属则只有+Ⅰ一种,这是因为铜族元素的ns 电子和(n-1)d 电子的能量相关不太大,在反应时容易补偿再被夺去1-2个电子的能量,例如我们比较同属四周期的Cu 和K ,Cu 的I 1=750KJ·mol -1,I 2=1970KJ·mol -1,而K 的I 1=421KJ·mol -1,I 2=3088KJ·mol -1,可见Cu 第二个电子的电离能较K 小得多。
铜族元素的I 1与I 2相相差约为1100-1400KJ·mol -1,而碱金属元素则相差2100KJ·mol -1 —6700KJ·mol -1。
3.金属活泼性同族从上到下按Cu 、Ag 、Au 的顺序金属活泼性减弱,这与所有副族元素一致,而与ⅠA 族等主族元素的金属性递变规律恰好相反。
其原因是因同副族元素从上到下原子半径增加不大,而新增加的次外层(对Au 还包括倒数第三层的f 电子)d 电子的屏蔽作用较小,因而有效核电荷从上到下增大的影响超过原子半径增大的影响所致。
从φ0值可以说明这一顺序:φ0Cu+/Cu =0.522V,φ0Ag+/Ag =0.796V ,φ0Au+/Au =1.68V与同周期碱金属元素相比,铜族元素由于次外层18e 结构, 核电荷又较同周期碱金属元素增加了10个单位,因此Z *增加明显,于是表现出x,I 均较大, 而原子半径和M +离子半径均较小,金属性较弱。
4.由于化合物共价性较明显,18e 结构离子有很强的极化力和变形性, 因此形成化合物时共价性较明显(如AgI )。
这可从它们的电负性值看出,按Pauling 提出的键的离子性百分数计算式键的离子性%=()1001241⨯⎥⎦⎤⎢⎣⎡---B A X X e当x A -x B >1.7键才属离子键。
铜族元素和锌族元素

Cu2O 不溶于水,对热稳定,在潮湿空气中缓慢被氧化成 CuO。它具 有半导体性质,曾用作整流器的材料。 Cu2O 的制备有干法和湿法: Cu2O 的干法制备在密闭容器中煅烧铜粉和 CuO 的混合物,即 得暗红色的 Cu2O: Cu+CuO→Cu2O Cu2O 的湿法制备在水溶液中,以硫酸铜为原料,亚硫酸钠为还 原剂,陆续加入适量氢氧化钠,反应过程中溶液维持微酸性 (pH=5) ,Cu2O 即按以下反应析出: 2CuSO4+3Na2SO3→Cu2O↓+3Na2SO4+2SO2↑ Cu2O 溶于稀硫酸,之后立即歧化: Cu2O+H2SO4→CuSO4+Cu+H2O Cu2O 溶于氨水和氢卤酸时,仍保持+的氧化值,分别形成稳定 的无色配合物,例如[Cu(NH3)2]+、[CuX2]-、[CuX3]2-等。 Cu2O+4NH3·H2O→2[Cu(NH3)2]OH+3H2O 可见 Cu+在水溶液中不稳定会发生岐化反应,而 Cu(I)在固相或 配位状态下可以稳定存在。 (2)氯化亚铜(CuCl) CuCl 为白色固体物质,属于共价化合物,其熔体导电性差。通 过测定其蒸气的相对分子质量,证实它的分子式应该是 Cu2Cl2,通 常将其化学式写为 CuCl。CuCl 是重要的亚铜盐,在有机合成中用 作催化剂和还原剂,在石油工业中作为脱硫剂和脱色剂,肥皂、脂
13.1.1 过渡元素的电子构型
过渡元素的原子结构特点是它们的原子最外层大多有 2 个 s 电 子(少数只有 1 个 s 电子,Pd 无 5s 电子),次外层分别有 l~10 个 d 电子,其价层电子构型为(n-1)d1-10ns1-2,其中ⅠB 和ⅡB 族为(n- 1)d10ns1-2。由于过渡元素原子最外层只有 1~2 个电子,较易失 去,故过渡元素都是金属元素。
铜族和锌族
铜族元素与碱金属元素的比较
1、与同周期的IA相比,铜族元素的原子半径较小,
第一电离能较大,最外层的电子难失去,故活泼性
不如IA; 2、铜族元素有+1、+2、+3三种氧化态,而碱金属 元素则只有+1氧化态; 3、IB的标准电极电势比IA的要大,故IB在水溶液中
的化学活泼性远小于IA的。
一、
1、
铜族元素
b、 卤化物 CuCl 、CuBr和CuI都是难溶化合物,且溶解度依次 减小。
均为白色。
都可以通过二价铜离子在相应的卤离子存在的条件 下被还原得到,如: Cu2+ + Cu + 4 Cl - 2 Cu2+ + 4 I- 2 [CuCl2]- (土黄色) 2 CuI ↓ + I2
CuCl不溶于硫酸、稀硝酸,但可溶于氨水、浓盐酸
一些黄金矿山多是先用汞齐法,再用氰化法,两种方
法联合使用。 金的精制是通过电解 AuCl3 的盐酸溶液完成的,纯度 可达 99.95% - 99.98%。
2、
铜的化合物
铜的常见氧化数为 +1、+2,本节重点介绍常见的
Cu(I)、Cu(II)化合物,以及两种价态之间的转换。
(1) 氧化数为 +1 的化合物 a、 氧化物和氢氧化物 Cu2O由于晶粒大小不同呈现出 不同的颜色,如黄、桔黄、鲜红或
但是,由于 ds 区元素原子的次外层有18 个电子, 而 IA与IIA元素原子次外层有8个电子,因此,无论是 单质还是化合物都表现出显著的差异。
如氯化钠易溶,而氯化银难溶;氧化镁和氧化锌
都难溶,但氧化镁呈碱性,而氧化锌呈两性。
希望通过学习,相互比较,加深理解。
铜族和锌族的元素电势图 EA
Ө /V
硫化物矿:辉铜矿Cu2S、黄铜矿CuFeS2 等;
第13章过渡元素(一) 铜族和锌族元素
第13章过渡元素(一)铜族和锌族元素第十三章过渡元素(一)铜族和锌族【内容】13.1 过渡元素的通性 13.2 铜族元素 13.3 锌族元素13.4 应用微量元素与人体健康(选学内容)【要求】1.掌握铜、银、锌、汞单质、氧化物、氢氧化物、重要盐类及配合物的生成、性质和用途。
2.掌握Cu(Ⅰ)、Cu(Ⅱ);Hg(Ⅰ)、Hg(Ⅱ)之间的相互转化。
3.了解ⅠA和ⅠB;ⅡA和ⅡB族元素的性质对比。
周期表中ⅠB ? ⅧB族,即ds区和d区元素称为过渡元素,(见表13��1)。
它们位于周期表中部,处在s区和p区之间,故而得名,它们都是金属,也称过渡金属。
表13-1 过渡元素ⅢB ⅣB ⅤB ⅥB ⅦB ⅧB ⅠB ⅡB Sc Y La Ac Ti Zr Hf Rf V Nb Ta Db Cr Mo W Sg Mn Tc Re Bh Fe Co Ni Ru Rh Pd Os Ir Pt Hs Mt Cu Ag Au Zn Cd Hg 通常按周期将过渡元素分成三个过渡系列:位于第4周期的Sc ? Zn称第一过渡系元素;第5周期的Y ? Cd为第二过渡系元素;第6周期的La ? Hg为第三过渡系元素。
过渡元素有许多共同性质,本章先讨论它们的通性,然后介绍ⅠB及ⅡB族元素。
13.1过渡元素的通性1.价层电子构型过渡元素原子的最后一个电子排布在次外层的d轨道(ⅡB除外)中,最外层有1?2个s (Pd除外)电子,它们的价层电子构型为(n-1)d1~10ns1~2。
2. 原子半径过渡元素原子半径(如图13-1所示)一般比同周期主族元素的小,同周期1元素从左到右原子半径缓慢减小,到铜族前后又稍增大。
同族元素从上往下原子半径增大,但第二、第三过渡系(除ⅢB外)由于镧系收缩使同族元素原子半径十分接近,导致元素性质相似。
原子半径/pm250过渡元素的原子半径第一过渡系第二过渡系200第三过渡系150100ⅠAⅡAⅢBⅣBⅤBⅥBⅦBⅧⅧⅧⅠBⅡB图13-1过渡元素原子半径3. 氧化态过渡元素有多种氧化态,因其最外层s电子和次外层部分或全部d电子都可作为价电子参与成键,一般可由+2依次增加到与族数相同的氧化态(Ⅷ族除Ru、Os外,其它元素尚无Ⅷ氧化态),这种氧化态的显著特征以第一过渡系最为典型。
铜和锌
铜族与碱金属元素的对比
原因在于它们电子构型的不同。铜族元素次外层 比碱金属多10个d电子。由于d电子屏蔽核电荷的 作用较小,致使铜族元素的有效核电荷比相应的 碱金属元素增大,核对价电子吸引力增强,第一 电离能增大,活泼性比碱金属差。
与主族元素相反
§1 铜族元素
Cu 价电子层结构 主要氧化数 ψθ(M+/M) r(M)/pm 升华热 电负性 金属活性 3d104s1 +1,+2 0.521 127.8 340 1.90 Ag 4d105s1 +1,(+2) 0.799 144.4 285 1.93 逐渐降低 Au 5d106s1 +1,+3 1.68 144.2 385 2.54 0.98~0.97 逐渐增强 IA ns1 +1 -2.7~-2.9
I2+2Na2S2O3→Na2S4O6+2NaI
CuCl的氨溶液或盐酸溶液能吸收CO,形成配合物 [Cu(CO)Cl]H2O-测气体混合物中CO含量。 CuCl:难溶于H2SO4,稀HNO3,但能溶于氨水、浓盐 酸及碱金属氯化物的浓溶液形成Cu(NH3)2+,CuCl2(CuCl32-,CuCl43-)
铜族元素的(n-1)d 轨道与ns 轨道能级差较小
一、铜族元素的单质
物理性质:
⑴ 特征颜色 Cu(紫红),Ag(银白),Au(金黄)
⑵ 熔、沸点较其它过渡金属低,比IA金属高
⑶ 导电性、导热性好,且Ag>Cu>Au
⑷ 延展性好 ⑸ 易形成合金 黄铜(Cu-Zn)
金的质量分数用 “K”表示,1 K 表示金的质量分数为 4.166%,纯金为 24 K 金。
?
比碱土金属单质低,也比铜族元素 单质低,由于锌族元素原子的最外 层 s 电子成对后稳定性增大的缘故。
第18章-铜族元素 锌族元素
第18章铜族元素锌族元素18.1 铜族元素18.1.1通性铜族元素:周期表ds区,第IB副族,包括铜(c opper)、银(s ilver)、金(g old)三种元素。
价电子构型为(n-1)d10ns1,最外电子层只有一个s电子,次外层为18个电子。
铜族元素与碱金属元素的性质差异主要体现在以下三点:●铜族元素的最外层电子受到的有效核电荷较大,使铜族元素的电离能高,原子半径小,密度大,化学活性差。
●铜族元素有多种氧化态,主要有+Ⅰ、+Ⅱ、+Ⅲ三种,而碱金属的氧化态只有+Ⅰ。
●碱金属从Na到Cs,金属活泼性增高;铜族元素恰恰相反,从铜到金化学活性逐渐降低。
从Cu到Au,原子半径增加不大,而核电荷却有明显增加,次外层18电子的屏蔽效应又小,使核对电子的吸引力增大,因而金属活泼性依次减弱。
铜族元素通性及变化规律:●从Cu到Au形成一价水合离子的活性越来越弱,金属的活泼性减弱。
●Cu+在高温和固态时很稳定--- ①d10全充满的稳定构型电子;②铜的第二电离能比第一过渡系任何元素都大的缘故。
但在溶液中Cu+不稳定,易歧化成Cu2+和Cu----Cu2+的水和热很大。
●一价离子具有18电子构型,有很强的极化能力和明显的变形性,本族元素易形成共价化合物;●原子中(n-1)d、n s、n p轨道的能量相差不大,有能级较低的空轨道,所以有很强的形成配合物的倾向。
18.1.2单质的物理性质和化学性质1.物理性质铜族元素单质的密度较大,熔沸点较高,但硬度较小。
它们都有很好的延展性,特别是金,1克金能抽成长达3 km的金丝或压成厚约0.0001mm的金箔,500 张的总厚度比头发丝的直径还薄些。
铜族元素都有良好的导电性和导热性。
银的导电性在金属中位居首位,铜列次席。
铜族金属之间以及和其它金属之间,都很容易形成合金,其中铜合金种类很多,历史也最久远,如青铜(80%Cu,15%Sn, 5%Zn)质地坚韧、易铸;黄铜(60%Cu、40%Zn)广泛用于制作仪器零件;白铜(50~70%Cu,18~20%Ni,13~15%Zn)主要用作刀具等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
铜族与锌族元素铜分族1.在Ag+溶液中,先加入少量的Cr2O72-,再加入适量的Cl-,最后加入足够量的S2O32-,估计每一步会有什么现象出现,写出有关的离子反应方程式。
2.具有平面正方形结构的Cu2+配合物[CuCl]22-(黄色)、[Cu(NH3)4] 2+(蓝色)、[Cu(en)2]2+(蓝紫色)的颜色变化是什么原因引起的?3.利用金属的电极电位,说明铜、银、金在碱性氰化物水溶液中被溶解的原因,空气中的氧对溶解过程有何影响?CN-离子在溶液中的作用是什么?4.将黑色CuO粉末加热到一定温度后,就转变为红色Cu2O。
加热到更高温度时,Cu2O又转变为金属铜,试用热力学观点解释这种实验现象。
并估计这些变化发生时的温度。
5.完成并配平下列反应式:(1)Cu2O+HCl →(2)Cu2O+H2SO4(稀)→(3)CuSO4+NaI →(4)Ag+HI →(5)Ag++CN-→(6)Ag+O2+H2S →(7)Cu++CN-→(8)Cu2++CN-→(9)HAuCl4+FeSO4→△(10)AuCl →(11)Ag3AsO4+Zn+H2SO4→(12)[Ag(S2O3)2]3-+H2S+H+→(13)Au+王水→6.为什么在高温、干态Cu+化合物更为稳定?而在水溶液中Cu2+化合物更为稳定。
倘若在水溶液中形成难溶物或配离子时是Cu(Ⅰ)化合物还是Cu(Ⅱ)化合物稳定?在什么情况下可使Cu2+转化为Cu+?试举例说明,并解释之。
7.判断下列各字母所代表的物质:化合物A是一种黑色固体,它不溶于水、稀醋酸和氢氧化钠,而易溶于热盐酸中,生成一种绿色溶液B,如溶液B与铜丝一起煮沸,逐渐变棕黑(溶液C),溶液C若用大量水稀释,生成白色沉淀D,D可溶于氨溶液中,生成无色溶液E,E若暴露于空气中,则迅速变蓝(溶液F),往溶液F中加入KCN时,蓝色消失,生成溶液G,往溶液G中加入锌粉,则生成红棕色沉淀H,H不溶于稀的酸和碱,可溶于热硝酸,生成蓝色溶液I,往溶液I慢慢加入NaOH溶液,生成蓝色胶冻沉淀J,将J 过滤,取出,然后加热,又生成原来化合物A。
8.用反应方程式说明下列现象:(1)铜器在潮湿空气中慢慢生成了一层铜绿;(2)金溶于王水;(3)热分解CuCl 2·2H 2O 得不到无水CuCl 2。
9.解释下列现象:(1)CuCl 2浓溶液逐渐加水稀释时,溶液颜色由黄棕色经绿色而变成蓝色。
(2)当SO 2通入CuSO 4与NaCl 的浓溶液中析出白色沉淀。
(3)往AgNO 3溶液中滴加KCN 溶液时,先生成白色沉淀而后溶解,再加入NaCl 溶液时并无沉淀生成,但加入少许Na 2S 溶液时,就析出黑色沉淀。
10.如何用最简便的方法分离Cu(NO 3)2和AgNO 3的混合物。
11.计算下列元素电势图中的E ø值。
(已知E øCu 2+/Cu +=0.15V,E øCu +/Cu =0.52V, K SP.CuS =7.94×10-36,KSP.Cu 2S =1.0×10-48) 12.已知下列反应Cu(OH)2(s )+2OH - ===== Cu(OH)42-的平衡常数K =10-3,在1升NaOH 溶液中,若欲使0.01摩尔Cu(OH)2溶解,问NaOH 的浓度至少应为多少?13.计算400毫升0.50 mol·L -1 Na 2S 2O 3溶液,可溶解多少克固体的AgBr ? 14.铁置换铜这一经典反应具有节能、无污染等优点,但通常只用于铜的回收,不用作铁件镀铜,因得到的镀层疏松、不牢固。
能否把铁置换铜的反应开发成镀铜工艺呢?下面就这一问题进行讨论,找出解决的途径。
(1)先不考虑溶液的pH 值范围,若向CuSO 4溶液中投入表面光滑的纯铁件后,可能发生的所有反应。
(2)实验证实造成镀层疏松的原因之一是夹杂固体杂质(CuOH 或Cu 2O )。
试通过电化学计算证实这一点。
(设镀槽的pH=4,CuSO 4的浓度为0.040mol·L -1)。
(3)通过计算说明在所指实验条件下,是否发生水解、放氢等反应。
(4)为了实现化学镀铜工业化,提出三种以上抑制副反应提高镀层质量的措施,不必考虑实施细节,说明理由。
(5)请提出铁置换铜反应的可能机理?(6)混在铜镀层中的Cu 2O 与Cu 颜色相近,如何鉴别?实验条件及有关数据列后:a. 实验条件:镀槽的pH=4,CuSO 4溶液的浓度为0.040mol·L -1,温度298K 。
b. 有关数据:E øFe 2+/Fe =-0.440V ;E øFe 3+/Fe 2+=0.770V ;E øCu 2+/Cu =0.342V ; E øCu 2+/Cu +=0.160V ; 平衡常数:K øw =1.0×10-14;K øsp (CuOH)=1.0×10-14; K øsp (Cu(OH)2)=1.0×10-20;K øsp (Fe(OH)2)=1.0×10-14; K øsp(Fe(OH)3)=1.0×10-36 15.合成CuCl 通常采用SO 2还原CuSO 4的方法,其工艺流程如下: CuS —— Cu 2S —— Cu E 2 ø E 3 ø E 1ø 合成 还原 冲稀 洗涤 干燥——————→ ————→ ————→ ————→ ————→成品 CuSO 4+NaCl 通入SO 2 大量水已知: (1)通过计算说明,为什么合成反应中一定要加入NaCl ?(2)为了加快氯化亚铜的合成速度,温度宜高一点好(70~80℃),还是低一点好(30~40℃)?请提出你的观点,并加以分析。
(3)写出合成中的总反应(离子方程式),如何判断反应已经完全?(4)合成反应结束后,为什么要迅速洗涤和干燥?16.工业上以废铜为原料经氯化生产氯化亚铜,其反应如下:a. Cu +Cl 2 ——→ Cu 2++2Cl -b. Cu 2++Cu +2Na +2Cl -——→ 2Na[CuCl 2] c. Na[CuCl 2] ——→ CuCl ↓+NaCl在操作中为了保证质量,必须按一定规范程序进行操作。
请回答下列问题:(1) 制备中当氯化完成后须经中间步骤(即生成配合物Na[CuCl 2]),为什么不用一步法制得CuCl ?(Cu 2++Cu ++2Cl -—→ 2CuCl ↓) (2)为什么必须外加NaCl 且控制接近饱和?(3)为什么要在反应体系中加入少量盐酸,它起何作用?(4)合成结束后为什么先用稀盐酸洗涤?再用酒精洗?为什么必须在真空密闭条件下进行抽滤操作?17.次磷酸H 3PO 2中加入CuSO 4水溶液,加热到40~50℃,析出一种红棕色的难溶物A 。
经鉴定:反应后的溶液是硫酸和磷酸的混合物;X 射线衍射证实A 是一种六方晶体,结构类同于纤维锌矿(ZnS),组成稳定;A 的主要化学性质如下:(1)温度超过60℃,分解成金属铜和一种气体;(2)在氯气中着火;(3)与盐酸反应放出气体。
根据以上信息: a. 写出A 的化学式和分解反应的方程式b. 写出A 的生成反应方程式c. 分别写出A 与氯气和A 与盐酸反应的化学方程式。
18.化合物A 是白色固体,不溶于水,加热时剧烈分解,产生一固体B 和气体C 。
固体B 不溶于水或盐酸,但溶于热的稀硝酸,得一溶液D 及气体E 。
E 无色,但在空气中变红。
溶液D 以盐酸处理时,得一白色沉淀F 。
气体C 与普通试剂不起反应,但与热的金属镁作用生成白色固体G 。
G 与水作用得另一种白色固体H 及一气体J 。
气体J 使湿润的红色石蕊试纸变蓝,固体H 可溶于稀硫酸得溶液I 。
化合物A 以硫化氢处理时得黑色沉淀K 、无色溶液L 和气体C ,过滤后,固体K 溶于浓硝酸得气体E 、黄色固体M 和溶液D 。
D 以盐酸处理得沉淀F 。
滤液L 以氢氧化钠溶液处理又得气体J 。
请指出A~M 所表示的物质名称,并用化学反应式表示各过程。
19.判断下列各字母所代表的物质:化合物A 是一种黑色固体,它不溶于水、稀醋酸和氢氧化钠,而易溶于热盐酸中,生成一种绿色溶液B ,如溶液B 与铜丝一起煮沸,逐渐变棕黑(溶液C ),溶液C 若用大量水稀释,生成白色沉淀D ,D 可溶于氨溶液中,生成无色Cu 2+ —— Cu + ——— Cu 0.5210.337 0.17 0.45 0.14SO 42- ——— H 2SO 3 ——— S ——— H 2S K øsp =1.2×10-6 H 2OH 2O溶液E,E若暴露于空气中,则迅速变蓝(溶液F),往溶液F中加入KCN时,蓝色消失,生成溶液G,往溶液G中加入锌粉,则生成红棕色沉淀H,H不溶于稀的酸和碱,可溶于热硝酸,生成蓝色溶液I,往溶液I慢慢加入NaOH溶液,生成蓝色胶冻沉淀J,将J 过滤,取出,然后加热,又生成原来化合物A。
20.比较下列配合物稳定性,并加以说明。
(1)为什么[Cu(en)3]2+与[Cu(H2O)4(en)]2+和[Cu(H2O)2(en)2]2+相比特别不稳定?(2)[Cu(H2O)2(en)2]2+的两个几何异构体中,哪个是主要存在形式?(3)[Ag(en)]+不如[Ag(NH3)2]+稳定(4)[Cu(en)2]2+比[Cu(NH3)4]2+稳定21.通过计算说明金属银在通空气时可溶于氰化钾溶液中。
已知:EøAg+/Ag=0.80伏;[Ag(CN)2]-的Kø稳=1.0×1021;H2(g)+1/2O2(g)=H2O(l)的△rGmø=-237.kJ·mol-1。
22.将CuSO4·5H2O加热时逐渐失水:102℃113℃258℃CuSO4·5H2O ——→CuSO4·3H2O ——→CuSO4·1H2O ——→CuSO4由失水温度上的差异推测各水分子所处的环境与结合力的关系,并画出其结构图。
锌分族1.解释下列实验事实(1)焊接铁皮时,常先用浓ZnCl2溶液处理铁皮表面;(2)HgS不溶于HCl,HNO3和(NH4)2S中而能溶于王水或Na2S中;(3)HgC2O4难溶于水,但可溶于含有Cl-的溶液中。
2.试选用合适的配合剂分别将下列各种沉淀物溶解,并写出反应方程式:Hg2C2O4HgS Zn(OH)2HgI23.(1)用一种方区别锌盐和铝盐。
(2)用两种方法区别锌盐和镉盐。
(3)用三种不同的方法区别镁盐和锌盐。
