原子结构和分子结构概要
有机化学结构与功能学习笔记第一部分

基础有机化学-----------------------------------------------------预备知识-----------------------------------------------------一. 原子结构1. 波尔理论对氢原子光谱的解释:氢原子在正常状态总是处于能量最低的基态,在受到光照射或放电等作用时,吸收能量,原子中的电子跳到能量较高的激发态。
但在激发态不稳定,回到低能量轨道时放出能量产生与能量对应的光,从而产生光谱。
hv E =∆。
2. 四个量子数:(1)主量子数n :n 为不同的电子层层数。
(2)角量子数l :同一电子层还可以分为不同的亚层,对应于n ,l =0~1-n 。
其中当0=l 时,为s 电子,1=l ,为p 电子,以此类推…(3)磁量子数m :用来描述同一亚层原子轨道和电子云的方向。
它受到l 的影响,当0=l 时,0=m ;1=l 时,1-=m 、0、1+,即p 电子有3种空间取向,分别为x p 、y p 、z p ;当2=l 时,可有五种空间取向,即2z d 、xz d 、yz d 、xy d 、22y x d -。
(4)自旋量子数s m :电子除绕核运转外,还有自旋运动。
电子自旋量子数只有2个取值,21+和21-,即电子有2个相反的自旋方向。
3. 原子轨道:我们常把电子层、电子亚层和空间取向都确定的运动状态称作原子轨道,即s 层有一个原子轨道,p 层有3个等等。
空间取向不同,并不影响电子的能量,因此同一亚层的几个原子轨道能量完全相同,这样的轨道称为等价轨道或简并轨道。
4. 原子轨道分布图描述的是解薛定谔方程得到的波函数ψ的值,函数值可以为正也可以为负。
形成共价键时要求同号重叠,即对成型匹配原则。
电子云角度分布图全为正。
5. 屏蔽效应:在多电子原子中,电子不但受到原子核的吸引,而且电子和电子之间也存在着排斥作用。
也就是说其余电子屏蔽了或削弱了原子核对该电子的吸引作用。
原子结构与性质知识点归纳
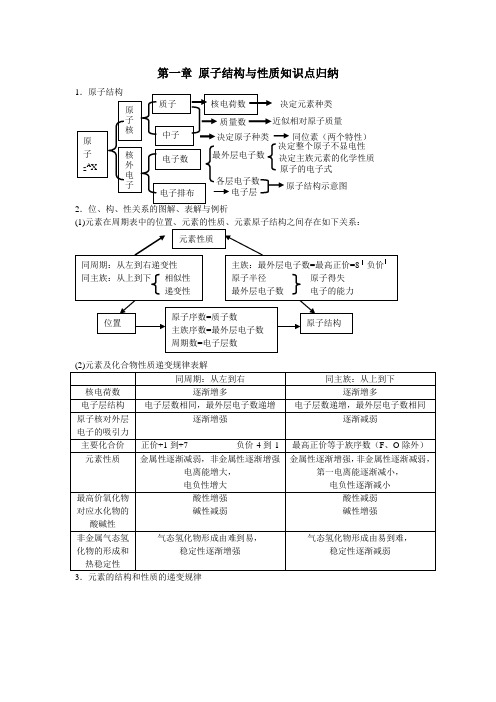
第一章 原子结构与性质知识点归纳2.位、构、性关系的图解、表解与例析3.元素的结构和性质的递变规律同位素(两个特性)4.核外电子构成原理(1)核外电子是分能层排布的,每个能层又分为不同的能级。
(2)核外电子排布遵循的三个原理:a .能量最低原理b .泡利原理c .洪特规则及洪特规则特例(3)原子核外电子排布表示式:a .原子结构简图 b .电子排布式 c .轨道表示式 5.原子核外电子运动状态的描述:电子云 6.确定元素性质的方法1.先推断元素在周期表中的位置。
2.一般说,族序数—2=本族非金属元素的种数(1 A 族 除外)。
3.若主族元素族序数为m ,周期数为n ,则: (1)m/n<1时为金属,m/n 值越小,金属性越强:(2)m/n>1时是非金属,m/n 越大,非金属性越强;(3)m/n=1时是两性元素。
随着原子序数递增① 原子结构呈周期性变化② 原子半径呈周期性变化③ 元素主要化合价呈周期性变化④ 元素的金属性与非金属形呈周期性变化⑤ 元素原子的第一电离能呈周期性变化⑥ 元素的电负性呈周期性变化元素周期律 排列原则① 按原子序数递增的顺序从左到右排列 ② 将电子层数相同的元素排成一个横行 ③ 把最外层电子数相同的元素(个别除外),排成一个纵行周期 (7个 横行) ① 短周期(第一、二、三周期)② 长周期(第四、五、六周期)③ 不完全周期(第七周期)性质递变 原子半径主要化合价元 素 周期表族(18 个纵行) ① 主族(第ⅠA 族—第ⅦA 族共七个) ② 副族(第ⅠB 族—第ⅦB 族共七个) ③ 第Ⅷ族(第8—10纵行) ④结构第二章 分子结构与性质复习1.微粒间的相互作用(2)共价键的知识结构2.分子构型与物质性质(1)微粒间的相互作用σ键π键 按成键电子云 的重叠方式极性键 非极性键一般共价键 配位键离子键 共价键 金属键 按成键原子的电子转移方式 化学键 范德华力氢键 分子间作用力本质:原子之间形成共用电子对(或电子云重叠) 特征:具有方向性和饱和性σ键特征 电子云呈轴对称(如s —s σ键、 s —p σ键、p —p σ键)π键 特征电子云分布的界面对通过键轴的一个平面对称(如p —p π键)成键方式共价单键—σ键共价双键—1个σ键、1个π键共价叁键—1个σ键、2个π键 规律 键能:键能越大,共价键越稳定键长:键长越短,共价键越稳定键角:描述分子空间结构的重要参数用于衡量共价键的稳定性 键参数 共 价 键定义:原子形成分子时,能量相近的轨道混合重新组合成一组新轨道sp 杂化 sp 2杂化sp 3杂化 分类 构型解释: 杂化理论sp 杂化:直线型sp 2杂化:平面三角形sp 3杂化:四面体型杂化轨道理论 价电子理论 实验测定 理论推测 构型判断 分 子 构 型共价键的极性 分子空间构型决定因素由非极性键结合而成的分子时非极性分子(O 3除外),由极性键组成的非对称型分子一般是极性分子,由极性键组成的完全对称型分子为非极性分子。
无机化学知识点归纳

无机化学知识点归纳无机化学是无机化合物化学的总称,是化学的一个分支。
它研究的内容包括元素周期律、原子结构、分子结构、化学键、化合物的性质和反应等。
无机化学的知识点非常多,下面我将详细介绍其中的一些重要知识点。
一、元素周期律元素周期律是无机化学的基础,它是指元素性质的周期性变化与元素原子序数的周期性变化之间的关系。
元素周期律的主要内容包括元素周期表、元素周期律的类型、元素周期律的解释等。
1.元素周期表元素周期表是元素周期律的具体表现形式,它将元素按照原子序数从小到大排列,并按照元素性质的周期性变化分为周期和族。
元素周期表中,周期是指元素原子核外电子层数相同的横行,族是指元素原子核外最外层电子数相同的纵列。
2.元素周期律的类型元素周期律主要有四种类型:原子半径周期律、电负性周期律、离子半径周期律和熔点、沸点周期律。
3.元素周期律的解释元素周期律的实质是元素原子结构与元素性质之间的关系。
原子结构包括原子核的电荷数、电子层数、最外层电子数等,元素性质包括原子半径、电负性、离子半径、熔点、沸点等。
元素周期律的周期性变化是由于元素原子核外电子排布的周期性变化所引起的。
二、原子结构与化学键1.原子结构原子结构是指原子核和核外电子的排布。
原子核由质子和中子组成,质子数决定了元素的原子序数,核外电子的排布决定了元素的化学性质。
2.化学键化学键是指原子之间通过共享或转移电子而形成的相互作用。
化学键的主要类型有离子键、共价键、金属键和氢键。
三、化合物的性质和反应1.化合物的性质化合物的性质包括物理性质和化学性质。
物理性质包括颜色、状态、密度、熔点、沸点等,化学性质包括氧化性、还原性、酸碱性、稳定性等。
2.化学反应化学反应是指物质在化学变化过程中所发生的一系列变化。
化学反应的主要类型有合成反应、分解反应、置换反应、复分解反应等。
四、无机化合物的分类无机化合物可以根据其结构和性质分为多种类型,如氧化物、酸、碱、盐、氢氧化物、硫化物等。
分子分型和细胞分型-概述说明以及解释

分子分型和细胞分型-概述说明以及解释1.引言1.1 概述概述部分的内容可以从以下角度进行撰写:概述部分是整篇文章的开篇,通过对分子分型和细胞分型的概括性介绍,引导读者对这两个主题有一个大致的了解。
首先,简要介绍分子分型和细胞分型是生命科学中的重要研究领域,涉及到生物体内分子和细胞的分类、识别和表征等方面。
随着生物科技的不断发展,这两个领域的研究意义和方法也得到了全面提升。
对于分子分型,可以介绍其涉及到对生物体内重要生物分子(如蛋白质、核酸、糖类等)结构、功能以及相互作用等方面的分析和研究。
通过对生物分子的分型,可以深入了解生物体内的代谢、信号传导、免疫应答等关键过程,为药物研发、生物学研究等提供重要支持。
相对于分子分型,细胞分型则更加注重对细胞的分类和表征。
细胞是生物体的基本结构和功能单位,通过对细胞形态、生理学特性、基因表达等方面的研究,可以更加深入地了解生物体内的发育、分化、疾病进展等过程。
细胞分型在癌症研究、干细胞研究、组织工程等领域发挥着重要作用。
本篇文章主要围绕分子分型和细胞分型展开,通过对这两个领域的概要介绍,介绍其定义、背景和研究意义,以及目前的研究方法与应用。
同时,还将结合目前的研究进展,总结分子分型和细胞分型之间的关系,并对其在未来的应用前景进行展望。
通过这样的概述,读者可以对分子分型和细胞分型有一个初步的了解,为后续章节的具体内容打下基础。
文章结构部分的内容如下所示:1.2 文章结构本文分为三个主要部分:引言、正文和结论。
引言部分提供了对分子分型和细胞分型的概述,介绍了文章的目的和结构。
通过引言可以帮助读者对分子分型和细胞分型有一个初步的了解,并建立起对这些主题的兴趣。
正文部分是本文的核心部分,主要包括分子分型和细胞分型这两个主题。
其中,分子分型部分包括定义和背景、分子分型的意义以及分子分型的方法与应用。
细胞分型部分包括细胞分型的概念和原理、细胞分型的分类方法以及细胞分型的研究进展。
考研必备-无机化学复习

第三章 “氮族元素”小结
一、第二周期元素氮的特殊性
N 2s2 2px12py1 2pz1 价轨道数 =4 → C.N.max = 4 价电子数 =5 → 多电子原子 (一)EA1 : N < P (二)键离解能 N-N < P-P 但 N≡N > P≡P 2p-2pπ 键特征, 3p-3pπ 键非特征, 2p →3d 反馈π 键特征(例 PO4 3-) 。 (三)N≡N 键能大,且打开第一个键需 946-160=546kJ·mol-1。 ∴R.T. N2 惰性。
碱 GeS 性 增 SnS 强 PbS
弱B 弱B 弱B
还原性
GeS2 B SnS2 B (无 PbS2) (6s2 惰性电子对效应)
酸性增强
八、Sn(II)的还原性
SnCl 2 2HgCl2 SnCl 4 Hg2 Cl 2 白色 灰黑色(重点) SnCl 2 Hg2 Cl 2 SnCl 4 2Hg(l)黑色
十一、Ellingham 图(△rGm -T 图)(重点)。 十二、反应耦联原理及应
第五章 “ 硼族元素”小结
一、B 的成键特征:
(一)共价成键为主; (二)缺电子原子,形成多中心、缺电子键,形成多面体, 例 1、-菱形硼;例 2、B2H6; (三)亲 F、亲 O
二、Lipsomb 硼烷成键五要素
无 机 化 学 复 习
一、基础无机化学的理论框架
物质结构原理(微 观) 元 素 周 期 热力学原理(宏 观) 律(微 观、宏 观)
| | —————————— ———————————— | | | | | | 原子结构 分子结构 晶体结构 反应过程 反应自发性 反应限度 能量变化 △ rG、 K △rH | | | | | | ——————————————————————————— | 性 质 | —————————————————— | | 制 备 应 用
第1章 原子结构与键合(1)-原子结构与键合

2.3 混合键
实际的材料内部原子结合键往往是各种键的 混合,结合键也表现出一定的过渡性。 混合,结合键也表现出一定的过渡性。
表 某些陶瓷化合物中混合键特征
化合物中离子键的比例取决于组成元素的电 负件差,电负性相差越大则离子键比例越高。 负件差,电负性相差越大则离子键比例越高。 鲍林经验公式:(确定化合物AB中离子键 鲍林经验公式:(确定化合物AB中离子键 :(确定化合物AB 结合的相对值): 结合的相对值):
1 (x A x B ) 2 4
离子结合(%) = [1 e]
×100%
(1 - 1)
式中, 分别为化合物组成元素A、 式中,XA、XB分别为化合物组成元素 、B 的电负性数值。 的电负性数值。
混合型晶体——石墨的结构 石墨的结构 混合型晶体
同时含有 共价键和 共价键和 范德瓦耳斯键
石墨晶体结构
金属键
化学键
主价键
一次键
离子键 共价键 范德瓦耳斯力 氢键
物理键
次价键
二次键
2.1 主价键 一、金属键
正离子与充满整个结构中的自由电子气之间的强相互作用。 正离子与充满整个结构中的自由电子气之间的强相互作用。 金属键没有方向性、饱和性。 金属键没有方向性、饱和性。 + + + + + + + + + + 结合能: 结合能: ~50 kcal/mol + + 特点: 特点:电子共有化 金属的导电性、导热性、 金属的导电性、导热性、 延展性都直接起因于金属 键结合(电子气)。 键结合(电子气)。
(二)角量子数
决定原子轨道的形状, 角量子数 l 决定原子轨道的形状 , 取值为 0、1、 、 、 2….n-1。在多电子原子中,当 n 相同而 l 不同时,电子 不同时, - 。在多电子原子中, 的能量还有差别,又常将一个电子层分为几个亚层。 的能量还有差别,又常将一个电子层分为几个亚层。 n=1 时,l =0,K 层只有 s 亚层; = , 亚层; n=2 时,l =0、1,L 层有 s、p 亚层; = 、 , 、 亚层; n=3 时,l =0、1、2,M 层有 s、p、d 亚层 = 、 、 , 、 、 亚层; n=4 时,l =0、1、2、3,N 层有 s、p、d、f 亚层。 = 、 、 、 , 、 、 、 亚层。 在多电子原子中, 也决定着原子轨道的能量。 在多电子原子中, l 也决定着原子轨道的能量。当 n 相同时,随 l 的增大,原子轨道的能量升高。 相同时, 的增大,原子轨道的能量升高。
无机化学-无机化学上册1-6章主要知识点-068
主要知识点
离子的电子层结构类型: ① 2电子构型(Li+ 、Be2+) ② 8电子构型: Na+ 、Ca2+ 18电子构型: Zn2+ 、Hg2+ 、 Cu+ 、 Ag+ (18+2)电子构型: Pb2+ 、 Sn2+ (9-17)电子构型: Fe2+ 、 Cr3+ 、 Mn2+ 离子型晶体的晶格能的影响因素。
10. 共价分子的键长、键能、键角;键的极性与分子的极性 (偶极矩m = q ·l)。
含极性键的分子不一定是极性分子;
化学键的极性: 非极性键
实 例:
H2
P4
S8
分子的极性: 非极性分子
极性键
NH3
BF3
SF4
CH4
H2O
CO2
构型不对称 构型对称
极性分子 非极性分子
q_ q+ q+ q_ OCO m=
O2分子轨道能级图 P 88
s*2S s2S
s*1S s1S
s*2pz
p*2px = p*2py p2px = p2py
s2pz
s*2S s2S
s*1S s1S
物质构成的奥秘用微粒的观点看物质知识概要许多
第三章物质构成的奥秘第一节:用微粒的观点看物质知识概要:1.许多实验表明,物质是由极其微小的、肉眼看不见的微粒构成的。
2.微粒的特点:(1)微粒是极其微小的;(2)微粒是不断地运动的;(温度越高,空气流动越好运动越快)例子:花园中花香弥漫,酒店前的酒香(扩散现象均可用此观点解释)(3)构成物质的微粒之间都有一定的空隙,不同物质微粒间的空隙大小不同。
在固体、液体中,微粒之间的空隙比较小,在气体物质中,微粒之间的空隙比较大。
例子:10mL酒精与10mL水混合后体积小于20mL,热胀冷缩(4)微粒之间存在斥力例题精讲:【例题1】洋葱被誉为“蔬菜皇后”。
切洋葱时可闻到刺激性气味,这说明()A.构成物质的微粒在不停地运动B.构成物质的微粒体积很小C.构成物质的微粒间有空隙D.构成物质的微粒质量很小答案:A解析:构成洋葱的微粒不断地运动,使我们闻到了刺激性气味。
【例题2】酒精和水混合后的总体积小于混合前总体积之和,这一事实说明()A.构成物质的微粒间有空隙B,构成物质的微粒可以再分C.构成物质的微粒在不断地运动着D.构成物质的微粒质量很小答案:A解析:典型的证明微粒间有空隙的例子。
【例题3】乒乓球被踩瘪后,放到热水中又会重新鼓起来。
其原因是()A.球内气体微粒体积增大B.球内气体微粒间空隙增大C.球内气体微粒质量增大D.球内气体微粒分解成更多微粒答案:B解析:微粒是有固定体积的,但是微粒间的空隙大小是随着温度而变化的。
乒乓球放到热水中会重新鼓起来,是由于温度升高,微粒间的空隙变大了。
【例题4】在加压条件下,25立方米的石油气可以装入0.024立方米的钢瓶中,由此可以说明的是()A.构成物质的微粒质量很小B.构成物质的微粒由更小的微粒构成C.构成物质的微粒之间有空隙D.构成物质的微粒在不断地运动答案:C解析:此题说明气体可以被压缩,在加压条件下,微观上,气体间的空隙变小,从宏观上就表现为气体的体积变小。
【例题5】请用微粒的观点解释下列现象,(1)妈妈在厨房炒菜,我在窗外就闻到了香味。
原子与分子物理专业介绍
原子与分子物理专业介绍原子与分子物理专业是物理学的分支领域之一,关注的是原子和分子的结构、性质、相互作用及其在物质世界中的应用。
原子和分子是物质的基本构成单位,从微观层面研究它们的行为和相互作用,可以深入了解物质的宏观特性,同时也对解决许多实际问题有很大的帮助。
原子与分子物理专业的学习内容包括原子结构、原子能级、化学键的形成和断裂、分子集体运动、原子和分子的光谱学、相互作用和反应等。
同时,也涉及到量子力学、量子场论、原子物理学和分子物理学的理论基础和实验技术等方面的知识。
在学习过程中,学生需要掌握基本的物理学和数学知识,如热力学、电磁学、微积分和线性代数等。
在实际应用中,原子与分子物理专业的毕业生可以在化学、材料科学、生物学、能源等领域中找到就业机会。
他们可以从事纳米技术、新材料研发、光电子设备设计、药物开发等方面的工作。
此外,原子与分子物理专业的毕业生还可以选择继续深入研究,攻读硕士和博士学位,成为研究人员或教师。
在学习原子与分子物理专业时,需要掌握的一些核心知识包括:1. 原子结构与能级原子由电子、质子和中子组成,其中质子和中子组成原子核,而电子以一定的能级分布在原子核周围。
了解原子结构和能级分布可以帮助我们理解化学键的形成和化学反应的机理,以及在光谱学中的应用。
2. 分子结构和化学键分子是由两个或多个原子组成的结构单元,它们通过化学键相互连接。
了解化学键的形成和断裂可以帮助我们理解材料的性质和化学反应的机理,对于研究新材料和制药等领域有着很重要的作用。
3. 原子和分子光谱学原子和分子在吸收和发射光辐射时会产生特定的光谱线,光谱学研究这些现象,可以帮助我们分析物质的结构和成分,同时也在光电子应用中有着广泛的应用。
原子和分子之间的相互作用是物质世界中重要的现象之一,包括分子间的静电作用力、分子间的范德华力、原子间的核力等。
了解原子和分子相互作用的机制和特点可以为物质科学和化学工程领域提供科学依据。
蛋白质基本组成单位通式
蛋白质基本组成单位通式蛋白质是生物体组成的重要组分,具有以下特征:一、蛋白质由氨基酸组成:1、氨基酸是蛋白质的基本组成单位,大多数蛋白质由20种不同的氨基酸构成,这些氨基酸的组合构成了蛋白质的复杂结构。
2、每种氨基酸都具有不同的结构,也有不同的物理和化学性质,它们的组合模式会决定蛋白质的活性和其他特性。
3、氨基酸的组成是通过氨基酸的通式来表示的,通常可以将氨基酸通式简化为COOH-N-CH2-CH2-CH(R)。
二、蛋白质细节结构:1、蛋白质分子包含4种主要部分:由氨基酸组成的酰胺链,羟基团,硫酸根和硫基团。
2、酰胺链由一个叫做亚胺的氨基酸残基连接几个氨基酸构成,并且在其中带有胺基、乙醇官能团(如乙醛或乙酸)和其他官能团(如-CONH2)。
3、羟基团是由一个水分子和一个连接到水分子上的氨基酸组成,它们可以用于改变蛋白质的官能团结构,同时参与生物物质分子间的特殊作用。
4、硫酸根是由硫酸根和含有硫气体的氨基酸组成,这种物质可以帮助蛋白质进行脱水缩合反应,以及调节蛋白质的结构。
5、硫基团是一种氨基酸与硫酸根复合物,它们可以参与疏水作用,从而改变蛋白质的结构大小,参与一些氨基酸的功能表达。
三、蛋白质结构:1、蛋白质结构分为三级结构:原子结构、分子结构和结构域(或折叠域)。
2、原子结构指的是蛋白质由氨基酸及其其他物质元素(例如硫酸根和羟基)的原子构成的结构,它代表了蛋白质的细节结构。
3、分子结构是由氨基酸残基之间的键结和官能团的组合形成,它指的是蛋白质的中化学性结构,是氨基酸残基三维空间组成和分布的模式。
4、结构域是蛋白质复杂结构中,可以被认为是独立单元的小区块,结构域包括介导蛋白质活性的部分,它会影响蛋白质的稳定性、活性和亲和力。
