臭氧知识点总结
氧族元素知识点总结
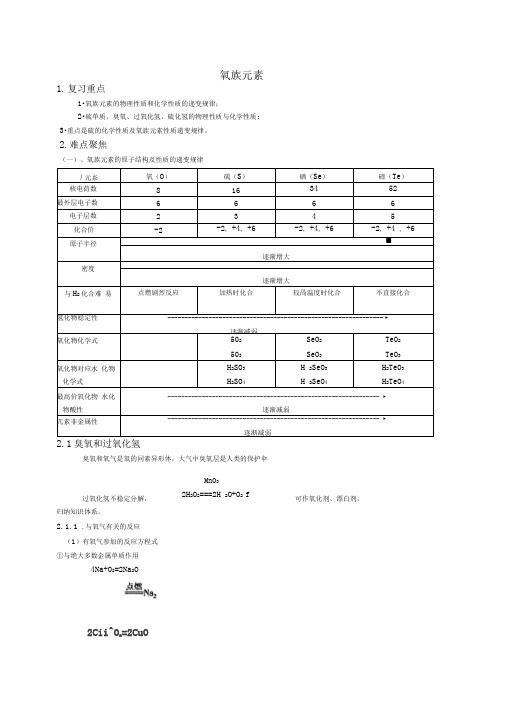
1.复习重点1•氧族元素的物理性质和化学性质的递变规律;2•硫单质、臭氧、过氧化氢、硫化氢的物理性质与化学性质; 3•重点是硫的化学性质及氧族元素性质递变规律。
2.难点聚焦(一)、氧族元素的原子结构及性质的递变规律丿元糸氧(O)硫(S)硒(Se)碲(Te)核电荷数8 16 34 52最外层电子数 6 6 6 6 电子层数 2 3 4 5化合价-2 -2, +4, +6 -2, +4, +6 -2, +4 , +6 原子半径■逐渐增大密度逐渐增大与H2化合难易点燃剧烈反应加热时化合较咼温度时化合不直接化合氢化物稳定性 --------------------------------------------------------------- ►逐渐减弱氧化物化学式502503SeO2SeO3TeO2TeO3氧化物对应水化物化学式H2SO3H2SO4H 2SeO3H 2SeO4H2TeO3H2TeO4最高价氧化物水化物酸性-------------------------------------------------------------- ►逐渐减弱兀素非金属性-------------------------------------------------------------- ►逐渐减弱2.1臭氧和过氧化氢臭氧和氧气是氧的同素异形体,大气中臭氧层是人类的保护伞过氧化氢不稳定分解,归纳知识体系。
2.1.1 .与氧气有关的反应(1)有氧气参加的反应方程式①与绝大多数金属单质作用4Na+O2=2Na2O2Cii^Oa=2CuO氧族元素MnO22H2O2===2H 2O+O2 f可作氧化剂、漂白剂。
②与绝大多数非金属单质作用2H 2S + O x 些25十汎0粹津2S0卫HyOPt4NHj *5® s^y^NO + 6^0高温4FeS 2+11O 22Fe 2O 2+8SO 2④与有机物作用料工佝+承H 』0(烽类物质慰爛:厢f 二耶峠 幡国滸就応FigiSr :%/芍皓評笫ESf 耳輕浑里恬晞点治样?空¥! :^n3E®HFiFrg|。
初三化学《制取臭氧》知识点总结

初三化学《制取臭氧》知识点总结
臭氧是一种具有较强氧化性的气体,可以用于消毒和净化空气。
以下是制取臭氧的主要方法和相关知识点的总结:
1. 电晕放电法
- 利用电晕放电的原理制取臭氧。
电晕放电是指在高电压场中,气体分子被电子激发,产生电离和激发态气体分子,进而发生反应
生成臭氧。
- 该方法需要使用臭氧发生器,通过电晕放电设备产生高电压场,使氧气电离产生臭氧。
2. 紫外光法
- 利用紫外光的照射使氧气分子发生分解反应,生成臭氧。
- 该方法需要使用紫外光设备,将氧气暴露在紫外光下,使氧
气分子分解产生臭氧。
3. 氧化法
- 利用氧化剂氧化反应生成臭氧。
- 常见的氧化剂有过氧化氢、臭氧自身和超氧化物等。
通过适当的条件和反应物,使氧化剂氧化反应生成臭氧。
4. 化学反应法
- 利用化学反应产生臭氧。
- 常见的化学反应有氢氧化钠和氢过氧化物反应生成臭氧。
根据具体反应条件和反应物的选择,可以制取臭氧。
臭氧的制取方法有多种,具体的选择取决于实际需求和条件。
制取臭氧时需注意安全,避免高浓度臭氧的直接接触,同时注意对设备的维护和操作的正确性。
以上是关于初三化学《制取臭氧》知识点的总结。
如果有任何疑问,请随时提出。
气体采样知识点总结

气体采样知识点总结1. 气体采样的目的和意义大气中存在着各种各样的气体成分,包括空气中的氮气、氧气以及其他稀有气体,还有从工业活动、交通运输、农业等活动中排放的有害气体。
这些有害气体包括但不限于二氧化硫(SO2)、二氧化氮(NO2)、一氧化碳(CO)、臭氧(O3)、颗粒物等。
它们对环境和人体健康都具有一定的危害。
因此,通过气体采样,可以及时有效地获取大气中的污染物数据,为环境监测和治理提供科学依据。
2. 气体采样的常见方法气体采样的常见方法包括主动采样和被动采样两种。
主动采样是指通过使用气泵或其他机械设备主动吸取大气中的气体,将其收集到采样器中。
被动采样则是指利用一些特定的吸附材料或装置 passively 收集大气中的污染物。
主动采样的优点在于可以控制采样流量和时间,适用于需要定量分析的场合。
而被动采样的优点在于简单易行,适用于长期监测和不易到达的场所。
3. 气体采样的设备和工具气体采样通常需要使用一些特定的设备和工具,其中包括采样器、气泵、吸附管、采样袋、吸附剂、分析仪器等。
采样器主要用于收集大气中的气体样品,属于主动采样设备。
气泵则是用于提供采样流量的机械设备,常见的有体积流量和定量流量两种。
吸附管则是用于被动采样的设备之一,通常使用活性炭、渗透树脂等材料作为吸附剂。
采样袋是一种用于存储气体样品的密封袋,便于携带和保存。
吸附剂则是用于吸附大气中的有害气体,通常选择具有良好吸附性能和稳定性的材料。
最后,分析仪器则是用于对采样样品进行定性和定量分析的工具,如气相色谱仪、质谱仪、光谱仪等。
4. 气体采样的注意事项在进行气体采样时,需要注意一些重要的事项,以确保采样的准确性和可靠性。
首先,需要选择合适的采样点和采样时间,避免受到外部干扰和污染。
其次,需要严格控制采样流量和时间,确保采样样品的代表性和可比性。
同时,需要对采样设备和工具进行定期维护和校准,确保其正常运行和准确性。
另外,需要在采样过程中注意采样环境的温度、湿度等因素,避免对采样效果造成影响。
高一地理必修一第二章知识点总结

高一地理必修一第二章知识点总结第二章地球上的碳氢化合物;第一节冷热不均引起大气运动;一、大气的组成及氮、氧、二氧化碳、水汽、臭氧和固;氧--生命活动必需的物质;二氧化碳--光合作用原料;保温作用臭氧--地球生;水汽和固体杂质--成云致雨;杂质:凝结核二、大气;1.对流层的特点:①随高度增加气温降低②大气对流;三、大气的受热过程;1、根本能量源:太阳辐射(各类辐射的波长范围及太;吸收(选择性臭氧第二章地球上的大气第一节冷热不均引起大气运动一、大气的组成及氮、氧、二氧化碳、水汽、臭氧和固体杂质甲烷等主要成分的作用低层大气组成:稳定比例的干洁空气(氧氮为主)、糖分不稳定的水汽、固体杂质氮--生物体基本成分氧--生命竞赛活动必需的物质二氧化碳--光合作用原料;保温作用臭氧--地球生命保护伞,吸收紫外线水汽和固体杂质--成云致雨;杂质:凝结核二、大气的垂直分层及各层对人类的影响1.对流层的特点:①随高度增加气温提高②大气环流运动显著③天气复杂多变 2.平流层的特点:①随高度增加水温升高②大气平稳有利于高空飞行③包含臭氧层三、大气的受热过程1、根本能量源:太阳辐射(各类辐射的范围及太阳辐射的性质--短波辐射) 2、大气的受热过程(大气的热力作用)--太阳晒热大地,大地烤热大气 3、大气对热辐射的削弱作用:三种形式及各自现象(用实例说明)吸收(选择性臭氧-紫外线、CO2-红外线)、散射(有一点选择性大点颗粒优先散射短波光-兰紫光)、反射(无选择性云层)外界影响削弱大小的主要原因:太阳高度角(各纬度削弱不同)4、大气对地面的保温积极作用:了解地面辐射(红外线长波辐射);大气辐射(红外线长波辐射)保温作用的过程:大气强烈释放出来地面长波辐射;大气逆高能量辐射将热量还给地面(图示及实例说明--如霜冻出现时间;日温差大小的比较)保温作用的意义:减少气温的杜博韦;有效保证地球适宜温度;维持全球热量平衡 5、太阳辐射(光照)的影响因素:纬度、天气、地势、大气透明度、太阳高度四、热力环流1、大气运动的根本原因:冷热不均(各纬度之间;海陆之间)2、大气运动形式:最简单形式:热力环流(图示及说明);举例:城郊风;海陆风;季风主要原因 3、热力环流分解:冷热不均引起大气垂直运动 4、水平气压差:水平气流由高压资金流向低压 5、形成水波的根本原因:冷热不均已经形成风的直接原因:水平压差(或水平气压斜率力)6、影响风的三个力:水平气压梯度力;地转偏向力;地表磨擦力风向的决定:1力风(理论风)--垂直于等压线,高压指向低压.2力风(高空风)--平行于等压线,北右偏,南左偏.3力风(实际地表风)--斜穿等压线,北右偏,南左偏7、风向:1、风向-—风来的方向; 2、根据等压线的分布弄清确定风向①确定水平气压梯度力的方向:垂直于等压线并且由高压指向低压,若是曲线垂直于切线②确定地转偏向力方向:与风向垂直,北半球右偏,南半球左偏,赤道无偏转③近地面受磨擦力(方向与风向相反)的影响,风向与等压线斜交高空山皮大气的风向是气压梯度力和地转偏重力两力共同作用的结果,风向与等压线交叉点(北半球向右,南半球向左)近地面的风,受气压梯度力、地转偏向力和磨擦力三力的共同影响,风向斜交于等压线8、三种局地热力环流:白天(郊区→城市、海风、谷风) 夜晚(城市→郊区、陆风、山风)9.热力环流的性质特点由于地面冷热不均而形成的空气环流,成为热力环流。
高中地理知识点总结:地球温室效应、臭氧层的破坏、酸雨等现象产生的原因及危害

努力加强国际间的合作;
植树造林
臭氧层的破坏
使用制冷设备等消耗臭氧物质
氟氯烃等
太阳紫外辐射增加:
直接危害人体健康;
对生态环境和农林牧渔业造成破坏
全球合作,减少消耗臭氧层物质的排放;
积极研制新型制冷系统
酸雨
燃烧化石燃料(主要是燃煤);
汽车气排放
二氧化硫和氧化氮等酸性气体
水体酸化,影响鱼类生长乃至死亡;
酸化土壤,危害森林和农作物生长;
腐蚀建筑物和文物古迹
危及人体健康
1、最根本途径:减少人为硫氧化物和氮氧化物的排放——研究煤炭中硫资源的综合开发和利用(如清洁煤技术;清洁燃烧技术;废气再利用)
2、燃烧低硫煤或其它清洁能源
高中地理知识点总结:地球温室效应、臭氧层的破坏、酸雨等现象产生的原因及危害
地球温室效应、臭氧层的破坏、酸雨等现象产生的原因及危害
现象
产生原因
污染物
危害
对策
温室效应
1、燃烧矿石燃料
2、毁林特别是热带森林的破坏
二氧化碳
1、海平面上升(原因?)对沿海低地构成直接威胁
2、引起各地区降水和干湿状况的变化,进而导致世界各国经济结构的变化(具体表现?)
初中化学臭氧层空洞知识点分析

臭氧层空洞臭氧和臭氧层空洞地球周围的大气,按其高度可分为对流层、平流层、中间层和散逸层。
臭氧(0 3 )是氧气(O 2 )的一种同素异形体,在大气中含量甚微。
其浓度因海拔高度而异。
臭氧分子是平流层大气的最关键的组成成分,其厚度约为10~15公里,浓度峰值在离地面20~25公里高度处。
一般就把平流层的这一部分成为臭氧层。
近年来,科学观测发现臭氧层遭受破坏,在南极甚至出现臭氧层消失的现象,即所谓的臭氧层空洞。
平流层中臭氧的存在对于地球生物至关重要,因为它阻挡了高能量的紫外辐射到达地面。
因此,有人形象地把臭氧层比喻为地球的“ 保护伞”,而把臭氧耗损比喻为“保护伞穿了孔”。
穿孔的保护伞据美国字航局观测的资料表明,自1969年以来,全球除赤道以外,所有地区臭氧层中臭氧的含量减少了3%~5%,全球臭氧层都已受到损害。
1985年英国科学家首先发现南极臭氧层己出现空洞。
人们对南极臭氧层的考察证实,南极上空周期性地出现臭氧层空洞,南极中心地区上空臭氧含量比正常含量减少了65%,南极边缘地区减少了30%~40%。
1989年,由美、英、挪和德的200名科学家组成的北极臭氧层考察队,进行为期6周的考察证实:北极虽尚未发现臭氧空洞,但臭氧层破坏严重,在北极上空造成臭氧损耗的高活性化学粒子氧化氯和氧化溴浓度比原先估计的高出50倍。
美国宇航局的资料还表明,自1969年以来,横跨美国、加拿大、日本、中国、前苏联、西欧等国广阔地带的臭氧层已减少了3%。
世界气象组织1995年在一份声明中说:“南极目前臭氧损耗严重的范围达1000万平方公里,与欧洲面积差不多,是1993年和1994年同时期臭氧空洞面积的2倍”。
联合国世界气象组织说,南极上空臭氧变薄的速度是有记载以来最快的,达到每天损失1%,空洞的范围有如欧洲一样大小。
伞破屋漏生灵遭殃阳光中的紫外辐射虽然只占太阳总发射能量的5%左右、但是它对于地球生命系统具有很大的伤害能力,并且能量越高,伤害越大。
我们周围的空气知识点总结
我们周围的空气知识点总结知识点总结用途供呼吸如潜水、医疗急救支持燃烧如燃料燃烧、炼钢、气焊知识梳理:1、第一个对空气组成进行探究的化学家:拉瓦锡(第一个用天平进行定量分析)。
2空气成分O2N2CO2稀有气体其它气体和杂质体积分数21%78%%%%(1)空气中氧气含量的测定a、可燃物要求:只与氧气反应且产物是固体:选择红磷b、装置要求:气密性良好c、现象:红磷燃烧,产生大量白烟,放出热量,冷却到室温后,打开止水夹,水压入集气瓶内,压入水的体积约占集气瓶内空气体积的1/5d、结论: O2约占空气体积的1/5,可支持燃烧;N2约占空气体积的4/5,不支持燃烧,也不能燃烧,难溶于水e、探究:①液面上升小于1/5原因:装置漏气,红磷量不足,装置未冷却就打开止水夹②能否用铁代替红磷不能原因:铁不能在空气中燃烧能否用碳、硫代替红磷不能原因:产物是气体,不能产生压强差能否用镁代替红磷不能用镁,因为镁不但跟氧气反应而且还跟氮气等反应,结果测得的不只是空气中氧气的体积。
会远远大于氧气的体积。
③做空气中氧气含量测定的实验时,为什么说集气瓶中的水面上升1/5体积就是空气中氧气的体积答:红磷在集气瓶的空气中燃烧时,红磷只与空气中的氧气发生化学反应,生成的白色固体形成白烟,由于燃烧匙内盛有过量的红磷,因此燃烧停止后,集气瓶空气中的氧气全部参加了化学反应.由于氧气的消耗,使集气瓶气体的压强小于外界大气压强,以至水面上升使集气瓶内外气压相等.进入集气瓶内的水约占1/5体积.得出结论为空气中氧约占1/5体积.实际在实验中测得的结果比真实值小,其原因可能是A红磷量不足 B装置气密性差 C未冷却至室温就打开止水夹 D、没有预先在导管中装满水f、原理: 4P + 5O2点燃2P2O5注意事项:A、所用的红磷必须过量,过少则氧气没有全部消耗完B、要等集气瓶(装置)冷却后才能打开弹簧夹,C、装置的气密性要好,(否则测量结果偏小),D、要先夹住橡皮管,然后再点红磷(否则测量结果偏大)。
氧族元素知识点梳理
氧族元素知识点梳理臭氧O31. 同素异形体:有同⼀种元素组成的性质不同的单质。
氧⽓和臭氧、⾦刚⽯和⽯墨、S 有多种同素异形体。
2. 在常温、常压下,臭氧是⼀种有特殊臭味的淡蓝⾊⽓体,密度⽐空⽓的⼤,也⽐氧⽓易溶于⽔。
液态臭氧呈深蓝⾊,沸点为-112.4℃,固态臭氧呈紫⿊⾊,熔点为-251℃。
3. 臭氧不稳定,在常温下能缓慢分解⽣成氧⽓,在⾼温时可以迅速分解。
2O33O24. 臭氧具有极强的氧化性,银、汞等在空⽓或氧⽓中不易被氧化的⾦属,可以与臭氧发⽣反应。
5. 臭氧可⽤于漂⽩和消毒。
某些染料受到臭氧的强烈氧化作⽤会褪⾊,臭氧还可以杀死许多细菌,因此,它是⼀种很好的脱⾊剂和消毒剂。
6. 在空⽓中⾼压放电就能产⽣臭氧。
放电3O22O3过氧化氢H2O21. 过氧化氢是⼀种⽆⾊粘稠液体,它的⽔溶液俗称双氧⽔,呈弱酸性。
2. 市售双氧⽔中过氧化氢的质量分数⼀般约为30%。
医疗上⼴泛使⽤稀双氧⽔的质量分数为3%(或更⼩)作为消毒杀菌剂。
⼯业上⽤10%的双氧⽔漂⽩⽑、丝以及⽻⽑等。
过氧化氢可⽤作氧化剂、漂⽩剂、消毒剂、脱氯剂等,也可作为⽕箭燃料,及⽣产过氧化物的原料。
3. 过氧化氢会分解⽣成⽔和氧⽓。
MnO22H2O22H2O + O2↑综合实验活动:H2O2性质研究及化学反应条件的控制活动任务:通过实验研究H2O2的化学性质,并讨论反应条件如浓度、温度、反应介质(⽔溶液的酸碱性)、催化剂等对化学反应结果的影响。
任务⼀:研究H2O2的化学性质通过实验研究H2O2的化学性质。
设计实验⽅案1. 请你根据你对H2O2性质的了解和对H2O2中氧元素化合价的分析,预测过氧化氢可能具有哪些化学性质。
2. 请选择具体试剂,实现上述反应关系。
可供选择的试剂:5%H2O2溶液、⼆氧化锰、碘化钾溶液、酸性⾼锰酸钾溶液、稀硫酸提⽰:(1)双氧⽔对⽪肤、眼睛和粘膜有刺激作⽤,使⽤时不要沾到⽪肤上。
⼀旦双氧⽔沾到⽪肤上或溅⼊眼内,应⽴即⽤⼤量清⽔冲洗。
臭氧层保护知识点总结
臭氧层保护知识点总结臭氧层是大气中极为薄层的一个部分,它包括气体中的臭氧分子,主要位于地球的平流层和对流层之间。
这一层对地球生物圈至关重要,因为它能够过滤掉太阳辐射中的紫外线,并起到保护地球上的生物免受伤害的作用。
然而,自20世纪中叶以来,人类活动已造成了大量的氯氟碳化合物的释放,导致了臭氧层的破坏。
为了保护臭氧层,全球各国采取了一系列的措施和政策。
本文将对臭氧层保护的相关知识点进行总结。
臭氧层的重要性臭氧层在地球的生物圈中扮演着非常重要的角色。
首先,臭氧层能够吸收大部分的紫外线辐射,被称为UV-B。
这种辐射对地球上的生物体具有较强的杀伤力,容易导致皮肤癌、白内障等疾病。
臭氧层的存在就像一层“天然的伞”,能够将有害的紫外线过滤出去,保护地球的生物体免受伤害。
其次,臭氧层对地球的气候系统也具有重要的影响。
臭氧层在过滤掉大部分的紫外线的同时,也能够吸收一部分的太阳辐射,使得地球的气温能够保持在适宜的范围内。
同时,臭氧层的存在也能够改变大气中的温度和压力分布,对地球的气候产生一定的影响。
然而,由于人类活动的不断扩张,导致了大量的氯氟碳化合物的释放,使得臭氧层遭受破坏,臭氧层的保护变得尤为重要。
臭氧层保护的措施和政策为了保护臭氧层,全球各国之间展开了一系列的合作和行动。
其中,最重要的合作机构是联合国环境规划署(UNEP)下属的臭氧层保护国际条约。
该条约于1987年签署,旨在通过减少全球温室气体的排放来保护臭氧层。
截至目前,该条约已经得到了195个国家的批准和加入。
在臭氧层的保护工作中,各国采取了一系列的措施和政策。
首先,许多国家已经制定了相关的法律和法规,禁止或限制使用含氯氟碳化合物的产品。
例如,制冷剂、擦洗剂等产品中的氯氟碳化合物已经被普遍停止使用,并逐渐转变成对臭氧层无害的替代品。
其次,各国还通过国际合作来共同推进臭氧层的保护工作。
在国际层面上,各国之间建立了信息交流平台,共同开展监测、评估和研究工作,及时掌握臭氧层的变化情况,并制定相应的防范措施。
高三地理臭氧知识点总结
高三地理臭氧知识点总结臭氧是地球大气层中一种重要的气体成分,它在保护地球生命的过程中扮演着极为重要的角色。
以下是高三地理中关于臭氧的知识点总结。
一、臭氧的定义和特性臭氧(O3)是一种由三个氧原子组成的气体,具有强烈的氧化性。
与氧气(O2)相比,臭氧分子更加不稳定,容易分解为氧气和自由氧原子。
二、臭氧的分布和形成臭氧主要分布在地球大气层的同温层和对流层中。
同温层臭氧主要以臭氧层的形式存在于平流层,而对流层臭氧则分布较为零散。
臭氧形成有两种主要机制:自然形成和人为形成。
自然形成的臭氧主要是通过紫外线照射下氧气分子发生光解反应生成;而人为形成的臭氧主要是由于大气污染物的排放和化学反应而产生。
三、臭氧层的作用和保护臭氧层在地球大气层中扮演着重要的保护层,主要具有以下作用:1.吸收紫外线:臭氧层可以吸收大部分太阳紫外线,保护地球表面的生物免受紫外线的伤害;2.调节气候:臭氧层的存在可以吸收和反射太阳的热量,对地球气候起到调节作用;3.维持生态平衡:臭氧层的保护对维持生态系统的稳定和平衡具有重要意义。
四、臭氧层破坏和问题然而,随着人类活动的增加和工业化进程的加快,地球大气层中的臭氧层出现了一系列问题和破坏现象:1.臭氧空洞:大气异常富含臭氧空洞,是指臭氧浓度明显低于正常情况的区域。
臭氧空洞主要是由人为因素引起的,如氯氟烃类化合物(CFCs)的排放;2.紫外线辐射增强:臭氧空洞导致紫外线辐射进一步增强,对人类和生物造成较大的伤害;3.气候变化:臭氧层的破坏也会对地球气候产生重要影响,如增加温室效应、加剧全球变暖等。
五、应对臭氧层问题的措施为了减轻和防止臭氧层的破坏,国际社会采取了一系列措施:1.国际合作与政策制定:各国共同努力,签署并执行国际协议和公约,限制和减少有害物质的排放;2.减少化学物质使用:鼓励研究和开发代替性物质,减少有害物质的使用;3.环境教育与意识提升:加强公众对臭氧破坏问题的认识和理解,提高环保意识,倡导低碳环保生活方式。
