2015-2016学年高二化学人教版选修4课后作业第四章 第三节 第1课时 电解原理 Word版含解析.doc
选修4第四章第三节电解池

想一想、做一做
[例]以石墨棒为电极,请写出分别电解下列溶液时,在 阴、阳两极上发生的电极反应式及总的化学方程式。 (1)NaCl溶液: 阳极:2Cl--2e-=Cl2↑ 阴极:2H++2e-=H2↑ (2H2O 总反应:2Cl-+2H
2H++2OH-)
O = Cl2↑+H2↑+2OH2
电解
(2)CuSO4溶液: OH-在哪一极产生? 阳极:4OH--4e-=2H2O+O2↑ (4H2O 4H++4OH-) 2+ +4e-=2Cu 阴极:2Cu
2、电解无氧酸溶液(氢氟酸除外)、不活泼金属的 无氧酸盐溶液,如电解盐酸、CuCl2溶液等 电解盐酸 阳极: 2Cl -- 2e-=Cl2↑ 阴极: 2H+ +2e-= H2 ↑
总反应:2HCl = Cl2↑ + H2↑ 类型:电解电解质型 实质:电解质本身被电解 电解后溶液中溶质的质量分数 减小 ,若要恢复 原来的组成和浓度,需加入一定量的 溶质 (通入一 定量的HCl气体)
活性金属 > S2->I->Br->Cl->OH->含氧酸根>F-
除Pt、Au
电极反应:
阳极: 2Cl- - 2e- = Cl2↑
(氧化反应)
阴极
Cu -
-- + e +
阳极
eoooo oooo oooo oooo oooo oooooooooooo ooooooooooo
阴极: Cu2+ + 2e- = Cu
4、根据金属活动顺序表,Cu不能发生如下反应:
Cu + 2H2O=Cu(OH)2↓+ H2↑。但选择恰当电极材料
人教版高中化学选修四第四章第三节第一课时电解原理课下30分钟演练.docx

高中化学学习材料(灿若寒星**整理制作)一、选择题(本题包括7小题,每小题3分,共21分)1.下列说法错误的是( )A.电解质的导电过程是化学变化,而金属的导电是物理变化B.电解质溶液导电的过程,就是电解质被电解的过程C.电解质在任何条件下均可以导电D.电解质溶液导电过程中一定有新物质生成解析:电解质导电的过程就是被电解的过程,在电解过程中发生氧化还原反应,一定有新物质生成,所以是化学变化。
金属导电是靠自由电子的定向移动,无新物质生成,是物理变化,A、B、D项正确。
电解质要导电只有在电离的条件下,存在自由移动的离子时才能导电,所以C项错误。
答案:C2.(2011·海南高考)一种充电电池放电时的电极反应为:H2+2OH--2e-===2H2O,NiO(OH)+H2O+e-===Ni(OH)2+OH-;当为电池充电时,与外电源正极连接的电极上发生的反应是( )A.H2O的还原B.NiO(OH)的还原C.H2的氧化D.Ni(OH)2的氧化解析:电池充电时为电解池,与电源正极相连的极为阳极,失去电子,发生氧化反应,故该电池充电时,阳极反应式为Ni(OH)2+OH--e-===NiO(OH)+H2O。
答案:D3.将一直流电源的正、负极(电极材料为Pt),用玻璃片分别压在一张用食盐水、碘化钾、淀粉溶液和石蕊试液浸透的滤纸上,经过一段时间后,两极附近滤纸的颜色分别是( )A B C D阳极蓝白红蓝阴极白蓝蓝蓝解析:阳极上I-放电生成I2,使淀粉变蓝,阴极上H+放电后,使溶液中的c(H+)<c(OH-),呈碱性,使石蕊显蓝色,故D项正确。
答案:D4.(2012·孝感高中高二期末检测)如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流表中有电流通过,则下列说法正确的是( )A.锌片是负极B.两个铜片上都发生氧化反应C.石墨是阴极D.两个番茄都形成原电池解析:根据图示推知左侧为原电池,其中Zn作负极,Cu作正极,Cu片上发生还原反应;右侧为电解池,其中Cu为阴极,发生还原反应,C为阳极,发生氧化反应。
人教版高中化学选修4第四章第三节:电解池

(2)在阴极,由于 H+ 容易得到电子被还原生成 H2 .
使H2O 电离向右移动,因此阴极 OH- 浓度增大, PH 增大 。 阴极方程式:2H+ + 2e- = H2 。
电解
总化学方程式:2NaCl 2H2O Cl 2 H2 2;NaOH
总离子方程式:
▪电源负极→电解池阴 极电解池阳极→电源正 极
试一试
练习:以石墨作电极,电解下列溶液,写出电 极反应及电解总反应式。
AgNO3溶液
阳极:4OH--4e-=2H2O+O2↑
阴极:4Ag++4e-=4Ag 总反应式:4Ag++2H2O通==电4Ag +O2↑+4H+
二、电解规律:用惰性电极(金、铂和石墨)电解时
总反应:2Cl-+2H2O电=解Cl2↑+H2↑+2OH-
(2)CuSO4溶液:
OH-在哪一极产生?
阳阴极极::42OCHu-2-+ 4+e4-e=-=2H22COu+O2↑ (4H2O
4H++4OH-)
总反应式:2Cu2++2H2O电=解2Cu+O2↑+4H+
H+应该在哪一极产生?
电解池与原电池有哪些异同
②电极: 阳极:与电源正极相连
③电解质溶液或熔融电解质;
④形成闭合回路。
[还原反应] [氧化反应]
小结:
①电极反应:阳极失电子,发生氧化反应;阴极得
电子,发生还原反应。(阳氧)
②离子流向:阳离子移向阴极,阴离子移 向阳极(异性相吸)
人教版化学选修四第四章第三节电解池(共13张PPT)

加酚酞溶液变红
实验装置
2.电镀
(1).
定义
利用电解原理在某些金属的表面镀上 一薄层其它金属或合金的过程。
(2). 电镀材料的选择
阴极——镀件 阳极——镀层金属
电镀液——含有镀层金属离子的溶液
(3).电极反应式
阴极:Cu2++ 2e- = Cu
阳极: Cu - 2e- = Cu2+ (4).电镀的特点
择决定命运,环境造就人生!
电解
==MgLeabharlann +Cl2↑
(3)制取金属铝
电解熔融氧化铝
阳极: 6O2- - 12e- = 3O2↑
阴极: 4Al3+ + 12e- = 4Al
总反应:
电解
2Al2O3 ==
4Al
+
3O2↑
小结:电解池、电解精炼池、电镀池的比较
电解池
电镀池
电解精炼池
定义
将电能转变成化学能 的装置。
应用电解原理在某些 金属表面镀上一层其 它金属的装置。
①阳极本身参加电极反应 ②电解质溶液的浓度保持不变
3、粗铜的电解精炼
-+
以粗铜为阳极,以纯铜 纯铜
粗铜
为阴极, 以CuSO4溶液 为电解液进行电解
阳极: Zn Zn-2e- = Zn2+
Fe Ni
Fe -2e- = Ni -2e- =
Fe2+ Ni2+
CuSO4溶液
阳极泥: 相对不活泼的金
Cu Cu-2e- = Cu2+ 属以单质的形式沉积在电
离子放电顺序:
阳离子 H+ > Na+ 阴离子 Cl- > OH-
人教化学选修4第四章第3节 电解池(共19张PPT)
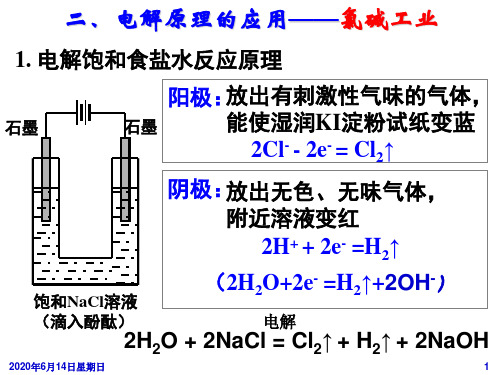
Cl2
H2
(2)电解饱和食盐水
2的Cl离-+子2方H2程O式=电=是解==2;OH淡-盐+水H2↑+Cl2N↑a+ (3)电解时用盐酸控
溶液A
制阳极区溶液的pH
氯 H减在 衡 酸C少气的移2l~O氯与作动,3气水用原,增在反_理用_大水应解_化H_中:释学_C_的C盐l平_的l_溶2+浓;解H度,2可O有使精利制平于饱衡和氯逆H气水向C的(移含l+溢少动出,。
2020年6月14日星期日
10
二、电解原理的应用——电解精炼铜
2020年6月14日星期日
11
二、电解原理的应用——电冶金
电解是最强有力的氧化还原手段,用于 冶炼Na、Ca、Mg、Al这样活泼的金属
钠的冶炼 (熔融NaCl作电解质)
阳极:2Cl--2e-=Cl2↑ 阴极:2Na++2e-=2Na 总反应: 2NaCl(熔融)通==电=2Na+Cl2↑
Cu
以粗铜为阳极,以纯铜
Zn Fe
纯铜 Cu
为阴极, 以CuSO4溶液 为电解液进行电解。
Ni Ag
Au
②电解后CuSO4浓度的变化 CuSO4浓度减小
CuSO4溶液
阳极: Zn -2e-=Zn2+ Fe-2e-=Fe2+
Ni -2e-=Ni2+ Cu-2e-=Cu2+
阴极: Cu2+ +2e-=Cu
2020年6月14日星期日
NaCl
量NaOH) 19
阴极:
4Al 3+ + 12 e- =4Al 阳极:
C
Fe
6O 2- -12e - =3O2↑ 总反应: 2Al2O3(熔融)通==电=4Al+3O2↑
人教版高中化学选修四课件第四章第三节电解池(第1课时).pptx

在此输入您的封面副标题
选修4-第四章-电化学基础
第三节电解池
(第一课时)
氢
氧
气
气
—
+
电解 电解水:2H2O2H2+O2
思考回忆
1、电解质是指在_____水_溶__液_或__熔__融_状_能态够下 导电的
化合物。 2、电离是指电解质在_______水_溶_或液_____熔_状融态 下离解成_____自__由_移__动_离_的子过程。 3、原电池是____把__化__学_能__转_化__为_的电能装置。
实验结论
P79实验4-2
结论1:电解质通电前在水溶液中的阴、阳离子
作_____自__由__运动;在外电源的作用下(直流电),
改作_____定__向__移动而导电。在导电的同时,在 阳、阴两极发生氧化—还原反应,即被电解,电 离是_____电__解___的前提。
实验结论
一、电解原理
P79实验4-2
成铜原子覆盖在阴极上;在阳极,氯离子失去电子而被 氧化成氯原子,并两两结合成氯分子,从阳极放出。
阴离子失去电子,阳离子得到电子的过程叫放电。 阴极: Cu2++2e-=Cu
阳极:
2Cl--2e-=Cl2↑
通直流电
电解CuCl2溶液的化学反应方程式: CuCl2=或=电C解u+Cl2↑
电解原理
1、电解的概念 使 通电过流电解质溶液而在 阴、阳两引极 起 氧化还原 反应的过程叫做电解。
结论2.电极反应式
阳极:
2Cl—-2e—=Cl2↑
阴极:
Cu2++2e—=Cu
总反应Cu:2++2Cl—Cu+Cl2↑电解 或CuCl2Cu+Cl2↑ 电解
人教版高中化学选修四课件第四章第三节第1课时电解原理
变式训练1
如图发生电解,已知电解不久后B电极附近溶液
出现浅红色,试判断甲、乙、丙的阴、阳极。
答案 解析
A——阳极
B——阴极
C——阳极
D——阴极
E——阳极
F——阴极
根据下列装置图,回答问题。
(1)若A、B均为惰性电极,电解质溶液为MgCl2溶液。
阳极:________________;
阴极:________________; 总反应式:________________。
(2)若A为Cu,B为碳棒,电解质溶液为CuSO4溶液。 阳极________,阴极________。 (3)若A为碳棒,B为铁,电解质为熔融NaCl 阳极________;阴极________;
总反应式________________________。
答案 (1)2Cl--2e-===Cl2↑ 2H++2e-===H2↑
电解 Mg +2Cl +2H2O=====Cl2↑+H2↑+Mg(OH)2↓
2+
-
(2)Cu-2e-===Cu2+ Cu2++2e-===Cu (3)2Cl--2e-===Cl2↑ 2Na++2e-===2Na 电解 2Na +2Cl =====2Na+Cl2↑
答案
(1)思维程序:写电离方程式―→找全离子分成两
(2)阳极上阴离子的放电顺序为:S2->I->Br->Cl->OH-
>含氧酸根离子。 (3)阴极上阳离子的放电顺序为:K+<Ca2+<Na+<Mg2+< Al3+<(H+浓度较小时)<Zn2+<Fe2+<Sn2+<Pb2+ <(H+浓度较大时)<Cu2+<Fe3+<Hg2+<Ag+。
人教版化学选修四第四章第三节电解池(共13张PPT)
阴极:镀件
阴极:纯金属
电极 阳极:氧化反应 反应 阴极:还原反应
阳极:氧化反应 阴极:还原反应
阳极:氧化反应 阴极:还原反应
人 教 版 化 学 选修四 第四章 第三节 电解池 (共13张 PPT)
总反应:
电解
2Al2O3 ==
4Al
+
3O2↑
人 教 版 化 学 选修四 第四章 第三节 电解池 (共13张 PPT)
人 教 版 化 学 选修四 第四章 第三节 电解池 (共13张 PPT)
小结:电解池、电解精炼池、电镀池的比较
电解池
电镀池
电解精炼池
定义
将电能转变成化学能 的装置。
应用电解原理在某些 金属表面镀上一层其 它金属的装置。
• 3阳、极两产极物_都是用_A_银g_+片;作阴电极极的电产解物A是g_AN_gO__3溶。液时,
人 教 版 化 学 选修四 第四章 第三节 电解池 (共13张 PPT)
二、电解原理的应用
人 教 版 化 学 选修四 第四章 第三节 电解池 (共13张 PPT)
1、电解饱和的食盐水
食盐水中存在的离子: Na+ 、Cl- 、H+ 、OH-
4、电冶金
人 教 版 化 学 选修四 第四章 第三节 电解池 (共13张 PPT)
• 由于电解是最强有力的氧化还原手段,所以电解 法是冶炼金属的一种重要的方法。对于冶炼像 Na、Ca、Mg、Al这样活泼的金属,电解法几乎 是唯一可行的工业方法。
(1)制取金属钠
电解熔融状态的氯化钠。
阳极: 2Cl - -- 2e- == Cl2↑ 阴极: 2Na+ + 2e- == 2Na
人 教 版 化 学 选修四 第四章 第三节 电解池 (共13张 PPT)
高二化学选修4同步练习:4-3-1电解原理
4-3-1电解原理一、选择题(每小题有1个或2个选项符合题意)1.下列关于电解池的叙述中不正确的是()A.与电源正极相连的是电解池的阴极B.与电源负极相连的是电解池的阴极C.电解池的阳极发生氧化反应D.电解池的阴极发生还原反应【解析】电解池的阴阳极根据连接的电源的正负极来确定,与电源正极相连的是阳极,与电源负极相连的是阴极。
所以A错,B 对。
阳极失电子,发生氧化反应,C对;阴极得电子,发生还原反应,D对。
【答案】 A2.在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是()A.原电池的正极和电解池的阳极所发生的反应B.原电池的正极和电解池的阴极所发生的反应C.原电池的负极和电解池的阳极所发生的反应D.原电池的负极和电解池的阴极所发生的反应【解析】原电池的正极和电解池的阴极发生的是还原反应,原电池的负极和电解池的阳极发生的是氧化反应。
【答案】BC3.用石墨做电极电解CuCl2溶液,下列说法正确的是()A.在阳极上析出金属铜B.在阴极上析出金属铜C.在阴极上产生有刺激性气味的气体D.阳极上发生还原反应【解析】根据电解原理,阳极发生氧化反应:2Cl--2e-===Cl2↑,阴极发生还原反应:Cu2++2e-===Cu。
因此阳极上产生有刺激性气味的气体——氯气,在阴极上析出铜。
故B项正确。
【答案】 B4.下列装置属于工作时的电解池的是(其中C表示石墨)()【解析】构成电解池的条件:①直流电源,②两个电极,③电解质溶液或熔触电解质并形成闭合回路。
A项乙醇不是电解质,B项无电源,D项把开关合上才是电解池。
【答案】 C5.下列说法错误的是()A.电解质的导电过程是化学变化,而金属的导电是物理变化B.电解质溶液导电的过程,就是电解质被电解的过程C.电解质在任何条件下均可以导电D.电解质溶液导电过程中一定有新物质生成【解析】电解质导电的过程就是被电解的过程,电解过程发生氧化还原反应一定有新物质生成,所以是化学变化;而金属导电是靠自由电子的定向移动,无新物质生成,是物理变化,故A、B、D项正确。
人教版高中化学选修四化学高二第四章第三节电解池同步练习.docx
高中化学学习材料唐玲出品人教版化学高二选修4第四章第三节电解池同步练习一、选择题1.银制器皿日久表面会逐渐变黑,这是生成了Ag2S的缘所以.根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去.下列说法正确的是()A.处理过程中银器一直保持恒重B.银器为正极,Ag2S被还原生成单质银C.该过程中总反应为2Al+3Ag2S═6Ag+Al2S3D.黑色褪去的原因是黑色Ag2S转化为白色AgCl答案:B解析:解答:A.银器放在铝制容器中,由于铝的活泼性大于银,所以铝为负极,失电子,银为正极,银表面的Ag2S得电子,析出单质银,所以银器质量减小,所以A错误;B.银作正极,正极上Ag2S得电子作氧化剂,在反应中被还原生成单质银,所以B正确;C.Al2S3在溶液中不能存在,会发生双水解反应生成H2S和Al(OH)3,所以C错误;D.黑色褪去是Ag2S转化为Ag而不是AgCl,所以D错误;所以选B.分析:本题考查原电池原理,明确正负极上得失电子是解本题关键.2.利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是()A.氯碱工业,若X、Y均为石墨,Y附近能得到氯气B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4C.外加电流的阴极保护法中,Y是待保护金属D.电镀工业中,X是待镀金属,Y是镀层金属答案:C解析:解答:根据电解池中电子的流向:电解池的阳极→电源的正极,所以X是阳极,Y是阴极.A、氯碱工业中,在阴极上产生氢气,所以A错误;B、电解精炼铜时,X是粗铜,Y是纯铜,Z是CuSO4溶液,所以B错误;C、外加电流的阴极保护法中,待保护金属作阴极,即为Y电极,所以C正确;D、电镀池中,镀件是阴极,即为Y极,镀层金属为阳极,即X极,所以D错误.所以选C.分析:本题考查电解池的工作原理以及电镀池、电解精炼铜装置的有关知识,可以根据教材知识来回答,属于基本知识的考查.3.如图,将两烧杯用导线相连,Pt、Cu、Zn、C分别为四个电极,当闭合开关后,以下叙述正确的是()A.Cu极附近OH﹣浓度增大B.Cu极为原电池负极C.电子流向是由C极流向Pt极D.当C极上有4mol电子转移时,Pt极上有1mol O2生成答案:A解析:解答:A、左边装置中,铜是阴极,阴极上水得电子生成氢气和氢氧根离子,所以铜极附近显碱性,氢氧根离子浓度增大,所以A正确;B、右边装置是原电池,锌作负极,左边装置是电解池,铜连接负极,所以铜是电解池中的阴极,所以B错误;C、电子流向为:原电池负极→电解池阴极→电解池阳极→原电池正极,即锌极→铜极→铂极→碳极,所以C错误;D、碳棒是原电池正极,氢离子在碳棒上得电子发生还原反应,Pt电极为电解池的阳极,溶液中氯离子失电子生成氯气,所以D错误;所以选A.分析:本题考查了原电池和电解池原理,会根据装置特点判断原电池和电解池.4.下列关于电解池的叙述中不正确的是()A.与电源正极相连的是电解池的阴极B.与电源负极相连的是电解池的阴极C.在电解池的阳极发生氧化反应D.电子从电源的负极沿导线流入电解池的阴极答案:A解析:解答:A、电解池中,与外接电源负极相连的为阴极,与正极相连的为阳极,所以A 错误;B、电解池中,与外接电源负极相连的为阴极,所以B正确;C、与正极相连的为阳极,阳极上得电子发生氧化反应,所以C正确;D、与外接电源负极相连的为阴极,电子从负极经导线流入阴极,所以D正确;所以选A.分析:本题考查电解池知识,侧重于考查学生的化学知识的综合运用,注意把握电解池的工作原理.5.下列过程需要通电才能进行的是()①电离②电解③电镀④电化学腐蚀.A.①② B.②③ C.②④ D.全部答案:B解析:解答:①电离是电解质在水溶液中离解出自由移动离子的过程,不需要通电,所以①错误;②电解池是外加电源强迫下的氧化还原反应,必须加外加电源,所以②正确;③电镀池实质是一个电解池,必须加外加电源,所以③正确;④电化学腐蚀原理是原电池原理,原电池中不含电源,是自发进行的氧化还原反应,所以④错误.所以选B.分析:本题是对电化学的电解池、原电池的构成条件的考查,要注意过程的发生需要的条件.6.如图,A池用石墨电极电解NaOH溶液,B池精炼粗铜,一段时间后停止通电,A池中d 极产生具有氧化性的气体在标准状况下为2.24L.下列说法正确的是()A.A池为电解池,B池为原电池 B.d、e两极都发生氧化反应C.e极应为粗铜板材料 D.B池中e极质量增加12.8g答案:D解析:解答:A池用石墨电极电解NaOH溶液,B池精炼粗铜,一段时间后停止通电,A池中d极产生具有氧化性的气体在标准状况下为2.24L.电解氢氧化钠溶液在阳极生成氧气具有氧化性,判断d极为电解池阳极,所以c为阴极,e电极为阴极;f电极为阳极;推断得到A池电解氢氧化钠溶液,d电极生成氧气;c电极生成氢气;B池精炼铜,阳极f为粗铜,e 电极为精铜;A、AB都为电解池,所以A错误;B、电解池中阳极上发生氧化反应,所以应为d、f电极上发生氧化反应,c、e电极上发生还原反应,所以B错误;C、池精炼铜,阳极f为粗铜,e电极为精铜;所以C错误;D、B池中e极为电解池阴极,电极反应Cu2++2e﹣=Cu,质量增加为铜,阳极电解池中电子守恒,A池中d电极生成氧气,电极反应:4OH﹣﹣4e﹣=2H2O+O2↑,生成氧气物质的量=0.1mol;转移电子为0.4mol,所以e极为电解池阴极电子转移0.4mol,电极反应Cu2++2e﹣=Cu,计算得到生成铜0.2mol,质量为12.8g,所以D正确;所以选D.分析:本题考查了电解池的原理应用,电解氢氧化钠溶液,电解精炼,电极判断,电极产物分析,电极反应,电子守恒的计算应用,电极判断是解题关键.7.下列叙述中,正确的是()①电解池是将化学能转变成电能的装置②原电池是将电能转变成化学能的装置③金属和石墨导电均为物理变化,电解质溶液导电是化学变化④不能自发进行的氧化还原反应,通过电解的原理有可能实现⑤电镀过程相当于金属的“迁移”,可视为物理变化.A.①②③④ B.③④ C.③④⑤ D.④答案:B解析:解答:①电解池是将电能转变成化学能的装置,所以①错误;②原电池是将化学能转变成电能的装置,所以②错误;③金属和石墨导电均为物理变化,电解质溶液导电是化学变化,发生电能和化学能的转化,一定发生化学变化,所以③正确;④不能自发进行的氧化还原反应,通过电解的原理有可能实现,如铜和稀硫酸的反应,铜为阳极被氧化,可生成硫酸铜,所以④正确;⑤电镀过程相当于金属的“迁移”,发生氧化还原反应,为化学反应,所以⑤错误.所以选B.分析:本题考查较为综合,涉及电解池和原电池知识,注意把握原电池和电解池的工作原理,学习中注意相关基础知识的积累.8.如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是()A.a为负极,b为正极B.a为阳极,b为阴极C.电解过程中,氯离子浓度不变D.电解过程中,d电极质量增加答案:D解析:解答:A.由电流方向可知a为正极,b为负极,所以A错误;B.a、b为电源的两极,为正极、负极,所以B错误;C.电解时阳极发生氧化反应,氯离子被氧化生成氯气,则氯离子浓度降低,所以C错误;D.阴极发生还原反应,铜离子被还原生成铜,则d电极质量增加,所以D正确.所以选D.分析:本题考查电解池知识,为高考高频考点,注意根据电流方向判断电解池的阴阳极电极反应,为解答该题的关键.9.下列关于铜电极的叙述正确的是()A.铜一锌原电池中,铜是负极B.用电解法精炼粗铜时,粗铜作阴极C.在镀件上电镀铜时,用金属铜作阳极D.电解稀硫酸制H2、O2时,铜作阳极答案:C解析:解答:A.原电池中活泼金属作负极,铜锌原电池中,Zn活泼,则Zn为负极,Cu为正极,所以A错误;B.粗铜精炼时粗铜作阳极,纯铜作阴极,所以B错误;C.电镀Cu时,Cu作阳极,在镀件上铜离子得到电子生成Cu,所以C正确;D.电解稀硫酸制取氢气和氧气时,用惰性电极作阳极,若利用Cu为阳极,则阳极上铜失电子而不是氢氧根离子失电子,所以D错误;所以选:C.分析:本题考查原电池和电解原理的应用,明确粗铜精炼、电镀、电解食盐水等电解的应用是解答本题的关键.10.如图所示,按如图甲装置进行实验,若图乙的x轴表示流入电极的电子的量,则y轴不可能表示的是()A.c(Ag+) B.c(NO3﹣) C.溶液的pH D.铁片质量答案:D解析:解答:由图甲可知,Ag连接电源的正极,则为阳极,电解质溶液为硝酸银溶液,则该装置实际上是在铁的表面电镀银,电解质溶液的浓度不变,即Ag+、NO3﹣的浓度不变,溶液的浓度及pH不变,所以A、B、C都可能;而图乙中,Y轴表示某个量不变,阳极上Ag溶解,阴极上Ag析出,则铁棒质量增大,银棒质量减小,所以D不可能,所以选D.分析:本题考查电镀原理,明确图中装置和坐标图中的含义、电解时发生的电极反应即可解答,明确该装置为电镀是解答的关键.11.某同学按如图所示的装置进行电解实验.下列说法不正确的是()A.电解过程中,铜电极上有H2产生B.电解初期,总反应方程式为 Cu+H2SO4电解CuSO4+H2↑C.电解一定时间后,石墨电极上有铜析出D.整个电解过程中,H+的浓度不断减小答案:A解析:解答:A.电解过程中,Cu作阳极,阳极上铜失电子发生氧化反应,所以铜逐渐溶解,所以A错误;B.电解初期,阳极上电极反应式为Cu﹣2e﹣=Cu2+、阴极上电极反应为2H++2e﹣=H2↑,所以电池反应式为Cu+H2SO4电解CuSO4+H2↑,所以B正确;C.电解一定时间后,溶液中铜离子达到一定程度后,石墨电极上铜离子放电生成铜,所以C正确;D.阳极上电极反应式为Cu﹣2e﹣=Cu2+、阴极上电极反应为2H++2e﹣=H2↑,溶液中氢离子浓度减小,所以D正确;所以选A.分析:本题考查了电解原理,知道阴阳极上发生的反应是解本题关键,注意活泼金属作阳极时,阳极上金属失电子而不是溶液中阴离子失电子,为易错点.12.如图所示,a、b、c均为石墨电极,d为铁电极,通电进行电解,假设在电解过程中产生的气体全部逸出.下列说法正确的是()A.甲烧杯中溶液的pH不变B.乙烧杯中c电极的反应式为:4OH﹣﹣4e﹣⇌2H2O+02↑C.当b极增重21.6g时,d极产生的气体在标准状况下为2.24LD.当电解足够时间后,将甲、乙两烧杯中的溶液混合,一定会有沉淀生成答案:C解析:解答:A.通电一段时间后,甲中阳极发生4OH﹣﹣4e﹣=2H2O+O2↑,阴极发生4Ag++4e ﹣=4Ag,反应后为硝酸,溶液pH减小,所以A错误;B.乙中c为阳极,发生2Cl﹣﹣2e﹣=Cl2↑,所以B错误;C.b极增重5.4g时,n(Ag)=21.6108/gg mol=0.2mol,由2Ag~2e﹣~H2↑,则d极产生的气体为0.1mol×22.4L/mol=2.24L,所以C正确;D.当电解一段时间后,甲可能为硝酸,乙为KOH,则二者混合不会生成沉淀,所以D错误.所以选C.分析:本题考查电解原理,明确发生的电极反应是解答本题的关键,注意图中阳极的判断及溶液中离子的放电顺序即可解答.13.粗铜中一般含有锌、铁、银、金等杂质.在如图所示的装置中,甲池的总反应方程式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.接通电路一段时间后,纯Cu电极质量增加了3.2g.在此过程中,下列说法正确的是()A.甲池中电解质溶液的pH值减小B.乙池中CuSO4溶液的浓度不变C.甲池中理论上消耗空气的体积是2.8L(空气中O2体积分数以20%计算)D.甲池通入CH3OH一极的电极反应为:CH3OH﹣6e﹣+2H2O═CO32﹣+8H+答案:A解析:解答:A.甲池能自发的发生氧化还原反应,符合原电池的条件,属于燃料原电池,总的电极反应式为::2CH3OH+3O2+4KOH═2K2CO3+6H2O,导致氢氧根离子的浓度减小,所以pH 值减小,所以A正确;B.乙池中,阳极上不仅溶解铜还溶解锌、铁、银等金属,阴极上只有铜析出,所以阳极上溶解的铜小于阴极上析出的铜,则溶液中硫酸铜溶液浓度减小,所以B错误;C.串联电路中转移电子相等,析出3.2g铜转移电子的物质的量=氧气得电子的物质的量,所以如果在标况下消耗空气体积=3.2264/4gg mol=2.8L,而状况不知,所以C错误;D.甲池中,通入甲醇的电极是负极,碱性条件下,电极反应式中不能产生氢离子,电极反应式为:CH3OH﹣6e﹣+8OH﹣═CO32﹣+6H2O,所以D错误;所以选A.分析:本题考查了原电池和电解池原理,明确各个电极上发生的电极反应式是解本题关键,易错选项是D,只有酸碱性条件下,燃料电池中电极反应式不同,所以书写燃料电池的电极反应式要结合电解质溶液的酸碱性,为易错点.14.如图中X为电源,Y为浸透饱和硫酸钠溶液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散,下列判断正确的是()A.c电极的电极反应式为:2H++2e﹣=H2↑B.Cu电极质量减小,Pt电极质量增大C.Z中溶液的pH先减小,后增大D.a为电源正极,b为电源负极答案:A解析:解答:由图可知,为电解装置,由通电后Y中央的紫红色色斑向d端扩散,则d为阳极极,b为电源的正极,a为负极,A.c为电解池的阴极,发生还原反应,电极方程式为2H++2e﹣=H2↑,所以A正确;B.Cu为阴极,发生还原反应生成铜,电极质量增大,所以B错误;C.Pt电极上氢氧根离子失去电子,电解生成铜和硫酸,则烧杯中溶液的pH减小,所以C 错误;D.由以上分析可知a负极,b为正极,所以D错误.所以选A.分析:本题考查电解原理,为高频考点,侧重于学生的分析能力的考查,明确装置为电解池及通电后Y中央的紫红色色斑向d端扩散是解答本题的关键.15.在化学能与电能的转化过程中,下列叙述正确的是()A.教材所示的铜﹣锌原电池在工作时,H+、Zn2+向铜片附近迁移B.电解饱和食盐水时,阳极得到Cl2和NaOH(aq)C.电解铝时,电解槽里的负极材料发生氧化反应D.原电池与电解池连接后,电子从原电池负极流向电解池阳极答案:A解析:解答:A、教材所示的铜﹣锌原电池在工作时,铜是正极,电解质中的阳离子移向正极即铜极,所以A正确;B、电解饱和食盐水时,阳极上是阴离子氯离子发生失电子的氧化反应,得到氯气,所以B 错误;C、电解铝时,电解槽里的阳极上发生氧化反应,所以C错误;D、原电池与电解池连接后,电子从阳极流向正极,从负极流向阴极,所以D错误.所以选A.分析:本题考查学生原电池和电解池的工作原理,注意知识的归纳和整理是关键,难度中等.16.如图所示的两个实验装置,溶液的体积均为200mL.开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液和体积变化,下列叙述中正确的是()A.产生气体的体积:①>②B.溶液的pH变化:①减小,②增大C.电极上生成物质的质量:①=②D.电极反应式:①中阳极2Cl﹣﹣2e﹣═Cl2↑,②中负极2H++2e﹣═H2↑答案:B解析:解答:A.导线中均通过0.02mol电子,①生成氯气,②生成氢气,体积相同,所以A错误;B.①阳极生成氯气可与水反应生成盐酸和次氯酸,溶液酸性增强,pH减小,②消耗硫酸,氢离子浓度减小,则pH增大,所以B正确;C.①中阴极生成铜,②生成氢气,则电极上析出物质的质量:①>②,所以C错误;D.②负极反应为Zn﹣2e﹣=Zn2+,所以D错误.所以选B.分析:本题综合考查原电池和电解池知识,注意把握电极反应的判断和电极方程式的书写,为解答该题的关键.17.CuI是一种不溶于水的白色固体,它可以由反应:2Cu2++4I﹣=2CuI↓+I2而得到.如图所示装置中,a、b都是惰性电极,通电一段时间后,在KI﹣淀粉溶液中阳极周围变蓝色,则下列说法正确的是()A.若a极变红,则在Pt电极上:2I﹣﹣2e﹣=I2淀粉遇碘变蓝B.若b极变红,在Pt电极上:4OH﹣﹣4e﹣=2H2O+O2 O2将I﹣氧化为I2,淀粉遇碘变蓝C.若a极变红,在Cu电极上:开始Cu+I﹣﹣e﹣=CuI,一段时间后2I﹣﹣2e﹣═I2淀粉遇碘变蓝D.若b极变红,在Cu极上:Cu﹣2e﹣═Cu2+ Cu2+显蓝色答案:C解析:解答:A、若a极变红,则该极上是氢离子发生得电子的还原反应,所有a为阴极,b 为阳极,Y为电源的正极,X为负极,则Pt电极为阴极,该极上是氢离子氢离子发生得电子的还原反应,析出氢气,所以A错误;B、若b极变红,则该极上是氢离子发生得电子的还原反应,所有b为阴极,a为阳极,Y为电源的负极,X为正极,则Pt电极为阳极,该极上是碘离子发生失电子生成碘单质的氧化反应,淀粉遇碘变蓝,所以B错误;C、电解NaCl溶液(滴入酚酞),阴极附近变红,若a极变红,则X为电源的负极,Y为正极,所以Cu电极为阳极,则Cu﹣2e﹣=Cu2+或Cu→Cu2++2e﹣,2Cu2++4I﹣=2CuI↓+I2,碘遇淀粉变蓝;若b极变红,则X为正极,Pt电极为阳极,则2I﹣﹣2e﹣=I2或2I﹣→I2+2e﹣,碘遇淀粉变蓝,所以C正确.D、若b极变红,则该极上是氢离子发生得电子的还原反应,所有b为阴极,a为阳极,Y为电源的负极,X为正极,Cu电极是阴极,该极上发生氢离子氢离子发生得电子的还原反应,析出氢气,所以D错误.所以选C.分析:本题考查电解原理,明确b极附近呈蓝色是解答本题的突破口,明确发生的电极反应及电解池阴阳极、电源正负极的关系即可解答.18.如图是某同学用Cu在Fe片上镀铜的实验装置,下列说法正确的是()A.Cu2+在A极被还原B.溶液蓝色逐渐变浅C.铜片连接A极,铁制品连接B极D.A极和B极直接相连,铜片被氧化答案:C解析:解答:用Cu在Fe片上镀铜时,镀件铁为阴极,镀层金属铜为阳极,电镀液是含有的镀层金属铜离子的盐.A、电镀池中,和电源的正极相连的金属铜是阳极,该极上是金属铜发生失电子的氧化反应,Cu﹣2e﹣=Cu2+,所以A错误;B、在电镀池的阴极上是Cu2++2e﹣=Cu,阳极上是Cu﹣2e﹣=Cu2+,电镀液中铜离子浓度不变,所以溶液蓝色不变,所以B错误;C、用Cu在Fe片上镀铜时,镀件铁为阴极,连接B极,镀层金属铜为阳极,连接A极,所以C正确;D、A极和B极直接相连,金属铜和金属铁构成原电池的两个电极,金属Cu为正极,该极上是铜离子发生得电子的还原反应,所以D错误.所以选C.分析:本题考查学生电镀池的工作原理方面的知识,注意知识的积累是解题的关键.19.如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加一滴石蕊试液,下列实验现象中正确的是()A.a电极附近呈蓝色,b电极附近出现红色B.一电极逸出无味气体,另一电极逸出刺激性气味气体C.a电极附近呈红色,b电极附近出现蓝色D.逸出气体的体积a电极的小于b电极的答案:A解析:解答:a连接电源的负极,为电解池的阴极,b连接电源的正极,为电解池的阳极,电解Na2SO4水溶液阳极发生的反应为:4OH﹣﹣4e﹣═2H2O+O2↑或2H20﹣4e﹣═4H++O2↑,阴极反应为:2H++2e﹣═H2↑,或2H2O+2e﹣═H2↑+2OH﹣.A、a电极生成OH﹣离子,呈碱性,滴加石蕊呈蓝色,b电极生成H+离子,呈酸性,滴加石蕊呈红色,所以A正确;B、两极生成的气体分别为氧气和氢气,都为无色无味气体,所以B错误;C、电极生成OH﹣离子,呈碱性,滴加石蕊呈蓝色,b电极生成H+离子,呈酸性,滴加石蕊呈红色,所以C错误;D、a极生成氢气,b极生成氧气,二者的体积比为2:1,逸出气体的体积a电极的大于b 电极的,所以D错误.所以选A.分析:本题考查电解原理,做题时注意电解池两极上的电极反应,以此判断两极PH的变化.20.如图所示,X为铁、Y是石墨电极,a是饱和食盐水,实验开始前,在U形管的两边同时各滴入几滴酚酞试液,下列叙述错误的是()A.合上K1、断开K2,该装置可以将化学能转变为电能B.合上K1、断开K2,X是阴极,Y电极附近溶液慢慢变为红色C.合上K2、断开K1,湿润的KI淀粉试纸靠近Y电极管口,试纸变蓝D.合上K2、断开K1,电解一段时间,X电极附近溶液呈红色答案:B解析:解答:A、合上K1、断开K2,该装置是原电池,是把化学能转变为电能的装置,所以A正确;B、合上K1、断开K2,该装置是原电池,较活泼的金属铁X作负极,石墨Y作正极,所以B 错误;C、合上K2、断开K1,该装置有外接电源,所以是电解池,连接电源正极的Y石墨电极是阳极,阳极上氯离子放电生成氯气,氯气和碘化钾发生置换反应生成碘单质,碘遇淀粉变蓝色,所以一段时间后,湿润的KI淀粉试纸靠近Y电极管口,试纸变蓝,所以C正确;D、合上K2、断开K1,该装置有外接电源,所以是电解池,电解池放电时,连接电源负极的电极X是阴极,阴极上氢离子得电子生成氢气,导致X电极附近氢氧根离子浓度增大,溶液碱性增强,所以一段时间后,X电极附近溶液呈红色,所以D正确;所以选B.分析:本题考查了原电池和电解池原理,明确原电池和电解池放电时,电极上发生的电极反应、溶液中阴阳离子的移动方向、化学能和电能的转化即可解答本题.二、非选择题21.按如图装置进行实验,并回答下列问题:(1)判断装置的名称:A池为池,B池为池;答案:原电|电解(2)锌极为极,电极反应式为;铜极为极,电极反应式为;石墨棒C1为极,电极反应式为,石墨棒C2附近发生的实验现象为;答案:负|Zn﹣2e﹣=Zn2+|正|Cu2++2e﹣=Cu|阳|2Cl﹣﹣2e﹣=Cl2↑|有气泡,溶液变红(3)当C2极析出224mL气体(标准状态)时,锌的质量变化(变大、不变或变小) g,CuSO4溶液的质量(增加、不变或减少)g.答案:变小|0.65|增加|0.01解析:解答:(1)该装置中A能自发的进行氧化还原反应为原电池,B为电解池;所以答案为:原电,电解;(2)A能自发的进行氧化还原反应,能将化学能转化为电能,活泼性较强的Zn为负极,电极反应式为Zn﹣2e﹣=Zn2+;活泼性较弱的Cu为正极,电极反应为:Cu2++2e﹣=Cu,石墨棒C1与正极相连为阳极,阳极上氯离子失电子生成氯气,其电极反应式为:2Cl﹣﹣2e﹣=Cl2;石墨棒C2为阴极,阴极上电解水生成氢气和氢氧根离子,所以阴极附近有气泡,溶液变红,所以答案为:负;Zn﹣2e﹣=Zn2+;正,Cu2++2e﹣=Cu;阳,2Cl﹣﹣2e﹣=Cl2;有气泡,溶液变红;(3)石墨棒C2为阴极,阴极上电解水生成氢气和氢氧根离子,其电极方程式为:4H2O+4e﹣=2H2↑+4OH﹣,当C2极析出224mL气体(标准状态)时,生成氢气的物质的量为n(H2)=0.22422.4/LL mol=0.01mol,则转移的电子为0.02mol,Zn电极的方程式为:Zn﹣2e﹣=Zn2+,根据电子守恒可知,消耗的Zn为0.01mol,则锌的质量减少0.65g,硫酸铜溶液质量增加依据反应计算:Zn+Cu2+=Cu+Zn2+溶液质量增加△m1mol 65g﹣64g=1g0.01mol mm=0.01g;所以答案为:变小,0.65,增加,0.01;分析:本题考查了原电池和电解池原理,正确判断原电池和电解池的电极反应是解本题关键,难点是电极反应式的书写和电子守恒的应用.22.某小组为研究电化学原理,设计如图装置.请回答下列问题:(1)a和b不连接时,铁片上发生反应的离子方程式为,此时能量转化形式主要是化学能转化为能.答案:Fe+Cu2+=Fe2++Cu|热(2)a和b用导线连接时,外电路中的电子是从(填“Fe”或“Cu”)电极流出,(填“Cu2+”或“SO42﹣”)向负极移动,铜极发生反应的电极反应式为.答案:Fe|SO42﹣|Cu2++2e﹣=Cu(3)现在要在铁片上镀一层金属铜,则a极要和直流电源的(填“正极”或“负极”)连接;此时铜片上发生的电极反应式为.答案:正极|Cu﹣2e﹣=Cu2+解析:解答:(1))a和b不连接时,会发生金属铁的化学腐蚀,发生反应为:Fe+Cu2+=Fe2++Cu,此时化学能转化为热能,所以答案为:Fe+Cu2+=Fe2++Cu;热;(2)a和b用导线连接时,形成原电池的工作原理,此时活泼金属铁为负极,金属铜为正极,外电路中的电子是从负极流向正极,在电解质中,阳离子移向阴极,阴离子移向阳极,所以答案为:Fe;SO42﹣;Cu2++2e﹣=Cu;(3)根据电镀池的工作原理:镀层金属Cu做阳极,要和直流电源的正极相连,发生失电子的氧化反应,Cu﹣2e﹣=Cu2+,镀件Fe作阴极,发生得电子的还原反应,所以答案为:正极;Cu﹣2e﹣=Cu2+.分析:本题考查学生化学反应与原电池反应,明确原电池的工作原理及所发生的氧化还原反应是解答本题的关键,电解过程的反应原理应用.23.按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液:(1)AB两个装置中,属于原电池的是(填标号,下同).答案:A(2)B池中,右边C是极,电极应式为:;答案:阴|Cu2++2e﹣=Cu(3)A池中溶解了6.5g锌时,转移了mol电子.答案:0.2解析:解答:(1)B有外接电源,属于电解池,A中Zn与硫酸反应,两个电极活性不同,且为闭合回路,构成原电池,所以答案为:A;(2)B中右边的碳连接电源的负极相,为电解池的阴极,发生还原反应,铜离子获得电子生成Cu,阴极电极反应式为:Cu2++2e﹣=Cu,所以答案为:阴;Cu2++2e﹣=Cu;。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三节 电解池 第1课时 电解原理 [目标要求] 1.理解电解原理,初步掌握一般电解反应产物的判断方法。2.掌握电解电极反应方程式的书写。3.了解电解反应的一般规律。
一、电解 1.概念 使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程。 2.特点 (1)电解是最强有力的氧化还原手段,是不可逆(填“可逆”或“不可逆”)的。 (2)电解质溶液的导电过程,就是电解质溶液的电解过程。 二、电解池 1.定义 把电能转化成化学能的装置。 2.形成条件 (1)直流电源; (2)两个电极:与电源正极相连的一极是阳极;与电源负极相连的一极是阴极; (3)电解质溶液或熔融电解质; (4)形成闭合回路。 3.装置及电极反应 以电解CuCl2溶液为例 (1)装置
(2)电极反应 阴极 Cu2++2e-===Cu发生还原反应 阳极 2Cl--2e-===Cl2发生氧化反应 总反应 CuCl2=====电解Cu+Cl
2↑
4.电子流向和离子流向 (1)电子流向 电源负极―→电解池阴极 电解池阳极―→电源正极 (2)离子流向 阳离子―→电解池阴极 阴离子―→电解池阳极
知识点一 电解池 1.如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
A.a为负极,b为正极 B.a为阳极,b为阴极 C.电解过程中,d电极质量增加 D.电解过程中,氯离子浓度不变 答案 C 解析 电流从电源的正极流出,故a为电源的正极,b为负极;与电源正极相连的c为阳极,与电源负极相连的d为阴极。在电解过程中,因为Cu2+是阳离子,移向阴极d,在阴极放电析出Cu,所以d电极质量增加;Cl-是阴离子,移向阳极c,在阳极放电析出Cl2,导致溶液中氯离子浓度降低。 2.下列有关电解池的说法正确的是( ) A.在电解池中与外接电源负极相连的电极是阳极 B.无论电解何种物质,阳极上失电子数都与阴极上得电子数相等 C.电解氯化铜溶液时,在阴极上有气体生成 D.电解NaCl、CuCl2两种溶液,参加反应的物质是相同的 答案 B 解析 与负极相连的是阴极。电解氯化铜时,阳极上有氯气生成,阴极上有铜析出;电解 NaCl溶液时,水参加了反应,而电解CuCl2溶液时,水没有参加反应。 知识点二 电解原理 3.如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色、无味气体放出。符合这一情况的是附表中的( )
a极板 b极板 X电极 Z溶液 A 锌 石墨 负极 CuSO4 B 石墨 石墨 负极 NaOH C 银 铁 正极 AgNO3 D 铜 石墨 负极 CuCl2
答案 A 解析 由题意知,通电后a极板质量增加,说明有金属析出,由此可知,a极为电解池的阴极,则X为电源负极,B、C均不符合;又b极放出的是无色无味的气体,可淘汰D。 4.在25℃时,将2个铜电极插入到一定的Na2SO4饱和溶液中,通直流电电解并不断搅拌,当阴极上收集到a mol气体时,溶液中析出了b mol的结晶水合物Na2SO4·10H2O,若保持温度不变,则所剩溶液中溶质的质量分数是( )
A.bb+18a B.bb+36a C.71b161b+18a D.71b161b+9a 答案 C 解析 电解发生的电极反应:阳极为Cu-2e===Cu2+,阴极为2H++2e===H2↑。电解时总的
化学反应方程式为Cu+2H2O=====电解Cu(OH)2↓+H2↑,阴极逸出a mol H2,水被电解了2a mol,根据溶解度知识,不难求出答案为C。如果将题中的铜电极换作铂电极,只改一个字,其电
解的总反应方程式即为2H2O=====电解2H2↑+O2↑,阴极逸出a mol H2,水被电解了a mol。可见因一字之差(“铜”与“铂”),答案各异。由此再次强调提高审题的准确性是多么的必要。 知识点三 电解规律应用 5.用惰性电极电解下列溶液一段时间后再加入一定量的某种纯净物(方括号内的物质),能使溶液恢复到原来的成分和浓度的是( ) A.AgNO3[AgNO3] B.NaOH[H2O] C.KCl[KCl] D.CuSO4[Cu(OH)2] 答案 B
解析 A项:4AgNO3+2H2O=====电解4Ag+O2↑+4HNO3脱离反应体系的物质是4Ag+O2,相当于2Ag2O,所以应当加入适量Ag2O才能复原。(加入AgNO3,会使NO-3的量增加);B项:
2H2O=====电解2H2↑+O2↑ 脱离反应体系的是2H2+O2,相当于2H2O,加入适量水可以复原。C项:2KCl+2H2O=====电解2KOH+H2↑+Cl2↑ 脱离反应体系的是H2+Cl2,相当于2HCl,应通入适量HCl气体才能复原。(加入盐酸时,同时也增加了水) D项:2CuSO4+2H2O=====电解
2H2SO4+2Cu+O2↑ 脱离反应体系的是2Cu+O2,相当于2CuO,加入适量CuO可以复原。 6.用铂作电极电解某种溶液,通电一段时间后,溶液的pH变小,并且在阳极得到0.56 L气体,阴极得到1.12 L气体(两种气体均在相同条件下测定)。由此可知溶液可能是( ) A.稀盐酸 B.KNO3溶液 C.CuSO4溶液 D.稀硫酸 答案 D
解析 阳极与阴极产生的气体体积比为=12,相当于电解水,pH变小说明电解了含氧酸。
练基础落实 1.把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示平面图),经过一段时间后,首先观察到溶液变红的区域是( )
A.Ⅰ和Ⅲ附近 B.Ⅰ和Ⅳ附近 C.Ⅱ和Ⅲ附近 D.Ⅱ和Ⅳ附近 答案 B 解析 此题将电解知识与原电池知识融合在一起。要解决此问题,必须要从概念、模型、电极名称、电极反应式等方面去区分,这些知识都弄清楚了,才能顺利解答此题,达到“在应用中理解、在理解中应用”的效果。左图为电解池,Fe为阳极,阳极反应式为Fe-2e-===Fe2+;Zn为阴极,阴极反应式为2H++2e-===H2↑,因此Ⅰ区域c(OH-)变大,碱性增强使酚酞
变红;右图为原电池,Fe为正极,正极反应式为2H2O+O2+4e-===4OH-,因此Ⅳ区域c(OH -)变大,碱性增强使酚酞变红。
2.用惰性电极实现电解,下列说法正确的是( ) A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变 B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小 C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2 D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1 答案 D 解析 电解稀H2SO4,其实质是电解水,因溶剂减少,H2SO4浓度将增大,故溶液的pH变小;电解稀NaOH溶液,虽然OH-在阳极放电,但H+同时也在阴极放电,其实质同样是电解水,溶液的浓度也将变大,故溶液的pH变大;电解Na2SO4溶液,其实质也是电解水,在阴极和阳极分别析出H2和O2,二者的物质的量之比为2∶1,而非1∶2;电解CuCl2溶液,在阴、阳两极上分别析出Cu和Cl2,二者的物质的量之比为1∶1。 3.电解CuCl2与NaCl的混合溶液,阴极上和阳极上最先析出的物质为( ) A.H2和Cl2 B.Cu和Cl2 C.H2和O2 D.Cu和O2 答案 B 解析 溶液中Cu2+、H+、Na+移向阴极,Cu2+先放电得到Cu;Cl-、OH-移向阳极,Cl-先放电得到Cl2。 4.在水中加等物质的量的Ag+、Pb2+、Na+、SO2-4、NO-3、Cl-,该溶液放在用惰性电极作电极的电解槽中,通电片刻,则氧化产物与还原产物质量比为( ) A.35.5∶108 B.16∶207 C.8∶1 D.108∶35.5 答案 C 解析 溶液中的六种离子,有四种发生反应生成沉淀,Ag++Cl-===AgCl↓、Pb2++SO2-
4
===PbSO4↓,最后溶液就成了NaNO3溶液;而电解NaNO3溶液,实质上就是电解水,电解
方程式为2H2O=====电解2H2↑+O2↑。氧化产物和还原产物的质量之比为m(O2)∶m(H2)=(1 mol×32 g·mol-1)∶(2 mol×2 g·mol-1)=8∶1,即C项正确。 5.下列说法正确的是( ) ①电解是把电能转变成化学能的过程 ②电解是化学能转变成电能的过程 ③电解质溶液导电是化学变化,金属导电是物理变化 ④不能自发进行的氧化还原反应,通过电解的原理可以实现 ⑤任何溶液被电解时,必然导致氧化还原反应的发生 A.①②③④ B.②③⑤ C.③④ D.①③④⑤ 答案 D 解析 从能量角度看,电解是把电能转变成化学能的过程,故①对、②错;电解质溶液的导电过程,必将伴随着两个电极上氧化还原反应的发生,同时生成新的物质,故③、⑤对;某些不能自发进行的氧化还原反应,通过电解的原理供给电能也可以实现,故④对。所以D 选项符合题意。 练方法技巧 6.在100 mL H2SO4和CuSO4的混合溶液中,用石墨作电极进行电解,两极均收集到2.24 L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为( ) A.1 mol·L-1 B.2 mol·L-1 C.3 mol·L-1 D.4 mol·L-1 答案 A 解析 两极均收集到气体时,阴极是Cu2+放电后,H+又放电生成氢气;阳极是OH-放电生成氧气。n(H2)=n(O2)=2.24 L/22.4 L·mol-1=0.1 mol,由电子守恒得n(Cu2+)×2+ n(H2)×2=n(O2)×4,即:c(Cu2+)×0.1 L×2+0.1 mol×2=0.1 mol×4,解得:c(Cu2+)=1 mol·L-1。本题考查阳离子在阴极的放电顺序:Cu2+>H+
。
7.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子的物质的量为( ) A.0.1 mol B.0.2 mol C.0.3 mol D.0.4 mol 答案 D
解析 由电解CuSO4溶液的反应的化学方程式2CuSO4+2H2O=====电解2Cu+O2↑+2H2SO4知,电解过程中只析出Cu和放出O2,故电解后加入CuO就可以复原。但本题提示加入0.1 mol Cu(OH)2可以复原,说明电解过程中不仅有CuSO4被电解,还有H2O被电解。0.1 mol Cu(OH)2
相当于0.1 mol CuO和0.1 mol H2O,由电子守恒0.1 mol CuO~0.1 mol Cu~0.2 mol e-,0.1
mol H2O~0.1 mol H2~0.2 mol e-,共计0.4 mol e-。 8.铅蓄电池的工作原理为Pb+PbO2+2H2SO4===2PbSO4+2H2O。研读下图,下列判断不正确的是( )
