【三维设计】(江苏专用)2015高考化学大一轮复习 含硅矿物与信息材料习题详解课件
【三维设计】(江苏专用)2015高考化学大一轮复习-第一单元-弱电解质的电离平衡和水的电离习题详解课

5.解析:A 项,加水促进弱电解质的电离,则电离平衡正向移动, 错误;B 项,加入少量 NaOH 固体,与 CH3COOH 电离生成 的 H+结合,使电离平衡正向移动,正确;C 项,加入少量 0.1 mol·L-1HCl 溶液,c(H+)增大,则电离平衡逆向移动,错误; D 项 , 加 入 少 量 CH3COONa 固 体 , 由 电 离 平 衡 可 知 , c(CH3COO-)增大,则电离平衡逆向移动,错误。 答案:B
2.解析:pH 均等于 2 的盐酸和醋酸溶液,起始氢离子浓度相同,但醋酸 为弱酸,醋酸的浓度远大于盐酸的浓度,与等量的 Na 反应时,醋酸的 电离平衡正向移动,醋酸中氢离子浓度大于盐酸中氢离子浓度,醋酸反 应速率快;由题给数据结合反应方程式判断,醋酸远过量,盐酸恰好反 应。醋酸与 Na 反应生成醋酸钠溶液,醋酸根离子水解显碱性,但醋酸 远过量,反应后溶液显酸性,溶液的 pH<7,盐酸与 Na 恰好完全反应 生成氯化钠,则反应后溶液的 pH=7,A 错误,B 正确;因 Na 的质量 相同,则与盐酸恰好完全反应,醋酸过量,生成氢气相同,且醋酸中氢 离子浓度大于盐酸中氢离子浓度,则醋酸中反应速率快,C、D 错误。 答案:B
[高考载体·巧妙利用]
(1)HCOOH>H2CO3>HCN
(2)能;NaCN+H2O+CO2===HCN+NaHCO3
(3)CO23->CN->HCO- 3 >HCOO-
(4)升高温度,能促进
HCOOH
的电离。加水稀释, cH+ 增 cHCOOH
大[cHcCHO+O H=cHcCHO+O·HcH·cCHOCOO-O -=cHCKOa O-,加水稀释,
cCH3COO-·cH+不变,而 cCH3COOH
c(H+)减小,所以ccCCHH33CCOOOOH-增
【三维设计】2015高考(江苏用)化学一轮配套课件专题2 第2单元 含硅矿物与信息材料
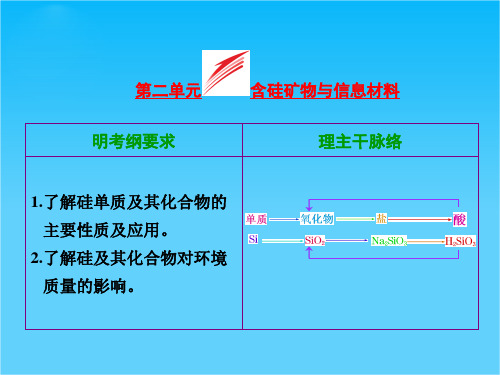
硅酸盐改写成氧化物形式的方法 (1)氧化物的书写顺序:活泼金属氧化物―→较活泼金属氧
化物―→二氧化硅―→水。
(2)氧化物前计量数的配置原则:除氧元素外,其他元素按 配置前后原子个数守恒原则配置计量数,且不同氧化物间以 “· ”隔开。 (3) 当计量数配置出现分数时应化为整数。如正长石:
KAlSi3O8 1 1 不 能 写 成 K O· Al2O3· 3SiO2 , 应 写 成 2 2 2
2. (2013· 上海高考)SiO2 是硅酸盐玻璃(Na2CaSi6O14)的主要成分, Na2CaSi6O14 也可写成 Na2O· CaO· 6SiO2。盛放 NaOH 溶液的 试剂瓶若用玻璃塞容易形成瓶体与瓶塞粘连,而无法打开,发 生反应的化学方程式为________________________。 长石是铝硅酸盐,不同类长石其氧原子的物质的量分数相同。 由钠长石化学式 NaAlSi3O8 可推知钙长石的化学式为______。
③用途:黏合剂(矿物胶),耐火阻燃材料。
3.传统硅酸盐材料
水泥、玻璃、陶瓷等都是常见的硅酸盐材料
水泥 生产原料 石灰石、黏土
玻璃 纯碱 、 石灰石 、 石英
陶瓷 黏土
主要设备
生产条件
水泥回转窑
玻璃熔窑
高温
陶瓷窑
1.判断下列描述的正误(正确的打“√”,错误的打“×”)。
(1)(2012· 新课( × )
(2)(2010· 江苏高考)水玻璃可用于生产黏合剂和防火剂。 ( √ )
(3)(2009· 广东高考)陶瓷是人类应用很早的硅酸盐材料。 ( √ )
(4)(2009· 广东高考)水泥、玻璃、水晶饰物都是硅酸盐制品。( × )
2.将下列材料与主要化学成分用短线连接起来。 ①刚玉 ②大理石、 B.硅酸盐 石灰石 ③普通玻璃 ④石英、水晶 C.二氧化硅 D.三氧化二铝 A.碳酸钙
2015年高考试题化学(江苏卷)解析版(2021年整理)

(完整word)2015年高考试题化学(江苏卷)解析版(word版可编辑修改) 编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整word)2015年高考试题化学(江苏卷)解析版(word版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整word)2015年高考试题化学(江苏卷)解析版(word版可编辑修改)的全部内容。
2015年普通高等学校招生全国统一考试(江苏卷)化学单项选择题:本题包括10小题,每小题2分,共计20分.每小题只有一个选项符合题意。
1.“保护环境"是我国的基本国策。
下列做法不应该提倡的是( )A .采取低碳、节俭的生活方式B .按照规定对生活废弃物进行分类放置C .深入农村和社区宣传环保知识D .经常使用一次性筷子、纸杯、塑料袋等 【答案】D考点:考查环保问题.2.下列有关氯元素及其化合物的表示正确的是( )A .质子数为17、中子数为20的氯原子:B .氯离子(Cl -)的结构示意图:C .氯分子的电子式:D .氯乙烯分子的结构简式:H 3C -CH 2Cl 【答案】C 【解析】试题分析:A 、左上角应是质量数,质量数=中子数+质子数=37,应是37 17Cl ,故A 说法错误;B 、氯离子质子数大于电子数,其结构示意图:B 错误;C 、氯原子最外层7个电子,每个氯原2 8 7+17子都达到8电子稳定结构,故C 正确;D 、氯乙烯结构简式:CH 2=CHCl ,而题目中是氯乙烷,故D 说法错误.考点:考查化学用语。
3.下列说法正确的是( )A .分子式为C 2H 6O 的有机化合物性质相同B .相同条件下,等质量的碳按a 、b 两种途径完全转化,途径a 比途径b 放出更多热能途径a :CCO+H 2CO 2+H 2O途径b :C CO 2C .在氧化还原反应中,还原剂失去电子总数等于氧化剂得到电子的总数D .通过化学变化可以直接将水转变为汽油 【答案】C考点:考查同分异构体、反应热、氧化还原反应等知识。
【三维设计】2015高考(江苏用)化学一轮习题详解课件课时跟踪检测(15)元素周期律和元素周期表

10.解析:(1)X 单质是一种半导体材料,所以 X 为硅元素,Y 的最外层 电子数是最内层电子数的三倍又在硅元素后面,所以 Y 是硫元素; (2)推断 W 为氧,M 是钠,N 是铝,X 是硅,Y 是硫,Z 是氯;A 项, M、X、Z 形成的单质熔沸点 X>M>Z,错误;C 项,硅和氧形成的 是共价键,硅和氯形成的是共价键,但二者晶体类型不同,错误;D 项,次氯酸的酸性没有硫酸的强,错误。(3)过氧化钠中既有共价键 也有离子键;(4)卤素氢化物的水溶性 HF>HCl>HBr>HI;(5)铝离子 和偏铝酸根离子能发生双水解反应。 答案:(1)第三周期第ⅣA 族 (2)B (3)Na [ O
7.解析:“X、Y、Z 最高价氧化物对应的水化物两两之间都能反 应”,说明三者依次是 Na、Al、Cl(或 S)。在结合原子结构的 关系,可知 Z 为 Cl,T 为 F。A 项,F-、Na+、Al3+具有相同 的电子层结构,核电荷数越多,半径越小,正确;B 项,F 无 正价,错误;C 项,室温下 Al 与浓硫酸发生钝化,属于化学 反应,错误;D 项,F2、Na 和 Al 均用电解法制得,正确。 答案:AD
6.解析:原子半径最小的原子 X 为 H,Y 最外层电子是次外层的 3 倍,则应为 O,W 与 Y 同主族,则 W 为 S,ZX2 中,H 显 -1 价,Z 显+2 价,则 Z 为 Mg。原子半径:Mg>S>O,A 错 误;气态氢化物的稳定性:H2O>H2S,B 错误;H2O 和 SO3 中均只含共价键,MgO 中只含离子键,C 错误;MgSO4· 7H2O 中 Mg2+水解显酸性,D 正确。 答案:D
8.解析:由题意推,Y 为铝,Z 为硅,则 X 为碳,W 的最外 层电子数为 7,由原子序数关系知为氯。A 项,原子半径: C<Cl<Si<Al,错误;B 项,硅酸为弱酸,正确;C 项,铝 与氧化铁可以发生铝热反应,正确;0.1 mol· L =1,错误。 答案:BC
【三维设计】(江苏专用)2015高考化学大一轮复习专题6化学反应与能量变化试题

第一单元化学反应中的热效应了解吸热反应、对应学生用书P94一、化学反应的焓变1.反应热在化学反应过程中,当反应物和生成物具有相同温度时所吸收或放出的热量。
2.焓变在恒温、恒压条件下,化学反应过程中吸收或释放的热量,符号为ΔH,单位:kJ·mol -1。
3.吸热反应与放热反应(1)从能量高低角度理解(2)从化学键角度理解二、热化学方程式 1.概念能够表示反应热的化学方程式。
2.意义表明了化学反应中的物质变化和能量变化及其关系。
如2H 2(g)+O 2(g)===2H 2O(l) ΔH =-571.6 kJ·mol -1:表示在25℃、101 kPa 条件下,2_mol 气态H 2和1_mol 气态O 2反应生成2_mol 液态H 2O 所放出的热量为571.6_kJ 。
三、反应热的测量与计算1.反应热的测量(1)中和反应反应热(简称中和热):酸与碱发生中和反应生成1 mol H 2O(l)时所释放出的热量。
(2)中和反应反应热的测量:①装置:(如图,请在横线上填写仪器名称) ②实验记录:Δt =⎝⎛⎭⎪⎫t 3-t 1+t 22/℃2.盖斯定律(1)内容:化学反应不管是一步完成还是分几步完成,其反应热是相同的。
如由A 到B 可以设计如下两个途径: 途径一:A→B(ΔH )途径二:A→C→B(ΔH 1+ΔH 2)则焓变ΔH 、ΔH 1、ΔH 2的关系可以表示为ΔH =ΔH 1+ΔH 2。
(2)应用:间接计算某些反应的反应热。
如已知在25 ℃、101 kPa 时:①C(s)+O 2(g)===CO 2(g)ΔH =-393.5 kJ·mol -1②2C(s)+O 2(g)===2CO(g) ΔH =-221 kJ·mol -1 则CO(g)+12O 2(g)===CO 2(g)的ΔH 为-283_kJ/mol 。
四、标准燃烧热、热值和中和热五、能源的充分利用1.判断下列描述的正误(正确的打“√”,错误的打“×”)。
【三维设计】(江苏专用)2015高考化学大一轮复习 第一单元 化学反应中的热效应习题详解课件.

(2)N2(g)+3H2(g)
催化剂 500℃、30MPa
2NH3(g)ΔH=-77.2
kJ/mol
(3)NaOH(aq) + HCl(aq)===NaCl(aq) + H2O(l)ΔH = - 57.4
kJ/mol
2.解析:燃烧热要求可燃物的物质的量必须为 1 mol,得到的
氧化物必须是稳定的氧化物,即 H2O 的状态必须为液态,A 项错误;中和反应是放热反应,ΔH 应小于 0,B 项错误;热化
ΔH=-285.8 kJ·mol-1
②CO(g)+12O2(g)===CO2(g)
ΔH=-283.0 kJ·mol-1
5.解析:将第二个热化学方程式乘以12,然后将三个热化学方程式 相加,即得:
Cu(s)
+
2H
+
(aq)
+
H2O2(l)
+
H2(g)
+
1 2
O2(g)===Cu2
+
(aq)
+
H2(g)
6.解析:根据盖斯定律,由第一个反应×23+第二个反应×23-第 三个反应×2 可得第四个反应,则 ΔH4=ΔH1×23+ΔH2×23- ΔH3×2=23(ΔH1+ΔH2-3ΔH3)。 答案:A
7.盖斯定律的常规考查。分别给已知方程式编号,由盖斯定律 可知所给方程式由③×12+②×5-①×2 得到,故 ΔH= 12ΔH3+5ΔH2-2ΔH1。 答案: A
[高考载体·巧妙利用] (1)放热反应 2 mol H2 和 1 mol O2 的总能量大于 2 mol H2O(g) 的能量 (2)221 kJ (3)不是,氢的燃烧热为 ΔH=-285.8 kJ/mol (4)2CO(s)+O2(g)===2CO2(s)ΔH=-566 kJ·mol-1 C 的燃烧热为 ΔH=-393.5 kJ·mol-1 (5)C(s)+H2O(g)===CO(g)+H2(g)ΔH=+131.3 kJ·mol-1 (6)ΔH1>ΔH2
高考化学一轮复习 课时提升作业十 含硅矿物与信息材料(含解析)苏教版-苏教版高三全册化学试题
含硅矿物与信息材料1.下列在生产和生活中应用的化学知识正确的是( )A.玻璃、水泥、水晶项链都是硅酸盐制品B.晶体硅是在通信工程中制作光导纤维的主要原料C.赏心悦目的雕花玻璃通常是用氢氟酸对玻璃进行刻蚀而制成的D.工业上,利用二氧化硅热分解法冶炼硅【解析】选C。
水晶的主要成分为二氧化硅,不属于硅酸盐,故A错误;二氧化硅具有良好的光学特性,是制作光导纤维的主要原料,故B错误;常温下氢氟酸能够与玻璃中的二氧化硅反应,所以常用氢氟酸雕刻玻璃,故C正确;工业上用SiO2热还原法冶炼硅而不是热分解法,故D 错误。
2.(2020·福州模拟)下列说法正确的是( )A.二氧化硅是制造太阳能电池的常用材料B.硅是非金属元素,合金材料中不可能含有硅C.酸性氧化物只能和碱反应,不能和酸反应D.水玻璃可用作木材防火剂【解析】选D。
单质硅用于生产太阳能电池,故A错误;合金可以是金属与非金属的熔合物,所以合金材料中可以含有硅,如硅钢中含有硅元素,故B错误;二氧化硅是酸性氧化物,但二氧化硅能与氢氟酸反应,故C错误;水玻璃是硅酸钠的水溶液,可用作木材防火剂,故D正确。
3.《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无沙粘(通‘黏’)土而为之”“凡坯既成,干燥之后,则堆积窑中燃薪举火”“浇水转釉(主要为青色),与造砖同法”。
下列说法错误的是( )A.沙子和黏土主要成分为硅酸盐B.“燃薪举火”使黏土发生复杂的物理化学变化C.烧制后自然冷却成红瓦,浇水冷却成青瓦D.黏土是制作砖瓦和陶瓷等的主要原料【解析】选A 。
沙子的主要成分为SiO2,不属于硅酸盐,A项错误;“燃薪举火”是使成型的黏土器皿发生复杂的物理化学变化而制成陶器,B项正确;烧制过程中铁的化合物被氧化为氧化铁,得到红瓦,若浇水则发生还原反应得到氧化亚铁而成为青瓦,C项正确;砖瓦、陶瓷的主要原料是黏土,D项正确。
4.(2020·拉萨模拟)已知:碳、硅、锗、锡、铅为第ⅣA族元素,其原子序数依次增大,碳、硅、锗、锡的+4价化合物是稳定的,而铅的+2价化合物是稳定的。
【三维设计】2015高考(江苏用)化学一轮习题详解课件课时跟踪检测(11)氧化还原反应
7.解析:I2 能氧化 H2SO3,向含有 HI 和 H2SO3 的溶液里通入氯气,氯气 先和亚硫酸反应生成硫酸,然后氯气再和碘离子反应生成碘单质,根 据氧化还原反应中得失电子守恒计算原溶液中 HI 和 H2SO3 的浓度; 设 亚硫酸和溴化氢的物质的量都为 x,氯气和碘化氢、亚硫酸反应的方程 式分别为: Cl2 + 2HI===I2 + 2HCl 、 Cl2 + H2SO3 + H2O===H2SO4 + 2HCl,由方程式知,反应中氯原子得电子的物质的量为 0.14 mol×2= 0.28 mol; 硫原子失电子的物质的量为 2x, 碘原子失电子的物质的量为 1/3x,根据得失电子数相等得 0.28 mol=2x+1/3x,x=0.12 mol,所以 原溶液中 HBr 和 H2SO3 的浓度都为 1.2 mol· L 1,选 D。
(4)ClO 与浓盐酸中的 Cl 会发生反应生成有毒的 Cl2。氯碱工业的 产物是 NaOH、H2 和 Cl2,NaOH 溶液和 Cl2 反应可以得到含有 NaClO 的溶液。 答案:(1)C (2)KHCO3 H2O2 是作化剂,其还原产物是 H2O,没有污染
课时跟踪检测(十一) 1.解析:A 项,有些同素异形体之间的变化不是氧化还原反 应,错误;B 项,还原性是物质失去电子的能力,含最低 价元素失电子能力不一定强,正确;C 项,亚铁离子既能 被氧化也能被还原,错误;D 项,氧化剂氧化性的强弱与 得电子多少无关,与得电子能力有关,错误。 答案:B
2.解析:分析反应中元素化合价的变化,H2C2O4 中 C 元素由+ 3 价升高至 CO2 中+4 价 C,H2C2O4 是还原剂,被氧化,CO2 是氧化产物,A 项、B 项正确;KClO3 中 Cl 元素由+5 价降 低为 ClO2 中+4 价,1 mol KClO3 参加反应,转移的电子为 1 mol, C 项正确; 根据还原剂的还原性大于还原产物的还原性, H2C2O4 的还原性强于 ClO2 的还原性,D 项错误。 答案:D
【三维设计】2015高考(江苏用)化学一轮习题详解课件课时跟踪检测(38)晶体结构与性质
答案:(1)3d10 (2)Br>As>Se (3)①sp3
② (4)①12
或 ②b<c<a
9.解析:(1)①Ti为22号,价电子排布为3d24s2,Ti 失去4s上面的
- 两个电子生成Ti2+,则Ti2+基态电子排布式为[Ar]3d2。②BH4
中,B可以提供3个电子,整个离子得一个电子,而4个H差4个 电子,故B中无孤对电子,为sp3杂化,BH4 为正四面体。
10.解析:(1)铬为 24 号,它的价电子为半满的稳定结构。(2)SCN
-
与 N2 互为等电子体,其结构相似,所以也为直线型。(3)a
项,S 形成两个键,且含有两对孤对电子,所以 S 为 sp3 杂 化,正确;b 项,等电子体的原子数相等,价电子数相等, CO 与 CN-互为等电子体,正确;c 项,硼酸为弱酸,错;d 项,中心离子 Fe 周围的配体为 CN-,配位数为 6,错。(4) 单键为 σ 键, 双键中有一个为 σ 键, 叁键中也有一个为 σ 键, 1 mol 双氰胺中共含有 9 mol σ 键。(5)Na+的半径比 K+小, 故 Na2S 的晶格能大。从晶胞知,S2-为 8×1/8+6× 1/2=4。 (Na2S 的晶胞中 Na+为 8 个, 从化学式的组成知, S2-为 4 个。 )
3.解析:根据已知信息可知,将铁加热到1 500 ° C分别急速冷却 和缓慢冷却,得到的晶体分别是α铁和δ铁,类型不相同,选 项A不正确。根据晶胞的结构特点可知,选项B正确;δFe晶胞 中含有2个铁原子,αFe晶胞中含有1个碳原子,两种晶体密度 比为2b3∶a3,选项C正确;由题意根据δFe晶胞可知,选项D 正确。 答案:A 4.解析:根据晶胞的结构示意图可知,在NaCl晶体中,距Na+最 近的Cl-是6个,形成正八面体,选项A正确。在CaF2晶体中, 每个晶胞平均占有8×1/8+6× 1/2=4个Ca2 ,B正确。在金刚石
【三维设计】(江苏专用)2015高考化学大一轮复习 金属材料与金属矿物习题详解课件
4.解析:Mg 的活泼性强,不能用 H2 还原法制备 Mg,而是用电 解熔融 MgCl2 的方法制备,电解饱和食盐水得到 NaOH 而不 是 Na;CuO 强热分解生成 Cu2O 而不是 Cu。 答案:B 5.解析:工业上冶炼镁采用的是电解熔融氯化镁的方法;冶炼铜 的方法较多,大多使用的是热还原法,也可以使用生物炼铜等 绿色环保的方法。 答案:B
答案:(1)+4 价 化钛
高温 (2)TiO2+2C+2Cl2=====TiCl4+2CO 高温 2Mg+TiCl4=====2MgCl2+Ti
四氯
(3)惰性气体保护
高温 高温 (4)①MgCO3 =====MgO + CO2↑, MgO+ Cl2+ C=====MgCl2 +CO 通电 ②MgCl2=====Mg+Cl2↑
-
答案:(1)2Al+2OH +2H2O===2AlO2 +3H2↑ (2)稀硫酸或 H2SO4 过滤
-
-
(3)在装置Ⅰ、Ⅱ之间增加一个盛有饱和 NaHCO3 溶液的洗气瓶
+ 2+ (4)3Cu+2NO- + 8H ===3Cu +2NO↑+4H2O 3
途径②最佳,理
由是原料利用率高,环境污染小
12.解析:方案Ⅱ中,加入稀 HNO3 时,铜铝均可以被溶解,无法 测定剩余固体,B 项错。 答案:B 13 . 解析: (1) 三种金属中,只有 Al 与碱反应, 2Al + 2OH + 2H2O===2AlO- 2 +3H2↑(2)分离铁、铜制备绿矾,所以用硫酸; 三步都是固液分离,过滤。(3)图中用的浓盐酸,HCl 易挥发, 则 CO2 中混有 HCl,除去 CO2 中的 HCl,应加装盛有饱和 NaHCO3 溶液的洗气瓶。(4)途径②最佳。途径①产生 NO,途 径③产生 SO2,环境污染,并且途径 ②中的 H2SO4 均转化成 CuSO4,原子利用率高。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
NaOH
(3)氧化
催化
活化能
氧化
(4)C
12.解析:根据青石棉的组成可知,该物质属于硅酸盐,不是一 种易燃品且难溶于水,A 不正确;根据氧原子守恒可知应该 是 Na2O· 3FeO· Fe2O3· 8SiO2· H2O,B 不正确;根据组成可知 和硝酸作用生成 2 mol 硝酸钠、5 mol 硝酸铁和 1 mol NO, 因此需要硝酸的物质的量是 18 mol,C 正确;和氢氟酸反应 生成 SiF4、NaF,物质的量分别是 8 mol 和 2 mol,所以需要 HF 的物质的量是 34 mol,D 不正确。 答案:C
- -
4 2H2↑;Si 与 OH 反应,生成 SiO4 ,这说明在反应中氧化剂
- -
应该是氢氧化钠。
(3)水蒸气在 600 ℃时可使粉末状硅缓慢氧化并放出氢气, 而普通 玻璃器皿中的水仅因含有从玻璃中溶出的微量的碱便可使粉末 状硅溶在其中,这说明在碱性水溶液条件下,H2O 可作氧化剂。 少量的氢氧化钠可以加快反应速率,说明氢氧化钠通过降低反应 的活化能,起催化剂的作用。在野外环境里,用较高百分比的硅 铁粉与干燥的 Ca(OH)2 和 NaOH,点着后焖烧,可剧烈放出 H2, 说明在高温无水环境下,NaOH 起氧化剂的作用,与硅反应放出 氢气。
- -
10.解析:反应①为石英砂和焦炭生成粗硅和一氧化碳的反应: 3 273 K SiO2+ 2C========Si+ 2CO↑ ,属于置换反应;反应 ②是 523~527 K Si+3HCl==========SiHCl3+H2,属于置换反应;反应③ 1 357 K 是 SiHCl3+H2========Si+3HCl,属于置换反应;反应④ 1 073 K 为特定条件下的反应: CO+H2O=======H2+CO2, 不属于 催化剂 置换反应。A、B、C 分别为 CO、CO2、HCl,其中 CO2 是温室气体, 是节能减排的目标气体, CO2 和 HCl 通入 W(硅 酸钠)溶液中能够生成白色沉淀(硅酸)。
4.解析:⑤硝酸、⑧氮气不能和二氧化硅反应。 答案:C 5.解析:硅在自然界中以化合态的形式存在,需通过化学反 应才能获得单质硅。 答案:C 6.解析:硅酸盐中均含有硅酸根离子(SiO2 3 ),根据图中结构
-
分析中可得硅原子与氧原子的个数比为 1∶3。 答案:B
7.解析:B 项,生成的是 CO2,故错;C 项,生成的是 CO,故 错;D 项,水泥的主要成分是硅酸盐,故错。故选 A。 答案:A 8.解析:SiO2 是酸性氧化物;Na2CO3 溶液呈碱性,试剂瓶不能 用玻璃塞;题图中有的转化不是氧化还原反应,例如 SiO2 与 NaOH 溶液的反应。 答案:C
9.解析:(1)根据氮化硅的组成元素,并依据二氧化硅和氢氟酸的 反应可知,反应后生成物应该是 SiF4 和氨气,反应的化学方程 式是 Si3N4+12HF===3SiF4↑+4NH3↑。 (2)根据反应物和生成物可知,反应的化学方程式是 3SiCl4 + 高温 2N2+6H2=====Si3N4+12HCl。 (3)钠的金属性最强排在前面, 因此根据该硅酸盐的化学式改写 成氧化物形成可表示为 Na2O· Al2O3· 3SiO2· 2H2O。
13.解析:(1)加热石英砂、木炭和铁时,得到的为合金。 (2)生产普通玻璃的主要原料为石英砂、纯碱和石灰石。 (3)①石英砂和焦炭在电弧炉中高温反应生成碳化硅, 化学方 高温 程式为:SiO2+3C=====SiC+2CO↑;碳化硅俗称金刚砂, 其晶体结构与金刚石类似。②比较 SiHCl3、SiCl4、SiH2Cl2、 SiH3Cl 的沸点,可得常温下 SiHCl3、SiCl4 为液体、SiH2Cl2、 SiH3Cl 为气体, 沉降除去产物中的固体后, 冷凝得到 SiHCl3、 SiCl4 的混合液体,用蒸馏可分离二者。③SiHCl3 极易水解: SiHCl3+3H2O===H2SiO3+H2+3HCl。
11.解析:(1)因为氢氟酸能和二氧化硅反应,从而腐蚀玻璃,反 应的化学方程式为 SiO2+4HF===SiF4↑+2H2O, 因此不能用 玻璃试剂瓶来盛 HF 溶液。 (2)硅单质能和氢氧化钠溶液反应生成硅酸钠和氢气,所以晶
2 片制绒反应的离子方程式为 Si + 2OH + H2O===SiO 3 +
答案:(1)①②③ 1 357 K (2)SiHCl3+H2======Si+3HCl 1 373~1 623 K (3)SiO2+Na2CO3=============Na2SiO3+CO2↑ (4)CO2 CO2 和 HCl
1 073 K (5)CO+H2O=======CO2+H2、CO2+Ca(OH)2===CaCO3↓ 催化剂 +H2O
课时跟踪检测(六) 1.解析:硅酸可用于制取干燥吸水等物品,并不做耐火材料。 答案:D 2.解析:玛瑙、水晶及光导纤维的主要成分均为二氧化硅;高 纯硅是太阳能电池板的主要原料,答案为 C。 答案:C 盐酸 △ NaOH 3. 解析: Na2SiO3――→H2SiO3; H2SiO3――→SiO2, SiO2―――→ Na2SiO3,SiO2 不能一步转化为 H2SiO3。 答案:C
(4)硅烷在常温下与空气和水剧烈反应,因此在使用硅烷时要注意隔离 空气和水,这是由于 SiH4 能与水发生氧化还原反应生成 H2,A 正确; 在反应 3SiH4+4NH3===Si3N4+12H2↑中,氨气中氢元素的化合价从 +1 价降低到 0 价得到电子,反应中 NH3 作氧化剂,硅烷是还原剂,B 正确;氮化硅的性质稳定,但硅烷的性质活泼,常温下与空气和水剧 烈反应,选项 C 不正确;氮和硅都是非金属,因此氮化硅晶体中只存 在共价键,Si3N4 是优良的新型无机非金属材料,D 正确。 答案:(1)SiO2+4HF===SiF4↑+2H2O
(4)氯碱工业产生的 H2、HCl,能作为上述工艺生产的原料。 答案:(1)含有硅、碳的铁合金(或硅铁) (2)石英砂、纯碱和石灰石 高温 (3)①SiO2+3C=====SiC+2CO↑ 金刚砂 金刚石(或单晶硅)
②精馏(或蒸馏) ③H4SiO4(或 H2SiO3)、H2、HCl (4)H2、HCl
(4)由于氢氧化钠溶液能和二氧化硅反应生成粘性很强的硅酸钠 溶液,从而使玻璃塞和瓶口粘合在一起而不易打开,反应的离
2- 子方程式是 2OH-+SiO2===SiO3 + H2O。
答案:(1)Si3N4+12HF===3SiF4↑+4NH3↑ 高温 (2)3SiCl4+2N2+6H2=====Si3N4+12HCl (3)Na2O· Al2O3· 3SiO2· 2H2O (4)2OH +SiO2===SiO2 3 +H2O
