药品不良事件报告表
药品不良反应事件报告表

药品不良反应/事件报告表跟踪报告口 严重口 一般口报告单位类别:医疗机构口 编码: 经营企业口生产企—其他口附表1首次报告口 报告类型:新的口填写说明一、严重药品不良反应是指因使用药品引起以下损害情形之一的反应:1)导致死亡;2)危及生命;3)致癌、致畸、致出生缺陷;4)导致显著的或者永久的人体伤残或者器官功能的损伤;5)导致住院或者住院时间延长;6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
二、新的药品不良反应是指药品说明书中未载明的不良反应。
药品不良反应在说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
三、报告时限新的、严重的药品不良反应应于发现或者获知之日起15 日内报告,其中死亡病例须立即报告,其他药品不良反应30 日内报告。
有随访信息的,应当及时报告。
四、关联性评价指标肯定:用药及反应发生时间顺序合理;反应符合该药已知的不良反应类型;停药或减量后,反应停止或减轻;再次使用可疑药品,反应再现;已排除并用药、原患疾病等其它因素影响。
很可能:用药及反应发生时间顺序合理;反应符合该药已知的不良反应类型;停药或减量后,反应停止或减轻;已排除并用药、原患疾病等其它因素影响。
可能:用药及反应发生时间关系密切;反应表现与已知该药ADR 不相吻合;无法排除并用药、原患疾病等其它因素影响。
可能无关:用药及反应发生时间相关性不密切;反应表现与已知该药ADR 不相吻合;无法排除并用药、原患疾病等其它因素影响。
待评价:需要补充材料才能评价。
无法评价:评价的必需资料无法获得。
五、其他说明怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
六、报告的处理所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
药品不良反应事件报告表填写要求

报 表
医疗卫生机构口 生产企业经营 企业口 个人口
医疗卫生机构: 指从事预防、诊断、 治疗疾病活动并使用药品的医疗机 构、疾病控制机构、保健机构、计 划生育服务机构等。
生产企业、经营企业:指药品的生 产企业和药品的销售企业。
个人:指消费者本人
正 确 填 写
ADR
报 表
编码:
省(自治区、直辖市) 市(地区) 县(区) □□ □□
明
正 确 填 写
ADR
报 表
不良反应/事件名称:
不良反应/事件名称应填写不良反应 中最主要、最明显的症状。
例如:不良反应/事件表现: 患者从X年X 月X日开始使用X, 1.0g, 1次/日, 静 滴,X日患者胸腹部出现斑丘疹,有瘙痒感。 继续使用后丘疹面积增大。不良反应/事件 名称可填写皮疹。
不良反应/事件名称的选取参《WH0 药品不良反应术语集》。
商品名称:填写药品的商品名。如 果没有或者不知道商品名,填写 “不详”。
通用名称:填写完整的通用名,不 可用简称,如“氨苄”, “先V”等。
监测期内的药品、进口药上市5年 内药品应在通用名称左上角以*注明。
正 确 填 写
ADR
报 表
生产厂家:填写药品说明书上的药 品生产企业的全称,不可用简称, 如:“上五”、 “白云”等。
最佳的估计。
联系方式: 最好填写患者的联系电话或者移动
电话。 如果填写患者的通信地址,请附上
邮政编码。
正 确 填 写
ADR
报 表
家族药品不良反应/事件: 选择正确选项。 如果需要详细叙述,请另附 A4纸说
明。
既往药品不良反应/事件情况: 包括药物过敏史。 如果需要详细叙述,请另附A4纸说
药品不良应事件报告表

商品名称:填写药品的商品名。如果没者,填 写药品的通用名。 通用名称: ①填写完整的通用名(含剂型),如:万古 霉素注射液。不可用简称,如“氨苄”, “先Ⅴ”,“双黄连粉针”应为“注射用双 黄连”。 ②监测期内的药品、进口药上市5年内药品应 在通用名称左上角以*注明。 生产厂家:填写药品说明书上的药品生产企业 的全称,不可用简称,如:“上五”、“白 云”等。
批号:填写药品包装上的生产批号, 如050318。注意不是“批准文号”。 用法用量: ①填写用药剂量和给药途径。例如: 500mg 每天四次口服,或者10mg 隔 日静脉滴注。 ②如系静脉给药,需注明静脉滴注、 静脉推注或者“小壶”给药等。 ③对于规定要缓慢静脉注射的药品应 在报告表注明是否缓慢注射。
民族:应正确填写,如不确切则填写“不 详”。
体重:①注意以千克(公斤)为单位。 ②如果不知道准确的体重,请做一个 最佳的估计。 联系方式: 最好填写患者的联系电话或者移动电话。
家族药品不良反应: ①根据实际情况填写“有”、“无”或 “不详”。 ②如选择“有”,应具体说明。 ③如果需要详细叙述,请另附纸说明。 既往药品不良反应情况: ①根据实际情况选择。 ②包括药物过敏史。 ③如果有,应具体说明。 ④如果需要详细叙述,请另附纸说明。
取干预措施之后的结果) 。
举例二:
患者因真菌性败血症(热带念珠菌)于 11月22日开始用二性霉素B脂质体,于 12:45 (用药时间)予5%GS+二性霉素B脂质 体25mg缓慢静滴,于13:15结束。13:20 (发生ADR时间)出现寒战,心率增至 160次/分,Bp160/106mmHg,R加深至40次 /分。(第一次ADR出现时的相关症状、 体征和相关检查)。立即(干预时间) 予非那根25mg im,安定、吗啡静推。 (采取的干预措施)。于14:00(终结 时间)上述症状缓解。(采取干预措施 之后的结果)
药品不良反应报告表填写模板
并 用
同上
药
品
不良反应/事件名称:请尽可能填写具体(具体解剖部位、表现), 不可用简写
不良反应/事件发生时间:
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页):
年月 日
患者 XXX,因 XXX 原患疾病于 XX 时间入院(就诊),临床诊断 XXX,从 X 年 X 月 X 日开始使用 X 药,1.0g/1 次/日。于何时出现何不良反应(若有相关检查项目,请填写具体项目名称及检验指标),何时停 药或减量,采取何措施(若给予相关药物,请填写具体的药物剂量、给药途径、次数),何时不良反应治愈或 好转。
药师□ 签名: 电话:
护士□
其他□ 报告日期:
个人□ 文献报道□ 上市后研究□ 其他□
年月 日
关联性评价
报告人评价: 肯定□ 很可能□ 可能□ 可能无关□ 待评价□ 无法评价□ 签名: 报告单位评价: 肯定□ 很可能□ 可能□ 可能无关□ 待评价□ 无法评价□ 签名:
报告人信息
报告单位信息
生产企业请 填写信息来源
备
注
联系电话: 电子邮箱: 单位名称: 医疗机构□
经营企业□
职业:医生□ 联系人:
其他□
(此栏的过敏史是指
药 品
批准文号
商品名称
通用名称 (含剂型)
如果商 通 用 名 称 要
品名称 填 写 完 整 ,
国药准字 没有或
怀 疑 药 品
(H/J/Z/ S)+4 为 年号+4 为顺序号
者不 详,统 一填写 “不
不可用简 称;注射剂 包含注射液 和粉针剂, 请认真填写
详” 正确的剂型
药 品 不 良 反 应 事 件 报 告 表

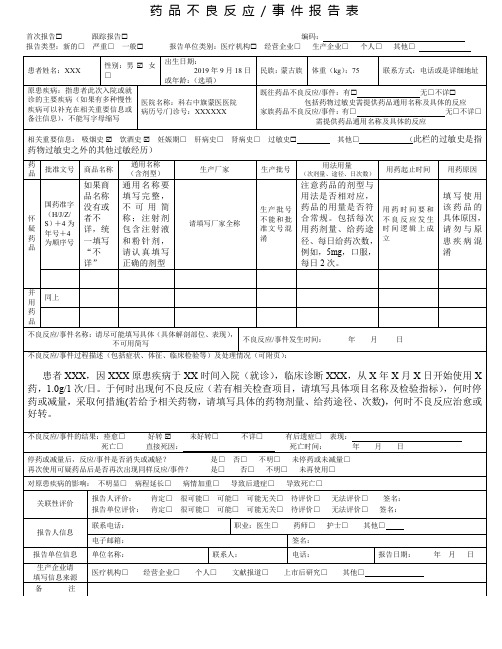
附表1药品不良反应 / 事件报告表首次报告□√跟踪报告□编码:报告类型:新的□严重□√一般□报告单位类别:医疗机构□√经营企业□生产企业□个人□其他□患者姓名:王xx 性别:男□√女□出生日期:1942年2月3日或年龄:民族:汉体重(kg):62联系方式:1380857XXXX原患疾病:慢性支气管炎高血压医院名称:金沙县xx镇卫生院病历号/门诊号:20120325既往药品不良反应/事件:有□无□√不详□家族药品不良反应/事件:有□√青霉素过敏史无□不详□相关重要信息:吸烟史□√饮酒史□√妊娠期□肝病史□肾病史□过敏史□其他□药品批准文号商品名称通用名称(含剂型)生产厂家生产批号用法用量(次剂量、途径、日次数)用药起止时间用药原因怀疑药品国药准字H20023019泰可欣注射用头孢噻肟钠北京紫竹药业有限公司1201162g/次,2次/日,静脉滴注2012-2-12--2012-2-12 呼吸道感染并用药品国药准字H200250110.9%氯化钠注射液四川科伦110236100ML/次,1次/日,静脉滴注2012-2-12--2012-2-12 呼吸道感染不良反应/事件名称:呼吸困难、口吐白沫、抽搐、多汗、发绀不良反应/事件发生时间:2012年 2 月12 日不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页):患者因咳嗽、咳痰13年,加重伴气促3天来我院就诊,初步诊断:慢性支气管炎急性发作,予以静滴0.9%氯化钠注射液100ml+注射用头孢噻肟钠2g,5分钟后,患者出现呼吸困难、口吐白沫、抽搐、多汗(过敏性休克)。
查体:T38.5℃,P90次/分,R13次/分,BP82/53mmHg,全身大汗,皮肤潮湿,呼吸困难,双唇发绀,口吐白沫,双肺呼吸音粗,双肺底可闻及少量细湿罗音,无哮鸣音,心率90次/分,未闻及杂音,腹部(-),余无特殊。
处理:1、立即停药;2、吸氧;3、皮下注射肾上腺素1mg,肌注苯海拉明40mg,地塞米松磷酸钠注射液10mg,静滴5%葡萄糖注射液250ml+多巴胺20mg,20分钟后,患者症状缓解并消失。
药品不良反应报告模板
药 品 不 良 反 应 / 事 件 报 告 表
首次报告√跟踪报告□编码:
填写信息来源
医疗机构□经营企业□个人□文献报道□上市后研究□其他□
备注
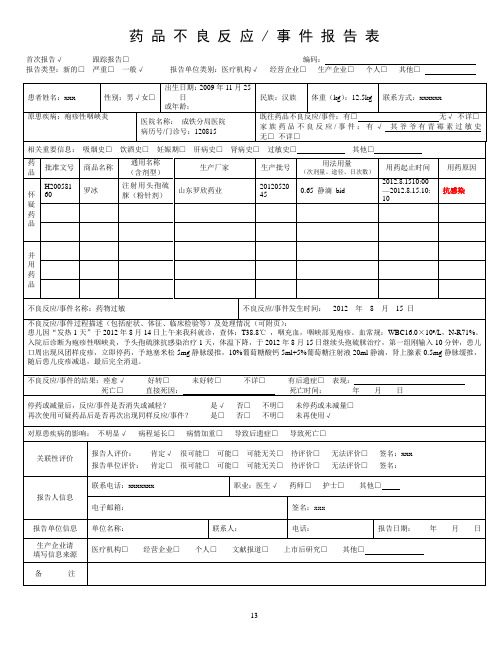
不良反应/事件的结果:痊愈√好转□未好转□不详□有后遗症□表现:
死亡□直接死因:死亡时间:年月日
停药或减量后,反应/事件是否消失或减轻?是√否□不明□未停药或未减量□
再次使用可疑药品后是否再次出现同样反应/事件?是□否□不明□未再使用√
对原患疾病的影响:不明显√病程延长□病情加重□导致后遗症□导致死亡□
2012052045
0.65静滴bid
2012.8.1510:00—2012.8.15.10:10
抗感染
并用药
品
不良反应/事件名称:药物过敏
不良反应/事件发生时间:2012年8月15日
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页):
患儿因“发热1天”于2012年8月14日上午来我科就诊,查体:T38.8℃,咽充血,咽峡部见疱疹。血常规:WBC16.0×109/L,N-R71%。入院后诊断为疱疹性咽峡炎,予头孢硫脒抗感染治疗1天,体温下降,于2012年8月15日继续头孢硫脒治疗,第一组刚输入10分钟,患儿口周出现风团样皮疹,立即停药,予地塞米松5mg静脉缓推,10%葡萄糖酸钙5ml+5%葡萄糖注射液20ml静滴,肾上腺素0.5mg静脉缓推,随后患儿皮疹减退,最后完全消退。
家族药品不良反应/事件:有√其爷爷有青霉素过敏史无□不详□
药品不良反应报告表(示范模板)
附表1药品不良反应/ 事件报告表首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□药品不良反应报告表部分项目填报注意事项一、药品不良反应事件名称及描述1.如果患者出现皮疹伴瘙痒,不要把二者同时列为一个不良反应,应当分类描述为“皮疹;瘙痒”,对于皮疹的发生部位、大约形态进行描述;2.如果患者发生多种过敏反应,就不用分类描述,直接描述为“过敏反应”或是“过敏样反应”;不属于过敏反应的其他症状,应当分类描述;3.如果患者出现过敏性休克,就必须描述患者的临床表现(包含呼吸道阻塞、微循环障碍、中枢神经系统症状及皮肤过敏症状)及体征;例如头晕、面色苍白、呼吸困难、胸闷、腹痛、出汗、脉搏增快及血压下降(80/50mmHg)等;此时相应的体征进行描述,如体温、心率、血压、呼吸频率等;还包含不良反应发生前后的症状和体征的动态变化。
4.如果患者出现血象异常,要将不良反应发生前后相应指标、实验室检查进行描述;例如患者白细胞降低,此时就需要提供患者入院时(或服药前)白细胞指数,服药后发生不良反应是监测的白细胞指数以及采取措施停药后患者白细胞有所恢复的指数。
5.如果患者出现消化道反应,例如腹泻、呕吐等,请具体描述一下相关的症状;例如腹泻,一日几次、什么性状;呕血,一日几次、颜色等性状;呕吐,一日几次、内容物是什么。
二、药品不良反应发生后采取的措施及转归1、药品不良反应发生以后,主要采取的治疗措施要进行描述。
例如立即停药,给与抗过敏治疗(过敏反应)、给与升白细胞治疗(白细胞下降)、给与物理降温(高热)等对症治疗。
具体的治疗措施,例如给与地塞米松10mg肌肉注射,要尽量详细描述对症治疗的药物及剂量。
2、药品不良反应的转归,要尽量描述采取对症治疗之后患者的转归。
有的医疗机构在患者刚刚发生不良反应,采取措施尚未缓解的时候就立即上报,这种是不规范的。
国家规定药品不良反应报告的上报时限。
药品不良反应事件报告表
不良反应/事件详细信息
不良反应/事件名称:
不良反应/事件发生时间
不良反应/事件过程描述:
不良反应/事件结果:
停药或减量后反应/事件是否消失或减轻:
再次使用可疑药品后是否再次出现同样反应/事件:
对原患疾病的影响:
报告人信息:
关联性评价:
报告人评价:
报告人签名:
报告单位评价
报告单位签字:
报告人信息;
联系电话:
职业:
电子邮件:
报告人签名:
报告单位信息:
单位名称:
联系人:
联系电话:
报告日期:
来源信息:
备注:
附件信息
序号
附名
附件类型
摘要
上传日期
上传单位
国家中心接受时间:
报告基本信息
首次/跟踪报告:
首次报告
编码:
报告类型:
新的一般
报告单位类别
医疗机构
患者基本信息
患者姓名
性别
民族
出生年月
年龄
体重
联系方式
原患疾病
医院名称
病历号/门诊号
既往药品不良反应/事件:
家族药物不良反应/事件:
相关重要信息
吸烟史过敏史
序号
批准文字
商品名称
通用名称
生产厂家
生产批号
用法用量
给药途径
用药起止日期
药品不良反应事件报告表
药品不良反应 / 事件报告表
首次报告□跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
药品不良反应事件报告表
药品不良反应事件报告表
药品不良反应 / 事件报告表
首次报告□跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
附表1制表单位:国家食品药品监督管理局
药品不良反应/ 事件报告表
新的□严重□一般□医疗卫生机构□生产企业经营企业□个人□编码□□□□□□□□□□□□□□□□□□□
单位名称:部门:电话:报告日期:年月日
◇不良反应/事件分析
1.用药与不良反应/事件的出现有无合理的时间关系?有□无□
2.反应是否符合该药已知的不良反应类型?是□否□不明□
3.停药或减量后,反应/事件是否消失或减轻?是□否□不明□未停药或未减量□
4.再次使用可疑药品后是否再次出现同样反应/事件?是□否□不明□未再使用□
5.反应/事件是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释?是□否□不明□
◇严重药品不良反应/事件是指有下列情形之一者:
①引起死亡□
②致畸、致癌或出生缺陷□
③对生命有危险并能够导致人体永久的或显著的伤残□
④对器官功能产生永久损伤□
⑤导致住院或住院时间延长□
◇编码规则:
省(自治区、直辖市) 市(地区)县(区)单位年代流水号
□□□□□□□□□□□□□□□□□□□
注:省(自治区、直辖市)、市(地区)、县(区)编码按中华人民共和国行政区划代码填写。
单位编码第一位如下填写:医疗机构1、军队医院2、计生机构3、生产企业4、经营企业5。
个人报告单位编码一栏填写6000
◇注:通用名称一栏,首次获准进口5年内的进口品种用*注明
国家药品不良反应监测中心药品不良反应监测中心通信地址:北京市崇文区法华南里11号楼二层通信地址:
邮编:100061 邮编:
电话:(010)67164979 电话:
传真:(010)67184951 传真:
E – mail :report@ E – mail:
新的、严重的药品不良反应/事件病例报告要求
药品生产企业报告要求
1.填报《药品不良反应/事件报告表》;
2.产品质量检验报告;
3.药品说明书(进口药品还须报送国外药品说明书);
4.产品注册、再注册时间,是否在监测期内(进口药是否为首次获准进
口5年内);
5.产品状态(是否是国家基本药物、国家非处方药、国家医疗保险药品、
中药保护品种);
6.国内上年度的销售量和销售范围;
7.境外使用情况(包括注册国家、注册时间);
8.变更情况(药品成分或处方、质量标准、生产工艺、说明书变更情况);
9.国内外临床安全性研究及有关文献报道情况;
10.除第1、2项以外,其他项目一年之内如无变更,可以免报。
