医用镁及镁合金材料表面改性的应用
生物医用镁合金表面改性研究

生物医用镁合金表面改性研究作者:张晓旭来源:《山东工业技术》2016年第06期摘要:镁合金因其优良的性能被认为是一种潜在的生物材料,但活泼的化学性质导致镁合金在生理环境中腐蚀过快,表面改性技术提高了其作为生物医用材料的可能性。
关键词:镁合金;表面改性;生物材料DOI:10.16640/ki.37-1222/t.2016.06.0381 前言近年来,镁及镁合金因其优良的性能被广泛地用作生物医用材料研究。
镁合金有良好的机械性能,与已被用作生物材料的钛合金相比,镁的密度更接近人骨密度。
镁有高的比强度和低的弹性模量、屈服强度,能对伤处提供支持并有效的缓解应力阻挡效应,有利于伤口愈合[1]。
镁元素是人体所必须的元素,是人体含量中仅次于钾、钠、钙的第四大金属元素。
镁元素参与人体的新陈代谢,参与组成骨细胞并对骨的愈合和矿物代谢过程起重要的调节作用。
镁元素存在于多种酶之中,对核算结构的稳定性有重要作用[2]。
镁及镁合金因其活泼的化学性质使其容易在生理环境中受到腐蚀,从而具有可降解性;与现用的金属植入材料相比,镁及镁合金的腐蚀产物已被证明是无毒的,可以通过人体代谢排出体外[3]。
此外,镁元素资源丰富,价格低廉,从而为其以后的广泛应用提供便利[4]。
镁及镁合金在生理环境中的过快的降解速度是制约其作为植入材料的重要因素,可通过调控合金组成和微观结构,改进制备合金工艺和表面改性等方法来对镁合金的降解速度进行调控,并提高其耐蚀性和生物相容性。
本文旨在介绍有效的表面改性方法从而提高镁合金作为潜在生物材料的可能性。
2 表面改性方法(1)仿生法。
仿生法是近年发展起来的一种在类似于人体生理环境的模拟体液(SBF)中模拟自然界中生理磷灰石矿化过程而在基体表面自发沉积生物陶瓷膜的技术方法。
朱伟[5]等将镁合金基体通过植酸自组装后,置于配置好的CaCl2溶液中并缓慢滴加K2HPO4溶液进行预钙化,经预钙化的试样置入到SBF和钙磷饱和溶液中进行仿生钙化处理,实验结果表明基体表面的沉积物是以羟基磷灰石(HA)为主,其中HA的沉积速度和沉积量在增加,减少了溶液的OH-,镁合金的耐蚀性有所提高。
生物医用ZTM630镁合金微弧氧化表面改性研究

山东科学SHANDONGSCIENCE第33卷第6期2020年12月出版Vol.33No.6Dec.2020DOI:10.3976/j.issn.1002 ̄4026.2020.06.009ʌ新材料ɔ收稿日期:2020 ̄04 ̄21基金项目:国家重点研发计划(2017YFB0103904ꎬ2016YFB0301105)ꎻ山东省重点研发计划(2017CXGC0404)ꎻ济南市 高校20条 资助项目(2019GXRC030)ꎻ山东省科学院青年科学基金(2018QN0034)作者简介:王世芳(1990 )ꎬ女ꎬ硕士ꎬ研究实习员ꎬ研究方向为金属腐蚀防护ꎮE ̄mail:wangshf@sdas.org∗通信作者ꎬ李涛ꎬ男ꎬ助理研究员ꎬ研究方向为轻合金ꎮTel:0531 ̄88728308ꎬE ̄mail:litao@sdas.org生物医用ZTM630镁合金微弧氧化表面改性研究王世芳ꎬ李航ꎬ刘洪涛ꎬ马百常ꎬ周吉学ꎬ李涛∗(齐鲁工业大学(山东省科学院)ꎬ山东省科学院新材料研究所ꎬ山东省轻质高强金属材料省级重点实验室ꎬ山东济南250014)摘要:为了进一步优化生物医用镁合金的耐蚀性能ꎬ满足临床使用要求ꎬ对新型生物医用高强韧ZTM630镁合金进行了微弧氧化表面改性处理ꎮ分别制备了氧化时间为2㊁5㊁8和15min的微弧氧化试样ꎬ并对其组织结构和耐腐蚀性能进行了表征和分析ꎮ结果发现:随着氧化时间的延长ꎬ涂层厚度与表面粗糙度均呈现增高的趋势ꎻ当氧化时间为5min时ꎬ试样表现出最强的耐蚀性ꎮ研究表明ꎬ微弧氧化时间的合理调控对于生物医用镁合金耐蚀性的提高具有重要的意义ꎮ关键词:镁合金ꎻ微弧氧化ꎻ生物医用ꎻ耐蚀性ꎻ涂层中图分类号:TG146.2ꎻTG174.4㊀㊀㊀文献标志码:A㊀㊀㊀文章编号:1002 ̄4026(2020)06 ̄0064 ̄08开放科学(资源服务)标识码(OSID):SurfacemodificationofZTM630magnesiumalloybymicro ̄arcoxidationWANGShi ̄fangꎬLIHangꎬLIUHong ̄taoꎬMABai ̄changꎬZHOUJi ̄xueꎬLITao∗(ShandongKeyLaboratoryofHighStrengthLightweightMetallicMaterialsꎬAdvancedMaterialsInstituteꎬQiluUniversityofTechnology(ShandongAcademyofSciences)ꎬJinan250014ꎬChina)AbstractʒTofurtheroptimizethecorrosionresistanceofbiomedicalmagnesiumalloysandmeetclinicaluserequirementsꎬsurfacemodificationwasperformedonanovelbiomedicalZTM630magnesiumalloywithhighstrengthandtoughnessviamicro ̄arcoxidation.Micro ̄arcoxidizedsampleswithoxidationtimesof2ꎬ5ꎬ8ꎬand15minwerepreparedꎬandtheirmicrostructureandcorrosionresistancewerecharacterizedandanalyzed.Resultsshowthatcoatingthicknessandsurfaceroughnessincreasedwiththeextensionofoxidationtime.Howeverꎬthesamplesshowedthehighestcorrosionresistancewhenoxidationtimewas5min.Thisstudyshowsthatthereasonableregulationofmicro ̄arcoxidationtimeisofgreatsignificanceintheimprovementofcorrosionresistanceofthebiomedicalmagnesiumalloy.Keywordsʒmagnesiumalloyꎻmicro ̄arcoxidationꎻbiomedicalꎻcorrosionresistanceꎻcoating㊀㊀可降解材料是骨折内固定等内植入医疗器械用生物材料未来的发展方向ꎬ临床要求可降解材料应具备的基本特征为力学兼容性㊁完全可降解性和生物安全性ꎮ由于镁合金在这几方面表现突出ꎬ近年来受到广泛56第6期王世芳ꎬ等:生物医用ZTM630镁合金微弧氧化表面改性研究关注[1 ̄2]ꎬ特别是几款镁合金可降解产品先后在部分欧洲国家以及韩国和中国进入临床应用研究ꎬ成为可降解材料发展史上的里程碑[3 ̄5]ꎮ然而ꎬ生物医用可降解镁合金在应用过程中还存在着一些问题ꎬ开发具有更高力学性能和更强耐蚀性能的合金材料一直以来都是材料研究领域的热点ꎮ合金设计是材料改性的基本手段ꎮ生物医用镁合金的发展ꎬ经历了从最初的基于工程用商业镁合金的验证与改性ꎬ到适用于体内植入特殊需求的针对化设计的过程ꎬMg ̄Zn系镁合金如今已发展成为一个被普遍认可的生物医用镁合金系列[6 ̄8]ꎮ研究表明ꎬSn在镁合金中可以起到晶粒细化作用ꎬ促进合金由粗大柱状晶向均匀等轴晶的转变ꎬ从而优化合金的力学性能[9]ꎮ用Sn取代传统的镁合金晶粒细化剂Zrꎬ一方面价格更低ꎬ另一方面ꎬ也是基于合金生物安全性的考虑ꎮSn是一种人体必需的微量元素ꎬ成年人每天需要摄取2~3mg[10]ꎮSn可参与蛋白质和核酸的合成ꎬ促进身体的生长发育ꎬ还可促进形成多种生物酶并参与体内一定的生化反应ꎬ能够增强人体内部环境的稳定性等[11]ꎮGu等[12]系统研究了二元Mg ̄1X(X为Al㊁Ag㊁In㊁Mn㊁Si㊁Sn㊁Y㊁Zn㊁Zr)合金的生物相容性ꎬ结果表明Mg ̄1Sn合金在细胞毒性㊁血液相容性和血小板黏附行为方面均表现出较好的生物相容性ꎮ刘西伟[13]在研究挤压态和轧制态的Mg ̄3Sn ̄0.5Mn合金时ꎬ同样发现其具有较佳的生物相容性ꎮMn在镁合金熔炼过程中可以净化Fe㊁Ni㊁Cu和Co等杂质元素ꎬ提高镁合金的耐蚀性能[14]ꎮ而且ꎬMn是人体必需的一种微量元素ꎬ对于维持细胞功能和促进骨骼发育具有重要作用[15]ꎮ基于上述原因ꎬ本课题组设计了一种新型的生物医用Mg ̄6.0Zn ̄3.0Sn ̄0.5Mn(ZTM630)镁合金ꎬ研究结果表明ꎬ铸态合金抗拉强度为212.3MPa㊁延伸率为11.1%ꎬ经挤压时效后合金抗拉强度可达412.4MPa㊁延伸率为8 4%ꎬ合金整体表现出均衡的强度和塑性[16 ̄18]ꎮ生物医用镁合金耐蚀性的提高ꎬ通常有如下解决方案:高纯净化㊁合金设计㊁热处理及塑性加工㊁表面改性和涂层[19]ꎮ对于生物医用镁合金植入体ꎬ更高的要求是希望其在植入初期缓慢降解以提供良好的力学支撑ꎬ并刺激骨生长和愈合ꎬ之后以均匀腐蚀的方式逐渐降解ꎬ保证力学完整性的渐进退化ꎬ直至完全降解ꎮ纵观上述解决方案ꎬ表面涂层是最具有发展潜力的技术ꎬ也是未来发展的方向[20 ̄21]ꎮ微弧氧化(micro ̄arcoxidationꎬMAO)技术近年来在生物医用镁合金领域的应用受到广泛关注ꎬ可以在镁合金表面形成一陶瓷膜层ꎬ该膜层具备高阻抗㊁电绝缘等特性ꎬ能够大幅增强镁合金的耐腐蚀性能[22]ꎮ众多研究均表明[23 ̄25]ꎬMAO可以提高镁合金的自腐蚀电位ꎬ降低其腐蚀速率ꎬ增强合金耐蚀性ꎮ本文针对新型ZTM630镁合金进行微弧氧化处理ꎬ研究工艺参数对合金涂层组织和性能的影响规律ꎬ以期在优异的力学性能基础上再赋予其良好的耐腐蚀性能ꎬ提供一种高强耐蚀的生物医用镁合金材料ꎮ1㊀材料与方法1.1㊀试样制备采用半连续铸造法制备ZTM630镁合金铸锭ꎬ然后进行挤压和时效处理ꎬ合金制备详细信息参见课题组前期工作[18]ꎬ其光谱分析化学成分如表1所示ꎬ最终用电火花线切割机加工成30mmˑ30mmˑ5mm的试片ꎬ并于试片一角钻取ϕ2mm的孔以方便连接导线ꎮMAO处理设备采用西安理工大学研制的JHMAO ̄DY ̄200kW型微弧氧化系列设备ꎮ合金试片经1000目砂纸打磨并清洗干净ꎬ与铝线连接ꎬ制成阳极ꎬ阴极采用不锈钢片ꎮMAO电解液组分为10g/LNaOH㊁8g/LNa2SnO3㊁10g/LNa2SiO3ꎬ其余为去离子水ꎬ试剂全部采用国药集团化学试剂有限公司生产的分析纯试剂ꎮMAO处理电流密度为1.5A/dm2ꎬ占空比为3%ꎬ频率为400HzꎮMAO处理不同时间后取出ꎬ清水冲洗干净ꎬ吹干待用ꎮ表1㊀ZTM630镁合金的化学成分[16][16]6.15402.93100.48900.00310.0011余量66山㊀东㊀科㊀学2020年1.2㊀表征测试试样的显微组织形貌观察采用ZEISSEVOMA10型扫描电子显微镜(SEM)进行ꎬ工作电压为15kVꎬ结合Oxford的EDX ̄500型能谱仪(EDS)对MAO涂层进行微区化学成分分析ꎬ试样分析前进行表面喷金处理ꎮ涂层厚度测试采用时代创合CTG260型厚度测试计ꎬ探头选用N1型电涡流式探头ꎬ每个试样测量5个数据取平均值ꎮ涂层表面粗糙度测试采用时代创合TR221型高精密涂层粗糙度测试仪ꎬ分辨率为0.001μmꎬ每个试样至少测量3个数据取平均值ꎮMAO涂层的附着力评价根据GB/T9286 1998[26]标准进行划格法测试ꎬ试验采用艾普计量仪器有限公司的QFH ̄A型百格刀ꎬ选用齿间距为1mm的11齿多刃切割刀ꎮ电化学试验采用上海辰华CHI660E型电化学工作站进行ꎮ对所有试验采用三电极体系:饱和甘汞电极(SCE)作参比电极ꎬ铂片电极为辅助电极ꎬ所测试样为工作电极ꎮ溶液介质为w(NaCl)=3.5%溶液ꎮ每次测试前在开路电压下稳定30minꎮ之后进行电化学阻抗谱(EIS)测试ꎬ振幅为10mVꎬ频率范围为1MHz到100mHzꎮ随后进行动电位极化曲线(PDP)测量ꎬ扫描速率为1mV/sꎬ通过Tafel外推法获得腐蚀电流密度icorr(μA/cm2)ꎬ并依据下式计算腐蚀速率Pi(mm/a):Pi=(KˑicorrˑW)/(nˑD)ꎬ(1)其中ꎬK=3.27ˑ10 ̄3ꎬW为元素相对原子质量ꎬn为元素化合价ꎬD为材料密度(g/cm3)ꎮ2㊀结果与讨论2.1㊀涂层组织结构图1为ZTM630镁合金经过MAO处理2㊁5㊁8和15min后试样的宏观形貌ꎮ由图可见ꎬMAO涂层成膜完整ꎬ无宏观不良现象ꎬ合金基体被均匀覆盖ꎮ特别地ꎬMAO涂层的颜色呈现土黄色ꎬ不同于传统制备所得的白色涂层ꎬ这主要是因为本研究所采用的的电解液含有Na2SnO3ꎬ其在MAO过程中生成SnO2被复合进入涂层中而显色ꎮ本研究选用Na2SnO3为主盐的电解液ꎬ一方面是因为其在促进MAO成膜的同时ꎬ可减少不必要的外来元素掺杂ꎬ保证合金材料的生物安全性ꎮ另一方面ꎬ课题组前期研究发现ꎬNa2SnO3的存在可以抑制Na2SiO3的水解ꎬ使电解液保持长期有效ꎬ延长了电解液的使用寿命ꎬ从而降低MAO处理的成本ꎮ图1㊀经MAO处理后试样的宏观形貌Fig.1㊀MacroscopicmorphologyofthesamplesafterMAOtreatment图2所示为MAO处理不同氧化时间后试样的显微形貌ꎮ如图所示ꎬ当MAO处理2min后ꎬ涂层内部分布着细小的孔洞ꎬ这些孔洞大小相差无几ꎬ分布均匀ꎮ但是ꎬ陶瓷相组织发育并不成熟ꎬ涂层骨架烧结欠佳ꎮ这说明MAO过程还处在初级阶段ꎬ试验过程中也发现合金表面起弧舒缓ꎬ弧光较小且弱ꎬ输出能量偏低ꎬ试验终止电压仅为350Vꎬ陶瓷膜质地欠致密ꎮ进一步延长氧化时间至5minꎬ可见涂层中孔洞有所长大ꎬ但大小仍相近ꎮ与MAO处理2min试样相比ꎬ陶瓷膜质地明显光滑致密ꎬ陶瓷氧化物相得到充分烧结发育ꎬ试验终止电压升高到400Vꎮ当氧化时间继续延长至8min时ꎬ涂层局部位置发生烧蚀ꎬ个别放电孔洞周围出现火山口堆积现象ꎮ当氧化时间延长至15min时ꎬ试验终止电压达到450VꎬMAO涂层出现明显的烧蚀现象ꎬ放电孔洞较大ꎬ膜层整体致密度降低ꎮ第6期王世芳ꎬ等:生物医用ZTM630镁合金微弧氧化表面改性研究图2㊀MAO处理不同氧化时间后试样的显微形貌Fig.2㊀SurfacemorphologiesofsamplestreatedbyMAOfordifferentoxidationtimes㊀㊀图3为ZTM630合金MAO处理5min后ꎬ涂层中的元素组成含量及分布图ꎮEDS分析显示ꎬ涂层主要由O㊁Mg㊁Si和Sn组成ꎮZTM630合金中的Zn和Mn元素以第二相的形态存在ꎬ其在微弧氧化成膜过程中是不参与反应的ꎬ因此在涂层的表面位置检测不到[27 ̄28]ꎮ涂层中的Si和Sn主要是来源于电解液中的Na2SnO3和Na2SiO3ꎬ参与微弧氧化成膜反应ꎮ通过对涂层进行元素面扫描分析可见ꎬSi和Sn在涂层中分布均匀ꎬ无明显团聚ꎬ涂层整体成分均匀ꎮ对于表面制备有MAO涂层的生物医用镁合金在体内降解过程的最初阶段ꎬ体液优先浸蚀MAO涂层的孔洞并与镁合金基体接触ꎬ而MAO涂层的意义在于构建了镁合金基体与体液间的阻碍ꎬ因为涂层表面的孔洞并不是直达合金基体的ꎬ从而延迟了镁合金基体腐蚀的速度ꎮ但是ꎬ以MgO为主要成分的微弧氧化涂层并不是一个完全的惰性涂层而永远存在ꎬ随着降解过程的持续ꎬMAO涂层同样也会受到体液的浸蚀ꎮ而MAO涂层中各元素的均匀分散可以保证涂层在生物体内持续的降解过程中ꎬ不会形成较大的颗粒脱落ꎬ也不至于发生合金元素的突释ꎬ避免机体出现堵塞㊁炎症等不良反应ꎬ最大限度地提高材料服役过程中的生物相容性ꎮ图3㊀MAO涂层EDS元素分析Fig.3㊀EDSelementalanalysisofMAOcoating76山㊀东㊀科㊀学2020年图4~6分别显示了MAO涂层厚度与表面粗糙度随氧化时间的变化关系ꎮ结果表明ꎬ随氧化时间的延长ꎬ涂层厚度与表面粗糙度均呈现增高的趋势ꎮ对于涂层厚度的升高ꎬ这是显而易见的ꎬ因为MAO过程是一个能量输出的过程ꎬ在一定范围内始终伴随着氧化物的生成并发生熔凝生长ꎮ但是MAO涂层在增厚的同时ꎬ其显微结构随着脉冲能量的变化而发生改变ꎮ本研究中ꎬMAO处理采用恒流模式ꎮ随着时间的延长ꎬ膜层不断增厚ꎬ若要维持电流密度不变必须升高电压ꎬ这样单脉冲输出的能量就会不断升高ꎮ另外ꎬ随着膜厚的增加ꎬ膜层击穿变得更困难ꎬ放电点位愈加集中ꎮ上述问题就导致了在膜层的局部薄弱位置发生能量集中释放ꎬ弧光增强ꎬ膜层放电通道变大ꎬ最终遗留下来的孔洞也变大ꎬ甚至出现烧蚀和严重的火山口堆积现象(如图2所示)ꎬ膜层整体均匀性下降ꎬ表面粗糙度降低ꎮ图4㊀MAO涂层厚度随氧化时间的变化Fig.4㊀VariationofthethicknessofMAOcoatingwithoxidationtime图5㊀MAO涂层表面粗糙度随氧化时间的变化Fig.5㊀VariationofthesurfaceroughnessofMAOcoatingwithoxidationtime图6㊀MAO处理不同氧化时间后试样的粗糙度测试原始波形Fig.6㊀OriginalwaveformfromthesurfaceroughnesstestofsamplestreatedbyMAOfordifferentoxidationtimes图7为采用划格法进行MAO涂层附着力的评价测试试验结果ꎬ结果显示ꎬ对于经过不同氧化时间处理得到的MAO涂层ꎬ其切割边缘均较平滑ꎬ无一格脱落现象发生ꎬ涂层附着力评级均为0级ꎬ表面MAO涂层在ZTM630镁合金基体上具有优异的附着力ꎬ这对于植入材料在真实服役过程中对抗组织间的摩擦及自身各部件间的磨损以防止涂层剥落是十分有利的ꎮ86第6期王世芳ꎬ等:生物医用ZTM630镁合金微弧氧化表面改性研究图7㊀MAO处理不同氧化时间后试样的涂层附着力测试结果Fig.7㊀CoatingadhesiontestresultofsamplestreatedbyMAOfordifferentoxidationtimes2.2㊀涂层耐蚀性能图8为经MAO处理后试样的动电位极化曲线ꎬ经拟合分析得出的电化学数据列出于表2ꎮ结果表明ꎬ试样经MAO处理5min后ꎬ其腐蚀速率表现为最低ꎬ线性极化电阻最高ꎬ这说明其具有最强的耐蚀性ꎮ图9中的电化学阻抗谱也显示ꎬ经MAO处理5min后的试样具有最大的容抗弧半径ꎬ结果同样表明MAO处理5min所得的涂层对合金基体具有最好的防护作用ꎮ图2中的显微组织观察已经发现ꎬ合金经MAO处理2min后ꎬ涂层陶瓷相组织发育并不成熟ꎬ涂层依然表现为较强的腐蚀敏感性ꎬ这一点也可以从极化曲线上试样具有较低的自腐蚀电位得到印证ꎮ但是随着MAO处理时间的延长ꎬ涂层的耐蚀性并非单调增强ꎬ试样经MAO处理5min后表现出最强的耐蚀性ꎬ此时涂层陶瓷相烧结发育完全ꎬ放电通道均匀ꎬ能够有效抵御侵蚀介质的腐蚀ꎮ虽然氧化8min后ꎬ涂层的厚度有所增加ꎬ但是涂层中出现局部的烧蚀现象ꎬ成为腐蚀介质入侵的薄弱部位ꎬ不利于涂层的整体耐蚀性ꎮ而随着氧化时间的进一步延长ꎬ涂层厚度的增加也不能弥补烧蚀的不利影响ꎮ综合比较ꎬZTM630镁合金在MAO处理5min后ꎬ涂层的组织结构和性能达到较好的平衡状态ꎬ试样表现出最强的耐蚀性ꎮ表2㊀经MAO处理后试样的电化学数据250.18450.407ˑ10-267732.73877.8800171.6ˑ10-2388.14157.313016.12ˑ10-22788.4图8㊀经MAO处理后试样的动电位极化曲线Fig.8㊀PotentiodynamicpolarizationcurvesofthesamplesafterMAOtreatment图9㊀经MAO处理后试样的电化学阻抗谱Fig.9㊀ElectrochemicalimpedancespectroscopyofthesamplesafterMAOtreatment9607山㊀东㊀科㊀学2020年3㊀结论基于本课题组研发的生物医用高强韧ZTM630镁合金ꎬ进行了MAO处理ꎬ以期增强其耐蚀性ꎬ研究了氧化时间对涂层的组织结构和耐蚀性的影响规律ꎮ研究表明ꎬ随着氧化时间的延长ꎬ涂层厚度与表面粗糙度均呈现增高的趋势ꎬ氧化时间为5min时ꎬ涂层既得到充分发育又未出现烧蚀现象ꎬMAO涂层显微结构最佳ꎬ此时ꎬ涂层表现出最强的耐蚀性ꎮ参考文献:[1]ZHENGYFꎬGUXNꎬWITTEF.Biodegradablemetals[J].MaterialsScienceandEngineeringRꎬ2014ꎬ77:1 ̄34.DOI:10.1016/j.mser.2014.01.001.[2]BOMMALAVKꎬKRISHNAMGꎬRAOCT.Magnesiummatrixcompositesforbiomedicalapplications:areview[J].JournalofMagnesiumandAlloysꎬ2019ꎬ7(1):72 ̄79.DOI:10.1016/j.jma.2018.11.001.[3]HAUDEMꎬINCEHꎬABIZAIDAꎬetal.Safetyandperformanceofthesecond ̄generationdrug ̄elutingabsorbablemetalscaffoldinpatientswithde ̄novocoronaryarterylesions(BIOSOLVE ̄II):6monthresultsofaprospectiveꎬmulticentreꎬnon ̄randomisedꎬfirst ̄in ̄mantrial[J].TheLancetꎬ2016ꎬ387(10013):31 ̄39.DOI:10.1016/S0140 ̄6736(15)00447 ̄X.[4]LEEJWꎬHANHSꎬHANKJꎬetal.Long ̄termclinicalstudyandmultiscaleanalysisofinvivobiodegradationmechanismofMgalloy[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmericaꎬ2016ꎬ113(3):716 ̄721.DOI:10.1073/pnas.1518238113.[5]ZHAODWꎬHUANGSBꎬLUFQꎬetal.Vascularizedbonegraftingfixedbybiodegradablemagnesiumscrewfortreatingosteonecrosisofthefemoralhead[J].Biomaterialsꎬ2016ꎬ81:84 ̄92.DOI:10.1016/j.biomaterials.2015.11.038. [6]LITꎬHEYꎬWUJHꎬetal.EffectsofscandiumadditionontheinvitrodegradationbehaviorofbiodegradableMg ̄1.5Zn ̄0.6Zralloy[J].JournalofMaterialsScienceꎬ2018ꎬ53(20):14075 ̄14086.DOI:10.1007/s10853 ̄018 ̄2626 ̄4.[7]LITꎬHEYꎬZHOUJXꎬetal.MicrostructureandmechanicalpropertyofbiodegradableMg ̄1.5Zn ̄0.6Zralloywithvaryingcontentsofscandium[J].MaterialsLettersꎬ2018ꎬ229:60 ̄63.DOI:10.1016/j.matlet.2018.06.097.[8]LIUYꎬZHENGYFꎬCHENXꎬetal.Fundamentaltheoryofbiodegradablemetals:definitionꎬcriteriaꎬanddesign[J].AdvancedFunctionalMaterialsꎬ2019ꎬ29(18):1805402.DOI:10.1002/adfm.201805402.[9]孙翠翠ꎬ周吉学ꎬ赵东清ꎬ等.Sn对镁及镁合金显微组织和性能影响的研究现状及展望[J].材料导报ꎬ2017ꎬ31(19):60 ̄65.DOI:10.11896/j.issn.1005 ̄023X.2017.019.008.SUNCCꎬZHOUJXꎬZHAODQꎬetal.Tininfluencesonmicrostructureandpropertiesofmagnesiumandmagnesiumalloys:currentresearchstatusandprospect[J].MaterialsReviewꎬ2017ꎬ31(19):60 ̄65.DOI:10.11896/j.issn.1005 ̄023X.2017.019.008. [10]王胜强ꎬ宋杰ꎬ张泽平ꎬ等.生物降解Mg ̄Zn ̄Ca ̄Sn合金铸态组织和力学性能研究[J].金属功能材料ꎬ2019ꎬ26(1):44 ̄47.WANGSQꎬSONGJꎬZHANGZPꎬetal.CastmicrostructureandmechanicalpropertiesofbiodegradableMg ̄Zn ̄Ca ̄Snalloy[J].MetallicFunctionalMaterialsꎬ2019ꎬ26(1):44 ̄47.[11]郎海洋.生物医用可降解Zn ̄Sn系和Zn ̄Mg ̄Sn系合金的制备㊁组织及性能研究[D].桂林:桂林理工大学ꎬ2019.LANGHY.PreparationꎬmicrostructureandpropertiesofbiomedicaldegradableZn ̄SnandZn ̄Mg ̄Snalloys[D].Guilin:GuilinUniversityofTechnologyꎬ2019.[12]GUXNꎬZHENGYFꎬCHENGYꎬetal.Invitrocorrosionandbiocompatibilityofbinarymagnesiumalloys[J].Biomaterialsꎬ2009ꎬ30(4):484 ̄498.DOI:10.1016/j.biomaterials.2008.10.021.[13]刘西伟.Mg ̄3Sn ̄0.5Mn合金的降解行为及生物相容性[D].哈尔滨:哈尔滨工程大学ꎬ2013.LIUXW.BiodegradationandbiocompatibilityevaluationofMg ̄3Sn ̄0.5Mnalloy[D].Harbin:HarbinEngineeringUniversityꎬ2013. [14]曾荣昌ꎬ崔蓝月ꎬ柯伟.医用镁合金:成分㊁组织及腐蚀[J].金属学报ꎬ2018ꎬ54(9):1215 ̄1235.ZENGRCꎬCUILYꎬKEW.Biomedicalmagnesiumalloys:compositionꎬmicrostructureandcorrosion[J].ActaMetallurgica17第6期王世芳ꎬ等:生物医用ZTM630镁合金微弧氧化表面改性研究Sinicaꎬ2018ꎬ54(9):1215 ̄1235.[15]ZHANGELꎬYINDSꎬXULPꎬetal.MicrostructureꎬmechanicalandcorrosionpropertiesandbiocompatibilityofMg ̄Zn ̄Mnalloysforbiomedicalapplication[J].MaterialsScienceandEngineering:Cꎬ2009ꎬ29(3):987 ̄993.DOI:10.1016/j.msec.2008.08.024. [16]马百常ꎬ周吉学ꎬ王金伟ꎬ等.铸造Mg ̄6Zn ̄3Sn ̄0.5Mn镁合金组织和力学性能[J].铸造技术ꎬ2018ꎬ39(2):263 ̄266.MABCꎬZHOUJXꎬWANGJWꎬetal.Microstructureandmechanicalpropertiesofas ̄castMg ̄6Zn ̄3Sn ̄0.5Mnalloy[J].FoundryTechnologyꎬ2018ꎬ39(2):263 ̄266.[17]王娜娜ꎬ周吉学ꎬ刘玉ꎬ等.ZTM630镁合金双级时效实验研究[J].山东科学ꎬ2018ꎬ31(3):34 ̄38.DOI:10.3976/j.issn.1002 ̄4026.2018.03.006.WANGNNꎬZHOUJXꎬLIUYꎬetal.Experimentalstudyontwo ̄stageagingtreatmentofZTM630magnesiumalloy[J].ShandongScienceꎬ2018ꎬ31(3):34 ̄38.DOI:10.3976/j.issn.1002 ̄4026.2018.03.006.[18]马百常.高性能Mg ̄Zn ̄Sn ̄Mn挤压镁合金组织与力学性能研究[D].济南:山东建筑大学ꎬ2016.MABC.StudyonmicrostructureandmechanicalpropertiesofhighperformanceMg ̄Zn ̄Sn ̄Mn ̄extrudedmagnesiumalloy[D].Jinan:ShandongJianzhuUniversityꎬ2016.[19]李涛ꎬ张海龙ꎬ何勇ꎬ等.生物医用镁合金研究进展[J].功能材料ꎬ2013ꎬ44(20):2913 ̄2918.DOI:10.3969/j.issn.1001 ̄9731.2013.20.002.LITꎬZHANGHLꎬHEYꎬetal.Researchprogressinbiomedicalmagnesiumalloys[J].JournalofFunctionalMaterialsꎬ2013ꎬ44(20):2913 ̄2918.DOI:10.3969/j.issn.1001 ̄9731.2013.20.002.[20]HORNBERGERHꎬVIRTANENSꎬBOCCACCINIAR.Biomedicalcoatingsonmagnesiumalloysareview[J].ActaBiomaterialiaꎬ2012ꎬ8(7):2442 ̄2455.DOI:10.1016/j.actbio.2012.04.012.[21]YINZZꎬQIWCꎬZENGRCꎬetal.Advancesincoatingsonbiodegradablemagnesiumalloys[J].JournalofMagnesiumandAlloysꎬ2020ꎬ8(1):42 ̄65.DOI:10.1016/j.jma.2019.09.008.[22]SANKARANARAYANANTSNꎬPARKISꎬLEEM.Strategiestoimprovethecorrosionresistanceofmicroarcoxidation(MAO)coatedmagnesiumalloysfordegradableimplants:prospectsandchallenges[J].ProgressinMaterialsScienceꎬ2014ꎬ60:1 ̄71.DOI:10.1016/j.pmatsci.2013.08.002.[23]ZHANGZQꎬWANGLꎬZENGMQꎬetal.Biodegradationbehaviorofmicro ̄arcoxidationcoatingonmagnesiumalloy ̄fromaproteinperspective[J].BioactiveMaterialsꎬ2020ꎬ5(2):398 ̄409.DOI:10.1016/j.bioactmat.2020.03.005.[24]HANLYꎬLIXꎬXUEFꎬetal.Biocorrosionbehaviorofmicro ̄arc ̄oxidizedAZ31magnesiumalloyindifferentsimulateddynamicphysiologicalenvironments[J].Surface&CoatingsTechnologyꎬ2019ꎬ361:240 ̄248.DOI:10.1016/j.surfcoat.2019.01.052. [25]WANGYSꎬLIXꎬCHENMFꎬetal.Invitroandinvivodegradationbehaviorandbiocompatibilityevaluationofmicroarcoxidation ̄fluoridatedhydroxyapatite ̄coatedMg ̄Zn ̄Zr ̄Sralloyforboneapplication[J].ACSBiomaterialsScience&Engineeringꎬ2019ꎬ5(6):2858 ̄2876.DOI:10.1021/acsbiomaterials.9b00564.[26]国家质量技术监督局.色漆和清漆漆膜的划格试验:GB/T9286 1998[S].北京:中国标准出版社ꎬ1999.StateBureauofQualityandTechnicalSupervisionofthePeople'sRepublicofChina.Paintsandvarnishes ̄Crosscuttestforfilms:GB/T9286 1998[S].Beijing:StandardsPressofChinaꎬ1999.[27]王艳秋ꎬ吴昆ꎬ王福会.第二相对镁基材料微弧氧化过程的影响机制[J].金属学报ꎬ2016ꎬ52(6):689 ̄697.DOI:10.11900/0412.1961.2015.00500.WANGYQꎬWUKꎬWANGFH.Effectsofsecondphasesonmicroarcoxidationprocessofmagnesiumbasematerials[J].ActaMetallurgicaSinicaꎬ2016ꎬ52(6):689 ̄697.DOI:10.11900/0412.1961.2015.00500.[28]GUNDUZKOꎬOTERZCꎬTARAKCIMꎬetal.PlasmaelectrolyticoxidationofbinaryMg ̄AlandMg ̄Znalloys[J].Surface&CoatingsTechnologyꎬ2017ꎬ323:72 ̄81.DOI:10.1016/j.surfcoat.2016.08.040.。
镁合金作为生物医用材料的潜在优势
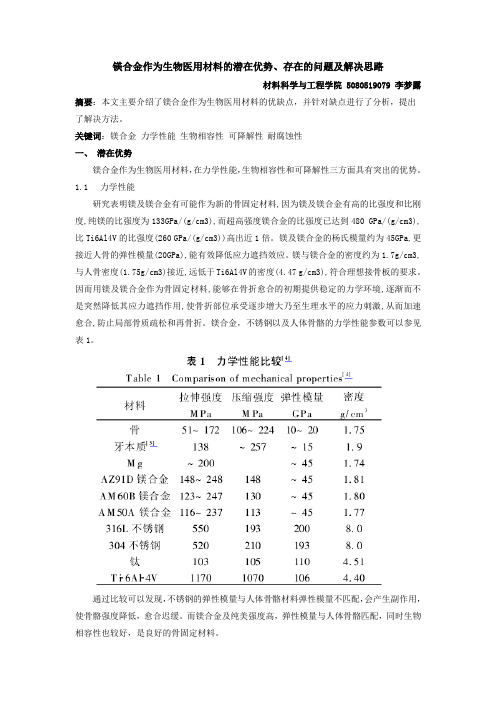
镁合金作为生物医用材料的潜在优势、存在的问题及解决思路材料科学与工程学院 5080519079 李梦露摘要:本文主要介绍了镁合金作为生物医用材料的优缺点,并针对缺点进行了分析,提出了解决方法。
关键词:镁合金力学性能生物相容性可降解性耐腐蚀性一、潜在优势镁合金作为生物医用材料,在力学性能,生物相容性和可降解性三方面具有突出的优势。
1.1力学性能研究表明镁及镁合金有可能作为新的骨固定材料,因为镁及镁合金有高的比强度和比刚度,纯镁的比强度为133GPa/(g/cm3),而超高强度镁合金的比强度已达到480 GPa/(g/cm3),比Ti6Al4V的比强度(260 GPa/(g/cm3))高出近1倍。
镁及镁合金的杨氏模量约为45GPa,更接近人骨的弹性模量(20GPa),能有效降低应力遮挡效应。
镁与镁合金的密度约为1.7g/cm3,与人骨密度(1.75g/cm3)接近,远低于Ti6Al4V的密度(4.47 g/cm3),符合理想接骨板的要求。
因而用镁及镁合金作为骨固定材料,能够在骨折愈合的初期提供稳定的力学环境,逐渐而不是突然降低其应力遮挡作用,使骨折部位承受逐步增大乃至生理水平的应力刺激,从而加速愈合,防止局部骨质疏松和再骨折。
镁合金,不锈钢以及人体骨骼的力学性能参数可以参见表1。
通过比较可以发现,不锈钢的弹性模量与人体骨骼材料弹性模量不匹配,会产生副作用,使骨骼强度降低,愈合迟缓。
而镁合金及纯美强度高,弹性模量与人体骨骼匹配,同时生物相容性也较好,是良好的骨固定材料。
1.2 生物相容性毒性试验表明,镁合金浸提液无细胞毒性,不会显著降低成纤维细胞和成骨细胞的存活率。
与纯镁对比,镁合金溶血率更低,黏附的血小板数量也更少,因此适当添加合金元素,可以将镁基合金应用在骨骼和血管植入物材料方面。
此外,体外溶血率和细胞黏附试验结果证实其具有良好的生物相容性,并能加快前成骨细胞在合金表面的黏附。
理想的生物可降解吸收材料在体内应完全降解,且其降解产物对周围组织无害。
医用镁合金表面改性结合抗菌性能研究进展

医用镁合金表面改性结合抗菌性能研究进展罗玉梅,李智,李海萍(成都医学院药学院,四川成都610500)摘要:随着医疗技术的进步,可降解镁合金因其良好的生物相容性、优越的抗菌性能及较高的力学性能,逐渐在骨科手术中得到更多的应用。
但是,可降解镁合金降解速度过快以及可能引起细菌感染等问题是限制它广泛应用的主要因素。
为了探究并解决降解过快问题,并提高可降解镁合金的抗腐蚀性以及抗菌性能,本文综述了近年来国内外对可降解镁合金进行的一系列表面改性技术研究,对可降解镁合金的抗菌性能研究的发展也进行了介绍。
关键词:可降解镁合金;表面改性;抗菌中图分类号:R318.08文献标识码:AResearch Progress on Surface Modification and Antibacterial Properties of Medical Magnesium AlloysLUO Yumei,LI Zhi,LI Haiping(College of Pharmacy,Chengdu Medical College,Chengdu610500,China)Abstract:With the advancement of medical technology,degradable magnesium alloys have been used in orthopedic surgery more and more with the advantage of good biocompatibility,superior antibacterial properties and high mechanical properties.However,rapid degradation rate and possible bacterial infec⁃tion were the main factors limiting its wide application.In order to explore and solve the problem of ex⁃cessive rapid degradation,and improve the corrosion resistance and antibacterial properties of degrad⁃able magnesium alloy,a number of surface modification researches of biodegradable magnesium alloys proceeded in recent years were reviewed in the paper,as well as the antimicrobial performance research. Keywords:degradable magnesium alloy;surface modification;antibacterial骨科内植入医用材料在骨科手术中有着非常重要的角色,例如用于骨折修复等。
镁合金的表面处理技术及其在材料工程中的应用

镁合金的表面处理技术及其在材料工程中的应用引言镁合金是一种重要的结构材料,在各个领域都有着广泛的应用前景。
然而,由于其易氧化、易腐蚀等特点,镁合金的表面处理成为了解决其应用限制的重要环节。
本文将探讨一些常用的镁合金表面处理技术,并讨论其在材料工程中的应用。
表面处理技术一:阳极氧化阳极氧化是一种常见的表面处理技术,可以形成致密的氧化膜,提高镁合金的抗腐蚀性能和耐磨性能。
该技术主要是将镁合金作为阳极,在硫酸、硝酸等电解液中进行电解,使得表面形成一层氧化膜。
经过阳极氧化处理的镁合金表面具有较好的耐腐蚀性和附着力,可以延长其使用寿命。
表面处理技术二:化学镀化学镀是一种通过化学反应,在镀液中形成金属对镁合金表面进行覆盖的方法。
常见的化学镀方法有镀镍、镀铬等。
这种表面处理技术可以提高镁合金的耐腐蚀性和耐磨性,同时还可以改善其外观。
表面处理技术三:喷涂涂层喷涂涂层技术是一种将具有一定特性的材料涂覆在镁合金表面的方法。
这种技术可以改善镁合金的表面硬度、耐磨性、耐腐蚀性等性能。
常见的喷涂涂层材料有陶瓷涂层、金属涂层等。
通过选择合适的喷涂涂层材料,可以满足不同工程的需求。
表面处理技术四:溅射溅射是一种利用高能离子束轰击镁合金表面,使其表面溅射出材料形成涂层的技术。
溅射涂层具有优异的耐腐蚀性、耐磨性和抗疲劳性能,可以有效地提高镁合金的使用寿命。
此外,溅射还能够改变镁合金的表面电子结构,从而改善其光学性能。
应用一:航空航天领域镁合金在航空航天领域有着广泛的应用。
通过表面处理技术,可以提高镁合金的耐腐蚀性,增加其在腐蚀环境下的使用寿命。
此外,表面处理技术还可以改善镁合金的表面硬度和耐磨性,提高其在高速飞行中的应力承载能力。
应用二:汽车工业领域镁合金在汽车工业中也有着重要的应用前景。
通过表面处理技术,可以提高镁合金的整体性能,如抗腐蚀性、耐磨性等,在汽车零部件的制造中起到了至关重要的作用。
特别是在电动汽车领域,镁合金的轻质化特点使得其成为理想的材料选择。
医用可降解镁合金应用及表面改性研究进展

第53卷第7期表面技术2024年4月SURFACE TECHNOLOGY·15·医用可降解镁合金应用及表面改性研究进展王国庆,李广芳,刘宏芳*(华中科技大学a.化学与化工学院b.生物医用与防护材料湖北省工程研究中心c.能量转换与存储材料化学教育部重点实验室d.材料化学与服役失效湖北省重点实验室,武汉 430074)摘要:镁及其合金作为新一代生物医用可降解材料,具有良好的经济性、力学性能、生物相容性、可降解性能,在骨科、心血管科、消化科等领域具有广阔的应用前景。
镁合金具有较高的化学活性,因此其降解速率较快,力学性能的维持受限,植入时可能发生的细菌感染会引发炎症和腐蚀加速等问题,因此需要通过表面改性来制备多功能一体化的涂层。
综述了医用可降解镁合金作为接骨板、螺钉、血管支架、胃肠吻合器、胆管支架等植入材料的应用现状及最新研究成果。
讨论了医用可降解镁合金在植入生物体时面临的析氢、pH升高、腐蚀加速、力学性能衰减、稀土元素毒性及内膜增生等具体问题,在此基础上,考察了化学转化、等离子喷涂、微弧氧化、聚合物涂层等4种镁合金表面改性技术的最新研究动态。
结合体内试验和体外试验,概述了表面改性对镁合金安全性、耐蚀性、抗菌性、生物相容性等方面的影响,并简要对比了几种表面改性技术的优缺点。
最后展望了医用可降解镁合金表面改性技术的发展方向。
关键词:镁合金;可降解;植入材料;表面改性;耐蚀性中图分类号:TG174.4;R318.08 文献标志码:A 文章编号:1001-3660(2024)07-0015-16DOI:10.16490/ki.issn.1001-3660.2024.07.002Research Progress in Application and Surface Modificationof Medical Degradable Magnesium AlloysWANG Guoqing, LI Guangfang, LIU Hongfang*(a. School of Chemistry and Chemical Engineering, b. Hubei Engineering Research Center for Biomedical andProtective Materials, c. Key Laboratory of Material Chemistry for Energy Conversion and Storage,Ministry of Education, d. Hubei Key Laboratory of Materials Chemistry and Service Failure,Huazhong University of Science and Technology, Wuhan 430074, China)ABSTRACT: As a new generation of biodegradable materials for medical use, magnesium and its alloys exhibit excellent affordability, mechanical property, biocompatibility and biodegradability, and possess extensive application prospects in orthopedics, cardiovascular treatment and gastroenterology. However, the high chemical activity of magnesium alloys leads to excessive degradation rates and limited maintenance of mechanical performance, and the possible bacterial infection during implantation can also lead to problems such as inflammation and accelerated corrosion, so surface modification is necessary to收稿日期:2023-04-18;修订日期:2023-09-25Received:2023-04-18;Revised:2023-09-25基金项目:国家自然科学基金(52171069)Fund:National Natural Science Foundation of China (52171069)引文格式:王国庆, 李广芳, 刘宏芳. 医用可降解镁合金应用及表面改性研究进展[J]. 表面技术, 2024, 53(7): 15-30.WANG Guoqing, LI Guangfang, LIU Hongfang. Research Progress in Application and Surface Modification of Medical Degradable Magnesium Alloys[J]. Surface Technology, 2024, 53(7): 15-30.*通信作者(Corresponding author)·16·表面技术 2024年4月form integrated multifunctional coatings. Starting from the current application of medical degradable magnesium alloys in various fields, the work aims to describe the research status of magnesium alloys as several types of implant materials, and clarify the specific challenges faced by magnesium alloys when implanted in organisms. Based on this, the latest research developments of four kinds of surface modification techniques of magnesium alloys are reviewed, and by evaluating the advantages and disadvantages of these techniques, targeted improvement directions are indicated to facilitate the development and practical application of surface modification techniques of medical degradable magnesium alloys. Medical degradable magnesium alloys are suitable as bone implant materials because of their osteogenic properties. When magnesium alloys are used as bone plates and screws, the mass loss and mechanical performance attenuation in long-term service are unacceptable, and they suffer from hydrogen evolution and pH increase simultaneously. Magnesium alloys can also serve as vascular stents because of their arrhythmia prevention and antithrombotic effects. Nevertheless, besides the rapid corrosion rate, the vascular stenosis caused by intimal hyperplasia should be considered, and the toxicity of rare earth elements in the new stent is not yet clear. When used as gastrointestinal staples as well as bile duct stents, the degradation rate of magnesium alloys needs to be more strictly controlled due to the corrosive digestive fluids they are exposed to. To improve the overall performance of medical degradable magnesium alloys, researchers have prepared various organic and inorganic coatings. The coatings including chemical conversion coatings, plasma spray coatings and micro-arc oxidation films are inorganic coatings. Chemical conversion coatings can effectively improve the biocompatibility and corrosion resistance of magnesium alloys, but the formation mechanism and long-term biological effects of the coatings should be further studied. Especially, attention needs to be paid to the coating formation mechanisms and health risks of the rare earth conversion coatings. Plasma spray, as a conventional method, can firmly integrate the coatings onto the surface of the magnesium alloy substrate, but it is difficult to avoid the formation of micro-pores and thermal stress residues, and further optimization of the spraying process or other post-treatment techniques is required. Micro-arc oxidation films are in-situ formed ceramic layers with excellent bonding strength and hardness. Similar to plasma spray coatings, their surfaces are also distributed with inherent micro-pores or micro-cracks, and these micro-defects are suitable as micro-containers and nano-containers or outer adhesion sites. Polymer coatings belong to organic coatings, which are denser than inorganic coatings, but they are prone to peel off from the substrate and their strength and hardness are not as good as those of inorganic coatings. A better strategy is to utilize the inorganic coating as an intermediate layer to provide sufficient adhesive strength and the polymer layer as a sustained drug release system, thus combining the advantages of the both. At present, the application of medical degradable magnesium alloys has been gradually extended from orthopedics and cardiovascular treatment to gastroenterology, oral and maxillofacial surgery. This change has put forward higher requirements on the comprehensive performance of magnesium alloys. Future research on surface modification of magnesium alloys should focus on key factors such as cell adhesion, controlled degradation, antimicrobial performance and biocompatibility, while moving from static simulations to the dynamic organisms and ensuring the effective functioning of the coatings after implantation.KEY WORDS: magnesium alloys; degradable; implant material; surface modification; corrosion resistance生物可降解材料是一类在生物机体中体液及核酸的作用下不断被降解、吸收或排出体外,最终完全被新生组织取代的生物医用材料,它包括生物可降解陶瓷、生物可降解高分子材料、生物可降解金属材料、复合材料及生物衍生材料等5类[1-2]。
医用镁合金的表面改性方法与制作流程

本技术公开了一种医用镁合金的表面改性方法,首先对医用镁合金进行表面化学处理,然后自组装固定氨基硅烷分子,最后将聚乙二醇、纤连蛋白以及肝素依次固定在材料表面,从而构建多功能的生物活性表面,同时提高材料的耐生理腐蚀性能。
采用本技术的方法对医用镁合金进行表面改性,不仅可以提高镁合金的耐生理腐蚀性能,而且可以赋予材料良好的血液相容性和促内皮细胞生长性能,为医用镁合金在血管内植入材料或器械(如血管支架)领域的应用奠定良好的基础。
权利要求书1.一种医用镁合金的表面改性方法,其特征在于包括以下步骤:1)首先对镁合金表面进行表面化学处理;2)然后在经过化学处理后的镁合金表面自组装固定氨基硅烷分子;3)最后将聚乙二醇、纤连蛋白以及肝素依次固定在材料表面,得多具有良好耐蚀性能的具有多功能生物活性的镁合金生物材料;将聚乙二醇、纤连蛋白以及肝素依次固定在材料表面的方法为:3.1)将步骤2)中得到的镁合金材料首先浸没到聚乙二醇二羧酸、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺及N-羟基丁二酰亚胺的混合溶液中,充分反应4~12小时;3.2)清洗干燥后浸没到纤连蛋白和肝素的混合溶液中继续反应4~12小时。
2.如权利要求1所述的一种医用镁合金的表面改性方法,其特征在于:所述步骤1)中,表面化学处理方法为:1 .1)将镁合金进行抛光、清洗;1.2)将抛光清洗后的镁合金浸没到温度在50~90℃范围内的氢氧化钠和磷酸钠的混合溶液中处理15~60min。
3.如权利要求2所述的一种医用镁合金的表面改性方法,其特征在于:所述步骤1 .2)中,所述氢氧化钠和磷酸钠混合溶液中的氢氧化钠的浓度在20~50 g/L 的范围内,十二水磷酸钠的浓度在5~10 g/L 的范围内。
4.如权利要求1所述的一种医用镁合金的表面改性方法,其特征在于:所述步骤2)中,自组装固定氨基硅烷分子的方法为:将步骤1)中的化学处理镁合金浸没到浓度在10~50mM范围内的氨基硅烷分子溶液中自组装反应12~24小时。
医用镁合金表面改性研究进展

医用镁合金表面改性研究进展曾荣昌;孔令鸿;陈君;崔洪芝;刘成龙【摘要】由于镁及其合金具有良好的生物相容性和力学相容性,降低镁合金过快的腐蚀速度成为其作为生物材料应用的关键,医用镁合金表面改性已成为新一代生物材料的研究重点.介绍医用镁合金的发展历程,重点讨论镁合金表面生物活性陶瓷(如羟基磷灰石(HA))、阳极氧化膜、可降解高分子聚合物(如聚乳酸(PLA)、PLGA、壳聚糖)、惰性生物陶瓷涂层(如TiO2、Al2O3、ZrO2)、化学转化膜(氟化膜、稀土转化膜)和金属镀层(如Ti、Zn)制备、耐蚀性及其生物相容性,并指出其发展趋势.%Magnesium and its alloys have excellent biocompatibility and mechanical compatibility. The reduction in their rapid corrosion rates becomes the key to clinical applications. The current study on magnesium alloys as biomaterials is focused on the surface modification. The history and recent cutting edge researches on the bio-coatings on medical magnesium alloys were predominately reviewed. The emphasis was placed on the recent progress of the preparation,corrosion resistance and biocompatibility of the bio-coatings. These coatings include hydroxyaptite (HA), micro arc oxidation films or plasma electrolyte oxidation coatings, degradable polymers (polylactic acid (PLA), poly (lactide-coglycolide) (PLGA) and chitosan), inert bio-ceramic coatings (TiO2, Al2O3 and ZrO2) and chemical conversion films (fluoride and rare earth) and ion implanted titanium and zinc films as well. The developmental trends were proposed.【期刊名称】《中国有色金属学报》【年(卷),期】2011(021)001【总页数】9页(P35-43)【关键词】镁合金;生物材料;生物涂层;腐蚀;生物相容性【作者】曾荣昌;孔令鸿;陈君;崔洪芝;刘成龙【作者单位】山东科技大学,材料科学与工程学院,青岛,266510;重庆理工大学,材料科学与工程学院,重庆,400050;重庆理工大学,材料科学与工程学院,重庆,400050;重庆理工大学,材料科学与工程学院,重庆,400050;山东科技大学,材料科学与工程学院,青岛,266510;重庆理工大学,材料科学与工程学院,重庆,400050【正文语种】中文【中图分类】TG146.22镁合金具有良好的生物相容性和力学相容性[1]、第三代医用材料的可降解性和生物活性特征[2]以及其他金属基生物材料和可降解高分子材料所不具备的性能。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
矿产资源开发利用方案编写内容要求及审查大纲
矿产资源开发利用方案编写内容要求及《矿产资源开发利用方案》审查大纲一、概述
㈠矿区位置、隶属关系和企业性质。
如为改扩建矿山, 应说明矿山现状、
特点及存在的主要问题。
㈡编制依据
(1简述项目前期工作进展情况及与有关方面对项目的意向性协议情况。
(2 列出开发利用方案编制所依据的主要基础性资料的名称。
如经储量管理部门认定的矿区地质勘探报告、选矿试验报告、加工利用试验报告、工程地质初评资料、矿区水文资料和供水资料等。
对改、扩建矿山应有生产实际资料, 如矿山总平面现状图、矿床开拓系统图、采场现状图和主要采选设备清单等。
二、矿产品需求现状和预测
㈠该矿产在国内需求情况和市场供应情况
1、矿产品现状及加工利用趋向。
2、国内近、远期的需求量及主要销向预测。
㈡产品价格分析
1、国内矿产品价格现状。
2、矿产品价格稳定性及变化趋势。
三、矿产资源概况
㈠矿区总体概况
1、矿区总体规划情况。
2、矿区矿产资源概况。
3、该设计与矿区总体开发的关系。
㈡该设计项目的资源概况
1、矿床地质及构造特征。
2、矿床开采技术条件及水文地质条件。
