利妥昔单抗说明书
利妥昔单抗说明方案完整版

利妥昔单抗说明方案集团标准化办公室:[VV986T-J682P28-JP266L8-68PNN]利妥昔单抗说明书【商品名称】美罗华【拼音名】LituoxidankangZhusheye【英文名】Rituximab Injection【成?份】主要组成成份:本品主要活性成分为重组利妥昔单抗,组成成分还包括枸橼酸钠,聚山梨醇酯80,氯化钠和注射用水。
【性?状】为无色或淡黄色澄明液体,无异物、絮状物及沉淀。
【适应症】本品适用于:复发或耐药的滤泡性中央型淋巴瘤(国际工作分类B、C和D亚型的B细胞非霍奇金淋巴瘤)的治疗。
CD20阳性弥漫大B细胞性非霍奇金淋巴瘤(DLBCL)应与标准CHOP化疗(环磷酰胺、阿霉素、长春新碱、强的松)8个周期联合治疗。
【用法用量】在无菌条件下抽取所需剂量的利妥昔单抗,置于无菌无致热源的含0.9%生理盐水或5%葡萄糖溶液的输液袋中,稀释到利妥昔单抗的浓度为1mg/ml。
轻柔的颠倒注射袋使溶液混合并避免产生泡沫。
由于本品不含抗微生物的防腐剂或抑菌制剂,必须检查无菌技术。
静脉使用前应观察注射液有无微粒或变色。
利妥昔单抗稀释后通过一种专用输液管静脉滴注,适用于不卧床患者的治疗。
利妥昔单抗的治疗应在具有完备复苏设备的病区内进行,并在有经验的肿瘤医师或血液科医师的直接监督下进行。
对出现呼吸系统症状或低血压的患者至少监护24小时。
每次滴注利妥昔单抗前应预先使用止痛剂(例如扑热息痛)和抗组胺药(例如苯海拉明)(开始滴注前30到60分钟)。
如果所使用的治疗方案不包括皮质激素,那么还应该预先使用皮质激素。
每名患者均应被严密监护,监测是否发生细胞因子释放综合征。
对出现严重反应的患者,特别是有严重呼吸困难,支气管痉挛和低氧血症的患者应立即停止滴注。
还应该评估患者是否出现肿瘤溶解综合征,例如可以进行适当的实验室检查。
预先存在肺功能不全或肿瘤肺浸润的患者必须进行胸部X线检查。
所有的症状消失和实验室检查恢复正常后才能继续滴注,此时滴注速度不能超过原滴注速度的一半。
09-美罗华使用和不良反应处理

• 预防肿瘤溶解综合症:碱化尿液、足够的补液量、别嘌呤醇 • 预处理给药:解热止痛药、抗组胺药、激素
• 将患者安排在有足够护理人员的门诊输液区(特需门诊输液),加强巡视;
• 配备急救药物,有条件配心电监护;
• 安排专门处理门诊注射急诊的值班医生; • 培训护士。
第16页,共17页。
谢 谢!
美罗华®的使用及不良反应处理
第1页,共17页。
目录
• 美罗华®的使用介绍 • 输注反应的介绍与处理
第2页,共17页。
目录
• 美罗华®的使用介绍 • 输注反应的介绍与处理
第3页,共17页。
美罗华®使用简介
美罗华® ,MabThera®,通用名为利妥昔单抗注射液,它是一种抗CD20的人/鼠嵌合单
第12页,共17页。
输注反应的预防
➢ 未经稀释不得静脉使用:配制成浓度为1 mg/mL液体静滴,不得推注。
➢ 配制后药液室温存放≤12小时,2-8°C≤24小时。
➢ 输注前30-60分钟予止痛剂(扑热息痛)和抗组胺药(苯海拉明),若治疗不包括皮质 激素,应给予。
➢ 初次滴注的速度为50mg/h,60分钟后可每30分钟增加50mg/h,以后滴注的开始速 度可为100mg/h,每30分钟增加100mg/h,最大速度400mg/h。
*对于年老体弱的患者(>70岁)或者心功能不好的患者, 禁止使用快速滴注法; 对于肿瘤高负荷患者也要慎用快速滴注法,防止肿瘤崩解综合症的
发生。
- 止痛剂(百服宁)
- 抗组胺药(苯海拉明) - NS 100ml
ivd
DXM 10 mg
- NS 100ml
奥美拉唑 60mg
ivd
滴注前30-60min 美罗华®前30min
医学课件美罗华利妥昔单抗
6
儿童肾脏疾病中的应用
• 系统性红斑狼疮和狼疮性肾炎 • ANCA相关性血管炎 • 肾病综合征(激素依赖、频复发、激素耐药、移植后复发) • 肾移植(移植后淋巴细胞增生性疾病 PTLD、抗体介导的排斥反
应、ABO血型不合移植的诱导和脱敏治疗)
Tullus K, Marks S D. Indications for use and safety of rituximab in childhood renal diseases[J]. Pediatric Nephrology, 2013
7
RTX治疗机制
• 随访12个月时:20/24例(83.3%)缓解,激素减至0.3~0.5 mg/kg,隔 日;12个月期间复发次数较治疗前明显减少[治疗前(4.0±0.4)次/(人·年) 治疗后(0.2±0.3)次/(人·年),P=0.000]
12
相关报道
• 2012年Kemper等报道,37例SDNS患儿,每周375 mg/m2,1~4个疗程; • 35例(94.5%)在RTX治疗后1.3(0.37~6.00)个月停用激素,22例患儿停
用免疫抑制剂; • 在12个月时26/37例(70.3%)患儿持续缓解; • 复发率为24/37例(64.8%),复发的时间为5.2~64.1个月,平均9.6个月; • 复发时间与RTX起始使用的次数有关:距第1次复发时间,16例首次接受1、
10
儿童肾病综合征
激素耐药相关报道 激素依赖及频复发相关报道
11
相关报道
利妥昔单抗注射液生物类似药临床试验指导原则

利妥昔单抗注射液生物类似药临床试验指导原则(征求意见稿)一、概述利妥昔单抗(Rituximab)是一种采用基因工程技术合成的人鼠嵌合单克隆抗体,由人源IgG1 kappa恒定区和鼠源CD20抗体可变区组成,可在中国仓鼠卵巢(CHO)细胞中表达,利妥昔单抗能特异性结合B细胞表面跨膜蛋白CD20,通过抗体依赖细胞介导的细胞毒作用(ADCC)和补体依赖的细胞毒作用(CDC)两种途径杀伤CD20阳性的B淋巴细胞。
利妥昔单抗由Genentech公司原研,1997年获得美国FDA批准上市,通用名为利妥昔单抗(Rituximab),商品名为RITUXAN®,之后该药物在欧洲(商品名MabThera®)和日本等地相继上市,适应症为:(1) 非霍奇金淋巴瘤(NHL);(2) 慢性淋巴细胞白血病(CLL);(3) 类风湿性关节炎(RA);(4) 多血管性肉芽肿(GPA)和显微镜性多发性血管炎(MPA)。
2000年利妥昔单抗在中国上市,商品名为美罗华®,批准的适应症[1]:(1)非霍奇金淋巴瘤:先前未经治疗的CD20阳性III-IV期滤泡性非霍奇金淋巴瘤患者,应与化疗联合使用;初治滤泡性淋巴瘤患者经美罗华联合化疗后达完全或部分缓解后的单药维持治疗;复发或化疗耐药的滤泡性淋巴瘤;CD20阳性弥漫大B 细胞性非霍奇金淋巴瘤(DLBCL)应与标准CHOP化疗(环磷酰胺、阿霉素、长春新碱、强的松)8个周期联合治疗。
(2)慢性淋巴细胞白血病:与氟达拉滨和环磷酰胺(FC)联合治疗先前未经治疗或复发性/难治性慢性淋巴细胞白血病(CLL)患者。
利妥昔单抗注射液原研产品中国专利已于2013年到期,多家国内外制药企业加入其生物类似药的研发。
国家药品监督管理局(NMPA)于2019年2月批准上市的上海复宏汉霖生物制药有限公司的利妥昔单抗注射液(汉利康®),为国内首个获批的利妥昔单抗生物类似药。
为进一步明确技术审评标准,提高企业研发效率,本文在原国家食品药品监督管理总局已发布的《生物类似药研发与评价技术指导原则(试行)》基础上(以下简称“指导原则”)[2],结合利妥昔单抗的特点,重点探讨当前普遍关注的临床研究策略和临床试验设计问题,以期为国内利妥昔单抗生物类似药的临床研发提供参考。
美罗华利妥昔单抗

2次RTX治疗患儿短于11例接收3、4次治疗时间[(10.3±3.5)个月比 (23.3±18.7)个月]。
• 白细胞分化抗原:血细胞在分化 成熟为不一样谱系、不一样阶段 及细胞活化过程中出现或消失细 胞表面标识分子
• CD:应用以单克隆抗体判定为 主方法,未来自不一样试验室单 克隆抗体所识别同一分化抗原归 为一个分化群。
• CD20:表示于除浆细胞外发育 分化各阶段B细胞,可能经过调 整跨膜钙离子流动直接对B细胞 起作用,在B细胞增殖分化中有 主要调整作用。
1.补体介导细胞毒性作用:RTX与B淋巴细胞表面CD20抗原结合并与补体C1q结合,激活补体级
联反应形成膜攻击复合物;
2.直接诱导B淋巴细胞凋亡:开启Caspase-3介导信号转导通路诱导细胞凋亡;
3.抗体依赖性细胞介导细胞毒性作用:RTX与B淋巴细胞表面CD20抗原结合,巨噬细胞、自然杀
伤细胞、单核细胞经过其Fc受体与RTXFc段结合而聚集,诱导CD20+B淋巴细胞溶解。
• 免疫球蛋白吸附疗法治疗FSGS患儿,能够显著减轻尿蛋白 • MCD患儿中可溶性CD23(B淋巴细胞活化标志物)和CD25(T淋巴细胞活化
标志物)均升高 • 有研究表明CD20也在T淋巴细胞表面表示 • 发觉RTX还能够直接与足细胞结合,经过与足细胞表示鞘磷脂磷酸二酯酶
酸样3b蛋白(SMPDL一3b)相互作用,稳定足细胞骨架,预防细胞凋亡
➢因造血干细胞和浆细胞不表示CD20,所以美罗华是靶向治疗B 淋巴细胞恶性肿瘤理想药品
利妥昔单抗 (Rituximab) 抗癌药物

利妥昔单抗 (Rituximab) 抗癌药物利妥昔单抗(Rituximab)抗癌药物利妥昔单抗(Rituximab)是一种被广泛应用于治疗恶性淋巴瘤的单克隆抗体药物。
本文将详细介绍利妥昔单抗的药理作用、临床应用和不同类型癌症的疗效,以及可能出现的副作用等。
一、药理作用利妥昔单抗通过靶向CD20抗原,作用于B淋巴细胞表面,并激活与之结合的免疫细胞,从而诱导细胞相关的免疫毒性。
其抗肿瘤机制包括:1. 诱导细胞凋亡:利妥昔单抗可以直接诱导B细胞凋亡,从而抑制肿瘤细胞增殖;2. 细胞相关的免疫毒性:利妥昔单抗激活免疫细胞(如自然杀伤细胞和巨噬细胞),促进其对肿瘤细胞的攻击;3. 通过抗体介导的依赖性细胞毒性(ADCC):利妥昔单抗激活免疫系统,使得肿瘤细胞遭受免疫细胞(如自然杀伤细胞和单核细胞)更多的攻击。
二、临床应用利妥昔单抗在治疗恶性淋巴瘤方面取得了显著的成果,尤其是对于CD20阳性(CD20+)的非霍奇金淋巴瘤。
其临床应用主要包括:1. 弥漫性大B细胞淋巴瘤(DLBCL):利妥昔单抗与化疗联合应用可作为DLBCL的一线治疗,同时也可用于复发或难治性病例的治疗。
2. 滑膜型大B细胞淋巴瘤(FL):利妥昔单抗可用于FL的一线治疗,也可用于复发或难治性FL的治疗。
3. 慢性淋巴细胞白血病(CLL):利妥昔单抗可与其它化疗药物联合应用,提高治疗效果。
同时,对于CD20阳性CLL的患者,利妥昔单抗也可作为首选单药治疗。
4. 自身免疫性血小板减少性紫癜(ITP):利妥昔单抗可用于ITP患者的二线治疗,对于对其他治疗方法无效的患者尤为适用。
三、疗效与副作用临床研究发现,利妥昔单抗在恶性淋巴瘤治疗中的有效率约为80%左右。
然而,利妥昔单抗也可能引起一些不良反应,包括:1. 过敏反应:包括寒战、低血压、皮疹等。
因此,使用利妥昔单抗前需要进行预防性药物治疗,以减轻过敏反应的风险;2. 感染:利妥昔单抗可能降低免疫功能,导致感染的风险增加。
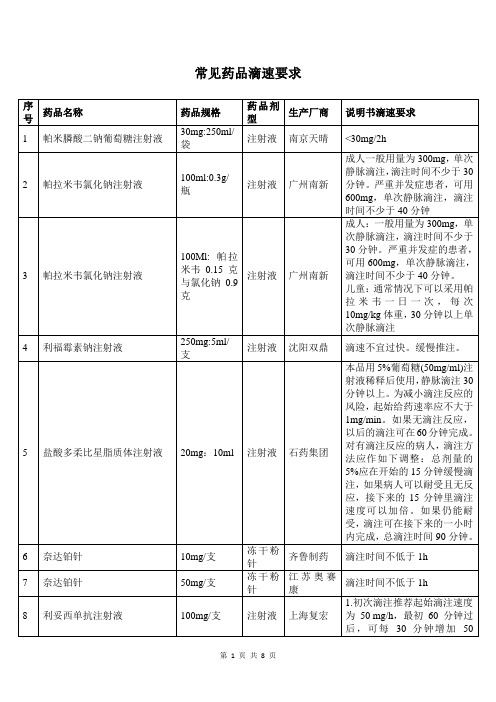
常见药品滴速要求
左乙拉西坦注射液浓溶液
5ml:500mg
注射液
Patheon Italia S.P.A
100ML静滴15分钟
13
左乙拉西坦注射用浓溶液
5ml:500mg
注射液
成都天台山
100ML静推15分钟
14
左乙拉西坦注射用浓溶液
5ml:500mg
注射液
海南普利
100ML静滴15分钟
15
丁苯酞氯化钠注射液
100ml/瓶
注射液
四川美大
成人常用量为每次250-1000ml,滴注速度应低于0.5g/kg/hr(以果糖计)
27
注射用盐酸瑞芬太尼
2mg/支
注射剂
江苏恩华
1.麻醉诱导
:本品应与催眠药(如丙泊酚、硫喷妥、咪达唑仑、笑气、七氟烷或氟烷)一并给药用于麻醉诱导。成人按每公斤体重0.5-1μg的输注速率持续静滴。也可在静滴前给予每公斤体重0.5-1μg的初始剂量静推,静推时间应大于60秒。
45
泮托拉唑钠针
40mg/支
冻干粉针
无锡凯夫
15-60分钟静脉滴完
46
注射用泮托拉唑钠
40mg/支
冻干粉针
扬子江
1小时内滴完
47
西咪替丁注射液
2ml:0.2g/支
注射液
山东方明
滴速为每小时1-4mg/kg
48
硫酸镁注射液
2.5g:10ml*5支/盒
注射液
杭州民生
1~2g/h
49
盐酸乌拉地尔注射液
50mg/支
3
帕拉米韦氯化钠注射液
100Ml:帕拉米韦0.15克与氯化钠0.9克
注射液
广州南新
利妥昔单抗注射液治疗慢性淋巴细胞白血病致过敏性休克1例

利妥昔单抗注射液治疗慢性淋巴细胞白血病致过敏性休克1例彭晔;张旭刚;谢娜;韩轶超【期刊名称】《医药导报》【年(卷),期】2014(000)010【总页数】2页(P1325-1326)【关键词】利妥昔单抗注射液;过敏性休克;不良反应【作者】彭晔;张旭刚;谢娜;韩轶超【作者单位】哈励逊国际和平医院肿瘤内科,衡水 053000;哈励逊国际和平医院肿瘤内科,衡水 053000;哈励逊国际和平医院肿瘤内科,衡水 053000;哈励逊国际和平医院肿瘤内科,衡水 053000【正文语种】中文【中图分类】R979.1;R733.4患者,男,56岁。
主因肝脾大2个月入院。
腹部超声:肝脾大性质待定;血常规:白细胞4.79×109·L-1,红细胞3.33×1012·L-1,血小板26.2×109·L-1,淋巴细胞百分比0.578;北京协和医院骨穿刺结果:慢性淋巴细胞性白血病(chronic lymphocytic leukaemia,CLL);中国医学科学院血液病医院会诊骨穿刺检查:符合边缘区细胞淋巴瘤侵犯骨髓,免疫组化显示:CD3小灶阳性,CD5小灶阳性,CD20广泛阳性,CD10阴性,CD68少数阳性,CD138阴性,CD23阴性,CD43小灶阳性,CyclinD1阴性,PAX-5阴性,Bcl-6阴性;电子显微镜超微结构检查报告:骨髓含高分化幼稚淋巴细胞,不排除CLL。
既往身体健康,无药物过敏史。
诊断为:CLL、肝脏、脾脏、骨髓受侵。
给予R-FC方案两个疗程治疗,即利妥昔单抗注射液(商品名:美罗华,上海罗氏制药有限公司,批号:SH0025),首次应用375 mg·(m2)-1·d-1,第2个疗程500 mg·(m2)-1·d-1,iv,第1天;氟达拉滨25 mg·(m2)-1·d-1,iv,第2~3天;环磷酰胺250 mg·(m2)-1·d-1,iv,第2天。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
利妥昔单抗说明书 Document number:PBGCG-0857-BTDO-0089-PTT1998利妥昔单抗说明书【商品名称】美罗华【拼音名】Lituoxidankang Zhusheye【英文名】Rituximab Injection【成份】主要组成成份:本品主要活性成分为重组利妥昔单抗,组成成分还包括枸橼酸钠,聚山梨醇酯80,氯化钠和注射用水。
【性状】为无色或淡黄色澄明液体,无异物、絮状物及沉淀。
【适应症】本品适用于:复发或耐药的滤泡性中央型淋巴瘤(国际工作分类B、C和D亚型的B细胞非霍奇金淋巴瘤)的治疗。
CD20阳性弥漫大B细胞性非霍奇金淋巴瘤(DLBCL)应与标准CHOP化疗(环磷酰胺、阿霉素、长春新碱、强的松)8个周期联合治疗。
【用法用量】在无菌条件下抽取所需剂量的利妥昔单抗,置于无菌无致热源的含%生理盐水或5%葡萄糖溶液的输液袋中,稀释到利妥昔单抗的浓度为1mg/ml。
轻柔的颠倒注射袋使溶液混合并避免产生泡沫。
由于本品不含抗微生物的防腐剂或抑菌制剂,必须检查无菌技术。
静脉使用前应观察注射液有无微粒或变色。
利妥昔单抗稀释后通过一种专用输液管静脉滴注,适用于不卧床患者的治疗。
利妥昔单抗的治疗应在具有完备复苏设备的病区内进行,并在有经验的肿瘤医师或血液科医师的直接监督下进行。
对出现呼吸系统症状或低血压的患者至少监护24小时。
每次滴注利妥昔单抗前应预先使用止痛剂(例如扑热息痛)和抗组胺药(例如苯海拉明)(开始滴注前30到60分钟)。
如果所使用的治疗方案不包括皮质激素,那么还应该预先使用皮质激素。
每名患者均应被严密监护,监测是否发生细胞因子释放综合征。
对出现严重反应的患者,特别是有严重呼吸困难,支气管痉挛和低氧血症的患者应立即停止滴注。
还应该评估患者是否出现肿瘤溶解综合征,例如可以进行适当的实验室检查。
预先存在肺功能不全或肿瘤肺浸润的患者必须进行胸部X线检查。
所有的症状消失和实验室检查恢复正常后才能继续滴注,此时滴注速度不能超过原滴注速度的一半。
如再次发生相同的严重不良反应,应考虑停药。
利妥昔单抗绝不能未稀释就静脉滴注,制备好的注射液也不能用于静脉推注。
滤泡性非霍奇金淋巴瘤,成年患者利妥昔单抗单药治疗的推荐剂量为375mg/㎡体表面积,每周静脉滴注1次,在22天内使用4次。
弥漫大B细胞性非霍奇金淋巴瘤,利妥昔单抗应与CHOP化疗联合使用。
推荐剂量为375mg/㎡体表面积,每个化疗周期的第一天使用。
化疗的其它组分应在利妥昔单抗应用后使用。
初次滴注,推荐起始滴注速度为50mg/h;最初60分钟过后,可每30分钟增加50mg/h,直至最大速度400mg/h。
以后的滴注,利妥昔单抗滴注的开始速度可为100mg/h,每30分钟增加100mg/h,直至最大速度400mg/h。
治疗期间的剂量调整.不推荐利妥昔单抗减量使用。
利妥昔单抗与标准化疗合用时,标准化疗药剂量可以减少。
【不良反应】1、全身症状:腹痛、背痛、胸痛、颈痛、不适、腹胀、输液部位疼痛。
2、心血管系统:高血压、心动过缓、心动过速、体位性低血压、心律失常。
3、消化系统:腹泻、消化不良、厌食症。
4、血液和淋巴系统:淋巴结病。
5、代谢和营养疾病:高血糖、外周水肿、LDH增高、低血钙。
6、骨骼肌肉系统:关节痛、肌痛、疼痛、肌张力增高。
7、神经系统:头昏、焦虑、感觉异常、感觉过敏、易激惹、失眠、神经质。
8、呼吸系统:咳嗽增加、鼻窦炎、支气管炎、呼吸道疾病、阻塞性细支气管炎。
9、皮肤和附属物:盗汗、出汗、单纯疱疹、带状疱疹。
10、感觉器官:泪液分泌疾病、结膜炎、味觉障碍。
【禁忌】已知对本药的任何组份和鼠蛋白过敏的患者禁用利妥昔单抗。
【注意事项】1、循环中有大量恶性肿瘤细胞(>25,000/ml)或高肿瘤负荷(病灶>10cm)者,发生严重的细胞因子释放综合征或肿瘤溶解综合征的风险较高,使用利妥昔单抗应极其慎重,可给予其他治疗选择。
应该考虑降低肿瘤负荷的预备治疗。
这类患者在第1次滴注利妥昔单抗时应考虑减慢滴注速度。
肺功能不全或高肿瘤负荷者出现严重的细胞因子释放综合征或肿瘤溶解综合征的风险增加。
这些反应在临床上可能与超敏反应无法区别。
严重的细胞因子释放综合征以严重的呼吸困难(常伴支气管痉挛和低氧血症),发热(可能出现高热惊厥),寒战,荨麻疹和血管性水肿为特征。
还可伴随出现一些肿瘤溶解综合征的特征,例如高尿酸血症,高钾血症,低钙血症,LDH升高,急性肾功能衰竭以及危及生命的呼吸衰竭。
2、急性呼吸衰竭可伴有胸部X线可见的肺间质浸润和水肿。
出现严重细胞因子释放综合症的患者应立即停止滴注,并给予积极的对症治疗。
少数患者在临床症状开始好转后再次出现恶化,所以应严密监护这些患者,直至症状和体征完全消失。
在症状和体征完全消退后对患者继续进行治疗,很少导致严重的输液相关反应。
预先存在肺功能不全或肿瘤肺浸润的患者用利妥昔单抗治疗必须极其谨慎,尤其是万一出现上述严重症状和体征时。
静脉滴注蛋白可导致患者发生过敏样反应或其它超敏反应。
与细胞因子释放综合征不同,典型的超敏反应常于开始滴注的几分钟内发生。
过敏反应临床上可与细胞因子释放综合征表现相似。
在滴注利妥昔单抗的过程中发生过敏反应,应立即使用抗变态反应的药物,如肾上腺素,抗组胺药和皮质激素。
约50%接受利妥昔单抗治疗的患者会出现输液相关不良反应。
这些反应通常是轻微的,类似流感,但大约10%的患者较严重,出现低血压、呼吸困难和支气管痉挛。
这些症状是可逆的,通常在停止静滴利妥昔单抗,并给予退热药和抗组胺药后好转。
偶尔需要吸氧,静滴生理盐水,甚至可能给予支气管扩张药和皮质激素。
由于滴注利妥昔单抗期间可能出现一过性低血压,所以滴注利妥昔单抗前12小时以及滴注期间应该考虑停用抗高血压药。
3、有心脏病史的患者(例如心绞痛、房扑和心房纤颤等心律失常或心衰)在利妥昔单抗滴注过程中应严密监护。
虽然利妥昔单抗单药治疗不会导致骨髓抑制,但在中性粒细胞计数<×10E9/l和/或血小板计数<75×10E9/l的患者接受治疗时,仍应谨慎,因为在这类患者中使用利妥昔单抗的临床经验有限。
利妥昔单抗曾应用于21例接受过自体骨髓移植及骨髓功能可能减低的其他风险组患者,并没有引起骨髓抑制。
与其他肿瘤治疗一样,利妥昔单抗单药治疗过程中应定期监测全血细胞计数,包括血小板计数。
当利妥昔单抗与CHOP化疗联合使用时,根据通常的医疗实践应定期检查全血细胞计数。
在单独利妥昔单抗治疗的患者中已有严重的皮肤粘膜反应的报道,有些甚至导致致命后果。
这些反应出现在开始治疗后1和13周之间。
出现这种情况的患者应停止滴注利妥昔单抗,并且必须立即接受医疗检查。
皮肤活检有利于区别不同的皮肤反应并决定随后的治疗。
报道的皮肤粘膜反应包括副肿瘤性天疱疮和中毒性表皮融解坏死。
在这些病例中再次使用利妥昔单抗治疗的安全性尚不清楚。
4、特别说明:对疫苗和基于抗原抗体反应的诊断性试验的可能反应尚未研究。
不相容性:未观察到利妥昔单抗与聚氯乙烯或聚乙烯袋或输液器之间的不相容性。
对驾驶和操作机器能力的影响:未知利妥昔单抗是否损害驾驶和操作机器的能力,尽管药理学特性和迄今为止报告的不良反应中没有显示上述的不良影响。
【进口药品】是【孕妇及哺乳期妇女用药】妊娠:利妥昔单抗尚未进行动物生殖毒性研究。
也不知妊娠妇女使用利妥昔单抗是否引起胎儿损害或利妥昔单抗是否影响生育能力。
但已知免疫球蛋白IgG可通过胎盘屏障,所以除非可能给患者带来的益处大于潜在的危险,利妥昔单抗不应用于妊娠妇女。
育龄妇女在使用利妥昔单抗的过程中及治疗后的12个月,应采取有效的避孕措施。
哺乳:尚不清楚利妥昔单抗是否分泌入乳汁。
已知母体的IgG可进入乳汁,那么利妥昔单抗就不能用于哺乳的母亲。
【儿童用药】利妥昔单抗应用于儿童的有效性和安全性尚未确定。
【老年用药】国外和国内临床研究中均纳入了老年患者,结果提示本品可用于老年患者,无特殊禁忌。
【药物相互作用】目前,尚无关于利妥昔单抗的可能药物相互作用的资料。
特别是利妥昔单抗与化疗(例如CHOP)合用的相互作用尚未研究。
人抗鼠抗体(HAMA)或人抗嵌合抗体(HACA)滴定阳性的患者,在接受其他诊断性或治疗性单克隆抗体时可发生过敏反应。
同时或序贯使用利妥昔单抗和其他倾向于引起正常B细胞耗竭的药物的耐受性尚未得到足够的研究。
【药代动力学】对滤泡性非霍奇金淋巴瘤的患者,以125、250或375mg/㎡体表面积的利妥昔单抗治疗,每周静脉滴注一次,共4次,血清抗体浓度随着剂量的增加而增加。
对于接受375mg/㎡剂量的患者,第一次滴注后利妥昔单抗的平均血清半衰期是小时,Cmax是μg/ml,而平均血浆清除率是小时;第四次滴注后的血清半衰期、Cmax和血浆清除率的平均值分别为小时、μg/ml和小时,但血清水平的变异性较大。
其次,反应患者的利妥昔单抗血清浓度明显较高。
一般来说,3~6个月时利妥昔单抗仍能在血清中被检出。
在弥漫大B细胞性非霍奇金淋巴瘤患者中,利妥昔单抗与CHOP合用时的清除和分布尚未进行研究。
【药理毒理】利妥昔单抗是一种人鼠嵌合性单克隆抗体,能特异性地与跨膜抗原CD20结合。
CD20抗原位于前B和成熟B淋巴细胞的表面,而造血干细胞、前前B细胞、正常浆细胞或其它正常组织不表达CD20。
95%以上的B细胞性非霍奇金淋巴瘤瘤细胞表达CD20。
抗原抗体结合后,CD20不会发生内在化,或从细胞膜上脱落进入周围的环境。
CD20不以游离抗原的形式在血浆中循环,因此不可能与抗体竞争性结合。
利妥昔单抗与B细胞上的CD20抗原结合后,启动介导B细胞溶解的免疫反应。
B细胞溶解的可能机制包括:补体依赖的细胞毒作用(CDC),抗体依赖细胞的细胞毒作用(ADCC)。
第一次输注利妥昔单抗后,外周B淋巴细胞计数明显下降,低于正常水平,6个月后开始恢复,治疗完成后9~12个月之间恢复正常。
体外实验显示,利妥昔单抗可以使耐药的人B淋巴瘤细胞株对某些化疗药物细胞毒作用的敏感性增强。
【贮藏】瓶装制剂保存在2~8℃。
【包装】152支/箱【产地】瑞士。
