初中化学-常见的盐的性质 八大成盐反应.ppt
初三的化学基本知识点归纳

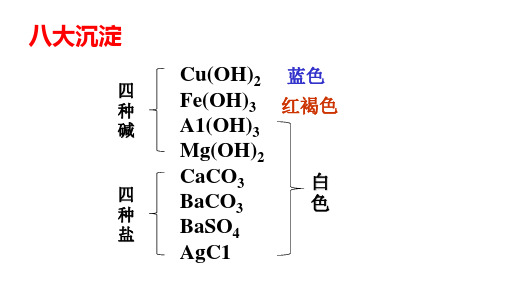
初三的化学基本知识点归纳初中化学只开设九年级一年,它既是化学学科的启蒙教育,又是初中毕业与升学的必考科目,那么要求学生掌握的知识点有哪些呢?下面是店铺为大家整理的初三化学知识点总结,希望对大家有用!初三的化学基本知识点归纳篇11、八大沉淀:白色沉淀:氯化银、硫酸钡、碳酸钙、碳酸钡、碳酸银、氢氧化镁;蓝色沉淀:氢氧化铜;红褐色沉淀:氢氧化铁;2、常见产生气体的离子:阳离子:氢离子(H+)、铵离子(NH4+);阴离子:碳酸根离子(CO32-)、碳酸氢根离子(HCO3-)、亚硫酸根离子(HSO3-);3、酸碱盐推断题中常见的一些离子的颜色归纳:(1)无色离子:钠离子、镁离子、钙离子、钡离子、铵离子、银离子、锌离子;(2)有色离子:二价亚铁为绿色,二价铜为蓝色,三价铁为黄色;4、气体与石蕊溶液和酚酞溶液的显色:石蕊遇酸变红色,遇碱变蓝色;酚酞遇酸变蓝色,遇碱变红色;5、化学框图推断中常见的酸性气体和碱性气体:碱性气体∶氨气;酸性气体∶二氧化硫,二氧化碳(二氧化碳的检验通常用澄清石灰水)。
初三的化学基本知识点归纳篇21.化学(Chemistry)一门研究物质的性质、组成、结构、变化、用途、制法,以及物质变化规律的自然科学。
化学是一门以实验为基础的科学。
2.物理变化:没有生成新物质。
如:冰化成水、水变成水蒸气、木刻成舟;化学变化:有生成新物质。
如:燃烧、食物腐败。
3.前20号元素:1H氢2He氦3Li锂4Be铍5B硼6C碳7N氮8O氧9F氟10Ne 氖11Na钠Mg镁13Al铝14Si硅15P磷16S硫17Cl氯18Ar氩19K 钾20Ca钙4.空气的组成我们每天呼吸着的空气,它的组分也是我们化学研究的对象。
空气的成分按体积计算,氮气占78%、氧气占21%、稀有气体占0.94%二氧化碳占0.03%、其它气体和杂质0.03%。
5.基础化学实验1)药品的使用要做到“三不”分别是:不能用手接触药品,不要把鼻孔凑到容器口去闻药品的气味,不得尝任何药品的味道。
初中化学课件:第十一单元_第一课时_生活中常见的盐课件
碱+盐→新碱+新盐 Na2CO3+Ca(OH)2==2NaOH+CaCO3↓ 盐+盐→新盐+新盐 BaCl2+Na2SO4==BaSO4↓+2NaCl
盐的化学性质 ①金属+盐→ 新盐+新金属
在金属活动性顺序表中,只有 位于前面 的金 属才能把 位于后面的金属从它的 盐溶液中置 换出来,与氢的位置 无关;盐必须是 可溶性 盐。 不要用K、Ca、Na置换盐溶液中的金属 铁参加的置换反应生成的都是亚铁盐
动物性食品。现在世界各国仍 允许用它来腌制肉类,但用量 严加限制。
一、氯化钠(食盐)
盐的起源
盐在中国的源起。“盐”字本意是“在器 皿中煮卤”。《说文》中记述:天生者称卤,煮 成者叫盐。传说黄帝时有个叫夙沙的诸侯,以海 水煮卤,煎成盐。现在推断中国人大约在神农氏 (炎帝)与黄帝之间的时期开始煮盐。中国古时 的盐是用海水煮出来。20世纪50年代福建有文 物出土,其中有煎盐器具,证明了仰韶时期(公 元前5000年~前3000年)古人已学会煎煮海盐。 根据以上资料和实物佐证,在中国,盐起源的时 间远在五千年前的炎黄时代,发明人夙沙氏是海 水制盐用火煎煮之鼻祖,后世尊崇其为“盐宗”。
古罗马货币
在古罗马表示富有与贫穷,不看拥有黄金的多少, 而是比藏有盐粒的数量,被历史上称为食盐货币时代。 我国的西藏过去也使用过盐巴货币。为了换取生活 必需的一小块盐巴,需要付出昂贵的代价。贵州解放 前只有少数人家吃得起吊盐(吃完饭以后,用舌头在 吊挂着的盐块上舔一下)可见食盐的贵重。
食盐的用途
浙教版科学九年级上册_知识总结:几种重要的盐

盐的复习一、几种常见的盐1、氯化钠:化学式——NaCl俗称食盐无色晶体易溶于水,有咸味。
重要的化工原料——广泛用于制取氯气、盐酸、火碱、纯碱等工业方面;并在塑料、橡胶、合成纤维、医药、农药等工业方面有广泛的应用,也是日常生活重要的调味品。
2、碳酸钠:化学式——Na2CO3,俗称:纯碱白色粉末,易溶于水成无色溶液。
实验事实:无色碳酸钠溶液能使无色酚酞试液变红。
说明:碳酸钠的水溶液呈碱性。
一般情况下:碳酸盐如碳酸钠,碳酸钾(K2CO3)等均能与盐酸发生剧烈反应,有无色气体产生——该气体能使澄清的石灰水变浑浊,即生成CO2。
Na2CO3+2HCl→2NaCl+H2O+CO2↑K2CO3+2HCl→2KCl+H2O+CO2↑主要用途:重要的化工原料——玻璃、造纸、纺织、制药、精炼石油等方面用途显著。
3、硫酸铜:化学式——CuSO4无水硫酸铜为白色粉末,易溶于水,其水溶液为蓝色。
硫酸铜晶体含五个结晶水,为蓝色、因此俗称蓝矾或胆矾,化学式为——CuSO4·5H2O。
主要用途:是制农药波尔多液的重要原料,也广泛应用于印染,电镀等工业方面。
二、盐溶液的导电性——盐的定义1、盐溶液的导电性:实验事实证明:可溶性盐的水溶液,均具有导电性。
说明: 盐溶液中存在着自由移动的阴、阳离子,在电场作用下,自由移动的离子定向移动而形成电流,——导电。
可溶性盐在溶液里的电离: 以食盐、碳酸钾、硫酸铵等为例,其水溶液中的电离方程式为:2、盐的定义:由金属(或铵根)离子与酸根离子相结合而组成的化合物,叫盐。
三、盐的分类:1、从盐的组成上分(1)正盐: 只由金属(或铵根)离子及酸根离子组成,例:NaCl 、Na 2SO 4、NH 4NO 3、MgCl 2、K 2CO 3等。
(2)酸式盐:组成当中,除金属(或铵根)离子与酸根离子外,还有氢离子。
以碳酸氢铵,碳酸氢钠为例看酸式盐在其水溶液中的电离:NH 4HCO 3→NH 4++H ++CO 32-NaHCO 3→Na ++H ++CO 32- 电离出来的阳离子除H +外,还有其它阳离子——NH 4+、Na +,因此上述二者是盐而不是酸。
课题1 生活中常见的盐4(盐的化学性质)
3、酸+金属氧化物→盐+水 基本反应类型:复分解反应
6HCl+Fe2O3====2FeCl3+3H2O H2SO4+CuO====CuSO4+H2O
②CaO→Ca(OH)2 ④HNO3→HCl ⑥Fe2O3→FeCl2 ⑧CO2→CO
6、下列物质可共存于水溶液中的是(C)
A、AgNO3和NaCl B、CuCl2和NaOH C、CaCl2和Cu(NO3)2 D、Na2CO3和HCl
7、下列各组离子在溶液中能共存并无色的
是(D )
A、Ba2+、OH-、CO32B、Fe3+、Cl-、NO3C、H+、OH-、CO32D、NO3-、SO42-、K+
A、氯离子
B、硫酸根离子
C、碳酸根离子 D、氢氧根离子
除杂
11、下列除去混合物中少量杂质的方法或加入试
剂合理的是( B )
1、除去杂质(只与杂质反应) 2、不减少被提纯物质 3、不带入新的杂质
12、为除去下列物质中的杂质(括号内是
杂质),下列操作方法正确的是(D )
13、除去下列各组物质中的少量杂质,所用
2、只用一种试剂就可一次性鉴别稀硫
酸、KOH溶液、CaCl2溶液的是( B )
A、KCl溶液
B、K2CO3溶液
C、稀盐酸
D、NaNO3溶液
3、能将AgNO3、K2CO3、ZnCl2三种无色
溶液一次鉴别出来的试剂是( C )
A、稀HNO3 C、稀HCl
B、Na2SO4溶液 D、BaCl2溶液
4、在盛有稀硫酸的烧杯中,分别加入下
高锰酸钾溶液呈紫红色 ;其它盐溶液一般为无色
10.3常见的盐(盐的化学性质)课件---2024--2025学年九年级化学人教版(2024)下册

1.掌握酸与盐、碱与盐、盐与盐、盐与金属之间的反应关系; 2.初步构建以盐为核心的酸、碱、盐、氧化物、金属的转化关系。
1.能在同一溶液中大量共存,且溶液为无色透明的一组物质是 A.FeCl3、CuSO4、NaCl B.BaCl2、Na2SO4、NaOH C.CaCl2、NaNO3、AgNO3 D.K2SO4、NaNO3、HCl
3.“八大”生成盐的反应:
①金属+盐(可溶)―→金属+盐;
②金属+酸―→盐+氢气(酸不能是硝酸、浓硫酸);
③金属氧化物+酸―→盐+水; ④非金属氧化物+碱―→盐+水;
⑤酸+碱―→盐+水;
⑥盐1+酸1―→盐2+酸2;
⑦盐1+碱1―→盐2+碱2;
⑧盐1+盐2―→盐3+盐4。
(注:在化学方程式中,凡有“↓”,则反应物须可溶)
__1_FeCl3+_3__NaOH__=_=_=_F_e_(_O_H__)_3↓_+__3_N__a_C_l_________ 产生红___褐__色__沉__淀__
盐的化学性质
化学方程式
实验现象
盐+盐
_1__NaCl+__1_AgNO3__=_=__=_A_g_C_l_↓_+__N__a_N_O__3 ____ __1_Na2SO4+__1_BaCl2_=_=_=_B__a_S_O_4_↓_+__2_N_a_C__l____ 产生_白__色__沉__淀__ __1_Na2CO3+_1__BaCl2=__=_=_B_a_C__O_3_↓_+__2_N_a_C__l____ __1_Na2CO3+__1_CaCl2=__=_=_C_a_C__O_3_↓_+__2_N__a_C_l____
盐
复习金属与盐溶液反应的实验现象和化学方程式;记录酸、 碱、盐之间有关实验的现象,完成相关反应的化学方程式。
九年级化学上册教案第十一章_盐__化肥

)+ (
) ) ) )
Zn + (
) — ZnSO4 + (
Na2CO3 +( )—( Al + ( ) — ( Mg(OH)2 +(
)+ HCl — FeCl3 + ( )+ HCl — FeCl2 + ( ) — ( ) + ( Fe(OH)3 Fe2O3 Fe )— NaOH
)—Mg(NO3)2 +(
介绍:蒸发皿蒸发:溶液量少于容积的 3 分之 2
京 翰 教 育 中 心 ht t p :/ /w w w.z gjh jy. co m
初 中 化 学 辅 导 网 ht t p ://w w w.h ua xu efu da o. cn /
补充练习
一、听写化学式 氯气 磷酸 苛性钠 氩气 水银 铂 氢氧化铝 氢氧化钡 纯碱 食盐 硼 硫酸 石灰石的主要成分 干冰 胆矾 亚硫酸 消石灰 碳酸钠晶体 尿素 氢硫酸 生石灰 铜绿 碳酸氢钙
硝酸亚铁 硫酸铁 硫化钠 小苏打 铁锈的主要成分 二、判断题(能反应的写化学方程式,不能反应的写原因) NaOH + CuCl2 — Cu + H2SO4 — BaSO4 + HNO3 — BaCO3 + HNO3 — CaCO3 + MgCl2 — Ba(OH)2 + CuSO4 — FeCl3 + Ba(OH)2 — SiO2 + H2O — NaCl + ZnSO4 — SO2 + HCl — NaOH + K2SO4 — Cu + AgNO3 — 三、完成下列化学方程式 NaOH +( Na2CO3 +( )— Fe(OH)3 +( )—( )+ NaCl )+ NaCl +( )+ Ag ) ) ) ( ( ( ( )+ CuO — ( Cu + ZnSO4 — Fe(OH)3 + K2SO4 — KNO3 + CuCl2 — Zn + AgCl — Na + HCl — K + CuSO4 — CO2 + Cu(OH)2 — NaOH + SiO2 — BaCO3 + NaOH — Na2SO4 + HCl — Fe2O3 + NaOH — NaNO3 + CuSO4 —
盐的分类以及盐的性质 课件 高一上学期化学人教版(2019)必修第一册
三、盐的物理性质
2.盐溶液的颜色
铜盐溶液一般
呈
铁盐溶液一般
呈
亚铁盐溶液一般 呈
高锰酸钾溶液
呈
其它盐溶液一般为
蓝色 棕黄色 浅绿色 紫红色 无色
三、盐的物理性质
3.常见的沉淀颜色
AgCl 白 BaSO 4白 CaCO3白 BaCO3白 Ag2CO3白 Mg(OH)2白 Al(OH)3白 Zn(OH)2白 Cu(OH)2 蓝 Fe(OH)3 红褐色 PbS/FeS/CuS/Cu2S 黑色 HgS(朱砂)红色
8.注意不同温度下,两者的溶解度比较;学会分析图象,控制变量法 10. 大米(糖类),岩盐(无机盐),烧鸡(蛋白质) 11. 黄铜和食醋都属于混合物(主要成分是Cu和CH3COOH)
14.注意题中条件要求:●溶液质量减小●化学反应 17.物质转化 18.计算(极限法)19.(4)注意审题,写复分解反应 21.实验室制备氧气: 氯酸钾分解、高锰酸钾分解(2KClO3=2KCl+3O2 、 2KMnO4=K2MnO4+MnO2+O2 ) 22.现象表示完整(首先出现Cu红色固体,硫酸铜蓝色溶液变为无色) (二)
交叉分类法特点:同一物质有不同的分类标准。
(eg:妈妈和爸爸可以有不同的身份,可以是姥姥、奶奶的女儿和儿子,也可以是我们的 爸爸和妈妈。)
3.同素异形体:由同一种元素组成的具有不同形态和性质不同的单质。(eg:石墨与金刚 石、O2和O3) 4.氧化物:可以分为金属和非金属氧化物。 在下节课学习分类方法:酸性氧化物、碱性氧化物、不成盐氧化物和两性氧化物。
二、盐的二分、类盐的分类与命名:
NaHCO3和Cu2(OH)2CO3是不是属于盐类?
盐类的水解及其应用 PPT
有弱才水解,越弱越水解; 谁强显谁性,同强显中性 。
步步高P182-题组一1
B 1.常温下,某NH4Cl溶液的pH=4,下列说法中正确的是( )
①溶液中c(H+)>c(OH-)
②由水电离产生的c(H+)约为10-10 mol·L-1
③溶液中离子浓度关系为c(Cl-)> c(NH+ 4 ) >c(H+)>c(OH-)
(5)0.2 mol·L-1 CH3COONa与0.1 mol·L-1盐酸等体积混合后的溶液中(pH<7):
√ c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) ( ) (2017·江苏,14D)
课时 P331-1
1.下列说法不正确的是( B)
A.明矾能水解生成Al(OH)3胶体,可用作净水剂 B.水解反应 NH+ 4 +H2O NH3·H2O+H+达到平衡后,升高温度平衡逆向移动 C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 D.盐类水解反应的逆反应是中和反应
10,则HX、HY、HZ的酸性由强到弱的排 判断成盐的酸碱强弱
列顺序是(C)
A.HX、HZ、HY
B.HZ、HY、HX
判断离子浓度大小
C.HX、HY、HZ D.HY、HZ、HX
判断离子共存
步步高P184-题组二- 4
5.下列有关问题与盐的水解有关的是 ( D )
①NH4Cl与ZnCl2溶液可作焊接金属时的除锈剂 ②NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 ③草木灰与铵态氮肥不能混合施用
) (2018·天津,6B )
× (2)16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA( ) (2018·全国卷Ⅰ,10A)
中考化学专题复习---盐化肥
二、含钙化合物之间的转化
1. 写出图中字母所代表物质的化学式 A:_C_a_(_O__H_)_2_ 2. 写出图中涉及的化学方程式 ①__C__a_C_O_3__=_=高_=温=_=__C_a_O__+__C_O__2↑___ ②__C__a_O_+__H__2O__=_=__=_C__a_(O__H_)_2___
c. 酸+金属氧化物、d.可溶性盐+可溶性碱、 e.可溶性盐+可溶性盐
三、酸碱盐的溶解性
酸:初中范围内所学的酸均溶于水
碱:除氢氧化钠、氢氧化钾、氢氧化钡易溶,氢氧化钙微溶外,其他的均不溶于水
盐的溶解性巧记:钾钠铵硝皆可溶,盐酸盐中银不溶,硫酸盐中钡不溶,碳酸盐除
钾钠铵外皆不溶
“八大沉淀 ”
AgCl、BaSO4:不溶于水,也不溶于酸 CaCO3、BaCO3、Mg(OH)2、Al(OH)3、Fe(OH)3、Cu(OH)2:不溶于
铜和硝酸 现象:_有__固__体__析__出__,__溶__液__由__无__色__变__为__蓝__色__ 银溶液 化学方程式:_C_u_+__2_A__g_N_O__3 _=_=_=__C_u_(_N_O__3)_2_+__2_A_g_
化 学 性
盐+酸 →新
碳酸钙和 现象:_固__体__溶__解__,__有__气__泡__产__生__ 稀盐酸 化学方程式:C__a_C_O__3_+__2_H__C_l_=_=_=__C_a_C__l2_+__H__2O__+__C_O__2_↑
化肥、农 药的使用
合理施用:降低病虫害的发生几率,促进农作物增产 过量施用:污染空气、污染土壤、污染水、危害人体健康 不合理施用:铵态氮肥与碱性物质混合施用会产生氨气,降低肥效
微点诊断
判断下列说法的正误,正确的请在括号内打“√”,错误的请打“×”。
生活中常见的盐(学案)(原卷版)——2020-2021学年人教版九年级化学下册
课题11.1 生活中常见的盐(学案)1.知道氯化钠、碳酸钠、碳酸氢钠和碳酸钙等盐在生活和生产中都有广泛的用途;2.认识碳酸钠等盐的化学性质,了解复分解反应及发生的条件,能正确判断酸、碱、盐之间的反应;3.进一步理解酸、碱、盐等基本概念和物质的分类。
1.掌握复分解反应发生的条件;2.盐的化学性质。
我们日常生活中所说的盐,通常指(主要成分是)。
化学中的盐,是指一类组成里含有和的化合物,如氯化钠、硫酸铵、碳酸钙等,不仅仅指食盐。
一、氯化钠(1)俗称:;(2)化学式:;(3)性状:白色晶体,于水,有咸味,溶液呈性;(4)氯化钠对人体的主要作用:人体内所含的氯化钠大部分以形式存在于体液中。
①钠离子对维持细胞内外正常的水分分布和促进细胞内外物质交换起主要作用;②氯离子是胃液中的主要成分,具有促生盐酸、帮助消化和增进食欲的作用;食盐对于人的正常的生理活动是不可缺少的。
人每天要食用一些食盐(5克左右)来补充从汗水、尿液、粪便里排出的氯化钠。
但长期从膳食中摄入过量食盐时,也会引起高血压等病症。
(5)食盐的用途①医疗上用的生理盐水是0.9%的氯化钠溶液(100毫升生理盐水中含0.9克医用氯化钠)。
②日常生活用于调味和腌渍蔬菜、鱼、肉、蛋等等。
③食盐是重要的化工原料,可用于制取钠、氯气、氢氧化钠、盐酸、纯碱等化工产品。
④农业上用氯化钠溶液选种。
⑤公路上的积雪也用食盐来消除。
(6)氯化钠的主要来源:、、盐井、盐矿。
粗盐提纯的步骤:①溶解用玻璃棒搅拌的目的是;②过滤一贴:滤纸紧贴在上(不留有气泡,提高过滤速度)。
二低:·滤纸边缘低于,·液面低于边缘。
(否则液体会从滤纸和漏斗壁之间流下,导致过滤不干净)。
三靠:·盛液烧杯口紧靠在倾斜的玻璃棒中部(让滤液沿玻璃棒缓缓地流入漏斗);·玻璃棒末端斜靠一边(避免将滤纸戳穿);·漏斗下端紧靠接液烧杯的内壁(避免 )。
玻璃棒的作用:。
③蒸发【注意】当时,停止加热,利用余热蒸干剩余的水份。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4、碱性氧化物+酸——盐+水
H2SO4+CuO
2 HCl + MgO 6 HCl+Fe2O3
CuSO4+H2O MgCl2+H2O
2FeCl3+ 3H2O
四种碱性氧化物能与水反应生成可溶性的碱
Na2O
K2O
CaO
BaO
CaO + H2O = Ca(OH)2 Na2O + H2O = 2NaOH
a.前置后 b.盐可溶
(不含钾钙钠) (铁二价)
下列置换反应能否发生?若能请完成方程式.
(1) Al (2) Zn (3) Cu (4) Mg
+ CuSO4 ─ + Hg(NO3)2 ─ + AgNO3 ─ + AgCl ─
3、酸性氧化物+碱——盐+水
Ca(OH)2+CO2== CaCO3↓+H2O 2NaOH + CO2== Na2CO3 +H2O 2NaOH + SO2== Na2SO3+H2O
(8) Cu(OH)2 + Na2SO4─ (9) NaOH + BaCl2─ (10) CuCl2 + NaOH─ (11) Ca(OH)2 + K2CO3─ (12) NaOH + FeCl3─ (13) CaCO3 + NaCl ─ (14) NaCl + KNO3─ (15) BaCl2 + Na2CO3─ (16) AgNO3 + KCl ─
(17) CuO + H2SO4─ (18) Fe2O3 + HCl─ (19) Na2O + HNO3─ (20) CaO + HCl─
(21) CO2 (22) CO2 (23) SO2 (24) CO2
+ NaOH─
+ Ca(OH)2─ + KOH─
+ Cu(OH)2 ─
课后作业:
1.整理学习笔记 ,总结八种成盐反 应,练习相关化学反应方程式;
初中化学
第七章 第三节
常见的盐 盐的化学性质 八大成盐反应
知识回顾
1.下列物质属于盐的是( C )
A CuO B Cu(OH)2 C CuSO4 D HCl
2.填写下表
(类别按酸、碱、盐、氧化物填写)
名称 化学式
类别
氢氧化钠 氯化钠
NaOH
NaCl
碱
盐
硫酸 氧化铁
H2SO4 Fe2O3 酸 氧化物
C
1.在生活中常用做调味剂和防腐剂的是( )
A.纯碱 B.酒精
C.食盐 D.醋C酸
2.下列物质溶于水,其溶液呈蓝色的是( )
A.食盐 B.蔗糖 C.硫酸铜 D.氢氧化钠
3.用做鉴别碳酸根离子的试剂是( D )
A.稀硫酸 B.食盐水
C.石灰水 D.稀盐酸和澄清石灰水
4.在改进制碱法方面,曾做出杰出贡献的科学
复
6、酸+盐——新酸+新盐
分 解
7、碱+盐——新碱+新盐
反
8、盐+盐——新盐+新盐
应
金属活动性顺序表:
K CaNaMg Al Zn Fe Sn Pb (H) CuHgAgPt Au
金属活动性顺序由强逐渐减弱
主要应用:
一 判断金属跟酸能否发生置换反应。
a.前置后 b.盐可溶
(不含钾钙钠) (铁二价)
如:NaCl + AgNO3 = AgCl↓ + NaNO3
单质、氧化物、酸、碱、盐之间的相互关系
非金属
金金属属
酸性 氧化物
碱性 氧化物
酸
碱
盐
盐
制取盐的八种方法
1、金属+酸——盐+氢气 2、金属+盐——盐+金属
置换 反应
3、酸性氧化物+碱——盐+水
4、碱性氧化物+酸——盐+水
5、酸+碱——盐+水
涂上下列物质可消除苦味的是( D )
A食醋 B食盐水 C自来水 D纯碱溶液
知识回顾:酸 的 通 性
酸能跟酸碱指示剂起反应 酸能跟活泼金属起反应 酸能跟某些金属氧化物反应 酸能跟某些盐反应 酸能跟碱反应
碱的通性
碱能跟酸碱指示剂起反应 碱能跟酸反应 碱能跟某些非金属氧化物反应 碱能跟某些盐反应
盐的化学性质 1、盐有酸性,有碱性的,还有中性的,所以某些盐
++
5、酸+碱——盐+水
HCl + NaOH = NaCl + H2O H2SO4 Ba(OH)2 = BaSO4↓+2H2O HNO3 NH3·H2 = NH4NO3+ H2O
O
a.反应实质:H++ OH-= H2O
b.中和反应: 属于复分解反应
6、酸+盐——新酸+新盐 a.特征反应
HCl+AgNO3 = HNO3 + AgCl↓
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
晶体
碳酸钠粉末的利用
化学家:侯德榜
常见的盐:硫酸铜
白色固体,能溶于水;水溶液呈蓝色;可以用于 配制农药波尔多液等。
Ca(OH)2+ CuSO4 = Cu(OH)2↓ + CaSO4 CuSO4 + 5H2O = CuSO4·5H2O
家是( )
A.侯德A榜 B.拉瓦锡 C.道时通常会感觉到涩味, 是因为制作过程中用到了熟石灰和纯碱为原料。 为了减轻涩味可在食用时添加调味品,这种调
味品最好是( D )
A食盐 B香油 C酱油 D食醋
6.鱼的味道很鲜美,但剖鱼时弄破鱼胆,胆汁 沾在鱼肉上,便有苦味产生苦味的是胆汁酸, 其pH约为6,且难溶于水。在沾有胆汁的地方
2.预习第十八节。
祝大家学习愉快!
1、金属+酸——盐+氢气
a.排在氢前的金属 (不含钾钙钠) b.无氧化性的酸 (盐酸、稀硫酸)
下列置换反应能否发生?若能请完成方程式.
(1) Al + H2SO4 ─ (2) Zn + HCl ─ (3) Fe + H2SO4 ─ (4) Cu + H2SO4 ─ (5) Ag + HCl ─
2、金属+盐——盐+金属
也能与酸碱指示剂作用。 2、某些盐能与某些酸反应,生成另一种盐和另一种酸。 如:HCl + AgNO3 = AgCl↓ + HNO3 3、某些可溶的盐能与金属反应,发生置换反应。 如:CuSO4 + Fe = Cu + FeSO4
4、某些盐能与某些碱反应,生成另一种盐和另一种碱。 如:Ca(OH)2 + Na2CO3 = CaCO3 ↓+ 2NaOH 5、盐和盐反应(两个盐都必须溶),生成另外两种盐。
H2SO4+Ba(NO3)2 = 2HNO3 + BaSO4↓
b.强酸复分解弱酸盐 2HCl+BaCO3 = BaCl2 + H2O + CO2↑
2HCl+Ag2CO3 = 2AgCl + H2O + CO2↑
7、碱+盐——新碱+新盐
CuSO4+2NaOH = Cu(OH)2↓+Na2SO4 FeCl3+3NaOH = Fe(OH)3 ↓+3NaCl
常见的盐:氯化钠
白色固体,易溶于水;可以做食品调味剂和防腐 剂;可以用于制取氯气、盐酸、烧碱和纯碱等; 并在橡胶、合成纤维、医药、农药等方面有广 泛应用;
NaCl + AgNO3 = AgCl↓ + NaNO3
氯
化
钠
的
用
途
常见的盐:碳酸钠 俗名:纯碱或苏打
白色固体,易溶于水;水溶液呈碱性;广泛用于 制玻璃、造纸、纺织、制药、精练石油等方面。
Ca(OH)2+Na2CO3= CaCO3↓+2NaOH
a.反应物: 都可溶 b.生成物: ↓、 ↑、 H2O
物质溶解性口诀: 酸都溶:
这些你都记 住了吗?
溶碱有五位:钾、钠、铵、钙、钡。
钾、钠、铵、硝酸盐都可溶。
盐酸盐只有氯化银不可溶。
硫酸盐只有硫酸钡不可溶。
碳酸盐只溶钾、钠、铵、剩下都不溶
练习与实践
下列反应能否发生?若能请完成方程式.
(1)Ba(OH)2 + H2SO4 ─ (2) Ca(OH)2 + HCl ─ (3) NaOH + HNO3 ─ (4) Cu(OH)2 + HCl ─ (5) AgCl + HNO3 ─ (6) CaCO3 + HCl ─ (7) Ba(NO3)2 + H2SO4 ─
