叶立德环丙烷化和环氧化反应的立体化学控制_英文_叶松
经典反应

人名反应1.Baeyer-Villiger氧化:酮过酸氧化成酯迁移规则:叔>仲>环己基>苄>伯>甲基>氢2.Corey-Kim 氧化:醇在NCS/DMF作用后,碱处理氧化成醛酮3.Criegee邻二醇裂解:邻二醇由Pb(OAc)4氧化成羰基化合物4.Criegee臭氧化:烯烃臭氧化后水解成醛酮5.Dakin反应:对羟基苯甲醛由碱性H2O2氧化成对二酚6.Dess-Martin过碘酸酯氧化:仲醇由过碘酸酯氧化成酮7.Fleming氧化:硅烷经过酸化,过酸盐氧化,水解以后形成醇8.Hooker氧化:2-羟基-3烷基-1,4-醌被KMnO4氧化导致侧链烷基失去一个亚甲基,同时羟基和烷基位置互变9.Moffatt氧化(Pfitzner-Moffatt)氧化:用DCC和DMSO氧化醇,形成醛酮10.Oppenauer氧化:烷氧基催化的仲醇氧化成醛酮11.Riley氧化:活泼亚甲基(羰基α位等)被SeO2氧化成酮12.Rubottom氧化:烯醇硅烷经过m-CPBA和K2CO3处理后α-羟基化13.Sarett氧化:CrO3络合物氧化醇成醛酮14.Swern氧化:用(COCl)2,DMSO为试剂合Et3N淬灭的方法将醇氧化成羰基化合物15.Tamao-Kumada氧化:烷基氟硅烷被KF,H2O2,KHCO3氧化成醇16.Wacker氧化催化剂下,烯烃氧化成酮1..Barton-McCombie去氧反应:从相关的硫羰基体中间用n-Bu3SnH,AIBN试剂经过自由基开裂发生醇的去氧作用2.Birch 还原:苯环由Na单质合液胺条件下形成环内二烯烃(带供电子基团的苯环:双键连接取代基;带吸电子基团的苯环,取代基在烯丙位。
)3.Brown硼氢化:烯烃和硼烷加成产生的有机硼烷经过碱性H2O2氧化得到醇4.Cannizzaro歧化:碱在芳香醛,甲醛或者其他无α-氢的脂肪氢之间发生氧化还原反应给出醇和酸5.Clemmensen还原:用锌汞齐和氯化氢将醛酮还原为亚甲基化合物6.Corey-Bakshi-Shibata(CBS)还原:酮在手性恶唑硼烷催化下的立体选择性还原7.Gribble吲哚还原:用NaBH4直接还原会导致N-烷基化,NaBH3CN在冰醋酸当中还原吲哚双键可以解决8.Gribble二芳基酮还原:用NaBH4在三氟乙酸中还原二芳基酮和二芳基甲醇为二芳基甲烷,也可以应用于二杂芳环酮和醇的还原9.Luche还原:烯酮在NaBH4-CeCl3下发生1,2-还原形成烯丙位取代烯醇10.McFadyen-Stevens还原:酰基苯磺酰肼用碱处理成醛11.Meerwein-Ponndorf-V erley还原:用Al(OPr’)3/Pr’OH体系将酮还原为醇12.Midland还原:用B-3-α-蒎烯-9-BBN对酮进行不对称还原13.Noyori不对称氢化:羰基在Ru(II)BINAP络合物催化下发生不对称氢化还原14.Rosenmund还原:用BaSO4/毒化Pd催化剂将酰氯氢化成醛,如催化剂未被毒化,会氢化为醇15.Wolff-Kishner-黄鸣龙还原:用碱性肼将羰基还原为亚甲基1.Boord反应:β-卤代烷氧基与Zn作用生成烯烃2.Chugaev消除:黄原酸酯热消除成烯3.Cope消除:胺的氧化物热消除成烯烃4.Corey-Winter olefin烯烃合成:邻二醇经1,1-硫代羰基二咪唑和三甲氧基膦处理转化为相应的烯5.Doering-LaFlamme丙二烯合成:烯烃用溴仿以及烷氧化物处理以后生成同碳二溴环丙烷再反应生成丙二烯6.Horner-Wadsworth-Emmons反应:从醛合磷酸酯生成烯烃.副产物为水溶性磷酸盐,故以后处理较相应的Witting反应简单的多7.Julia-Lythgoe成烯反应:从砜合醛生成(E)-烯烃8.Peterson成烯反应:从α-硅基碳负离子合羰基化合物生成烯烃.也成为含硅的Witting反应9.Ramberg-Backlund烯烃合成:Α-卤代砜用碱处理生成烯烃10.Witting反应:羰基用膦叶立德变成烯烃11.Zaitsev消除:E2消除带来更多取代的烯烃。
药物合成反应 第六章第五节 含烯键化合物的氧化

一、烯键环氧化
(1)反应通式
(2)反应机理
亲核加成
一、烯键环氧化
(3)影响因素
H3C CH3 C C H C O H3C O C H CH3 C C CH3 H3C
H2O2/NaOH/MeOH H3C CH3 CH C O H3C O C CH3
同上条件
一、烯键环氧化
O H2O2/NaOH -15~0℃
C
C
OH OMnO2 O
高锰酸钾氧 化反应机理
R H
1
OH OH
KMnO4
(a)
亲电加成
R H
1
R
2
(b)
C
C
R
2
C O
C O
H
R CHO
1
+
R CHO
2
+
MnO3
R COOH
1
+ R2COOH
OH O H
MnO
Py
四氧化锇氧 化反应机理
C
Py + OsO4
H H3C(H2C)7
C C
H (CH2)7COOH
1) I2 /AcOH/PhH 2) KOH/EtOH/H2O
H H3C(H2C)7
OH C C H OH (CH2)7COOH
(75%)
三、烯键的断裂氧化
(1)反应通式
(2)反应机理
高锰酸钾氧化反应为亲电加成反应机理
三、烯键的断裂氧化
对于水不溶性烯烃 用KMnO4水溶液氧化时,由于溶解度差,收率甚低,加入相转 移催化剂(如冠醚),可提高产物收率。 如二苯乙烯或α-蒎烯在用KMnO4水溶液氧化时,不加冠醚,收 率为40%~60%;加入冠醚,收率提高到90%以上。加冠醚的反 应一般在室温下进行,温度过高会使冠醚-高锰酸钾络合物分解。
有机化学答案高占先【全】

有机化学〔第二版〕课后习题参考答案第一章绪论1-1 扼要解释以下术语.(1)有机化合物(2) 键能、键的离解能(3) 键长(4) 极性键(5) σ键(6)π键(7) 活性中间体(8) 亲电试剂(9) 亲核试剂(10)Lewis碱(11)溶剂化作用(12) 诱导效应(13)动力学操纵反响(14) 热力学操纵反响答:(1)有机化合物-碳氢化合物及其衍生物(2) 键能:由原子形成共价键所放出的能量,或共价键断裂成两个原子所汲取的能量称为键能。
键的离解能:共价键断裂成两个原子所汲取的能量称为键能。
以双原子分子AB为例,将1mol气态的AB拆开成气态的A和B原子所需的能量,叫做A—B键的离解能。
应注意的是,对于多原子分子,键能与键的离解能是不同的。
分子中多个同类型的键的离解能之平均值为键能E(kJ.mol-1)。
(3) 键长:形成共价键的两个原子核之间距离称为键长。
(4) 极性键: 两个不同原子组成的共价键,由于两原子的电负性不同, 成键电子云非对称地分布在两原子核周围,在电负性大的原子一端电子云密度较大,具有局部负电荷性质,另一端电子云密度较小具有局部正电荷性质,这种键具有极性,称为极性共价键。
(5) σ键:原子轨道沿着轨道的对称轴的方向互相交叠时产生σ分子轨道, 所形成的键叫σ键。
(6) π键:由原子轨道侧面交叠时而产生π分子轨道,所形成的键叫π键。
(7) 活性中间体:通常是指高生动性的物质,在反响中只以一种〞短寿命〞的中间物种存在,很难别离出来,,如碳正离子, 碳负离子等。
(8) 亲电试剂:在反响过程中,如果试剂从有机化合物中与它反响的那个原子获得电子对并与之共有形成化学键,这种试剂叫亲电试剂。
(9) 亲核试剂:在反响过程中,如果试剂把电子对给予有机化合物与它反响的那个原子并与之共有形成化学键,这种试剂叫亲核试剂。
(10) Lewis碱:能提供电子对的物种称为Lewis碱。
(11)溶剂化作用:在溶液中,溶质被溶剂分子所包围的现象称为溶剂化作用。
【国家自然科学基金】_环丙烷_基金支持热词逐年推荐_【万方软件创新助手】_20140731
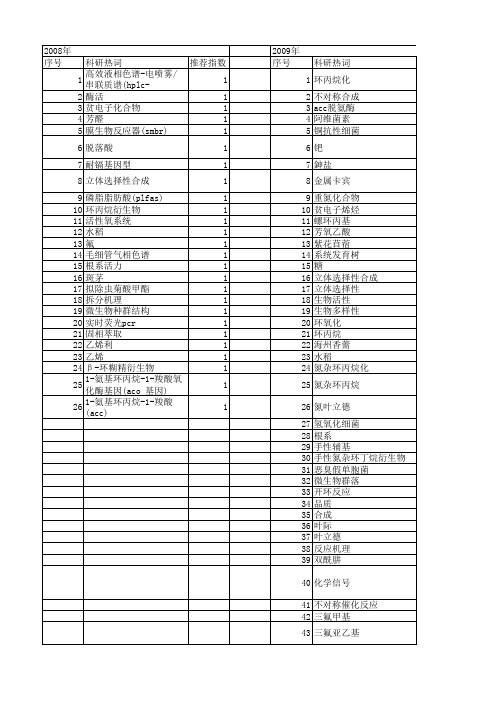
2013年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52
推荐指数 2 2 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
2010年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30
科研热词 环丙烷化 不对称合成 acc脱氨酶 阿维菌素 铜抗性细菌 钯 鉮盐 金属卡宾 重氮化合物 贫电子烯烃 螺环丙基 芳氧乙酸 紫花苜蓿 系统发育树 糖 立体选择性合成 立体选择性 生物活性 生物多样性 环氧化 环丙烷 海州香薷 水稻 氮杂环丙烷化 氮杂环丙烷 氮叶立德 氢氧化细菌 根系 手性辅基 手性氮杂环丁烷衍生物 恶臭假单胞菌 微生物群落 开环反应 品质 合成 叶际 叶立德 反应机理 双酰肼 化学信号 不对称催化反应 三氟甲基 三氟亚乙基 t-rflp plfa cis-3-(2-氯-3,3,3-三氟丙烯基)-2,2-二甲基 16s rdya
2011年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47
大学有机化学反应方程式总结(较全)
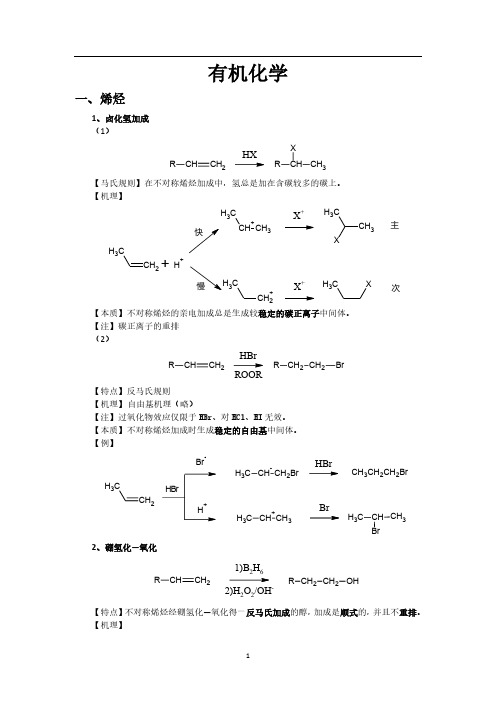
有机化学一、烯烃1、卤化氢加成 (1)CHCH 2RHXCH CH 3RX 【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】CH 2CH 3CH +CH 3CH 3X +CH 3CH 3X+H +CH 2+C3X +CH 3X主次【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排 (2)CHCH 2RCH 2CH 2R BrHBrROOR【特点】反马氏规则 【机理】 自由基机理(略)【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】CH 2CH3BrCH CH 2BrC H 3CH +CH 3C H 3HBrBrCH 3CH 2CH 2BrCH BrCH 3C H 32、硼氢化—氧化CHCH 2R CH 2CH 2R OH1)B 2H 62)H 2O 2/OH-【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】CH2CH 33H 323H 32CH CH 2CH 3HBH 2CH CH=CH (CH 3CH 2CH 2)3-B-H 3CH 2CH 2C22CH 3CH 2B OCH2CH 2CH 3H 3CH 2CH 2CCH 2CH 2CH 3+OH -OHB-OCH 2CH 2CH 3CH 2CH 2CH 3H 3CH 2CH 2OBOCH 2CH 2CH 3CH 2CH 2CH 3OCH 2CH 2CH 3HOO -B(OCH 2CH 2CH 3)3B(OCH 2CH 2CH 3)3+3NaOH3NaOH3HOCH 2CH 2CH 33+Na 3BO 32【例】CH 31)BH 32)H 2O 2/OH-CH 3HH OH 3、X 2加成C CBr/CCl CC BrBr 【机理】CC CC Br BrC CBr +CC Br OH 2+-H +CC Br OH【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
氧化反应

CH3CH2CH CH2 CH3CH=CHCH3
RCOOOC(CH3)3/CuBr
CH3CHCH=CH2 OCR
CH3CH
+
O (90 %)
CHCH2 OCR O (10%)
4. 用二氯氧钒酯路易斯酸氧化(补)
O R2
O R2
O R2
VO(OR)Cl2 /ROH /O2 R1=Me
O Me
VO(OR)Cl2 /ROH /N2 R1=H
Me
H3C
CH3
CH2O / HCl / AcOH
NOH
H3C
CH3 O
O
例3:
O
C6H5CH2 C
C6H5
SeO2 / HAc / H2O 89 oC
(91 %)
O
OO
C6H5C
C
C6H5
(91 %)
O
② α酮酸的制备
例1:
O
C CH3 KMnO4 / KOH 0 oC
例2:
O
C CH3 SeO2 / C5H5N
CuBr,
O O C C6H5
(4)应用特点
O
CH2
N
SeO2
HOAc COOCH3
N
CH
CH2CH3
O N N
喜树碱
CH2OAc
COOCH3 CH
CH2CH3
喜树
2铬➢. 用的CCoH其Clli3rn他Os试C3配-r剂吡O合:3啶物.C2配氧rPO合y化3/•C物2PH(y2CClo2llinsC试H剂3 )和
CH2CH3
CH2CH3
SeO2 HO
SeO2
OH
OH
+
手性硫叶立德在不对称三元环化合物合成中的应用
手性硫叶立德在不对称三元环化合物合成中的应用颜雪明;张红英【摘要】通过论述近年来手性硫叶立德在不对称环丙烷、环氧丙烷、氮杂环丙烷等三元化合物合成中的研究进展,提动了今后手性三元环不对称合成领域的研究方向。
%The synthesis and application of the three membered ring structure has get much attentions in recent years. The recent progress in research of chiral sulfur ylides in asymmetric cyclopropanation, propylene oxide, aziridine is summarized. The research direction of asymmetric synthesis of chiral three membered ring in future is put forward.【期刊名称】《佛山科学技术学院学报(自然科学版)》【年(卷),期】2015(000)005【总页数】11页(P71-80,91)【关键词】叶立德;三元环;不对称反应;手性【作者】颜雪明;张红英【作者单位】南华大学化工学院,湖南衡阳421001;衡阳财经工业职业技术学院材料系,湖南衡阳421001【正文语种】中文【中图分类】TQ032.42三元环是一种具有良好生物活性的结构单元,如含三元环结构的螺杂环化合物广泛存在于天然生物碱及药物分子中,并具有抗艾滋病、抗心律失常、抗癌、杀菌等活性[1-3]。
三元环是最小的环状结构,它的环张力非常大,具有一定的不饱和度,因此,三元环化合物具有烯烃的性质,是一类反应活性很强的特殊分子结构。
三元环结构单元极易和亲核试剂、亲电试剂、自由基等试剂进行反应,从而衍生合成各种复杂的分子结构。
三元环结构还具有极易重排的特点,能与多种活泼官能团发生扩环反应,可以由三元环到四元环、五元环和七元环,特别是当在三元环上有不同的取代基修饰时,更能赋予其反应的丰富性[4-5]。
【国家自然科学基金】_叶立德_基金支持热词逐年推荐_【万方软件创新助手】_20140731
2013年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21
2014年 科研热词 推荐指数 序号 药物合成 1 羟醛缩合反应 1 羟基叶立德 1 查尔酮类化合物 1 晶体结构 1 手性磷酸 1 异色烯 1 密度泛函理论 1 多组分 1 四硫富瓦烯 1 四氢-β -咔啉 1 合成 1 协同催化 1 偶联反应 1 亚甲胺叶立德 1 串联反应 1 中间体 1 不对称催化 1 hiv-1蛋白酶抑制剂 1 [3+3]环加成 1 (2s,3s)-1,2-环氧基-3-叔丁氧酰胺基-4-苯丁烷 1
1 2 3 4 5
2014年 科研热词 链转移反应 配位链转移聚合 聚烯烃 端基功能化 活性聚合 推荐指数 1 1 1 1 1
推荐指数 2 2 2 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
2010年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24
科研热词 推荐指数 甲亚胺叶立德 2 螺环丙基 1 螺杂环 1 茚二酮 1 膦叶立德 1 膦亚胺 1 胂叶立德 1 细菌生物膜 1 立体选择性合成 1 立体和区域选择性 1 氮杂wittig反应 1 氨基乙基富勒烯吡咯烷 1 氧化吲哚 1 杂环 1 噻唑并[3 1 合成 1 叶立德 1 六氢吡嗪 1 n取代3,4-富勒烯吡咯烷 1 l 1 4-羟甲基-2(5h)-呋喃酮 1 3-偶极环加成 1 2-a]嘧啶 1 1,3-偶极环加成 1
2008年 序号 1 2 3 4 5 6 7 8 9 10 1基苯甲醛 合成工艺 合成 主链链端功能化 c60
《有机化学》(第四版)第七章 卤代烃(习题答案)
第七章卤代烃相转移催化反应邻基效应思考题P235 习题7.1 用普通命名法命名下列各化合物,并指出它们属于伯、仲、叔卤代烷中的哪一种。
(1) (CH3)3CCH2Cl (2) CH3CH2CHFCH3(3) CH2=CHCH2Br解:(1) 新戊基氯(伯卤代烷) (2) 仲丁基氟(仲卤代烷) (3) 烯丙基氯(伯卤代烷) 习题7.2 用系统命名法命名下列各化合物,或写出结构式。
(1)CH3CHCHCH2CHCH3CH3CH3Cl2,3-二甲基-5-氯己烷(2)CH3CHCH2C CHCH3CH3ClClCl2-甲基-3,3,5-三氯己烷(3) BrCH2CH2CHCH2CH2CH3C2H53-乙基 -1-溴己烷(4) CH3CH2CHCH2CH3CH2Cl3-氯甲基戊烷(5) Cl1-环戊基-2-氯乙烷或 氯乙基环戊烷(6)CH3Cl1-甲基-1-氯环己烷(7) CH3CH3CH2Cl1,1-二甲基-2-氯甲基环戊烷(8)Cl1-氯双环[2.2.1]庚烷(9)CH 3CH CH 2CH 2BrCH 3异戊基溴 (10)CH 3CH 2CH 2CH 3H Br(R)-2-溴戊烷P236 习题7.3 命名下列各化合物:(1) Cl 2CHCH=CH 23,3-二氯-1-丙烯(2) CH 3CHCH=CHCH 3Cl4-氯-2-戊烯(3)CH 3Br1-甲基-4-溴-2-环戊烯(4)BrCl 1-氯-4-溴苯(5)CH=CHCH 2CH 2Br 1-苯-4-溴-1-丁烯(6)CH 2CH=CH 2ClBr2-氯-4-溴烯丙基苯3-(2-氯-4-溴苯基)-1-丙烯P236 习题7.4 写出下列各化合物的构造式或结构式:(1)4-溴-1-丁烯-3-炔CH 2=CH C CBr(2) 反-1,2-二氯-1,2-二苯乙烯C=C Cl ClPhPh(3)对氯叔丁苯ClC(CH 3)3(4)-溴 代乙苯CHCH 3BrP239 习题7.5 试预测下列各对化合物哪一个沸点较高。
第三章 反应历程
烷烃在超酸如SbF5-FSO3H的作用下,可 产生烷基正离子。
(CH3)3C-H SbF5-FSO3H (CH3)3C .SbF5-FSO3 + H 2
•质子或带电的基团与双键加成产生
H3C C H CH2 + HBr H3C H3C H C Br H C CH3 + Br
CH3
O
H+ OH
•芳环上的亲电取代反应产生
• 如果邻近的原子具有未共享电子对时,由于电子-电子的排斥 作用,降低了碳负离子的稳定性 。 • 简单烷基碳负离子的稳定性:甲基 > 一级 > 二级 > 三级。
• 杂化作用
一般来讲,C-H键中的碳原子s成分愈多,则愈容易以质子释放 出。 这是由于杂化轨道的s成分增加,减小了他的方向性和重叠 程度,因此酸性顺序为: 炔烃 > 烯烃 > 烷烃
(1)中间体离析
RCONH2+ NaOBr RNH2
离析了中间体RCONHBr
O RCONH2 + NaOBr R C N Br H2O NaOH H O R C N
R-N=C=O
RNH2 + CO2
(2)中间体捕获
H3C Cl + O H3C LiTMP THF, Heat CH3 CH3 O
LiTMP
按键的断裂方式 离子型反应:化学键按异裂方式断裂成 两个离子 自由基反应:化学键均裂成两个单电子 的自由基 协同反应:反应过程中只有键变化的过渡态, 往往通过环过渡态所进行的反应, 既非离子也非自由基反应。 按反应物与生成物之间的关系 取代、加成、消除、重排、氧化还原 及各类型掺杂反应
3. 有机反应试剂的分类
5. 有机反应活性中间体
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
*supportedbytheNationalNaturalSciencesFoundationofChina(20172066)EXCERPTOFDISSERTATIONStereoselectiveYlideCyclopropanationandEpoxidation*YESongTANGYongDAIL-iXin(StateKeyLaboratoryofOrganometallicChemistry,ShanghaiInstituteofOrganicChemistry,ChineseAcademyofSciences,Shanghai200032,China)
(Received26December2002)
Abstract FocussesonthestereoselectivecyclopropanationofsulfoniumandtelluroniumallylidewithMichaelacceptors.Threestrategies(additive,chiralauxiliaryorchiralreagent)weredevelopedtoimprovethediastereoselectivityorenantioselectivityoftheylidecyclopropanationreactions.Somepreliminaryre-sultsofepoxidationreactionofsulfoniumallylidewerealsoincluded.Keywords ylide,cyclopropanation,epoxidation,diastereoselectivity,enantioselectivityCLC O62
Theoccurrenceofvinylcyclopropanesubunitinmanynaturalandsyntheticbiologicallyactivecompounds[1],aswellasitsutilityasasyntheticintermediate[2],haspromotedmanystrategiesforitsconstruction.Inviewofthediff-icultyassociatedwiththeregioselectivity,diastereoselectivity(cis/trans)andenantioselectivity,thehighlyselectivesynthesisofopticallyactivemultisubsitutedvinylcyclopropanesinonestepremainsachallengingproblem[3].1 Switchingofstereochemistry:DramaticeffectofHMPAonthestereoselectivityofthecyclo-propanationreactionoftelluroniumallylideswithA,B-unsturatedestersandamidesHuang,etal.reportedthatthetelluroniumallylideswerereadilyavailableandreactedwithA,B-unsaturatedes-terstoprovidethevinylcyclopropanederivativesinhighyieldswithhighstereoselectivity[4].Interestingly,thestereos-electivityofylidecyclopropanationcouldbecontrolledbythechoiceofthebaseusedfortheformationofylide(equa-tion1).
WhenKHMDSisusedasthebase,thiscyclopropanationreactionissubjectedtothermodynamiccontrolandcis-isomer2isthemajorproduct.Inthepresenceoflithiumsalts,however,thereactionmayproceedviaachelatingsix-memberedringtransitionstate,whichisformedbycoordinationoflithiumionwithcarbonyloxygenandylidiccarban-ionsimultaneously(TSAinChart1).Thiscoordinationcanchangethestereochemicalcourseofthereaction.Thismechanisticinsightsuggestedthatitispossibletotunethestereoselectivityofsuchreactionsbyinhibitionofthecoor-
第20卷第3期2003年9月中国科学院研究生院学报JournaloftheGraduateSchooloftheChineseAcademyofSciencesVol.20 No.3Sept. 2003dinationinsitu.Chart1
HMPAisahighlypolaraproticsolventwhichcoordinateswelltothelithiumion[5].Asexpected,silylatedte-lluroniumallylide4,whichwasgeneratedinsitufromthecorrespondingtelluroniumsalt3andLDA,reactedwithmethylcinnamatetoaffordtrans-2-pheny-ltrans-3-((trimethylsilyl)vinyl)cyclopropylesterT5ainhighyieldwithhighselectivityintheabsenceofHMPA.Thesamereactionprovidedtrans-2-pheny-lcis-3-((trimethylsilyl)vinyl)cyclo-propylesterC5ainthepresenceofHMPA(Scheme1).TheabilityofHMPT,TMEDA,PMDETAand12-crown-4toaffectthestereochemicalcoursewerealsostudied.Scheme1
FurtherstudiesshowedthattheamountofHMPAusedinthisreactionalsoinfluencedthestereoselectivityandtheyield.ThegeneralityofthistuningreactionwasestablishedbyinvestigatingavarietyofA,B-unsaturatedcarbonylcom-poundsassubstrates.EitherB-ary-lsubstitutedorB-alkylsubstitutedA,B-unsaturatedestersoramideswereused,thesereactionsproceededsmoothly.HMPA,likeaswitchofstereochemistry,couldplayacrucialroletotunethestereoselecttivityofthesecyclopropanationreactions(equation(2)).
Theswitch-likemethodforthestereocontrolofylidecyclopropanationprovidesafacilemeansforthesynthesisofthetwogeometricalisomersofamultifunctionalized3-vinylcyclopropanederivatives[6].2 HighlyDiastereoselectivesynthesisofvinylcyclopropanederivativeswith(-)-8-phenylmen-tholaschiralauxiliaryItwasreportedthat(-)-8-phenylmentholisapowerfulchiralauxiliaryinMichaeladditionreaction[7].The
第3期YESong,etal:StereoselectiveYlideCyclopropanationandEpoxidation377 firststepofylidecyclopropanationisusuallyconsideredtobeaMichaeladditionstep,sowecarriedouttheasymmet-ricalylidecylcopropanationwith(-)-8-phenylmentholasachiralauxiliary.Itwasfoundthatsilylatedtelluroniumallylidecouldreactwith(-)-8-phenylmenthylA,B-unsaturatedesterstoaffordvinylcyclopropaneswithhighdiastere-oselectivityinhighyields.Thescopethesubstanceswasalsoinvestigated.ItwasfoundavarietyofA,B-unsaturatedesterscanreactsmoothlytoaffordtheproducts(equation(3)).
Basedonthedifferentreactionresultswith(-)-menthyl,(-)-8-(2-naphthyl)menthylor(-)-8-phenylmen-thylasthechiralauxiliary,itwasproposedthatthepossibleP-stackingeffectbetweenthearylofchiralauxiliaryanddienylgroupofA,B-unsaturatedestersisinvolvedinthediastereoselectivityofthesereactions(Chart2).Chart2
