食品化学第三章蛋白质Pptppt文档
食品化学要点分析(蛋白质)

蛋白质是构成生物体的基本物质。
酶是蛋白质简单蛋白质(homoproteins)在细胞中未经酶催化改性的蛋白质。
仅含有氨基酸。
结合蛋白质(conjugated proteins)或杂蛋白质(heteroproteins)经过酶催化改性的或与非蛋白质组分复合的蛋白质。
含有氨基酸和其它非蛋白质化合物。
辅基(prosthetic proteins)结合蛋白中的非蛋白质组分。
球蛋白(Globular proteins)以球状或椭圆状存在的蛋白质,由多肽链自身折叠而成;纤维状蛋白(Fibrous proteins)棒状分子,含有相互缠绕的线状多肽链大多数酶是球状蛋白,而纤维状蛋白总是起着结构蛋白的作用。
蛋白质的生物功能:酶、结构蛋白、收缩蛋白(肌球蛋白、肌动蛋白、微管蛋白)、激素(胰岛素、生长激素)、传递蛋白(血清蛋白、铁传递蛋白、血红蛋白)、抗体(免疫球蛋白)、储藏蛋白(蛋清蛋白、种子蛋白)、保护蛋白(毒素和过敏素)。
食品蛋白质:易于消化、无毒、富有营养、显示功能特性、来源丰富各种蛋白质的含氮量很接近,其平均值为16%。
组成蛋白质的氨基酸除了脯氨酸和羟脯氨酸外都是α-氨基酸。
都是L-型的α-氨基酸中性氨基酸(一氨基,一羧基)Gly(甘),Ala(丙),V AL(缬), LEU(亮), ILE(异亮)酸性氨基酸(一氨基,二羧基)——ASP(天冬),GLU(谷)碱性氨基酸(二氨基,一羧基)——ARG(精),L YS(赖)含羟氨基酸(一氨基,一羧基,一羟基)——SER(丝),THR(苏)含硫氨基酸(一氨基,一羧基,一巯基)——CYS(半胱氨酸),MET(蛋)含环氨基酸(一氨基,一羧基,一环)——PHE(苯丙),TRP(色), HIS(组),PRO(脯),TYR 非极性氨基酸或疏水性氨基酸。
含有脂肪族(Ala、Ile、Leu、Met、Pro和Val)和芳香族侧链的氨基酸(Phe,Trp)是疏水的。
在pH7时(生理条件下)带正电荷的极性氨基酸(碱性氨基酸),如L YS,ARG,HIS。
食品化学_ 蛋白质_ 蛋白质变性因素分析_

适度的热处理引起的蛋白质变性
蛋白质的一些功能性质发生变化
破坏食品组织中酶,有利食品的品质 促进蛋白质消化 破坏抗营养因子和有毒性的蛋白质
• yT是一种嗜热真细菌,能在70~ 75℃生长。该菌是1969年从美国黄 石国家森林公园火山温泉中分离的。
• 一般认为,温度越低,蛋白质稳定性愈 高
• 蛋白质显示最高稳定性的温度取决于极 性和非极性相互作用对蛋白质稳定性贡 献的相对值。
• 肌红蛋白和突变型噬菌体T4溶菌酶分别在30 度和12.5度时显示最高稳定性,低于0度时, 两种蛋白遭受冷诱导变性。
影响食品的安全性
加热不当
蛋白质的AA分解
含S的AA产生H2S
Fe,Sn
肉制品加热变色 的主要原因
FeS(黑) SnS(蓝)
硫化斑
AA与还原性物质(糖)发生褐变
• 40-80°C;0.1Mpa
高压诱导:25°C
• 100-1200Mpa • 压力诱导转变的中点:400-800Mpa • 主要原因: 蛋白质的柔性和可压缩(空穴) • 压力诱导的蛋白质是高度可逆的 • 食品加工手段:灭菌和蛋白质的凝胶作用(肌肉纤维嫩化)
3.剪切和变性
• 机械剪切 • 空气泡的并入、蛋白分子吸附至气-液界面
• 在干燥状态,蛋白质具有静止的结构,多肽链段的移动受到了限制。 • 当水分含量增加,水合作用和水部分穿透至蛋白质结构的空洞表面,导致蛋白质的肿胀。
蛋白质的肿胀提高了多肽链的移动性和柔性。
糖类和蛋白质(共34张PPT)

A.甲醛溶液 C.饱和Na2SO4溶液
B.CuSO4溶液 D.浓硫酸
5. 下列实例中利用了蛋白质变性的是( A )
①利用过氧乙酸对环境、物品进行消毒;
②利用高温、紫外线对医疗器械进行消毒;
③蒸煮鸡蛋食用;
④松花蛋的腌制;
⑤用蛋白质灌服重金属中毒的病人。
A.全部
B.①②③④
C.①②③
D.①②
A.麦芽糖和蔗糖
B.C2H6与C3H8 C. O2与O3 D.CH3-CH2-CH2-CH3 与
1.单糖——葡萄糖、果糖(C6H12O6)
(1)物理性质:白色晶体,有甜味,能溶于水。
(2)组成与结构 分子式:C6H12O6 最简式:CH2O 结构简式:CH2OH(CHOH)4CHO (葡萄糖)
CH2 — CH — CH — CH — CHCHO OH OH OH OH OH (葡萄糖)
(3)向3试管滴加少量硫酸铜溶液; 变性 蛋白质凝聚,加水沉淀不溶解。
(4)向4试管中加入浓硝酸溶液;
蛋白质呈黄色。
蛋白质的显色反应
1.水解 蛋白质在蛋白酶的作用下水解生成各种_氨__基__酸_。
2.显色反应:——能用于检验蛋白质的存在。 有些蛋白质遇浓硝酸呈黄色
3.盐析: ——是可逆的物理变化 向蛋白质溶液中加入浓的盐溶液 (轻金属盐) , 会使蛋白质的溶解度降低而从溶液中析出。 注意:要分清轻金属盐是少量还是浓溶液,少 量促进溶解,浓溶液蛋白质析出。 盐析后继续加水,析出的蛋白质能够溶解, 因为蛋白质没有失去生理活性。
何提供能量?
提示:工业上通常用淀粉催化水解法制取葡萄糖。
催化剂
(C6H10O5)n+ nH2O
nC6H12O6
《蛋白质结构》PPT课件
位于结构域之间,有利 于活性中心与底物结合
12
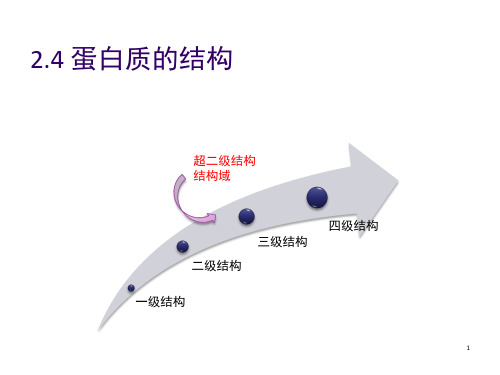
4、蛋白质的三级结构
多肽链在二级结构、超二级结构和结构域等结构 层次的基础上,组装而成的完整结构单元。
三级结构的形成使肽链中所有的原子都达到空间 上的重新排布。
举例:1963年Kendrew等通过鲸肌红蛋白的x-射 线衍射分析,测得了它的空间结构
4
(1)α-螺旋(α-helix)
a-螺旋:是多肽链沿长轴卷曲 而成的有规则的螺旋型构象。
要点 每个螺旋含3.6个AA残基,螺距
0.54nm,螺旋直径0.5nm,每个残 基绕轴旋转100o ; 螺旋体中所有氨基酸残基R侧链 都伸向外侧
5
相邻螺旋间(第n个氨基酸残基C=O的氧与第n+4 个氨基酸残基的-NH氢之间)形成平行于螺旋轴 的氢键,肽链上所有的肽键都参与氢键的形成
20
(三)蛋白质的变性
概念:天然蛋白质受物理或化学因素的影响,分 子内部原有的高度规则性的空间排列发生变化, 致使其原有性质和功能发生部分或全部丧失。
变性的因素及作用机制
因素
作用机制
热
破坏氢键
酸碱
破坏盐键
醇
分子进入肽链间空隙,破坏次级键
ቤተ መጻሕፍቲ ባይዱ
高浓度尿素 破坏氢键
盐酸胍
破坏氢键,使-SH暴露
21
变性后的特征
谷氨酸、丝氨酸 8、请列举氨基酸的化学性质,并简述其应用。
作业:P61 3、4
28
3
2、蛋白质的二级结构
蛋白质的二级结构:蛋白质分子中多肽链本身折叠和 盘绕的方式,它仅涉及肽链中主链的构象,并不涉及 侧链的构象。
蛋白质主链的折叠是由氢键维系的有规则的重复构象 组成
食品化学绪论-PPT课件

法国化学家拉瓦锡(Antoine Larent Lavoisier)
用平衡反应式表示了发酵过程; 发表了关于水果中含有机酸的文章。
法国化学家尼古拉斯(Nicolas) 用灰化的方法测定了植物中的矿物质含量; 首先完成了乙醇的精确化学分析。
第三阶段 成熟时期
20世纪初中期
食品工业成为重要工业,大部分食品的物质组成已被化学 家、生物学家和营养医学家的研究所探明,为食品化学的 建立积累了大量的素材;
食品工业的不同行业创建自身的化学基础,粮油化学、果 蔬化学、乳品化学、糖业化学、肉禽蛋化学、水产化学、 添加剂化学、风味化学等分支学科的崛起,为系统的食品 化学学科的建立奠定了坚实的基础;
的 化
风味物质
学
激素
组
有毒物质
成
天然来源的添加剂
食品添加剂 人工合成的添加剂
非天然成分
加工中不可避免的污染物质
污染物质 环境污物质
3、食品化学
化学组成
成分结构
化
理化性质
学
特殊性质
分
营养价值
子
安全性
水
平
各种变化
影响
食品化学:是从化学角度和分子水平 研究食品的组成、结构、理化性质、 生理和生化性质、营养与功能性质以 及它们在食品储藏、加工和运销中的 变化及其对食品品质和安全性影响的 学科。
第一阶段 早期研究
法国化学家盖-吕萨克(Gay-Lussac) 泰纳尔(Thenard)
发明定量测定干燥植物C、N、H的第一个方法
英国化学家戴维(Davy)
食品化学之蛋白质讲学

2.引起蛋白质变性的因素
3.3 蛋白质的功能性质
功能性质:
在食品加工、保藏、制备和消费期间影响
蛋白质在食品体系中的性能的那些蛋白质的物
理和化学性质。
水化性质、表面性质、结构性质、感观性质
1)蛋白质的胶凝作用
是指变性的蛋白质分子聚集并形成有序的蛋白质网络结构过程。
按形成条件的差异,食品蛋白凝胶可分为以下四种类型:
麦谷蛋白 麦醇溶蛋白
面筋蛋白质中含有的化学键
氢键 :谷氨酰胺、脯氨酸和丝氨酸、苏氨酸: 水吸收能力强,有黏性。 非极性氨基酸:使蛋白相互聚集、有黏弹性 与脂肪有效结合。 二硫键:使面团坚韧。
面团的形成过程
小麦蛋白质中约80%为水不溶性的面筋蛋白:麦醇溶 蛋白和麦谷蛋白。面筋蛋白富含谷氨酰胺(超过33%)、 脯氨酸(15~20%)、丝氨酸及苏氨酸等,它们倾向于形成 氢键,使面筋蛋白有极强的水吸收能力(其吸水量为干蛋 白质重量的180%~200%),有粘性 ;含约30%的非极性氨 基酸,使水化面筋蛋白质相互聚集、有粘弹性,并与脂肪 有效结合;含2-3%的半胱氨酸、胱氨酸,易于形成链内、 链间二硫键,这是面团物质产生坚韧性的原因。 当面粉和水混合并被揉搓时,面筋蛋白开始水化、定 向排列和部分展开,促进了分子内和分子间二硫键的交换 反应并增强了疏水相互作用,当最初面筋蛋白质颗粒变成 薄膜时,二硫键也使水化面筋形成了黏弹性的三维蛋白质 网络,于是便起到了截留淀粉粒和其它面粉成分的作用, 从而形成面团结构。
Chapter 5 氨基酸、肽、蛋白 质
3.1 蛋白质的结构
1、蛋白质的元素组成
所有蛋白质均含有 : C 50%-55% H 6%-8% O 20%-23% N 15%-17% 某些蛋白质含有: S 0.3%-2.5% 以及P 少数蛋白质含有:Fe, Cu,Zn,Mo和I等元素 蛋白质中N的平均含量约16%,因此食物与 饲料中蛋白质的含量可以通过凯氏定N(Kjeldahl 法)进行大致估计。
实验三 蛋白质的功能性质
食品化学实验三蛋白质的功能性质1.实验原理各种蛋白质具有不同的功能性质,如牛奶中的酪蛋白具有凝乳性,在酸、热、酶(凝乳酶)的作用下会沉淀,用来制造奶酪。
酪蛋白还能加强冷冻食品的稳定性,使冷冻食品在低温下不会变得酥脆。
面粉中的谷蛋白(面筋)具有粘弹性,在面包、蛋糕发酵过程中,蛋白质形成立体的网状结构,能保住气体,使体积膨胀,在烘烤过程中蛋白质凝固是面包成型的因素之一。
肌肉蛋白的持水性与味道、嫩度及颜色有密切的关系。
鲜肉糜的重要功能特性是保水性,脂肪粘合性和乳化性。
在食品的配制中。
选择哪一种蛋白质,原则上是根据它们的功能性质。
通过本实验可以定性地了解上述几种蛋白质的功能性质。
2.试剂和仪器⑴实验样品:面粉、牛奶、瘦肉。
⑵乳酸溶液。
⑶焦磷酸钠。
⑷铰肉机。
⑸100mL小烧杯。
⑹滴管。
⑺大号塑料碗。
⑻10mL移液管。
⑼5mL移液管。
⑽玻璃棒。
⑾蒸锅。
3.实验步骤⑴酪蛋白的凝乳性在小烧杯中加入15ml牛奶,遂滴滴加50%的乳酸溶液,观察酪蛋白沉淀的形成,当牛奶溶液达到pH=4.6时(酪蛋白的等电点),观察酪蛋白沉淀的量是否增多。
⑵面粉中谷蛋白的粘弹性分别将20g高筋面粉和低筋面粉加9ml水揉成面团,将面团不断在水中洗揉,直至没有淀粉洗出为止,观察面筋的粘弹性,并分别称重,比较高筋粉和低筋粉中湿面筋的含量。
⑶肌肉蛋白质的持水性将新鲜瘦猪肉在搅肉机中搅成肉糜,取10g肉糜三份,分别加入2ml水,4ml水以及4ml含有20mg焦磷酸钠(或三聚磷酸钠)的水溶液,顺一个方向搅拌2分钟,放置半小时以上,观察三份肉糜的持水性、粘着性。
蒸熟后再观察其胶凝性。
4.思考题⑴牛奶败坏为何出现沉淀?沉淀是什么?⑵在面制品的加工中如何选择使用高筋粉和低筋粉?⑶为什么加入焦磷酸钠会增加肉的持水性?。
