第八章 氧化还原反应 1-2
氧化还原反应ppt课件

根据下列反应判断有关物质还原性强弱的顺序 A
H2SO3 + I2 + H2O === 2HI + H2SO4
2FeCl3 + 2HI === 2FeCl2 + 2HCl + I2 A.H2SO3 > I- > Fe2+ B.I- > Fe2+ > H2SO3 C.Fe2+ > I- > H2SO3 D.Fe2+ > H2SO3 >I-
电子的得失、共用电子对的偏移
氧化反应 还原反应 二者关系
元素化合价
电子的转移
升高
失电子(偏离)
降低
得电子(偏向)
二者是同时进行的
1.下列变化过程中,元素失去电子的是( D )
A.MnO2 → Mn2+
B.CuO → CuCl2
C.Ag+ → Ag2O
D.Sn2+ → Sn4+
2.下列说法正确的是( D ) A.有得、失氧的反应才是氧化还原反应 B.氧化还原反应中,氧化反应与还原反应是先后进行的 C.有电子得失的反应才是氧化还原反应 D.凡是有化合价升降的反应,都是氧化还原反应
高温
C + H2O ===== H2 + CO
CuO + H2 ==== Cu + H2O
物质 CuO
C H2O
C CuO H2
氧化(还原)反应 还原 氧化 还原 氧化 还原 氧化
化合价变化 降低 升高 降低 升高 降低 升高
化合价升高 —— 氧化反应
化合价降低 —— 还原反应
化合价升高,发生氧化反应
Zn + 2HCl ==== ZnCl2 + H2↑
化合价
得失电子
氧化还原反应 课件

化合价降低 被还原 得到2xe-
Cl2-化合价降低,得到电子 Cl2-是氧化剂 Cl2-具有氧化性 Cl2-发生还原反应 Cl2-被还原
与Cl2对应的产物-NaCl是还原产物
2、还原剂:失去电子(或电子对偏离)的物质
化合价升高 被氧化 失去2xe-
2mol HNO3被还原
部分作还原剂
5mol HCl被氧化
4、电子守恒(化合价升降守恒)
氧化还原反应中有物质得电子,必有物质失电子; 且得电子总数等于失电子总数。
氧化还原反应中有物质元素化合价上升,必有 物质元素化合价降低;且化合价升高总值必等于 化合价降低总值。
5、氧化还原反应在生产、生活中的应用
2HC氧lO =化2H剂Cl,+ O还2 ↑ 原剂为同种物质中的不同种元素
拓 展 与 提
(3)
(4)2CHl2同2S+ 种+H2SO元O2=素=HC3既lS +被+H2CH氧lO2O化,又被(还归原中反应)
高
3Cu +8HNO3(稀)= 3Cu(NO3)2 + 2NO↑+ (4H歧2O化反应)
(5)KC部lO3分+ 作6HC氧l =化K剂Cl + 3Cl2 + 3H2O
化合价升高 被氧化 失去2xe-
2 Na0 +C0l2 =点=燃=
2+N1aC-l1
二
.
氧
化合价降低 被还原 得到2xe-
化
e-
剂 和
还原剂
氧化剂 还
失去电子
得到电子
原
(或电子对偏离)
(或电子对偏向) 剂
第八章 氧化还原反应

第八章氧化还原反应第一节基本概念有电子得失或电子转移的反应,被称为氧化还原反应。
氧化:还原:Zn2+ Zn - 2eCu Cu2+ + 2eZn + Cu2+Zn2+ + Cu氧化剂:还原剂:Cu2+Zn半反应①单质中,元素的氧化值为零。
②在单原子离子中,元素的氧化值等于该离子所带的电荷数 。
③在大多数化合物中,氢的氧化值为 +1;只有在金属氢化物中氢的氧化值为 -1。
④通常,氧在化合物中的氧化值为-2;但是在过氧化物中,氧的氧化值为-1,在氟的氧化物中,如OF 2 和O 2F 2中,氧的氧化值分别为+2和+1。
确定氧化值的规则: 氧化值:是指某元素的一个原子的荷电数,该荷电数是假定把每一化学键中的电子指定给电负性更大的原子而求得的。
⑤中性分子中,各元素原子的氧化值的代数和为零 ,复杂离子的电荷等于各元素氧化值的代数和。
第二节氧化还原反应方程式的配平配平原则:① 电荷守恒:氧化剂得电子数等于还原剂失电子数。
② 质量守恒:反应前后各元素原子总数相等。
配平步骤:①用离子式写出主要反应物和产物(气体、纯液体、固体和弱电解质则写分子式)。
②分别写出氧化剂被还原和还原剂被氧化的半反应。
③分别配平两个半反应方程式,等号两边的各种元素的原子总数各自相等且电荷数相等。
④确定两半反应方程式得、失电子数目的最小公倍数。
将两个半反应方程式中各项分别乘以相应的系数,使得、失电子数目相同。
然后,将两者合并,就得到了配平的氧化还原反应的离子方程式。
有时根据需要可将其改为分子方程式。
例1:配平反应方程式+)42−+−−++=+10e10H 5SOO 5H 5SO223+−+−+=++O8H 2Mn 10e 16H 2MnO 224+−+−+=++O 4H Mn 5e 8H MnO ②224①−+−−++=+2e2H SO O H SO 24223②③①×2+②×5得O3H SO K 6MnSO 22424++=O 3H 5SO 2Mn 6H 5SO 2MnO 2242234++=++−++−−+−−−++Mn SO SO MnO ①2242343H SO SO 5K 2KMnO 4324++2第三节电极电势一、原电池利用自发氧化还原反应产生电流的装置。
有机化学课件:第8章 氧化还原反应

还原态物质的还原能力就越弱; 氧化态物质的氧化能力越弱,其对应的 还原态物质的还原能力就越强。
2 MnO4 + 10 Cl + 16 H+ = 2 Mn2+ + 5Cl2 + 8 H2O
Cl Cl2
MnO4 H Mn2 H2O
氧化值是人为的定义;
氧化值与化合价的区别
化合价:表示元素的原子结合成分子时,原子 数目的比例关系。从分子结构来看,化合价是 指形成共价化合物时所形成的共价键的数目。 只能是正整数。
CH4 、CH3Cl 、CH2Cl2 、CHCl3 CCl4 化合价均为4 氧化值分别为:-4、-2、0、+2、+4
二、氧化还原反应
氧化半反应
还原半反应
电池反应:原电池中发生的总的氧化还原反应 Zn + Cu2+ Cu + Zn2+
盐桥的作用
盐桥:饱和KCl溶液+琼胶,其中离子可自由迁移。
负极: Zn Zn2+ + 2eZn2+过剩,显正电性,阻 碍半反应继续进行,盐桥 中的Cl-中和过量的正电荷。
正极的情况与之相反。
盐桥的作用
元素的氧化值发生变化的反应
Cu2++Zn
Zn2++Cu
在氧化还原反应中, 氧化(oxidation):元素的氧化值升高的过程
还原(reduction):氧化值降低的过程 氧化剂(oxidant): 氧化值降低 的物质 还原剂(reductant):氧化值升高的物质
Cu2+ + Zn
氧化剂 还原剂
第八章氧化还原和电极电位 - 第八章氧化还原反应

2Fe3+ +Sn4+
Cu+ FeCl3
CuCl(s)+ FeCl2
28
(二) 原电池组成式
电池组成:电极、盐桥(或多空隔膜)、电解质 溶液及导线。
电池组成式(电池符号)表示法的统一规定: 1. 半电池中,“|”表示相界面,同一相的不同物 质用“,”隔开,用“||”表示盐桥。负极写在左边, 正极写在右边。
化物中为-1,如在NaH、CaH2中。 (5)卤族元素。氟的氧化值在所有化合物中为-1;
其它卤原子的氧化值在二元化合物中为-1,但在
卤族的二元化合物中,列在周期表中靠前的卤原
子的氧化数为-1,如Cl在BrCl中;
在含氧化合物中按氧化物决定,如ClO2中Cl的氧 化值为+4。
(6)电中性的化合物中所有原子的氧化值的和为零。
由正极反应和负极反应所构成的总反应,称
为电池反应(cell reaction)。
Zn + Cu2+
Cu + Zn2+
27
电池反应就是氧化还原反应: 正极反应--还原半反应; 负极反应--氧化半反应。
从理论上讲:任一自发的氧化还原反应都可 以设计成一个原电池。
思考 下列反应如何设计成原电池呢?
一、氧化值
(一) 氧化值的定义 氧化值是某元素一个原子的表观荷电数,这种
荷电数是假设把每一个化学键中的成键电子指定 给电负性较大的原子而求得。
电负性(electronegativity):表示一个原子在 分子中吸引成键电子能力的量度。一般用X表示 (无单位)。p188
3
注:分子中元素的氧化数取决于该元素成键电 子对的数目和元素的电负性的相对大小。
1-2 氧化还原反应
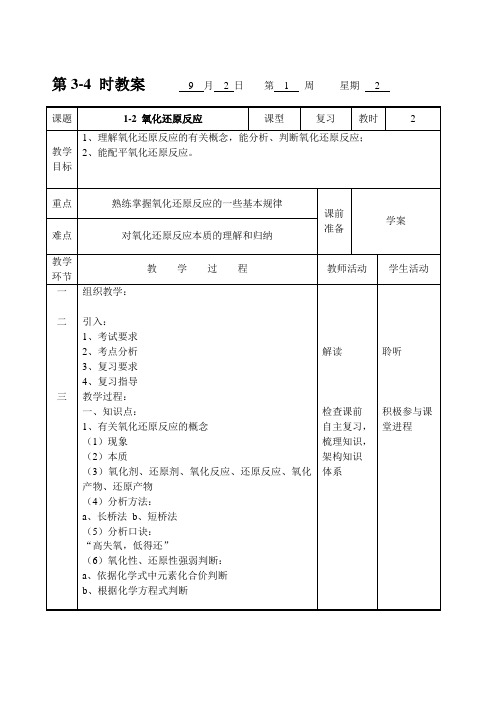
教学过程:
1、知识点:
1、有关氧化还原反应的概念
(1)现象
(2)本质
(3)氧化剂、还原剂、氧化反应、还原反应、氧化产物、还原产物
(4)分析方法:
a、长桥法b、短桥法
(5)分析口诀:
“高失氧,低得还”
(6)氧化性、还原性强弱判断:
a、依据化学式中元素化合价判断
b、根据化学方程式判断
解读
检查课前自主复习,梳理知识,架构知识体系
(4)【例题4】【练习1-2】
2、巩固练习1-4
3、课堂总结分Leabharlann 例题点评练习归纳方法
聆听分析
独立练习
小结心得
课堂小结
课外作业
见同步练习
板书设计
1-2氧化还原反应
1、有关概念
1、现象、本质
2、重要概念
3、分析方法
4、分析口诀
2、配平
1、依据
2、方法、步骤
教后札记
课题
1-2氧化还原反应
课型
复习
教时
2
教学目标
1、理解氧化还原反应的有关概念,能分析、判断氧化还原反应;
2、能配平氧化还原反应。
重点
熟练掌握氧化还原反应的一些基本规律
课前准备
学案
难点
对氧化还原反应本质的理解和归纳
教学环节
教学过程
教师活动
学生活动
一
二
三
组织教学:
引入:
1、考试要求
2、考点分析
3、复习要求
聆听
积极参与课堂进程
第3-4时教案9月2日第1周星期2
2、配平
(1)依据:a、原子守恒b、电子守恒c、电荷守恒
氧化还原反应ppt课件
+2
0 高温 0
+4
2CuO + C = 2Cu + CO2
有氧参与的反应
化合价升高,被氧化,发生氧化反应
一、氧化还原反应
凡有元素化合价升降的化学反应都是氧化还原反应。
化合价降低,被还原,发生还原反应
+1
0
0
+2
无氧参与的反应
化合价升高,被氧化,发生氧化反应
(2019·抚顺高一期末)下列化学反应中,不属于氧化还原反应的是
解析 A项,氧化性:Z2>W2,不符合题给信息,反应不能发生; B项,氧化性:Z2>X2,符合题给信息,反应能发生; C项,氧化性:Y2>W2,不符合题给信息,反应不能发生; D项,氧化性:X2>Z2,不符合题给信息,反应不能发生。
二、氧化性、还原性强弱比较
(3)根据反应的难易(反应条件)比较下列物质的氧化性强弱
√A.CaCO3+2HCl===CaCl2+CO2↑+H2O
B.Fe+CuSO4===Cu+FeSO4 高温
C.Fe2O3+3CO===== 2Fe+3CO2 D.2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
判断正误
(1)氧化还原反应中一定有氧元素的得失(× ) (2)氧化还原反应中得电子的物质发生还原反应(√ ) (3)氧化还原反应中所有元素的化合价都一定发生变化(× ) (4)一个反应中可以只有元素化合价升高,而无元素化合价降低(× ) (5)有单质参加的反应一定是氧化还原反应(× )
②Fe+S
△ =====
FeS
可判断氧化性:氯气__>__硫。
1.下列微粒:①Al3+ ②Cl- ③N2 ④S2- ⑧MnO-4 。既具有氧化性又具有还原性的是
第八章 氧化还原反应与电极电位2014
还原(reduction): 得到电子,氧化数降低的过程 还原剂: 提供电子的物质 ( 电子供体), 氧化剂: 得到电子的物质 (电子受体),
失2e-
例2:
Zn0 + Cu2+SO4 = Zn2+ SO4 + Cu0 得 2e-
还原剂: Zn 电子供体,发生氧化反应
+ SO42- + H2O
(1) (2)
Cr2O72- + H+
Cr3+ + H2O
SO32-+ H2O
Cr2O72- + 14H+
SO42- + H+
2Cr3++ 7H2O
SO32-+ H2O
+ + 6eCr2O7214H +
SO42- + 2H+
2Cr3+ + 7H2O
(3)
SO32-+
H2O - 2e-
氧化剂Cu2+ : Cu2+ + 2e
氧化型物质
Cu 还原半反应
还原型物质
•意义:氧化还原半反应反映了化学变化的实际过程
半反应的通式: (还原半反应)
氧化型物质(Ox) + n e 2. 氧化还原电对
还原型物质(Red)
同一元素原子氧化型物质和还原型物质构成
形式:氧化型 / 还原型 (Ox / Red) Zn2+/ Zn, Cu2+/Cu
1. 单质中原子的氧化值为零;
H2 (0); O2 (0)
2. 单原子离子中原子的氧化值等于离子的电荷。
无机化学试题
第八章氧化还原反应与氧化还原滴定习题1.是非判断题1-1氧化数在数值上就是元素的化合价。
1-2 Na2S,Na2S2O3,Na2SO4和NaS4O6中,硫离子的氧化数分别为-2,2,4,6和+5/2 。
1-3 NH4+中,氮原子的氧化数为-3,其共价数为4。
1-4氧化数发生改变的物质不是还原剂就是氧化剂。
1-5任何一个氧化还原反应都可以组成一个原电池。
1-6两根银丝分别插入盛有0.1 mol·L-1和 1 mol·L-1 AgNO3溶液的烧杯中,且用盐桥将两只烧杯中的溶液连接起来,便可组成一个原电池。
ϕ值大的电对应是正极,而θϕ值小的电对应为负极。
1-7在设计原电池时,θ1-8原电池中盐桥的作用是盐桥中的电解质中和两个半电池中过剩的电荷。
1-9半反应NO3- + H+ + e⇔NO + H2O 配平后,氧化态中各物质的系数依次为1,4,3。
1-10在碱性介质中进行的反应CrO2-+Cl2+OH-⇔CrO42-+Cl-+H2O 被配平后反应生成物CrO42-的系数分别为8和2。
1-11对电极反应S2O82-+2e2SO42- 来说,S2O82- 是氧化剂被还原,SO42-是还原剂被氧化。
1-12原电池中,电子由负极经导线流到正极,再由正极经溶液到负极,从而构成了回路。
1-13金属铁可以置换CuSO4溶液中的Cu2+,因而FeCl3溶液不能与金属铜反应。
1-14标准电极电势表中的ϕθ值是以氢电极作参比电极而测得的电势值。
1-15电极电势表中所列的电极电势值就是相应电极双电层的电势差。
1-16某电对的标准电极电势是该电对与标准氢电极组成原电池时的原电池电动势。
1-17电极反应为Cl2+2e 2Cl-的电对Cl2/Cl-的Eθ=1.36V;电极反应为1Cl2+e Cl-时ϕθ(Cl2/Cl-)2=1/2×1.36=0.68V。
1-18电极电势大的氧化态物质氧化能力大,其还原态物质还原能力小。
基础化学第八章氧化还原反应和电极电位ppt课件
精选PPT课件
4
第一节 氧化还原反应
一、氧化值(氧化数 oxidation number) 1. 1970年IUPAC给出的定义是:氧化值是某
元素一个原子的表观荷电数(apparent charge number),这种荷电数是假设把每 一个化学键中的电子指定给电负性更大的 原子而求得。 例:NH3中,N的氧化值是-3,H的氧化值
⑥ 电中性的化合物中所有原子的氧化值的和为 零。多原子离子中所有原子的氧化值的和等 于离子的电荷数。
精选PPT课件
7
第一节 氧化还原反应
氧化值可为整数,也可为分数。 例: Fe3O4 中,Fe:+8/3; S4O62- 中,S:+5/2。
按确定元素氧化值6条规则的先后顺序,就 能正确确定化合物中各元素的氧化值。 例:KMnO4,先确定K,+1; 再确定O,-2; 最后确定Mn,+7。
精选PPT课件
13
第一节 氧化还原反应
三、氧化还原反应方程式的配平
例: KMnO4 + HCl → MnCl2 + Cl2 + H2O 1. 写出离子方程式
MnO4- + Cl- → Mn2+ + Cl2 +H2O 2. 根据氧化还原电对,拆成两个半反应
还原反应:MnO4- + H+ → Mn2+ + H2O
精选PPT课件
3
教学基本要求
1. 掌握电池组成式的书写,了解电极电位产生的 原因,熟悉标准电极电位概念,掌握用标准电 极电位判断氧化还原反应的方向。掌握离子— 电子法配平氧化还原反应式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电化学基础
8.2 原电池和电极电势
8.2原电池和电极电位 • 氧化还原反应和原电池的能量变化
温度计
℃
保温瓶
CuSO4
T2 T 6.5 C T1
锌粉
化学能转变为 热能
图8-1 测定 CuSO4 溶液和 Zn 反应热效应的装置
产生的热量 ΔH、动能改变 TΔS 和势能改变ΔG 可分别计算如下:
如
氧化数
HCl
H Cl +1 –1
C +4
CO2
O -2
1. 氧化数 定义 在离子化合物中,简单阳、 阴离子所带的电荷数即为该元 素原子的电荷数。
如
NaCl
CaSO4
Ca S O +2 +6 -2
Na Cl 氧化数 +1 –1
1. 氧化数
规则
(1) 在单质中,元素原子的 氧化数为零。
1. 氧化数
eZn + Cu2+ → Zn2+ + Cu
2.原电池的表示方法
负极写在左边
用“||‖表示盐桥
正极写在右边
浓度
(-)Zn | Zn2+(c1)
―| ‖
Cu2+(c2) | Cu(+)
+6 -2
-2
-2
3H2O2 + Cr2(SO4)3 + 10KOH
→ 2K CrO + 3K SO + 8H O
2 4 2 4 2
返回
氧化还原反应式配平课堂练习
(1) Cr2O7 +Fe2++H+ → Cr3++Fe3++H2O
+ → 3+ + + 3++7H Cr O + H Cr H2O +14H +6e → 2Cr 1 2 7 2O
2-
-
e- →
2-
以上即为配平的离子反应方程式
注意
在配平半反应式,如果反应物、 生成物所含氧原子数不等时, 可根 据介质的酸碱性条件来配平
半反应式 介质 多氧原子 少氧原子 一侧 一侧 酸性 加H+ 加H2O 注 意 不能出现OH-
碱性
加H2O
加OH-
不能出现H+
2) 离子-电子法
优点
1. 在配平时,无须知道元素的氧化数 2.能反映在水溶液中的氧化还原本质
-1
+5
(4)用观察法配平氧化数未改变的元 素原子数目 10HClO3+3P4+18H2O 10HCl+12H3PO4
(1)写出未配平的反应方程式 PbO +MnBr +HNO →Pb(NO ) +Br +HMnO +H O
2 2 3 3 2 2 4 2
例
(2)找出元素原子氧化数降低值与元素 原子氧化数升高值
第一节 氧化还原反应方程式的 第八章 氧化还原反应和 配平
电化学基础
8.1 氧化还原反应
8.1.1 氧化值和化合 1. 氧化数
定义
1970年国际纯粹与应用化学联合会 确定: (IUPAC) 元素的氧化数是元素的一个原子 的形式荷电数, 这个荷电数可由假 设把每个键中的电子指定给电负性 较大的原子而求得。
例
(1)写出未配平的离子反应方程式
MnO4 + SO3 →MnO4 + SO4 +OH222-
(2)将反应分解为两个半反应方程式
MnO4 → MnO4 SO3 → SO4
22-
2-
例
(2)将反应分解为两个半反应方程式
1.使半反应式两边相同元素的原子数相等 MnO4 → MnO4
2-
SO3 +
2-
物质获得电子,氧化还原的本质就是
电子的得失或转移。
8.1.3氧化还原方程式的配平
1)氧化值法
(1) 元素原子氧化数升高的 总数等于元素原子氧化 数降低的总数
(2) 反应前后各元素的原子 总数相等
配平步骤
(1)写出未配平的反应方程式 HClO3 + P4 + H2O → HCl + H3PO4
(2)找出元素原子氧化数降低值与 元素原子氧化数升高值
(-1)-(+5)=(-6) +5 0
HClO3 + P4 + H2O → HCl + H3PO4
(+5)-0=(+5)
-1
+5
(3)根据第一条规则,求出各 元素原子氧化数升降值的最小公倍数
10HClO3+3P4+H2O →10HCl+12H3PO4
[(+5)×4]×3=(+60) +5
(-6)×10=(-60) 0
MnO4 + H+ → Mn2+ SO3 → SO4
2-
2-
步骤
(2)将反应分解为两个半反应方程式
1.使半反应式两边相同元素的原子数相等 + → Mn2+ + 4H O MnO+ 8H 2 4
左边多 4个O原子,右边加 4个H2O, 左边加 8个H+
2-
SO3 + H2O → SO4 + 2H+ 右边多 1个O原子,左边加 1个H2O, 右边加2个H+
Zn(s) + Cu2+(aq)
f Hmθ (298. 15)/(kJmol1) 0 64. 8 –99. 6 Smθ (298. 15)/(Jmol1K1) 41. 6
Zn2+(aq) + Cu(s)
–153. 9 –112. 1 0 33. 2
r Hmθ (298. 15) = [(–153. 9) – 64. 8] kJmol1 = –218. 7 Jmol1 r Smθ (298. 15) = [–112. 1 + 33. 2 – (–99. 6) – 41. 6] Jmol1K1 = –20. 9 Jmol1K1 TrSmθ (298. 15) = 298. 15 K × (–20. 9) Jmol1K1 = –6. 23 kJ· mol–1 r Gmθ (298. 15) = r Hmθ (298. 15) – Tr Smθ (298. 15) = [–218. 7– (–6. 23)] kJ· mol–1 = –212. 47 kJ· mol–1
(+7)-(+2)=(+5) 0-(-1)=(+1) +4 +2 -1 +2 0 +7 PbO2+MnBr2+HNO3→Pb(NO3)2+Br2+HMnO4+H2O (+2)-(+4)=(-2)
(3) 根据第一条规则,求出各
例
元素原子氧化数升降值的最小公倍数 (+5) [(+5)+(+2)]×2=14 (+1)×2=(+2) +4 +2 -1 +2 0 +7 PbO2+MnBr2+HNO3→ Pb(NO3)2+Br2+HMnO4+H2O (-2)×7=14 (4)用观察法配平氧化数未变的元素原子数目 7PbO2+2MnBr2+14HNO3 7Pb(NO3)2+2Br2+2HMnO4+6H2O
电负性
是指分子中元素原子吸引电子的能力
元素原子吸引电子能力越大,其电负性越大
元素原子吸引电子能力越小,其电负性越小
如: H : Cl 共用电子对靠近Cl一边,
电负性
H < Cl
1. 氧化数
定义
元素的氧化数是指该 元素原子在其化合态中 的形式电荷数。
1. 氧化数
定义
在共价化合物中,元素的氧 化数等于该元素的原子偏近或 偏离的形式电荷数。
A
盐桥
KCl
+
Cu
盐桥内含 KCl 或 NaNO3 溶液,可用琼 脂溶胶或多孔塞保护、 维持电流畅通。
ZnSO4
CuSO4
图 8-2 铜锌原电池
8.2.1 原电池 1.原电池的概念
原电池
是将化学能转变为电能的装置
1.原电池的概念(动画演示)
Cu~Zn 原电池
Cu 极——正极 Cu2+ + 2e- → Cu Zn 极——负极 Zn - 2e- → Zn2+
氧化数法
简单、快捷
适用于
优点
水溶液
气、固相
氧化还原反应
2)离子-电子法
原则
(1)反应过程中氧化剂得到
的电子数等于还原剂失 去的电子数 (2)反应前后各元素的原子
总数相等
步骤
(1)写出未配平的离子反应方程式
MnO4 + SO3
2-
+H+ →
Mn2+
+ SO4
2-
(2)将反应分解为两个半反应方程式
22-
+) 6
2-
2+ → 3+ 3+ 2+ Fe Fe Fe - e → Fe
Cr2O7 + 14H+ + 6Fe2+ 2Cr3+ + 7H2O + 6Fe3+
返回
氧化还原反应式配平课堂练习
(2) K MnO +H O →KMnO +MnO +KOH 2MnO4 +H O → MnO4 + MnO2+ OH221 MnO HO MnO + OH MnO + + 2H O→ + 2e → MnO + 4OH
