无机及分析化学第8章 习题答案
南农无机及分析化学补充习题8

第八章 补充习题一、选择题1.配合物中心离子的配位数等于:A. 配位体数B. 配位体中的原子数C. 配位原子数D. 配位原子所具有的孤对电子总数2.在FeCl 3溶液中加入KSCN 试剂,则:A. 生成复盐B. 产生沉淀C. 无现象D. 生成配离子3.在FeCl 3与KSCN 的混合溶液中加入足量NaF 试剂,则:A. 无现象B. 有红色出现C. 红色变为无色D. 有沉淀4.下列物质能溶于氨水的是:A. Ag 2SB. AgClC. AgID. PbCl 25.已知AgCl 的sp K Θ 及[Ag(NH 3)2]+的f K Θ ,则AgCl + 2NH 3[Ag(NH 3)2]+ + Cl -的平衡常数为:A. sp K Θ⨯f K ΘB. sp K Θ/f K ΘC. f K Θ /sp K ΘD. 1/[sp K Θ⨯f K Θ ]6.在[Co(en)2Cl 2]+离子中,钴的氧化数和配位数分别为:A. 0和4B. +2和4C. +3和6D. +2和67.下列配离子中最稳定的离子是:A. [AgCl 2]-B. [Ag(NH 3)2]+C. [Ag(S 2O 3)2]3-D. [Ag(CN)2]-8.下列物质中,不能作配位体的是:A. -NH 2B. CH 3NH 2C. NH 4+D. NH 39. 以下表达式中,正确的是:A. ()()()/MY (MY)M Y =f c K c c ΘB. [][][]/f MY M Y =K Θ C. [][][]f MY (MY)M Y =K D. [][][]f M Y (MY)MY =K 10. 利用酸效应曲线可选择单独滴定金属离子时的:A. 最低酸度B. pH 突跃范围C. 最低pH 值D. 最高pH 值11. 当M 与Y 反应时,溶液中有另一配位剂L 存在,若αM(L) = 1,则:A. M 与L 没有副反应B. M 与L 的副反应严重C. M 与L 的副反应较弱D. [M]=[L]12. 下列关于酸效应的叙述正确的是:A. 酸效应系数愈大,配合物稳定性愈大;B. 酸效应系数愈小,配合物稳定性愈小;C. pH 值愈高,酸效应系数愈大;D. 酸效应系数愈大,配位滴定的pM 突跃范围愈大。
无机及分析化学(第三版)第8章

CuI可由和直接反应制得:
2Cu2++2I– == 2CuI + I2
5. 硫酸铜
制 备 Cu + 2 H2SO4(浓)
CuSO4 + SO2 + 2 H2O
2 Cu + 2 H2SO4(稀) + O2
2 CuSO4 + 2 H2O
热分解
CuSO4 ·5 H2O 也算是一个配合物,受热时
不溶于水的白色固体 由于Hg(I)无成单电子,因此Hg2Cl2有抗磁性。 对光不稳定 :Hg2Cl2 光 HgCl2 + Hg
Hg2Cl2常用来制做甘汞电极,电极反应为:
Hg2Cl2 + 2e == 2Hg(l) + 2Cl-
2. Hg(I)与Hg(II)相互转化
Hg22+ == Hg + Hg2+
2. 卤化银
Ag++X– == AgX↓ (X=Cl、Br、I) Ag2O+2HF == 2AgF+H2O↓ (蒸发,可制AgF)
AgX的某些性质
颜色 溶度积 键型 晶格类型
AgF AgCl
白
–离子白 1.来自×10–10 过渡NaCl NaCl
AgBr
黄 5.0 ×10–13 过渡 NaCl
AgI
K0歧=8.36×10-3
HgCl2 0.63 Hg2Cl2 0.26 Hg 从元素电势图和K0歧
可以看出Hg22+在水溶液中可以稳定存在,歧化 趋势很小,因此,常利用Hg2+与Hg反应制备亚 汞盐,如:
振荡
Hg(NO3)2+Hg
《无机及分析化学》第八章课后题答案

第八章思考题与习题参考答案一、选择题1. 在给出的4个选项中,请选出1个正确答案。
(1)已知sp K (AB)=4.0×10-10;sp K (A 2B)=3.2×10-11,则两者在水中的溶解度关系为( A )A. S (AB )< S (A 2B ) B. S (AB )>S (A 2B )C. S (AB )=S (A 2 B )D. 不能确定不能确定 (2)Mg (OH )2沉淀在下列溶液中溶解度最大的是( B ) A. 纯水纯水 B. 在0.1mol ·L -1 HCl 中C. 在0.1mol ·L -1 NH 4Cl 中D. 在0.1mol ·L -1 Mg Cl 2 中(3)莫尔法测定Cl -和Ag +时,所用滴定剂分别为( B ) A. AgNO 3,Na Cl B. AgNO 3,AgNO 3C. AgNO 3,KSCN D. AgNO 3,NH 4SCN (4)用佛尔哈德法测定溶液中Cl -时,所选用的指示剂为( D ) A. K 2CrO 4 B. 荧光黄荧光黄 C. 曙红曙红 D. 铁铵矾铁铵矾(5) 佛尔哈德法测定Cl -时,溶液中没加有机溶剂,在滴定过程中使结果( A ) A. 偏低偏低 B.偏高偏高 C.无影响无影响 D. 正负误差不定正负误差不定 二、填空题2.相同温度下,HAc 在N a Ac 溶液中的解离度小于纯水中的解离度,CaCO 3在Na 2CO 3溶液中的溶解度小于其在纯水中的溶解度,这种现象可用_同离子效应__来解释。
来解释。
3.分步沉淀的次序不仅与溶度积常数及沉淀的 类型类型 有关,而且还与溶液中相应离子相应离子 浓度浓度 有关。
; 4.BaSO 4和Mg(OH)2的θsp K 分别为1.1×10-10和5.6×10-12,两者在水中溶解度为 1.05×1.05×1010-5 , 1.1×1.1×1010-4 。
无机及分析化学知到章节答案智慧树2023年齐鲁工业大学

无机及分析化学知到章节测试答案智慧树2023年最新齐鲁工业大学第一章测试1.无机及分析化学就是将无机化学和分析化学有机整合,集二者的基础性和实用性于一身的一门化学专业基础课程,是大学化学的基石和化学研究的起点。
参考答案:对2.测定常量组分的某样品中硫酸根的含量,可采用硫酸钡重量分析法。
参考答案:对3.从历史上看,无机化学是发展最早的一门化学分支学科,是化学研究的先驱。
参考答案:对4.以化学反应为基础的分析方法,称为:参考答案:化学分析法5.通常所说的四大化学是指?参考答案:物理化学;有机化学;无机化学;分析化学6.本课程包含化学的哪两个二级学科?参考答案:分析化学;无机化学7.下列哪些内容属于无机化学的研究对象?参考答案:电化学;配位化学;化学热力学;结构化学;化学动力学;元素化学第二章测试1.已知置信度为90%,n = 6 时,t =2.015,在一组平行测定中, 所得测定结果如下: 8.44, 8.32, 8.45, 8.52, 8.69, 8.38,下列内容正确的是参考答案:置信度为90%时平均值的置信区间8.47±0.11;标准偏差为0.132.已知n = 6 时,Q0.90 = 0. 56。
在一组平行测定中,所得测定结果如下:10.56,10.44,10.57,10.64,10.81,10.50,则参考答案:所有数据都是可靠值3.系统误差具有重现性,是可测误差参考答案:对4.带有偶然误差的测量数据,不能参加平均值的计算参考答案:错5.滴定分析中,指示剂确定的滴定终点与化学计量点不一致,由此产生的误差属于试剂误差。
参考答案:错6.系统误差主要影响分析测定中的准确度参考答案:对7.pM=-lg[Mn+]=3.00,金属离子浓度[Mn+]有效数字位数为3位参考答案:错8.对于同一组测定数据,置信度越小,置信区间越小。
参考答案:对9.用分析天平采用减量法称量试样,要使称量误差不大于0.1%,至少要称取试样参考答案:0.2g10.已知 pH=5.25,则[ H+ ]=5.62×10-6mol•L-1 。
无机及分析化学第八章答案
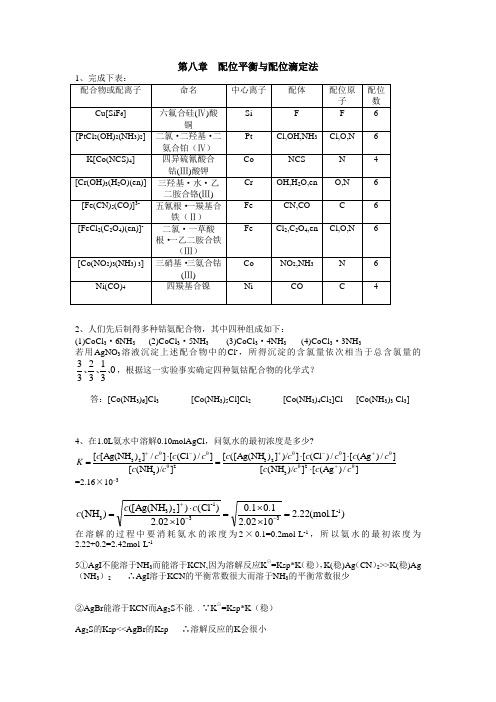
第八章 配位平衡与配位滴定法2、人们先后制得多种钴氨配合物,其中四种组成如下:(1)CoCl 3·6NH 3 (2)CoCl 3·5NH 3 (3)CoCl 3·4NH 3 (4)CoCl 3·3NH 3若用AgNO 3溶液沉淀上述配合物中的Cl -,所得沉淀的含氯量依次相当于总含氯量的0313233、、、,根据这一实验事实确定四种氨钴配合物的化学式?答:[Co(NH 3)6]Cl 3 [Co(NH 3)5Cl]Cl 2 [Co(NH 3)4Cl 2]Cl [Co(NH 3)3 Cl 3]4、在1.0L 氨水中溶解0.10molAgCl ,问氨水的最初浓度是多少?=2.16×10–3)mol.L (22.21002.21.01.01002.2)(Cl )])[Ag(NH ()(NH 1-33-1233=⨯⨯=⨯⋅=--+c c c 在溶解的过程中要消耗氨水的浓度为2×0.1=0.2mol·L -1,所以氨水的最初浓度为 2.22+0.2=2.42mol·L -15①AgI 不能溶于NH 3而能溶于KCN,因为溶解反应K ⊙=Ksp*K (稳),K(稳)Ag (CN )2>>K(稳)Ag (NH 3)2 ∴AgI 溶于KCN 的平衡常数很大而溶于NH 3的平衡常数很少②AgBr 能溶于KCN 而Ag 2S 不能,,∵K ⊙=Ksp*K (稳)Ag 2S 的Ksp<<AgBr 的Ksp ∴溶解反应的K 会很小]/)Ag ([])/(NH []/)Ag ([]/)Cl ([])/])([Ag(NH [])/(NH []/)Cl ([]/])Ag(NH [[θ2θ3θθθ232θ3θθ23c c c c c c c c c c c c c c c c K ++-+-+⋅⋅⋅=⋅=③Fe 与SCN -会生成血红色的配合物 ④略6、0. l0mol ∙L -1的AgNO 3溶液50mL ,加密度为0.932g ∙ mL -1含NH 3 18.24%的氨水30mL ,加水稀释到100mL ,求算这溶液中的Ag +浓度。
《无机及分析化学》1-12章习题答案

第一章 气体和溶液 (15页)
17. 聚沉能力由大到小排列: A. 100 mL0.005mol·L-1KI 和100 mL0.01mol·L-1
AgNO3 制成的为正溶胶,所以排列顺序为: AlCl3 K3[Fe(CN)6] MgSO4 (电荷同由小到大) B. 100 mL0.005mol·L-1 AgNO3和100 mL0.01mol·L-1 KI制成的为负溶胶,所以排列顺序为: K3[Fe(CN)6] AlCl3 MgSO4(电荷同由大到小)
13.
2SO2(g) + O2(g) = 2SO3(g)
n平衡
1.90
0.95 1.10
K K p( p ) B K C ( Rp T ) B
c(ScO (2S)O c3()O2)RpT1
1.1208.0 010.31 1.2 90.9 58.31151 00.5 031
第三章 化学反应速率和化学平衡 (56页)
V=1425∕900=1.58 L
c=1 25.2 0∕1.5.81 0 =.0 151 .80m1 o8 l·.L6 0 -1 0 9. 40.:0 6.6 00 :5.33 1:2:1
T bm B 0 .05 0 1 .50 00 M K b m A0 .51 9 .0 20 1g 8 m 0-1o
⑸ 减小容器体积
n(Cl2)增大
⑹ 减小容器体积
p(Cl2)增大
⑺ 减小容器体积
K⊖不变
⑻ 升高温度
K⊖增大
⑼ 升高温度
p(HCl)增大
⑽ 加N2 ⑾ 加催化剂
无机及分析化学第八章答案

第八章 思考题与习题8-2 判断题 (1)√ (2)× (3)√8-3 填空题(1)1.51 ,1.509,MnO 42-,Mn 3+ ; (4) 0.86±0.0592/2;(5) 5.6×104 ; (6) 高锰酸钾, 重铬酸钾, 碘量 ;(7) H 2SO 4 ,Mn 2+ , 75~85 , 自身指示剂 , 无, 红。
8-4 选择题1 A ;2 B ;3 B ;4 A ;5 B ;6 B ;7 D ; 8 D ; 9 C ; 10 C ; 11 B ; 12 D.8-5用离子电子法配平下列电极反应解 (1)MnO -4+ 2H 2O + 3e = MnO 2 +4OH - (碱性介质)(2)CrO -24+ 4H 2O + 3e = Cr(OH)3 + 5OH - (碱性介质)(3)H 2O 2+ 2H + + 2e = 2H 2O (酸性介质)(4)H 3AsO 4+ 2H + + 2e = H 3AsO 3 + H 2O (酸性介质)(5)O 2+ 2H + + 2e = H 2O 2(aq) (酸性介质)8-6计算题1.解 :(1)查表:φθ(Cl 2/Cl -)=1.358、φθ(Br 2/ Br -)=1.066、φθ(I 2/ I -)=0.536、φθ(Fe 3+/Fe 2+)=0.771、φθ(MnO 4-/Mn 2+)=1.5072解:(1) 电极反应: (+):MnO 2 + 4H + + 2e -=Mn 2+ + 2H 2O ( -):Cl 2 + 2e -= 2Cl - 或 2Cl - - 2e= Cl 2如果设计成原电池,则原电池符号为:(-)Pt | Cl 2(p 1)| Cl - (c 1)|| Mn 2+ (c 2) , H +(c 3)| MnO 2 | Pt (+)(2) 查表得:φθ(MnO 2/Mn 2+)=1.22V φθ(Cl 2/Cl -)=1.36V ,εө=φθ(MnO 2/Mn 2+)-φθ(Cl 2/Cl -)=1.22-1.36= -0.14<0,在标态下该反应不能正向自发进行。
分析化学:第8章课后习题答案

第八章思考题与习题1.什么叫沉淀滴定法?沉淀滴定法所用的沉淀反应必须具备哪些条件?答:沉淀滴定法是以沉淀反应为基础的一种滴定分析方法。
沉淀滴定法所应的沉淀反应,必须具备下列条件:(1)反应的完全程度高,达到平衡的速率快,不易形成过饱和溶液。
,即反应能定量进行。
(2)沉淀的组成恒定,沉淀的溶解度必须很小,在沉淀的过程中不易发生共沉淀现象。
(3)有确定终点的简便方法。
2.写出莫尔法、佛尔哈德法和法扬斯法测定Cl-的主要反应,并指出各种方法选用的指示剂和酸度条件。
答:(1)莫尔法主要反应:Cl-+Ag+=AgCl↓指示剂:铬酸钾酸度条件:pH=6.0∽10.5(2)佛尔哈德法主要反应:Cl-+Ag+(过量)=AgCl↓Ag+(剩余)+SCN-=AgSCN↓指示剂:铁铵矾。
酸度条件:0.1∽1 mol/L(3)法扬斯法主要反应:Cl-+Ag+=AgCl↓指示剂:荧光黄酸度条件:pH=7∽10.53.用银量法测定下列试样:(1)BaCl2,(2)KCl,(3)NH4Cl,(4)KSCN,(5)NaCO3+NaCl,(6)NaBr,各应选用何种方法确定终点?为什么?答:(1)BaCl2用佛尔哈德法或法扬斯法。
因为莫尔法能生成BaCrO4沉淀。
(2)Cl-用莫尔法。
此法最简便。
(3)NH4Cl用佛尔哈德法或法扬斯法。
因为当、[NH4+]大了不能用莫尔法测定,即使[NH4+]不大酸度也难以控制。
(4)SCN-用佛尔哈德法最简便。
(5)NaCO3+NaCl用佛尔哈德法。
如用莫尔法、法扬斯法时生成Ag2CO3沉淀造成误差。
(6)NaBr 用佛尔哈德法最好。
用莫尔法在终点时必须剧烈摇动,以减少AgBr吸附Br-而使终点过早出现。
用法扬斯法必须采用曙红作指示剂。
4.在下列情况下,测定结果是偏高、偏低,还是无影响?并说明其原因。
(1)在pH=4的条件下,用莫尔法测定Cl-;(2)用佛尔哈德法测定Cl-既没有将AgCl沉淀滤去或加热促其凝聚,有没有加有机溶剂;(3)同(2)的条件下测定Br-;(4)用法扬斯法测定Cl-,曙红作指示剂;(5)用法扬斯法测定I-,曙红作指示剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第八章 氧化还原反应 习题解答1. 什么叫金属的电极电势?以金属-金属离子电极为例说明它是怎么产生的?1. 当把金属插入其盐溶液中,在金属与溶液间由于电荷不均等原因而产生了电势差,这种产生在金属和它的盐溶液之间的电势叫做金属的电极电势。
当把金属插入其盐溶液中,会同时出现两种相反的过程。
一方面金属晶格中金属离子受极性水分子的吸引而形成水合离子进入溶液。
另一方面金属表面的自由电子会吸引溶液中的金属离子使其沉积到金属表面。
这两个过程可表示如下:M(s)M (aq)e n n +-+ 溶解沉积当溶解速率与沉积速率相等时,就达到动态平衡。
一般地说,在溶解和沉积过程中,由金属表面进入溶液中的金属离子总数与从溶液中沉积到金属表面的金属离子总数并不相等,这样在金属与溶液间就由于电荷不均等而产生了电势差。
2. 举例说明什么是歧化反应?2. 在Cl 2+H 2O=HClO+HCl 中:Cl 2既是反应的氧化剂,又是还原剂,这种氧化-还原反应叫做歧化反应。
3. 指出下列化合物中各元素的氧化数:4. 举例说明常见电极的类型和符号。
4. 常见电极共有四种类型:(1)金属-金属离子电极 金属置于其金属离子的盐溶液中所构成的电极。
如Zn(s) | Zn 2+(2)气体-离子电极 这类电极的构成需要一个固体导电体,该导电固体与所接触的气体和溶液都不起反应,但它有时能催化气体电极反应的进行。
如Pt | H 2(g) | H +(3)金属-金属难溶盐或氧化物-阴离子电极 表面涂有该金属的难溶盐(或氧化物)的金属浸入与该盐具有相同阴离子的溶液即构成此类电极。
如Ag | AgCl(s) | Cl -(4)“氧化还原”电极 将惰性导电材料(铂或石墨)放于含有同一元素不同氧化数的两种离子的溶液中即构成此类电极。
如Pt | Fe 2+,Fe 3+5. 写出5种由不同类型电极组成的原电池的符号和对应的氧化还原反应方程式。
5. (1)(-)Pt | H 2(p ) | H +( c 1 ) || Cu 2+(c 2 ) | Cu(+) (2)(-)Pt | H 2(p ) | H +( c 1) || Cl -(c 2 ) | AgCl | Ag(+)(3)(-)Zn | Zn 2+(c 1) || Cl -(c 2) | AgCl | Ag(+)(4)(-)Zn | Zn 2+(c 1) || Fe 3+(c 2 ), Fe 2+(c 3) | Pt(+) (5)(-)Pt | H 2(p ) | H +( c 1) || Fe 3+(c 2), Fe 2+(c 3 ) | Pt(+) 6. 用氧化数法配平下列方程式:(1) 4 Zn +10 HNO 3(极稀) = 4 Zn(NO 3)2 + NH 4NO 3 +3 H 2O(2) K 2Cr 2O 7 + 6 KI + 7 H 2SO 4 = Cr 2(SO 4)3 + 4 K 2SO 4 + 3 I 2 + 7 H 2O(3) 5Na 2C 2O 4+2KmnO 4+3H 2SO 4=2MnSO 4+K 2SO 4+5Na 2SO 4+10CO 2+8H 2O (4) 3H 2O 2 + Cr 2(S O 4)3 + 10KOH = 2K 2CrO 4 +3 K 2SO 4 +8 H 2O (5) 2Na 2S 2O 3 + I 2 = Na 2S 4O 6 +2NaI(6) 5K 2S 2O 8 + 2MnSO 4 + 8H 2O = 8H 2SO 4 + 2KmnO 4 +4K 2SO 47. 用离子-电子法配平下列反应方程式[(1)~(5)为酸性介质,(6)~(10)为碱性介质]。
7. (1) IO 3-+ 5I -+6H += 3I 2+3H 2O(2) 2Mn 2++ 5NaBiO 3 +14H += 2MnO 4-+ 5Bi 3++5Na ++7H 2O(3) 2Cr 3++ 3PbO 2 +H 2O = CrO 72-+ 3Pb 2++2H +(4) 5C 3H 8O + 4MnO 4-+12H += 5C 3H 6O 2 + 4Mn 2++11H 2O(5) 10HClO + 3P 4+18H 2O = 10Cl -+ 12H 3PO 4+10H +(6) 2CrO 42-+3 HsnO 2-+ H 2O = 2 CrO 2-+ 3 HsnO 3-+ 2OH -(7) 3 H 2O 2 + 2 CrO 2-+ 2 OH -= 2 CrO 42-+ 4 H 2O(8) I 2 + H 2AsO 3-+4OH -= AsO 43-+ 2I -+ 3H 2O(9) Si + 2OH -+H 2O = SiO 32-+ 2H 2(10) 3 Br 2 + 6OH -= BrO 3-+ 5Br -+ 3H 2O8. 根据电极电势判断在水溶液中下列各反应的产物,并配平反应方程式。
8. (1)2Fe + 3Cl 2= 2FeCl 3 (2)2Fe + 3Br 2= 2FeBr 3 (3)Fe + I 2 = FeI 2(4)Fe + 2HCl = FeCl 2 + H 2↑ (5)2FeCl 3 + Cu = 2FeCl 2 + CuCl 2 (6)2FeCl 3 + 2KI = 2FeCl 2 + 2KCl + I 29. 试将下述化学反应设计成电池,并写出原电池符号。
9. (1)Ni 2+ + Fe Fe 2+ + Ni(-)Fe| Fe 2+( c 1 mol·L -1) || Ni 2+(c 2mol·L -1) | Ni(+)(2)H 2 + Cl 2 2HCl(-)Pt | H 2(p 1)|H +(c 1 mol·L -1) || Cl -(c 2 mol·L -1) |Cl 2 (p 2) | Pt(+)(3) Ag ++ Br - AgBr(-)Ag | AgBr (s)| Br -(c 1mol·L -1) || Ag +(c 2 mol·L -1) | Ag(+)(4) AgCl + I - AgI + Cl -(-)Ag | AgI (s)| I -( c 1mol·L -1) || Cl - (c 2 mol·L -1) | AgCl (s)|Ag(+)(5)2+2342MnO 5Fe16H Mn 5Fe 8H O -+++++++ (-)Pt| Fe 2+(c 1mol·L -1) ,Fe 3+(c 2mol·L -1) ||2+4345MnO (), Mn (),H ()c c c -+| Pt(+)10. 已知电极电势的绝对值是无法测量的,人们只能通过定义某些参比电极的电极电势来测量被测电极的相对电极电势。
若假设Hg 2Cl 2 +2e - 2Hg +2Cl -电极反应的标准电极电势为0,则2(Cu /Cu)E θ+、2(Zn /Zn)E θ+变为多少?10. 查得甘汞电极标准电极电势为+0.268V 2(Cu /Cu)E θ+=0.337-0.268=0.069V 2(Zn /Zn)E θ+=-0.7628-0.268=-1.0308V11. 已知NO 3-+3H + +2e - HNO 2 +H 2O 反应的标准电极电势为0.94V ,HNO 2的解离常数为K a θ=5.1×10-4。
试求下列反应在298K 时的标准电极电势。
NO 3-+H 2O +2e - NO 2-+2OH -11. 3333a 2122[NO ][H ][NO ][H ]0.0592V 0.0592V lg 0.94V lg 2[HNO ]2[H ][NO ]K E E θθθ-+-++-=+=+2a 3w 2[NO ]0.0592V 0.94V lg 2[NO ][OH ]K K θθ---⎛⎫⎛⎫ ⎪=+ ⎪ ⎪ ⎪⎝⎭⎝⎭23a w 22[NO ]0.0592V 0.0592V 0.94V lg lg()22[OH ][NO ]K K θθ---=++ 当[3[NO ]-=[NO 2-]=[OH -]=1 mol·L -1时 ()224142a w 0.0592V 0.0592V 0.94V lg()0.94V lg 5.110 1.0100.014V 22E K K θθθ--⎡⎤=+=+⨯⨯⨯=⎢⎥⎣⎦12. 反应3A(s)+2B 3+(aq) 3A 2+(aq)+2B(s)在平衡时[B 3+]=0.02mol·L -1,[A 2+]=0.005mol·L -1。
(1)求反应在25℃时的E θ,K θ及r m G θ∆;(2)若E =0.05917V ,[B 3+]=0.1 mol ⋅dm -3,求[A 2+]=? 12. (1)反应3A(s)+2B 3+(aq) 3A 2+(aq)+2B(s)平衡时:2334[A ]0.005 3.12510[B ]0.02K θ+-===⨯ 由0.0592nE K θθ=lg 得 0.05920.0592(0.0346V 6K E nθθ⨯===-l g l g 3.125-4)11r m 696485(0.0346)J mol =20.03kJ mol G nFE θθ--∆=-=-⨯⨯-⋅⋅(2)32223230.0592V []0.0592V 0.1lg 0.0346V lg 0.05917V 6[][]B E E n A A θ+++=+=-+= 解得24-1[] 1.4610mol L A +-=⨯⋅13. 某酸性溶液含有Cl ,Br ,I ---离子,欲选择一种氧化剂能将其中的I -离子氧化而不氧化Cl -离子和Br -离子。
试根据标准电极电势判断应选择H 2O 2、Cr 2O 72-、Fe 3+中的哪一种?13. 由附录6查得E Θ( I 2/ I -) = 0.5355V , E Θ( Br 2/ Br -) = 1.0652V , E Θ( Cl 2/ Cl -) = 1.3595V ,222(H O /H O) 1.77V E θ=,2327(Cr O /Cr ) 1.33V E θ-+=,32(Fe /Fe )0.771V E θ++=。
222(H O /H O) E θ)>E Θ(Cl 2 /Cl -) >2327(Cr O /Cr )E θ-+>E Θ(Br 2/ Br -) > E Θ( Fe 3+/ Fe 2+)>E Θ(I 2/ I -)1.77V 1.3583V 1.33V 1.0652V 0.771V 0.5355V H 2O 2溶液能将I -、Br -、Cl -氧化成I 2、Br 2、Cl 2; Cr 2O 72-溶液能氧化I -、Br -,而不能氧化Cl -;Fe 3+溶液只能氧化I -离子成I 2,而不能氧化Br -离子、Cl -离子。
