第八章氧化还原反应和电化学基础
氧化还原反应与电化学

5. 电极电势
电极电势
关于原电池的疑问
– 为何组成原电池后,电子会自发由负极流向正极?为何两个电极 之间存在电势差? – 不同的电极组成原电池后,哪个为正极,哪个为负极?
电极电势(电极电位)
电极电势
电极电势
标准氢电极
标准电极电势绝对值是无法测定的,于是建立了标准氢电极(SHE)
4. 原电池
原电池
铜锌原电池( Daniell电池) 直接氧化还原反应
negative pole
特点
– Zn + CuSO4 = ZnSO4positive + Cu
pole
氧化反应和还原反应发生在 不同地方
电子通过外电路由发生氧化 – 电子传递直接在氧化剂与还原剂接触面进行 – 化学能转变为热能,无法直接利用 反应的电极传递到发生还原 反应的电极
本题虽未标明,但明显应是碱性环境
电对:ClO-/Cl– 半反应: ClO- + H2O + 2e- = Cl- + 2OH-
电对:Fe(OH)3/FeO42最终结果
– 半反应:Fe(OH)3 + 5OH- = FeO42- + 4H2O + 3e– 2Fe(OH)3 + 3ClO- + 4OH- = 2FeO42- + 3Cl- + 5H2O
电极电势的产生 M(s)
双电层理论
溶解 沉淀
Mz+ + ze-
M活泼 + + + + – – – –
第08章 电化学基础

∴ E (H+/H2)= -0.28V
2HOAc+2e ⇌2OAc- + H2(g) EӨ =-0.28V
8.3.3 沉淀对电极电势的影响
例 298K时,在Fe3+、Fe2+的混合溶液中加入NaOH时有Fe(OH)3、Fe(OH)2
沉淀生成,假设无其它反应发生,当沉淀反应达到平衡时,保持C(OH-) =1. 0mol· -1 ,求E(Fe3+/Fe2+)为多少? L
荷过剩,CuSO4溶液中则由于Cu2+的沉积而负电荷过剩。
从而阻止电子从锌极流向铜极,电池反应便会停止,直至 无电流产生。 3:当有盐桥存在时,随着反应的进行,盐桥中的负离子进 入ZnSO4溶液中,正离子进入CuSO4溶液中,以保持溶液的
电中性,使电流连续产生。
原电池的构造是这样的,如何表示原电池呢?
=1.60V 说明:含氧酸盐在酸性介质中氧化性增强。
8.3.3 酸度对电极电势的影响
例 已知电极反应2H++2e =H2(g),EӨ =0.0V ,向体系中加入NaOAc,使得 C(HOAc)=C(NaOAc)=1. 0mol· -1 ,P(H2)=PӨ,求E(H+/H2)。 L
Ka = 1.8*10-5
确定了标准之后,如何确定其它电极电势呢?
8.3.2 标准电极电势-电极电势的定义
将待测电极与标准氢电极组成一个原电池,测得该原
电池的电动势(E),就可以知道待测电极相对于标准氢
电极的电极电势。
E(电池)= E(待测)- E(标准氢电极)
测定Cu电极的EӨ,组成如下电池:
(-)Pt|H2(g)∣H+(CӨ)‖Cu2+(CӨ)∣Cu(+) EӨ = EӨ(Cu2+/Cu) - EӨ(H+/H2) 0 ∴ EӨ(Cu2+/Cu)=0.340V
氧化还原反应与电化学原理(基础知识)

氧化还原反应与电化学原理(基础知识)【考情分析】一、考纲要求1.理解氧化还原反应的本质和特征2.从多个角度理解氧化剂和还原剂等概念3.会比较与判断氧化性或还原性强弱4.知道常见的氧化剂和还原剂5.能判断氧化还原反应中的电子转移方向和数目6.能配平化学方程式7.能运用氧化还原反应的规律进行有关计算8.理解原电池原理。
熟记金属活动性顺序。
了解化学腐蚀与电化学腐蚀及一般防腐蚀方法。
9.通过电能转变为化学能的探究活动,了解电解池工作原理,能正确书写电解池的阴、阳极的电极反应式及电解反应方程式。
10.知道电解在氯碱工业、精炼铜、电镀、电冶金等方面的应用。
认识电能转化为化学能的实际意义。
二、命题趋向(1)由氧化还原反应方程式判断氧化性、还原性强弱。
(2)由氧化性、还原性强弱判断氧化还原反应方程式的正误。
(3)由氧化还原反应方程式判断氧化还原反应方程式的正误。
【考点剖析】普通的氧化还原反应在一处进行,不形成电流,化学能转变成热能或光能。
原电池中发生的反应具有两个特点:①是自发的氧化还原反应,②该反应在两处进行,分别叫正极和负极,其结果是化学能转变成电能。
电解池中发生的反应也具有两个特点:①是被迫发生的氧化还原反应,②该反应在两处进行,分别叫阴极和阳极,其结果是电能转变成化学能。
我们把研究电能与化学能相互转化的化学,叫做电化学。
氧化还原反应和电化学,作为高中化学中的基本概念和基础理论,在高考中占有非常重要的地位。
前者主要的考查点有:氧化剂、还原剂等概念的理解,氧化性、还原性强弱的判断,依据电子守恒进行配平和计算等。
后者的基本要求是:(1)了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。
了解常见化学电源的种类及其工作原理;(2)理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施;(3)应用电解知识理解电镀铜、电解精炼铜、氯碱工业等化工生产原理。
氧化剂、还原剂等概念的理解,氧化性、还原性强弱的判断,依据电子守恒进行配平和计算等。
氧化还原反应和电化学基础

8
⑷ 离子型化合物中,元素的氧化数等于该 ⑸ 离共子价所型带化的合电物荷中数,,共如用:电N子aC对I。偏向于电负性大 的原子 ,两原子的形式电荷数即为它们的氧化数, 如:HCI。 ⑹ 中性分子中,各元素原子氧化数的代数和为9 零。
S4O62- 4x+(-2)×6=-2 x=2.5 H5IO6 I:+7 ; S2O32- S:+2 例:求MnO4-中Mn的氧化值
2×3
0
+5
Zn+ HNO3
+2
+2
Zn(NO3)2+ NO + H2O
3 ×2
56
配系数
先配变价元素,再用观察法配平其 它元素原子的系数。
15
用氧化数表示氧化还原的状态 对于离子化合物的氧化还原反应来说,电 子是完全失去或完全得到的。但是,对于共价化 合物来说,在氧化还原反应中,有电子的偏移, 但还没有完全的失去或得到,因此用氧化数来表 示就更为合理。
16
例如:
H2+Cl2=2HCl 这个反应的生成物是共价化合物,氢原子的电子 没有完全失去,氯原子也没有完全得到电子,只是形成 的电子对偏离氢,偏向氯罢了。用氧化数的升降来表示 就是氯从0到-1,氢从0到+1。这样,氧化数的升高就是 氧化,氧化数的降低就是还原。在氧化还原反应里,一 种元素氧化数升高的数值总是跟另一种元素氧化数降低 的数值相等的。
11
一、氧化值的定义
在氧化还原反应中,电子转移引起某些原子的价 电子层结构发生变化,从而改变了这些原子的带电状 态。为了描述原子带电状态的改变,表明元素被氧化 的程度,提出了氧化态的概念。表示元素氧化态的的 数值称为元素的氧化值,又称氧化数。
氧化还原反应电化学基础N
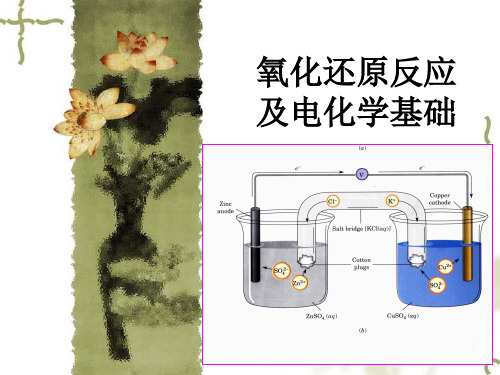
这一反应可在下列装置中分开进行
盐桥:在U型管中装 满用饱和KCl溶液和 琼胶作成的冻胶。 盐桥的作用:使Cl向锌盐方向移动, K+向铜盐方向移动, 使Zn盐和Cu盐溶液 一直保持电中性, 从而使电子不断从 Zn极流向Cu极。
这种装置能将化学能转变为电能,称为原电池。
正极(铜电极): Cu2+ + 2eCu 负极(锌电极): Zn Zn2+ + 2e正、负两极分别发生的 反应,称为电极反应。 电池反应:Zn + Cu2+ = Cu + Zn2+(总反应)
例:
H5I O6 S2 O S4 O
2 3 2 6
I的氧化值为 7 S的氧化值为 2 S的氧化值为 2.5 8 Fe的氧化值为 3
Fe3O 4
2、氧化还原半反应和氧化还原电对
氧化还原反应的方程式可分解成两个“半反应”。 反应中,氧化剂(氧化型)在反应过程中氧化数降 低生成氧化数较低的还原型; 还原剂(还原型)在反应 过程中氧化数升高转化为氧化数较高的氧化型。 由一对氧化型和还原型构成的共轭体系称为氧化还 原电对,可用“氧化型/还原型”表示。
Fe3+
溶液中,另一铂片插入到含有MnO4- 、Mn2+ 及H+ 的溶液
正极反应: MnO4- + 8H+ + 5e- = Mn2+ + 4H2O 电池反应: MnO4- + 8H+ + 5Fe2+ = Mn2+ + 5Fe3+ + 4H2O
电池符号:
(-)Pt|Fe2+(c1),Fe3+(c2)||MnO4-(c3),H+(c4),Mn2+(c5)|Pt (+)
氧化还原反应及电化学基础

+1,-1 +2,-1
3) 共价化合物中,成键电子对偏向电负性大的元素。
O: -2 (H2O 等);-1 (H2O2); -0.5 (KO2 超氧化钾) H: +1 (一般情况);-1 (CaH2 、NaH)
原电池,在恒温、恒压下,体系自由能降低等于体系所作的最大电功,则:
1) 电池G电=动– 势WmaEx 和 G
③ 盐桥(琼脂 + 强电解质KCl, KNO3等,作用是补充电荷、 维持电荷平衡)
2)电极反应:
正极(Cu): 负极(Zn):
Cu2+ + 2e = Cu Zn- 2e = Zn2+
3)电池反应及电池符号: Zn + Cu2+ = Zn2+ + Cu
(-)Zn | Zn2+ (c1) || Cu2+ (c2) | Cu (+)
历 年代
氧化反应
还原反应
认 识
史 18世纪末
与氧化合
从氧化物夺取氧
不
发 19世纪中 化合价升高
化合价降低
断 深
展 20世纪初
失去电子
得到电子
化
例如: Fe + Cu2+ = Fe2+ + Cu 称为全(总)反应
电子转移
氧化
Fe - 2e
Fe2+
(氧化)半反应
Cu2+ + 2e 还原 Cu (还原)半反应
2)标准电极电势的测定
将待测的标准电极与标准氢电极组成原电池,在 25ºC下,用检流计确定
08电化学基础与氧化还原平衡习题解答

< >
Eθ (Ag2CrO4/Ag) Eθ (AgCl/Ag)
三、计算题 1.将下面的电池反应用电池符号表示之, 将下面的电池反应用电池符号表示之, 将下面的电池反应用电池符号表示之
Cu(s)+2H+(0.01mol·L-1) = Cu2+ (0.1mol·L-1)+H2(0.9×1.013×105Pa) × ×
15.使下列电极反应中有关离子浓度减小一半, 使下列电极反应中有关离子浓度减小一半, 使下列电极反应中有关离子浓度减小一半 而E值增加的是 值增加的是 (A)Cu2+ +2e = Cu ) (B)I2+2e = 2I) (C)2H+ +2e = H2 ) (D)Fe3+ +e = Fe2+ ) ( B )
(-)Cu(s)|Cu2+(1mol·L-1)||H+(1mol·L-1)|H2(1.013×105Pa)|Pt(+) ×
E池θ=EθH /H - EθCu2+/Cu =-0.34 v < 0 。
2 +
nE池 lg K = = −11.5, K ө=2.98×10-12 × 0.059
θ
θ
θ × ∆rGmθ = -nFE池 = 6.56×104J·mol-1>0。
-
2.将下列反应设计成原电池时,不用惰性电 将下列反应设计成原电池时, 将下列反应设计成原电池时 极的是 (A)H2+Cl2 = 2HCl ) (B)2Fe3+ +Cu = 2Fe2+ +Cu2+ ) (C)Ag+ +Cl- = AgCl ) (D)2Hg2+ +Sn2+ = Hg22+ +Sn4+ ) (C)
氧化还原反应 电化学基础

电池反应 Sn2++ 2Fe3+ = Sn4+ + 2Fe2+
(-) (Pt) H2(pθ)H+(1mol·dm-3) Fe3+(1mol·dm-3) , Fe2+ (1 mol·dm-3) Pt(+) 负极,氧化反应: 负极,氧化反应: H2 - 2e = 2H+ 正极,还原反应: 正极,还原反应: Fe3+ + e = Fe2+ 电池反应: 电池反应: H2 + 2 Fe3+ = 2H+ + 2 Fe2+
(Pt)H2(p)H+(1 mol·dm-3) Cl2(p)Cl– (c mol·dm-3)Pt
负极,氧化反应: 负极,氧化反应: H2 - 2e = 2H+ 正极,还原反应: 正极,还原反应: Cl2 + 2 e = 2Cl– 电池反应: 电池反应: H2 + Cl2 = 2H+ + 2Cl–
二、确定氧化态的规则 (the rules for the determination of oxidation state) 1. 离子型化合物中,元素的氧化数等于该离子所 离子型化合物中, 带的电荷数 2. 共价型化合物中,共用电子对偏向于电负性大 共价型化合物中, 的原子 ,两原子的形式电荷数即为它们的氧化数 3. 单质中,元素的氧化数为零; 离子 n-氧化数为 单质中,元素的氧化数为零; 离子X n4. 中性分子中,各元素原子的氧化数的代数和为 中性分子中, 零 ,复杂离子的电荷等于各元素氧化数的代数和
Zn + Cu2+ = Zn2+ + Cu 氧化反应 Zn = Zn2+ + 2e Cu2+ + 2e = Cu 还原反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(4)氢在化合物中的氧化数一般为+1,但在金属氢 化物,如NaH、CaH2中,氢的氧化数为-1。氧在 化合物中的氧化数一般为-2,但在过氧化物,如 H2O2、BaO2等中,氧的氧化数为-1。在超氧化 物,如KO2中,氧的氧化数为-1/2。在氟氧化物, 如OF2中,氧的氧化数为+2,氟在化合物中的氧化 数皆为-1。
本章内容
§8.1 氧化还原反应 §8.2 原电池和电极电势
§8.1 氧化还原反应
氧化还原反应:有电子得失或电子转移的反应,被 称为氧化还原反应。
8.1.1 氧化值和化合价
为了表示化合物中各元素的原子同其他原子结合的 能力,19C中叶引入“化合价”的概念。
化合价是表示元素原子能够化合或置换1价原子(H) 或1价集团(OH- )的数目,也表示化合物中某原 子成键的数目。
2KClO3=2KCl+2O2
(3)若氧化数的变化发生在同一物质中同一元素的 不同原子间的氧化还原反应称为歧化反应。 如:Cu+在水溶液中的反应: 2Cu+=Cu+Cu2+
(4) 若氧化数的变化发生在不同物质的同一元素 间的氧化还原反应称为反歧化反应。如: Hg2+ + Hg = Hg22+
氧化还原半反应 :
例10-1 计算下列物质中带*元素的氧化数。
H2S*O4、S*2O32-、S4*O62-、Mn*O4-、Fe3*O4
6
2
2.5
7
8/3
指出下列物质中各元素的氧化数:
+1 +7 -2 +1 -2 +1 -1 +1 -1
KClO4 、 Cu2O 、H2O2 、NaH
7.1.2. 氧化还原反应的特征
氧化数升高,被氧化
0
Cl2 + 2I-
-1
-1
I2 + 2Cl-
0
氧化数降低,被还原
氧化剂
还原剂
❖ 氧化:在氧化和还原反应中,元素氧化数升高的 过程称为氧化。
❖ 还原:在氧化和还原反应中,元素氧化数降低的 过程称为还原。
特征: 反应中氧化过程和还原过程同时发生
一种元素的氧化数升高,必有另一种元素的氧化数 降低,且氧化数升高总数与氧化数降低总数相等。
*或:A原子与电负性较大的B原子成键时“给
出”的电子数。
OCO
确定元素氧化数所遵循的一般原则如下: (1) 任何形态的单质中元素的氧化数为零。如N2、 Zn、S8等物质中,N2、Zn、S的氧化数都为零。
(2)单原子离子的氧化数等于离子所带的电荷数。 如Fe3+、Cl-离子中铁和氯元素的氧化数分别为 +3、-1。(注意离子电荷与氧化数表示方法不 同。)
例:Cl2/Cl-,I2/I❖ 氧化还原电对的书写形式与反应式有关。
半反应
电对
MnO4-+8H++5e=Mn2++4H2O
MnO4-/Mn2+
MnO4-+2H2O+3e=MnO2+4OH- MnO4-/MnO2
氧化型物质的氧化能力与还原型物质的还原能力与 共轭酸碱的强弱相似:
在氧化还原电对中,氧化型的氧化能力越强,则 其共轭还原型的还原能力越弱;反之,还原型的 还原能力越强,则其共轭氧化型的氧化能力越弱。 氧化还原反应是两个氧化还原电对共同作用的结 果,反应一般按照较强的氧化剂和较强的还原剂 相互作用的方向进行。
在共价化合物中某原子的原子价数即为该原子形成 的共价单键的数目,在离子型化合物中即为离子的 原子价数。如NH3、PCl5 、CO2 、NH4+
在价键理论和电负性的基础上,为了表示各元素在 化合物中所处的化合状态,无机化学中引入了氧化 值(又称氧化数)的概念。
1970 年 国 际 纯 粹 与 应 用 化 学 联 合 会 ( IUPAC ) 对 氧化值作了如下定义:氧化值(又称氧化数)是某 元素一个原子的荷电荷,在化合物中,这种荷电 荷把成键电子指定给电负性较大的原子而求得。
7.1.4 氧化还原反应方程式的配平
1. 氧化数法 原则:还原剂氧化数升高数和氧化剂氧化数降低数相 等(得失电子数目相等)
写出化学反应方程式 确定有关元素氧化态升高及降低的数值 确定氧化数升高及降低的数值的最小公倍数。找 出氧化剂、还原剂的系数。
核对,可用H+, OH–, H2O配平。
例: As2S3 + HNO3 H3AsO4 + H2SO4 + NO
物质
氧化剂 还原剂
得 还原 失 氧化
降低 升高
氧化性 活泼非金 属,高价 离子
还原性 活泼金属 低价离子
练习:指出下列反应的氧化剂、还原剂并写 出它们的氧化反应和还原反应。
(1)CuO + H2= Cu + H2O
(2)2Cu+ = Cu + Cu2+
还 原 剂
氧化数由0变为+1(升高)
氧 化
CuO + H2= Cu + H2O
氧化数升高的元素:
2As3+ →
3S2– →
2As5+ 3S6+
升高 4 升高24
共升高 28
N5+ → N2+
降低3
3As2S3 + 28HNO3 6H3AsO4 + 9 H2SO4 +
28NO 左边28个H, 84个O ;右边36个H,88个 O 左边比右边少8个H,少4个O
❖ Cl2+2KI=2KCl+I2
还原反应Cl2+2e=2Cl氧化反应 2I--2e=I2
氧化还原半反应
氧化还原半反应式中,氧化数较高的物 质称为氧化型物质,氧化数较低的物质 称为还原型物质。
7.1.3 氧化还原电对
❖ 同一元素的氧化型和还原型构成的共轭体 系称为氧化还原电对。
用“氧化型/还原型”表示。
❖ 氧化剂:得电子的物质,氧化数降低。
❖ 还原剂:失电子的物质,氧化数升高。
❖ 氧化反应:失电子即氧化数升高Biblioteka 过程,2I- - 2e I2
❖ 还原反应:得电子即氧化数降低的过程,
Cl2 + 2e
2Cl-
❖ 氧化性:得电子的能力
❖ 还原性:失电子的能力
反应物 电子 发生反 氧化数 呈现
得失 应
变化 性质
剂
氧化数由+2变为0(降低)
还原反应:CuO+2H++2e≒Cu+H2O 氧化反应:H2+2OH--2e≒2H2O
氧化还原反应分类 :
(1)将氧化数变化发生在不同物质中不同 元素间的反应称为一般氧化还原反应 .
(2)若氧化数的变化发生在同一物质中不同 元素间的反应称为自身氧化还原反应。
+5 -2 -1 0
