精细化学品计算题
中考化学化学计算题题20套(带答案)

中考化学化学计算题题20套(带答案)一、中考化学计算题1.某粗盐样品仅含NaCl和MgCl2,为探究粗盐中NaCl的质量分数,某研究性小组取了10g样品,加适量水使其完全溶解后,加入20g 5%的氢氧化钠溶液,测得相关数据如图。
(1)请列式计算该粗盐样品中NaCl的质量分数为____________。
(2)当加入氢氧化钠溶液至ag时,此时所得溶液中溶质的质量是____________?【答案】90.5% 10.22g【解析】(1)根据氯化镁与氢氧化钠反应的化学方程式,由氢氧化镁的质量求出氯化镁的质量即可求出氯化钠的质量,再计算出粗盐样品中NaCl的质量分数;(2)根据图像分析解答。
(1)设样品中氯化镁的质量为x,反应生成氯化钠的质量为y。
MgCl2+ 2NaOH=Mg(OH) 2↓+2NaCl95 58 117x 0.58g y95581170.58x g y==x=0.95gy=1.17g样品中氯化钠的质量为10g-0.95g=9.05g该粗盐样品中NaCl的质量分数为9.0510gg×100%=90.5%(2)当加入氢氧化钠溶液至ag时,此时所得溶液中溶质的质量为10g-0.95g+1.17g=10.22g 答:(1)该粗盐样品中NaCl的质量分数90.5%;(2)当加入氢氧化钠溶液至ag时,此时所得溶液中溶质的质量10.22g。
2.现有碳酸钠和氯化钠的固体混合物12.6g,其中含氧元素4.8g,将该混合物加入到一定质量的稀盐酸中,恰好完全反应,得到137g氯化钠溶液。
计算:(l)原固体混合物中碳酸钠的质量分数(结果保留至0.1%)______;(2)所用稀盐酸中溶质的质量分数(结果保留至0.1%)______。
【答案】84.1% 5.7%【解析】【分析】【详解】(l)原固体混合物中碳酸钠的质量分数4.8g÷=10.6g;混合物中碳酸钠的质量分数为10.6g÷12.6g×100%≈84.1%;(2)设盐酸中溶质的质量为x,生成二氧化碳质量为y2322Na CO+2HCl=2NaCl+H O+CO106734410.6g x y↑1067344==10.6g x yx=7.3gy=4.4g所用稀盐酸中溶质的质量分数7.3g÷(137g+4.4g-12.6g)×100%≈5.7%3.为测定某大理石样品中碳酸钙(杂质不溶于水也不参与反应)的质量分数,某小组的同学进行了如下实验(水和氯化氢的挥发忽略不计):取12.5g样品研碎放入烧杯中,每次加入20.8 g稀盐酸后并用电子天平称量,记录实验数据如下。
化学计算题试题含答案
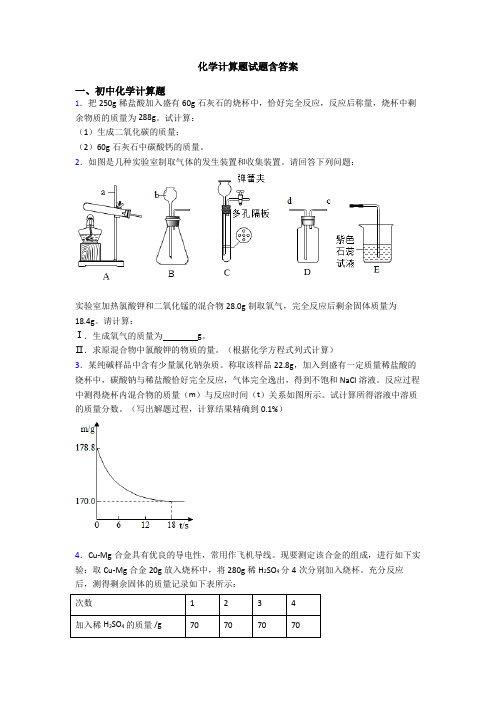
化学计算题试题含答案一、初中化学计算题1.把250g稀盐酸加入盛有60g石灰石的烧杯中,恰好完全反应,反应后称量,烧杯中剩余物质的质量为288g。
试计算:(1)生成二氧化碳的质量;(2)60g石灰石中碳酸钙的质量。
2.如图是几种实验室制取气体的发生装置和收集装置。
请回答下列问题:实验室加热氯酸钾和二氧化锰的混合物28.0g制取氧气,完全反应后剩余固体质量为18.4g。
请计算:Ⅰ.生成氧气的质量为g。
Ⅱ.求原混合物中氯酸钾的物质的量。
(根据化学方程式列式计算)3.某纯碱样品中含有少量氯化钠杂质。
称取该样品22.8g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液。
反应过程中测得烧杯内混合物的质量(m)与反应时间(t)关系如图所示。
试计算所得溶液中溶质的质量分数。
(写出解题过程,计算结果精确到0.1%)4.Cu-Mg合金具有优良的导电性,常用作飞机导线。
现要测定该合金的组成,进行如下实验:取Cu-Mg合金20g放入烧杯中,将280g稀H2SO4分4次分别加入烧杯。
充分反应后,测得剩余固体的质量记录如下表所示:次数1234加入稀H2SO4的质量 /g7*******(2)所用稀H2SO4 中溶质的质量分数。
(3)第1次反应后所得溶液中溶质的质量分数。
(计算结果精确到0.1%)5.某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的质量分数,取10g样品放入烧杯中,再取60g稀硫酸分六次加入烧杯中,充分反应,实验数据如下:的值为.(2)黄铜样品中锌的质量分数为.(写出计算步骤,下同)(3)所用稀硫酸的溶质质量分数为多少?6.某课外小组同学为了测定石灰石中碳酸钙的质量分数,取某地石灰石样品10.0g于烧杯中,将50.0g稀盐酸分5次加入烧杯中,充分反应后(杂质不与稀盐酸反应),测得剩余固体的质量记录如下:(1)X的值为_____。
(2)计算该实验中产生二氧化碳的质量。
化学计算题(通用15篇)

化学计算题(通用15篇)化学计算题第1篇化学反应过程中各物质的物理量往往是符合一定的数量关系的,这些数量关系就是通常所说的反应规律,表现为通式或公式,包括有机物分子通式,燃烧耗氧通式,化学反应通式,化学方程式,各物理量定义式,各物理量相互转化关系式等,甚至于从实践中自己总结的通式也可充分利用.熟练利用各种通式和公式,可大幅度减低运算时间和运算量,达到事半功倍的效果.[例11]120℃时,1体积某烃和4体积O2混和,完全燃烧后恢复到原来的温度和压强,体积不变,该烃分子式中所含的碳原子数不可能是()A、1B、2C、3D、4本题是有机物燃烧规律应用的典型,由于烃的类别不确定,氧是否过量又未知,如果单纯将含碳由1至4的各种烃的分子式代入燃烧方程,运算量大而且未必将所有可能性都找得出.应用有机物的燃烧通式,设该烃为CXHY,其完全燃烧方程式为:CXHY+(X+Y/4)O2==XCO2+Y/2H2O,因为反应前后温度都是120℃,所以H2O为气态,要计体积,在相同状况下气体的体积比就相当于摩尔比,则无论O2是否过量,每1体积CXHY只与X+Y/4体积O2反应,生成X体积CO2和Y/2体积水蒸气,体积变量肯定为1-Y/4,只与分子式中氢原子数量有关.按题意,由于反应前后体积不变,即1-Y/4=0,立刻得到分子式为CXH4,此时再将四个选项中的碳原子数目代入,CH4为甲烷,C2H4为乙烯,C3H4为丙炔,只有C4H4不可能.化学计算题第2篇物质在参加反应时,化合价升降的总数,反应物和生成物的总质量,各物质中所含的每一种原子的总数,各种微粒所带的电荷总和等等,都必须守恒.所以守恒是解计算题时建立等量关系的依据,守恒法往往穿插在其它方法中同时使用,是各种解题方法的基础,利用守恒法可以很快建立等量关系,达到速算效果.[例10] 已知某强氧化剂[RO(OH)2]+能被硫酸钠还原到较低价态,如果还原含×10-3mol[RO(OH)2]+的溶液到低价态,需的亚硫酸钠溶液,那么R元素的最终价态为+3 +2 +1因为在[RO(OH)2]-中,R的化合价为+3价,它被亚硫酸钠还原的同时,亚硫酸钠被氧化只能得硫酸钠,硫的化合价升高了2价,根据×10-3mol[RO(OH)2]-与12mlו的亚硫酸钠完全反应,亚硫酸钠共升×价,则依照升降价守恒,×10-3mol[RO(OH)2]-共降也是价,所以每摩尔[RO(OH)2]-降了2价,R原为+3价,必须降为+1价,故不需配平方程式可直接选C。
例析初三化学金属类计算题的常见解法初三化学计算题

例析初三化学金属类计算题的常见解法初三化学计算题在初三化学中,金属类计算题是非常常见的。
这类题目主要涉及到金属的质量、体积、密度、摩尔质量等之间的关系,需要运用化学知识和数学运算来解答。
下面以几个常见的金属类计算题为例,详细解析其解题思路和解法。
1. 金属的密度为5.8 g/cm³,质量为38 g,请计算该金属的体积。
解题思路:根据密度的定义,密度=质量/体积。
我们已知密度和质量,所以通过这个公式可以计算出体积。
解题步骤:密度=质量/体积,即5.8=38/体积通过移项变形,可以得到体积=质量/密度代入已知数值,体积= 38 / 5.8 ≈ 6.55 cm³ (保留两位小数)2. 铁锭的摩尔质量为55.85 g/mol,质量为125 g,请计算该铁锭的摩尔数。
解题思路:摩尔质量表示每一摩尔物质的质量,而摩尔数表示物质的量。
我们可以根据质量和摩尔质量的关系来计算摩尔数。
解题步骤:摩尔质量=质量/摩尔数,即55.85=125/摩尔数通过移项变形,可以得到摩尔数=质量/摩尔质量代入已知数值,摩尔数= 125 / 55.85 ≈ 2.238 mol (保留三位小数)3.一些金属在250mL的容器中,质量为90g,请计算该金属的密度。
解题思路:密度的定义是质量与体积的比值,我们已知质量和体积,可以通过这个比值来计算密度。
解题步骤:密度=质量/体积,即密度=90g/250mL注意,体积的单位应该和密度单位一致。
在本题中,将mL换算为cm³,即密度= 90 g / 250 cm³计算得,密度≈ 0.36 g/cm³ (保留两位小数)4. 其中一种金属的质量为8.96 g,摩尔质量为63.55 g/mol,请计算该金属的摩尔数。
解题思路:与题目2类似,我们可以通过质量和摩尔质量的关系来计算摩尔数。
解题步骤:摩尔质量=质量/摩尔数,即63.55=8.96/摩尔数通过移项变形,摩尔数=质量/摩尔质量代入已知数值,摩尔数= 8.96 / 63.55 ≈ 0.141 mol (保留三位小数)通过以上四个例子的解析,我们可以看出,金属类计算题的解答方法主要是根据已知条件和化学公式之间的关系进行计算。
大学化学计算题汇总

大学化学计算题汇总1. 分子式计算题问题描述给定化合物的分子式,计算其相对分子质量。
解决方法通过分子式中各元素的原子质量,可以计算出化合物的相对分子质量。
实例分子式为H2O的化合物相对分子质量为:\[M(H2O)=2 \times M(H) + M(O)\]2. 反应计算题问题描述给定化学反应的反应方程和反应物的摩尔数,计算产物的摩尔数。
解决方法根据反应方程中各物质的化学计量关系,可以计算出产物的摩尔数。
实例对于反应方程\[2H2 + O2 \rightarrow 2H2O\],若反应物H2的摩尔数为3mol,O2的摩尔数为2mol,则产物H2O的摩尔数为:\[n(H2O)=2 \times n(H2) = 2 \times 3mol = 6mol\]3. 溶解度计算题问题描述给定一种物质在溶剂中的溶解度,计算所溶解物质的摩尔浓度。
解决方法根据溶解度的定义,溶解度可以表示为溶解物质在单位体积溶剂中的摩尔数。
实例若物质A在溶剂中的溶解度为0.5mol/L,则溶液中物质A的摩尔浓度为0.5mol/L。
4. 稀释计算题问题描述给定一个已知浓度的溶液及其体积,计算稀释后的溶液的浓度。
解决方法根据稀释液体积和浓度的关系,可以计算出稀释后的溶液浓度。
实例若有100mL浓度为0.5mol/L的溶液,将其稀释至500mL,则稀释后的溶液浓度为:\[C_{diluted} = \frac{V_{concentrated} \timesC_{concentrated}}{V_{diluted}} = \frac{100mL \times0.5mol/L}{500mL} = 0.1mol/L\]5. 配平化学方程式计算题问题描述给定不平衡的化学方程式,计算平衡条件下各物质的摩尔数。
解决方法通过配平方程式,可以得到各物质在平衡条件下的摩尔数比例。
实例对于方程式\[H2 + O2 \rightarrow H2O\],在平衡条件下,若H2的摩尔数为2mol,O2的摩尔数为1mol,则H2O的摩尔数也为2mol。
宁波工程学院化工原理计算题

第五单元 精 馏5—1.若苯-甲苯混和液在45℃时沸腾,总压为20.3kpa 。
已知在45℃时,纯苯的饱和蒸气压kpa p 7.220=苯,纯甲苯的饱和蒸气压kpa p 6.70=甲苯.求其气液相的平衡组成及相对挥发度。
解:(1)平衡时苯的液相组成x 苯、气相组成y 苯84.01.157.126.77.226.73.20000==--=--=甲苯苯甲苯苯p p p p x 而94.084.03.207.220=⨯=⋅=苯苯苯x p p y 因苯—甲苯可当作理想溶液,故相对挥发度为:0.36.77.2200≈==甲苯苯p p α 本题要求掌握泡、露点方程及其应用。
5-3.在一两组分连续精馏塔中,进入精馏段中某层理论板n 的气相组成y n +1为0.75,从该板流出的液相组成x n 为0。
65(均为摩尔分数),塔内气液比V/L=2,物系的相对挥发度α为2.5,求:1)回流比R ;2)流入该板的液相组成x n -1;3)从该板上升的蒸气组成y n 解:1)求R 由211=+=R R V L (1分)可解出:2R =R +1,R =1(2)求x n -1 ①由精馏段操作线方程111+++=+R x x R R y D n n ,得265.02175.0D x +=⨯ 解出x D =0.85(2分) ②因111+++=-R x x R R y D n n ,代入已知量得 285.021823.01+=-n x ,解出796.01=-n x 3)求y n可用气液平衡方程由α、x n 求出y n()823.065.05.1165.05.211=⨯+⨯=-+⋅=n n n x x y αα 本题要求熟练运用操作线方程和平衡方程解决精馏过程有关计算问题。
5—4.在泡点进料下,某两组分连续精馏塔的操作线方程为:精馏段:263.0723.0+=x y提馏段: 1.250.0187y x =-求:1)回流比;2)馏出液;3)釜残液的组成;4)原料液的组成。
【化学】初中化学化学计算题练习题
【化学】初中化学化学计算题练习题一、中考化学计算题1.某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的质量分数,取10克样品放入烧杯中,再取60克稀硫酸分六次加入烧杯中,均充分反应,实验数据如下:第六第一次第二次第三次第四次第五次次加入稀硫酸的日101010101010(g)剩余固体的质量(g)9.358.78.057.4 6.75 6.75(1)黄铜样品中锌的质量分数为多少?(写出计算步骤,下同)(2)所用稀硫酸的质量分数为多少?【答案】(1)32.5%;(2)9.8%【解析】质量分数的一种常用的计算方法是分别计算出目的物质的质量和样品的总质量,然后求比值。
第(2)问中的化学反应方程式以及计算是关键。
(1)10g样品反应完全后,剩下6.75g为铜的质量,所以锌的质量为二亭-6-5_f=三二M 所以样品中锌的质量分数为(2)设在第二次加入稀硫酸后,参加反应硫酸的质量为x,据表中数据知,参加反应的锌的质量为根据反应方程式65980.65gx有,解得所用稀硫酸的质量分数为2.若要生产含杂质4%的生铁100t,需要含氧化铁60%的赤铁矿石的质量是多少(要求写出计算过程,计算结果保留小数点后1位)【答案】228.6t【解析】试题分析:含杂质物质的计算要把混合物的质量转化为纯物质的质量,即纯物质质量=含杂质物质质量X纯度,再把纯物质的质量带入化学方程式计算。
最后再把计算出的纯物质质量转换为含杂质物质的质量。
[解]设:需要向炼铁高炉中投入这种铁矿石的质量为X高总Fe2O3+3CO==2Fe+3CO216011260%x(1-4%)xlOOtx="228.6"t答:需要向炼铁高炉中投入这种铁矿石的质量为228.6t。
考点:含杂质的物质利用化学方程式的计算3.取24g氢氧化钠和碳酸钠的固体混合物,加136g水完全溶解后,再缓慢加入石灰乳(氢氧化钙和水的混合物)至恰好完全反应,过滤得到4g沉淀和10%的氢氧化钠溶液•试计算反应中应加入石灰乳的质量是?【答案】73.6g【解析】【详解】设:24g样品中碳酸钠的质量为x,生成的氢氧化钠的质量为yCa(OH)2+Na2CO3=CaCO3^+2NaOH10610080x4gyx=4.24gy=3.2g.得到的10%NaOH溶液的质量为(24g-4.24g+3.2g)+10%=229.6g加入石灰乳的质量为229.6g+4g-136g-24g=73.6g答:应加入石灰乳的质量是73.6go4.化学兴趣小组的同学取10g铜锌合金样品于烧杯中,向其中加入一定量的稀硫酸,当加入稀硫酸的质量为93.7g时,恰好完全反应,生成气体的质量与反应时间的关系如图所示,试回答下列问题:(1)样品中锌的质量为g 。
化学计算题试题含答案
化学计算题试题含答案一、初中化学计算题1.鸡蛋壳的主要成分是碳酸钙(其他成分不溶于水也不与酸反应)。化学兴趣小组为了测定鸡蛋壳中碳酸钙的含量,做了如下实验,请回答下列问题:(1)鸡蛋壳发生反应的化学方程式为 ____________;(2)根据已知条件列出求解碳酸钙质量(x)的比例式 _____________;(3)该鸡蛋壳中碳酸钙的质量分数为 ____________;(4)最终所得溶液中溶质的质量分数为 _____________;(5)用 25%的盐酸配制上述稀盐酸需要加水的体积为 ___________。2.氧化亚铜(Cu2O)可用于生产船底防污漆,防止海生物对船舶设备的污损。
现将Cu2O 和Cu的固体混合物6.8g放入烧杯中,加入23.0g稀硫酸,恰好完全反应后,过滤,并用15.0g蒸馏水洗涤,得到滤液和4.8g干燥固体(已知:Cu2O+H2SO4=CuSO4+Cu+H2O)。
请计算:(1)Cu2O中铜元素的化合价为_____价。
(2)所得滤液中溶质的质量分数_____。
(3)若将上述23.0g稀硫酸,稀释为溶质的质量分数为4.9%的溶液,需要加入水的质量_____。
3.兴趣小组用氧化铜样品(含少量杂质铜)进行了如下实验:用一定量的稀盐酸溶解5g 样品,充分反应后过滤,得到100g滤液,向滤液加入NaOH溶液,所得实验数据如图:(1)从图可知,加入的NaOH溶液先跟滤液中的反应(填化学式)。
(2)求NaOH溶液的溶质质量分数(写出计算过程)(3)请画出滤液中氯化铜质量随NaOH溶液质量变化的图像(4)另取5g该样品,用足量的CO还原成纯铜,理论上可得到纯铜 g。
4.某课外活动小组为测定一包碳酸钠样品的质量分数,取来了一些样品,准确称取样品10g放于烧杯中(杂质既不溶于水,也不与稀盐酸反应),向其中加入足量的稀盐酸,根据实验测得的数据绘制出所加稀盐酸的质量和放出的CO2的质量关系图。
(1)10g样品可以产生多少克二氧化碳?(2)该样品中碳酸钠的质量分数是多少?(3)加入稀盐酸到恰好完全反应时,所得的溶液中溶质的质量分数是多少?(写出计算过程)5.某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的质量分数,取10g样品放入烧杯中,再取60g稀硫酸分六次加入烧杯中,充分反应,实验数据如下:第1次第2次第3次第4次第5次第6次加入稀硫酸的质量(g)101010101010剩余固体的质量(g)9.35m8.057.4 6.75 6.75的值为.(2)黄铜样品中锌的质量分数为.(写出计算步骤,下同)(3)所用稀硫酸的溶质质量分数为多少?6.“学化学,爱化学,用好化学”学习小组为测出鸡蛋壳(主要成分是碳酸钙)中碳酸钙的质量分数,某同学称取已洗净、晾干、研成粉末的鸡蛋壳10g置于烧杯中,将烧杯放在电子天平上,往烧杯中平均分5次加入50g的稀盐酸,测得实验数据如表:实验次数12345加入稀盐酸质量/g10.020.030.040.050.0剩余物质质量/g19.028.037.046.756.7(1)第_____ 次实验时鸡蛋壳已经完全反应。
初三化学化学计算题题20套(带答案)
初三化学化学计算题题20套(带答案)1. 假设有一块铁块,其质量为56克。
求该铁块中含有的铁原子数。
解答:我们需要知道铁的摩尔质量。
铁的摩尔质量约为56克/摩尔。
因此,该铁块中含有的铁原子数为56克 / 56克/摩尔 = 1摩尔。
由于1摩尔物质中含有6.022 x 10²³个原子,所以该铁块中含有的铁原子数为1摩尔x 6.022 x 10²³个/摩尔= 6.022 x 10²³个。
2. 某化学反应中,反应物A和反应物B的化学计量比为2:3。
如果反应物A的质量为24克,求反应物B的质量。
解答:我们需要根据化学计量比计算出反应物B的质量。
由于反应物A和反应物B的化学计量比为2:3,所以反应物B的质量为24克x (3/2) = 36克。
3. 在一定条件下,一定量的氧气与一定量的氢气完全反应,了36克水。
求反应中消耗的氧气和氢气的质量。
解答:我们需要根据水的化学式H₂O计算出水的摩尔质量。
水的摩尔质量为2 x 1.008克/摩尔 + 16.00克/摩尔 = 18.016克/摩尔。
因此,36克水的物质的量为36克 / 18.016克/摩尔 = 2摩尔。
由于水的化学计量比为2:1,所以反应中消耗的氢气的物质的量为2摩尔,质量为2摩尔 x 2.016克/摩尔 = 4.032克。
同样,消耗的氧气的物质的量为1摩尔,质量为1摩尔 x 32.00克/摩尔 = 32.00克。
4. 某溶液中,溶质的质量分数为10%。
如果该溶液的质量为500克,求溶质的质量。
数为10%,即溶质的质量占溶液总质量的10%。
因此,溶质的质量为500克 x 10% = 50克。
5. 在一定条件下,一定量的氢气和一定量的氧气完全反应,了水。
如果反应中消耗的氢气的质量为2克,求反应中消耗的氧气的质量。
解答:我们需要根据水的化学式H₂O计算出水的摩尔质量。
水的摩尔质量为2 x 1.008克/摩尔 + 16.00克/摩尔 = 18.016克/摩尔。
【高中化学】选修(2)4.2.1表面活性剂 精细化学品
普通高中课程标准实验教科书—化学选修第二册[人教版]第四单元化学与技术的发展课题2 表面活性剂精细化学品教学目标:1.通过实例了解精细化工产品的生产特点,知道精细化工在社会发展中的作用。
2、了解我国精细化工的发展现状。
教学重点、难点:通过实例了解精细化工产品的生产特点探究建议:1、参观当地的精细化工企业(或者观看有关的影像片、收集有关的资料),讨论精细化工发展的前景和可能存在的问题。
2、调查:化学在染整工艺中的应用。
课时划分:两课时教学过程:第一课时见PPT文件[课堂练习]1.衣物干洗正逐渐得到人们的普遍认可,目前世界各国干洗店公认的标准干洗剂是A、煤油B、酒精C、苯D、四氯乙烯2.下列物质中,不属于天然高分子的是A.牛油B.蚕丝C.酚醛树脂D.淀粉3.下列叙述中正确的是A.能发生酯化反应的酸一定是羧酸B.油脂水解后得到丙三醇C.天然蛋白质水解的最后产物是多种 -氨基酸D.淀粉、纤维素、油脂都是高分子化合物4.要证明硬脂酸具有酸性,可采用的正确实验是A.把硬脂酸溶于汽油,向溶液中加入石蕊试液变红B.把纯碱加入硬脂酸并微热产生泡沫C.把硬脂酸加热熔化加入金属钠产生气泡D.在稀NaOH溶液中加入酚酞,再加入硬脂酸并微热,红色变浅甚至消失5.下列说法正确的是A.不含其他杂质的天然油脂属于纯净物B.油脂在酸性或碱性条件下都比在纯水中易水解C.油脂的烃基部分饱和程度越大,熔点越低D.各种油脂水解后的产物中都有甘油6.1998年江西曾发生误食工业用猪油的中毒事件,调查原因是工业品包装中混入有机锡等,下列有关叙述正确的是A、猪油是天然高分子化合物B、猪油是高级脂肪酸甘油酯C、猪油发生皂化反应后,反应液使蓝色石蕊试纸变红D、猪油皂化反应完全后,反应液静置分为两层7.如何除去下列物质中所含少量的杂质?写出所需试剂,分离方法及所用仪器混合物所用试剂分离方法使用仪器①肥皂水(甘油)②乙酸酯(乙酸)③硬脂酸(硬酯酸钠)8.参考下列①~③项回答问题。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
精细化学品合成原理与工艺习题 六、计算题:
1、100mol苯胺在用浓硫酸进行溶剂烘培磺化时,反应物中含89mol对氨基苯磺酸,2mol苯胺, 另外还有一定数量的焦油物等副产物。试求苯胺的转化率、生成对氨基苯磺酸的选择性和理论收率。 解:苯胺的转化率 %00.98%1001002100X,
生成对氨基苯磺酸的选择性和理论效率:%82.90%10021001189S %89%1001001189Y 或 %89%82.90%00.98XSY 2、在苯的一氯化制氯苯时,为了减少二氯苯的生成量,每100mol苯用40mol氯气,反应产物中含38mol氯苯, 1mol二氯苯,还有61mol未反应的苯,经分离后可回收60mol苯, 损失1mol苯,试求苯的单程转化率、总转化率、生成氯苯的选择性及生成氯苯的总收率。 解:苯的单程转化率 %00.39%10010061100X=单, 苯的总转化率 %5.97%1006010061100X=总
生成氯苯的选择性%44.97%100611001138S, 生成氯苯的总收率95.00%97.44%97.50=总Y
或 95.00%100601001138%-=总Y 3、在实际生产中,300kg对硝基甲苯(分子量为137)用20%的发烟硫酸800kg在100~125℃进行 一磺化制2-甲基-5-硝基苯磺酸,试计算其废酸的π值和ω(H2SO4)/[ω(H2SO4)+ω(H2O)]。 解:对硝基甲苯的量=300/137=2.19kmol 800kg20%发烟硫酸含H2SO4=800×104.5%=836kg 1
一磺化消耗H2SO4=2.19×98=214.62kg 18.81%10098806.2148009880)6.214836( 即 ω(H2SO4)/[ω(H2SO4)+ω(H2O)]=99.44% 4、欲配置1000kg质量分数为100%的H2SO4,要用多少千克质量分数为98%的硫酸和多少千克质量分数为20%的发烟硫酸? 解:20%发烟硫酸换算成H2SO4的百分含量为: ω(H2SO4)=100%+0.225 ω(SO3)=100%+0.225×0.2=104.5% 设用98%的硫酸Xkg,则发烟硫酸为(1000-X)kg 98%X+104.5×(1000-X)=1000×100% 解得 X=692.3kg 1000-X=307.7kg 即要用692.3kg98%的硫酸和307.7kg质量分数为20%的发烟硫酸。 5、用600kg质量分数为98%的硫酸和500kg的质量分数为20%的发烟硫酸, 试计算所配硫酸的质量百分比浓度?(以c(H2SO4)表示) 解:20%发烟硫酸换算成H2SO4的百分含量为: ω(H2SO4)=100%+0.225 ω(SO3)=100%+0.225×0.2=104.5% 所配硫酸的质量分数为 ω(H2SO4)=%9.100%100500600%5.104500%98600
6、设1kmol萘在一硝化时用质量分数为98%硝酸和98%硫酸,要求混酸的脱水值为1.35, 硝酸比φ为1.05,试计算要用98%硝酸和98%硫酸各多少千克?(在硝化锅中预先加有适量上一批的废酸, 计算中可不考虑,即假设本批生成的废酸的组成与上批循环非酸的组成相同)。 解:100%的硝酸用量=1.05kmol=1.05×63=66.15kg 98%的硝酸用量=66.15/0.98=67.5kg 2
所用硝酸中含水量=67.50-66.15=1.35kg 理论消耗HNO3=1.00kmol=63.00kg 剩余HNO3=66.15-63.00=3.15kg 反应生成水=1.00kmol=18.00kg 设所用98%的硫酸的质量为xkg;所用98%硫酸中含水为0.02xkg,则D.V.S.=35.102.01835.198.0x
x
解得x=27.41kg 即所用98%硫酸的质量为27.41kg
7、设1kmol萘在一硝化时用质量分数为98%硝酸和98%硫酸,要求混酸的脱水值为1.2, 硝酸比φ为1.05,试计算要用98%硝酸和98%硫酸各多少千克?(在硝化锅中预先加有适量上一批的废酸, 计算中可不考虑,即假设本批生成的废酸的组成与上批循环废酸的组成相同) 解:100%的硝酸用量=1.05kmol=1.05×63=66.15kg 98%的硝酸用量=66.15/0.98=67.5kg 所用硝酸中含水量=67.50-66.15=1.35kg 理论消耗HNO3=1.00kmol=63.00kg 剩余HNO3=66.15-63.00=3.15kg 反应生成水=1.00kmol=18.00kg 设所用98%的硫酸的质量为xkg;所用98%硫酸中含水为0.02xkg,则 D.V.S.=2.102.01835.198.0x
x,
解得x=26.51kg 即所用98%硫酸的质量为26.51kg 8、设1kmol萘在一硝化时用质量分数为98%硝酸和98%硫酸,要求混酸的脱水值为1.35, 硝酸比φ为1.05,试计算要用98%硫酸多少千克?(在硝化锅中预先加有适量上一批的 3
废酸,计算中可不考虑, 即假设本批生成的废酸的组成与上批循环非酸的组成相同) 解:100%的硝酸用量=1.05kmol=1.05×63=66.15kg 98%的硝酸用量=66.15/0.98=67.5kg 所用硝酸中含水量=67.50-66.15=1.35kg 理论消耗HNO3=1.00kmol=63.00kg 剩余HNO3=66.15-63.00=3.15kg 反应生成水=1.00kmol=18.00kg 设所用98%的硫酸的质量为xkg;所用98%硫酸中含水为0.02xkg, 则D.V.S.=35.102.01835.198.0xx 解得x=27.41kg 即所用98%硫酸的质量为27.41kg 9、设1kmol萘在一硝化时用质量分数为98%硝酸和98%硫酸,要求混酸的脱水值为1.35, 硝酸比φ为1.05,试计算所配混酸的质量组成。(在硝化锅中预先加有适量上一批的废酸, 计算中可不考虑,即假设本批生成的废酸的组成与上批循环非酸的组成相同) 解:100%的硝酸用量=1.05kmol=1.05×63=66.15kg 98%的硝酸用量=66.15/0.98=67.5kg 所用硝酸中含水量=67.50-66.15=1.35kg 理论消耗HNO3=1.00kmol=63.00kg 剩余HNO3=66.15-63.00=3.15kg 反应生成水=1.00kmol=18.00kg 设所用98%的硫酸的质量为xkg;所用98%硫酸中含水为0.02xkg, 则 D.V.S.=35.102.01835.198.0xx 解得x=27.41kg;所用98%硫酸的质量为27.41kg;混酸中含H2SO4=27.41×0.98=26.86kg; 4
所用98%硫酸中含水=27.41-26.86=0.55kg;故混酸中含水=1.35+0.55=1.90kg 混酸质量=67.5+27.41=94.91kg;混酸组成(质量分数):H2SO4 28.30%;HNO3 69.70% ;H2O 2.0% 10、60℃时甲醇的饱和蒸汽压是83.4kPa,乙醇的饱和蒸汽压是47.0kPa,二者可形成理想液态混合物, 若混合物的组成质量百分比各50%,求60℃时此混合物的平衡蒸气组成,以摩尔分数表示。 解:由题意可设甲醇为A物质,乙醇为B物质,MA=32,MB=46 kPapA4.83 kPapB0.47
5898.0465032503250AX 4102.05898.011ABXX 根据Raoult定律,易得 kPapA19.495898.04.83; kPapB28.194102.00.47 kPapppBA47.6828.1919.49;
718.047.6849.49ppyAA;282.0718.011AByy
11、苯在并流沸腾一氯化时,氯化液的质量分数组成是苯72%,氯苯28%,沸腾温度80℃, 在80℃时苯、氯苯的蒸汽压分别为101.3kPa、19.3kPa,按Raoult定律计算此混合物的平衡蒸气组成之比。(苯/氯苯) 解:由题意可设苯为A物质,氯苯为B物质,MA=78,MB=112.5 kPapA3.101 kPapB3.19
788.05.1122878727872AX
5
212.0788.011ABXX 根据Raoult定律,易得 kPapA82.79788.03.101 ; kPapB09.4212.03.19 kPapppBA91.8309.482.79;
951.09.8382.79ppyAA
049.0951.011AByy; 5.19049.0951.0BAyy 或 5.1909.482.79BABA
ppy
y
12、60℃时甲醇和乙醇可形成理想液态混合物,甲醇、乙醇的饱和蒸汽压分别为83.4kPa、 47.0kPa, 若混合物的组成质量百分比各50%,求60℃时此混合物的平衡蒸气组成之比。(平衡蒸气组成以摩尔分数表示) 解:由题意可设甲醇为A物质,乙醇为B物质,MA=32,MB=46 kPapA4.83 kPapB0.47
5898.0465032503250AX 4102.05898.011ABXX 根据Raoult定律,易得 kPapA19.495898.04.83; kPapB28.194102.00.47 kPapppBA47.6828.1919.49;
718.047.6849.49ppyAA282.0718.011AByy
546.2282.0/718.0BAyy 或 393.0718.0/282.0AB
y
y
13、在80℃时苯、氯苯的蒸汽压分别为101.3kPa、19.3kPa,苯在并流沸腾一氯化时, 氯化液的质量分数组成是苯80%,氯苯20%(沸腾温度80℃),按Raoult定律计算此混合物的平衡蒸气组成。
