化学配位化合物的立体构型
9.2 配位化合物空间结构及几何异构现象
9.2 配位化合物空间结构及几何异构现象
9.2.1 配位化合物的空间结构
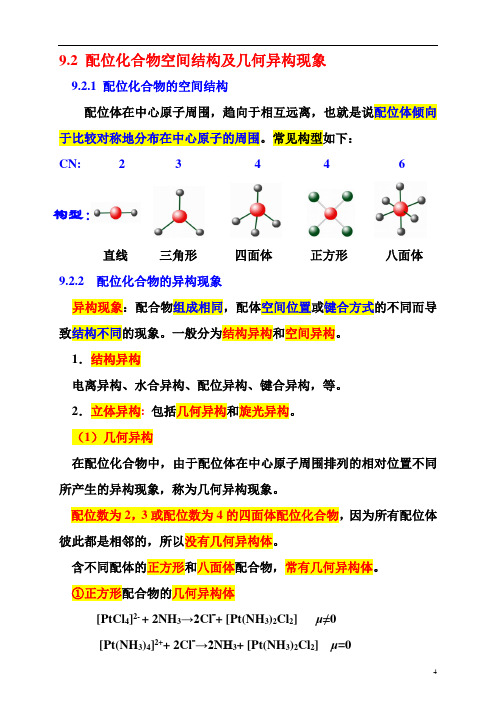
配位体在中心原子周围,趋向于相互远离,也就是说配位体倾向于比较对称地分布在中心原子的周围。
常见构型如下:
CN: 2 3 4 4 6
构型:
直线三角形四面体正方形八面体9.2.2 配位化合物的异构现象
异构现象:配合物组成相同,配体空间位置或键合方式的不同而导致结构不同的现象。
一般分为结构异构和空间异构。
1.结构异构
电离异构、水合异构、配位异构、键合异构,等。
2.立体异构:包括几何异构和旋光异构。
(1)几何异构
在配位化合物中,由于配位体在中心原子周围排列的相对位置不同所产生的异构现象,称为几何异构现象。
配位数为2,3或配位数为4的四面体配位化合物,因为所有配位体彼此都是相邻的,所以没有几何异构体。
含不同配体的正方形和八面体配合物,常有几何异构体。
①正方形配合物的几何异构体
[PtCl4]2- + 2NH3→2Cl-+ [Pt(NH3)2Cl2] μ≠0
[Pt(NH3)4]2++ 2Cl-→2NH3+ [Pt(NH3)2Cl2] μ=0
4。
配位数及其构形
一种非常罕见的六配位配合 物是具有三棱柱的几何构型, 之所 以罕见是因为在三棱柱构型中配 位原子间的排斥力比在三方反棱 柱构型中要大。
6 七配位化合物
大多数过渡金属都能形成七配位的化合物,其立 体化学比较复杂,已发现七配位化合物有下面几种构 型,但最常见的是前三种。
五角双锥
单帽八面体 单帽三角棱柱体 (帽在八面体的 (帽在三棱柱的 一个三角面上) 矩形面上)
其中最常的是四方反棱柱体和十二面体。
九配位的理想几何构型是三帽三角棱柱体,即在三 角棱柱的三个矩形柱面中心的垂线上,分别加上一个帽 子;另外一种构型是单帽四方反棱柱体,帽子在矩形的 上面。
三帽三角棱柱体
单帽四方反棱柱体
配 位 数 为 10 的 配
位多面体是复杂的, 通常遇到的有双帽四 方反棱柱体和双帽 12 面体。 双帽四方反棱柱体
三帽三角棱柱体单帽四方反棱柱体双帽四方反棱柱体双帽12面体配位数为10的配位多面体是复杂的通常遇到的有双帽四方反棱柱体和双帽12棱柱体棱柱体十一配位的化合物极少理论上计算表明配位数为十一的配合物很难具有某个理想的配位多面体
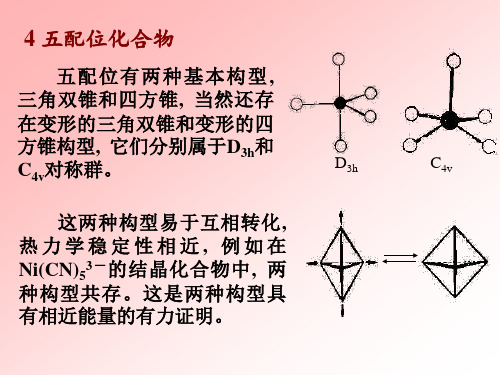
4 五配位化合物
五配位有两种基本构型 , 三角双锥和四方锥 , 当然还存 在变形的三角双锥和变形的四 方锥构型, 它们分别属于D3h和 C4v对称群。 这两种构型易于互相转化 , 热力学稳定性相近, 例如在 Ni(CN)53 - 的结晶化合物中 , 两 种构型共存。这是两种构型具 有相近能量的有力证明。
综合以上条件, 高配位的配位物, 其 中心离子通常是有 d0∼d2电子构型的第二、三过 渡系列的离子及镧系、锕系元素离子, 而且它们的氧 化态一般大于+3; 而常见的配体主要是F-、O2-、CN-、NO3-、 NCS-、H2O等。
化学配位化合物的立体结构与异构体练习题详解

化学配位化合物的立体结构与异构体练习题详解化学配位化合物的立体结构与异构体是化学领域中的重要概念,对于理解化学反应和化学性质起着关键作用。
在本文中,我们将详解一些关于化学配位化合物立体结构与异构体的练习题,帮助读者更好地理解这个概念。
一、以下是一些关于配位配合物立体结构的问题,请回答并说明原因:1. 对称型配合物的空间群是否一定具有反射面?2. 说一说平面六配位配合物的形状和空间构型。
3. 请画出一个具有三方截尖顶体及其等价面的四配位配合物的球棍模型。
4. 对于配位配合物[Ni(Cl)4]2-,根据VSEPR理论,它的形状是什么?5. 高配位数的配合物中,配位键倾角是否会改变?1. 对称型配合物的空间群是否一定具有反射面?答案:不一定具有反射面。
空间群是描述晶体中原子或分子排列的对称性的指标,它包含了各种对称操作,如旋转、反射、平移等。
对称型配合物的立体结构中,即使具有对称性,也不一定具有反射面。
因此,对称型配合物的空间群不一定具有反射面。
2. 说一说平面六配位配合物的形状和空间构型。
答案:平面六配位配合物具有八面体的空间构型,形状呈六角形平面。
在平面六配位结构中,配体以六个顶点均匀分布在配合物的一个平面上,而中心金属离子位于这个平面的中心。
3. 请画出一个具有三方截尖顶体及其等价面的四配位配合物的球棍模型。
答案:[球棍模型]4. 对于配位配合物[Ni(Cl)4]2-,根据VSEPR理论,它的形状是什么?答案:根据VSEPR理论,[Ni(Cl)4]2-的形状是正方形平面。
根据VSEPR理论,该配合物的中心金属离子Ni2+被四个氯离子(Cl-)配位,形成一个正方形平面结构。
5. 高配位数的配合物中,配位键倾角是否会改变?答案:是的,高配位数的配合物中配位键倾角会改变。
配位键倾角是指配体和中心金属离子之间的键角,它受到电子云的排斥作用影响。
在高配位数的配合物中,由于配体的增加,电子云之间的排斥作用增强,导致配位键倾角变小。
2-1配合物的立体化学

[Co(en)3]3+
2、旋光异构
四配位 Td点群: MABCD
乳酸
OH
COOH C H CH3
六配位Oh点群: M(L-L)3, cis-M(L-L)2A2, MA2B2C2, MABCDEF eg. [Co(en)3]3+
N N Co N N N N
N N Co N N N N
D (+) Co(en)33+
配合物的异构类型
1、几何异构(geometric isomerism) 2、旋光异构(chiral isomerism)
异构类型
3、键合异构(linkage isomerism) 4、电离异构(ionization isomerism) 5、溶剂合异构(solvate isomerism)
6、配位异构(coordination isomerism)
空间斥力:配体间静电排斥, 与配体大小有关。
立方体场
Oh
四面体场
Td
球形场
八面体场 四方畸变
Oh D4h
平面四方场
D4h
中心离子的电子组态为:d0
d5
d10 d1
d6
通常与弱场配体形成 Td构型配合物。 例如: TiBr4 (d0),
FeCl4- (d5),
ZnCl42- (d10),
VCl4 (d1),
③ 同类配体(同为阴离子或同为中性分子)以配 位原子元素符号英文字母的先后排序。
配位化合物的命名原则:
① 阴离子名称在前,阳离子名称在后,阴、阳离子名称 之间用“化”字或“酸”字相连。此时,配阴离子一 律当含氧酸根看待; ② 配位个体中:配体名称在前,中心原子名称在后;
不同配体名称的顺序同书写顺序,相互之间以中圆点 “”分开,最后一种配体名称之后缀以“合”字;
高中化学配位化合物立体构型与配位数关系题目解析

高中化学配位化合物立体构型与配位数关系题目解析在高中化学的学习中,配位化合物是一个重要的概念。
配位化合物是由中心金属离子和周围的配体离子或分子通过配位键结合而成的化合物。
在配位化合物中,配位数和立体构型是两个重要的概念,它们之间存在着一定的关系。
本文将通过具体的题目举例,分析和说明配位化合物的立体构型与配位数之间的关系,并给出解题技巧和使用指导。
题目一:下列哪种配位数的配位化合物一定是正四面体构型?A. 2B. 4C. 6D. 8解析:这道题目考察了正四面体构型与配位数之间的关系。
正四面体构型是指配位化合物中,中心金属离子与四个配体离子或分子形成四个配位键,构成一个四面体的立体构型。
在正四面体构型中,中心金属离子与四个配体离子或分子的配位数为4。
根据题目的选项,选项A的配位数为2,不符合正四面体构型的要求;选项B的配位数为4,符合正四面体构型的要求;选项C的配位数为6,不符合正四面体构型的要求;选项D的配位数为8,不符合正四面体构型的要求。
因此,答案是B. 4。
解题技巧:对于此类题目,需要记住不同立体构型对应的配位数。
正四面体构型对应的配位数为4,八面体构型对应的配位数为6,以此类推。
通过对配位数和立体构型的了解,可以快速判断出正确的答案。
题目二:下列哪种配位数的配位化合物一定是八面体构型?A. 2B. 4C. 6D. 8解析:这道题目考察了八面体构型与配位数之间的关系。
八面体构型是指配位化合物中,中心金属离子与六个配体离子或分子形成六个配位键,构成一个八面体的立体构型。
在八面体构型中,中心金属离子与六个配体离子或分子的配位数为6。
根据题目的选项,选项A的配位数为2,不符合八面体构型的要求;选项B的配位数为4,不符合八面体构型的要求;选项C的配位数为6,符合八面体构型的要求;选项D的配位数为8,不符合八面体构型的要求。
因此,答案是C. 6。
解题技巧:对于此类题目,同样需要记住不同立体构型对应的配位数。
配位化合物中的配位数与配位立体构型的关系

配位化合物中的配位数与配位立体构型的关系配位化合物是由配位键连接的中心金属离子和一个或多个配体组成的化合物。
在配位化合物中,配位数表示配体与中心金属离子之间的配位键的数量,而配位立体构型则描述了配位化合物中配体相对于中心金属离子的排布方式。
配位数和配位立体构型之间存在着密切的关系,本文将对其进行探讨。
一、配位数的概念及计算方法配位数是指配位化合物中一个中心金属离子周围的配位键的数量。
配位数的大小直接影响着配位化合物的性质和化学活性。
一般来说,同一元素的中心离子在不同配体的配位下可以存在不同的配位数。
例如,对于具有d轨道的过渡金属离子来说,可以形成2、4、6、8等不同的配位数。
计算配位数的方法有多种,常用的有以下几种:1. 电子剖面法:根据中心金属离子的电子剖面,统计位于能量最低的n个电子层的电子数,即为配位数。
2. 伊文斯方法:对过渡金属离子来说,配位数等于其周围配体的个数。
3. 立体效应:根据配位键的键长和配体的立体效应判断配位数。
二、配位立体构型的概念及分类配位立体构型是指配位化合物中配体相对于中心金属离子的排布方式。
不同的配位数对应着不同的配位立体构型。
常见的配位立体构型有以下几种:1. 线形构型:当配位数为2时,配体以线性方式与中心金属离子相连,共享两对电子。
2. 方阵构型:当配位数为4时,配体以方阵的形式围绕中心金属离子排列,共享四对电子。
3. 八面体构型:当配位数为6时,配体以八面体的形式环绕中心金属离子排列,共享六对电子。
4. 正四面体构型:当配位数为4时,配体以正四面体的形式排列,共享四对电子。
5. 正六面体构型:当配位数为6时,配体以正六面体的形式排列,共享六对电子。
三、配位数与配位立体构型的关系配位数和配位立体构型之间存在着密切的关系,一般来说,配位数增加会导致配位立体构型的改变。
例如,当配位数从4增加到6时,配位立体构型从方阵构型转变为八面体构型。
这是由于随着配位数的增加,配体的排布方式发生了改变,从而导致了配位立体构型的转变。
配位化合物的立体构型与同分异构体
配位化合物的立体构型与同分异构体配位化合物是由一个中心金属离子与周围的配体形成的,其中配体可以是各种无机或有机分子。
这些配位化合物具有不同的立体构型,这取决于金属离子的电子构型和配体的性质。
在化学领域中,研究配位化合物的立体构型和同分异构体对于理解其性质和应用具有重要意义。
一、正方形配位正方形配位是一种常见的配位构型,其中中心金属离子周围的配体分别位于配位面的四个顶点上。
当配体是单原子配体时,正方形配位通常是以四个相同的配体环绕金属离子形成的。
例如,在[Co(NH3)4]2+离子中,四个氨分子以正方形构型周围环绕着钴离子。
正方形配位也可以由配体的两个双电子对形成,使配位化合物的电子构型更为稳定。
二、八面体配位八面体配位是另一种常见的配位构型,其中中心金属离子周围的配体形成一个八面体的结构。
八面体配位通常由六个配位点环绕金属离子而成,配位点位于八个顶点上。
例如,[Co(NH3)6]3+离子以八面体构型形成,其中六个氨配体分别位于八个顶点上。
三、四面体配位四面体配位是一种较少见的配位构型,其中中心金属离子周围的配体形成一个四面体的结构。
四面体配位通常由四个配位点环绕金属离子而成,配位点位于四个顶点上。
四面体配位对于d0和d10电子构型的金属离子特别常见。
例子包括[Ni(CN)4]2-离子,其中四个氰根离子形成四面体构型周围包围着镍离子。
同分异构体是一类化合物,它们具有相同的化学式但不同的结构。
在配位化合物中,同分异构体的存在可以由立体构型的差异导致。
具有完全相同的化学式的同分异构体可以显示出不同的物理和化学性质,因为它们的立体构型影响了它们的分子形状和空间排列。
以[CoCl2(en)2]+离子为例,它是由一个钴离子和两个氯化物配体以及两个乙二胺配体构成的。
该离子可以有两种同分异构体:光学异构体和构效异构体。
光学异构体是由于手性中心存在而产生的异构体。
在[CoCl2(en)2]+离子中,乙二胺配体具有两个官能团,因此该离子可以形成两个非对映体。
高三化学配位化合物的配位数与立体构型
高三化学配位化合物的配位数与立体构型化学配位化合物是由中心金属离子和周围配体离子或分子组成的。
在配位化合物中,中心金属离子能够与不同数目的配体形成不同配位数的配合物,并且配位数的不同还可以导致配合物的立体构型发生变化。
本文将探讨高三化学中配位化合物的配位数与立体构型的关系。
一、配位数的定义和影响因素配位数指的是中心金属离子所配位的配体数目。
常见的配位数包括2、4、6以及8等。
而影响配位数的主要因素有以下几个方面。
1. 配体的种类和性质:不同的配体具有不同的配位能力,一些配体能够给予中心金属离子更多的电子密度,使得中心金属离子更容易接受更多的配位。
2. 配体的空间构型:一些配体本身的空间构型限制了其与中心金属离子的配位方式,从而影响了配位数的大小。
3. 中心金属离子的电子排布:中心金属离子的电子排布也会影响其对配位数的选择,一些电子排布不利于接受多个配位。
二、配位数与立体构型的关系配位数的不同将导致配位化合物的立体构型发生变化。
根据配位数的不同,配合物的立体构型分为以下几类。
1. 配位数为2的立体构型:配位数为2的立体构型形式上类似于线性结构,中心金属离子和配体排列在一条直线上。
常见的例子是[Ni(CO)4],其中镍离子与4个一氧化碳分子形成配位键。
2. 配位数为4的立体构型:配位数为4的立体构型形式上类似于四面体结构或平面方形结构。
四面体结构中,中心金属离子和4个配体形成四面体的形状,常见的例子是[TiCl4]。
平面方形结构中,中心金属离子和4个配体形成平面方形的形状,常见的例子是[Ni(CN)4]2-。
3. 配位数为6的立体构型:配位数为6的立体构型常见的是八面体结构或正八面体结构。
八面体结构中,中心金属离子和6个配体构成八面体的形状,常见的例子是[Co(NH3)6]3+。
正八面体结构中,中心金属离子和6个配体构成正八面体的形状,常见的例子是[Cr(H2O)6]3+。
4. 配位数为8的立体构型:配位数为8的立体构型常见的是双四面体结构或正二十面体结构。
配位化合物的立体构型练习题
配位化合物的立体构型练习题题目1:考虑一个具有化学式[Co(en)3]Cl3的配位化合物,其中en代表乙二胺。
请回答以下问题:1) 该化合物的立体构型是什么?2) 请绘制出一个示意图,展示配位化合物中钴(Co)原子的坐标排布。
解答:1) [Co(en)3]Cl3中的钴(Co)原子为八面体构型。
2) 请参考下图,展示了配位化合物中钴(Co)原子的坐标排布。
Cl/H H /H N NH \ /CoH \ / NH N NH / \Cl题目2:考虑一个具有化学式[Cu(NH3)4]2+的配位化合物,请回答以下问题:1) 该化合物的立体构型是什么?2) 请绘制出一个示意图,展示配位化合物中铜(Cu)原子的坐标排布。
解答:1) [Cu(NH3)4]2+中的铜(Cu)原子为四面体构型。
2) 请参考下图,展示了配位化合物中铜(Cu)原子的坐标排布。
H/H -- Cu -- H\H题目3:考虑一个具有化学式[Fe(CO)5]的配位化合物,请回答以下问题:1) 该化合物的立体构型是什么?2) 请绘制出一个示意图,展示配位化合物中铁(Fe)原子的坐标排布。
解答:1) [Fe(CO)5]中的铁(Fe)原子为三角双锥构型。
2) 请参考下图,展示了配位化合物中铁(Fe)原子的坐标排布。
C/O OO -- Fe -- C\O O通过以上练习题,我们可以更加熟悉不同配位化合物的立体构型。
在实际研究和应用中,了解配位化合物的立体构型有助于我们理解其性质和反应性。
同学们可以结合理论知识和实践经验,继续研究更多的配位化合物立体构型,并深入探索其在化学领域的重要性。
高中化学题型之配位化合物的立体构型计算
高中化学题型之配位化合物的立体构型计算在高中化学的学习中,配位化合物是一个重要的概念。
配位化合物由一个中心金属离子和周围的配位体组成,其中配位体通常是带有孤对电子的分子或离子。
配位化合物的立体构型是指配位体在空间中的排列方式,它对于化学性质和反应机理的理解至关重要。
本文将介绍配位化合物的立体构型计算方法,并通过具体题目的举例来说明。
在计算配位化合物的立体构型时,我们需要了解以下几个关键概念和方法。
首先是配位数的确定。
配位数是指中心金属离子周围配位体的个数。
常见的配位数有2、4、6等。
例如,对于氯化铜(II) [CuCl2],其中铜离子的配位数为2,因为它周围只有两个氯离子。
其次是配位体的空间排列方式。
配位体可以以不同的方式排列在中心金属离子周围,形成不同的立体构型。
常见的立体构型有线性、平面正方形、八面体等。
例如,对于四氯化铜(II) [CuCl4]2-,其中铜离子的配位数为4,配位体以平面正方形的方式排列在铜离子周围。
接下来是确定配位体的空间取向。
配位体在空间中的取向可以是顺时针或逆时针方向。
例如,对于六配位的六氯合铜(II) [CuCl6]2-,配位体以八面体的方式排列在铜离子周围,但是它们的取向可以是顺时针或逆时针方向。
最后是确定立体构型的对称性。
立体构型的对称性可以通过观察配位体的位置和取向来确定。
例如,对于六配位的六氯合铜(II) [CuCl6]2-,当配位体以八面体的方式排列,并且取向相同的时候,立体构型具有八面体的对称性。
通过以上的概念和方法,我们可以解决一些关于配位化合物立体构型的问题。
下面通过具体的题目来说明。
题目:确定[Co(NH3)6]3+的立体构型。
解析:首先,我们需要确定配位数。
由于配位体是六个氨分子,因此配位数为6。
接下来,我们需要确定配位体的空间排列方式。
六个氨分子可以以八面体的方式排列在钴离子周围。
然后,我们需要确定配位体的空间取向。
在八面体的构型中,氨分子可以以顺时针或逆时针方向取向。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学配位化合物的立体构型
化学配位化合物是由中心金属离子与一或多个配位体形成的化合物。
在配位化学中,研究和了解配位化合物的立体构型对于理解其性质和
反应机制至关重要。
本文将介绍配位化合物的立体构型以及相关的分
子几何形状。
一、线性型构型
线性型构型是指配位体以直线方式与中心金属离子配位形成的构型。
例如,一价阳离子氯离子(Cl-)可以以线性方式配位到两个一价阳离
子银离子(Ag+)上,形成Ag-Cl-Ag的线性链状结构。
此外,双原子
分子中的配位体,如一氧化碳(CO)和氰化物(CN-),也可形成线
性型构型。
二、四面体型构型
四面体型构型是指四个配位体环绕着中心金属离子呈四面体形状排
列而成的构型。
在这种构型中,配位体通常位于四面体的四个顶点位置。
例如,四个一价阴离子氯离子(Cl-)可以与一个四价阳离子钛离
子(Ti4+)形成四面体型构型,其中氯离子位于四面体的四个顶点。
三、正方形平面型构型
正方形平面型构型是指四个配位体环绕着中心金属离子呈正方形平
面形状排列而成的构型。
在这种构型中,配位体位于正方形平面的四
个角位置。
例如,四个一价阴离子氰化物离子(CN-)可以与一个二价
阳离子镍离子(Ni2+)形成正方形平面型构型,其中氰化物离子位于正方形平面的四个角。
四、八面体型构型
八面体型构型是指八个配位体环绕着中心金属离子呈八面体形状排列而成的构型。
在这种构型中,配位体通常位于八面体的八个顶点位置。
例如,八个二价阴离子氟离子(F-)可以与一个二价阳离子镍离子(Ni2+)形成八面体型构型,其中氟离子位于八面体的八个顶点。
五、扭曲型构型
扭曲型构型是指配位体与中心金属离子配位形成的构型具有非常规形状的情况。
在某些情况下,配位体之间的相互作用会导致立体构型偏离理想的几何形状。
例如,五个一价阴离子溴离子(Br-)和一个一价阳离子铜离子(Cu+)形成的配位化合物呈扭曲型构型。
结论
化学配位化合物的立体构型对其性质和反应机制有着重要影响。
不同的立体构型决定了配位化合物的形状以及与其他分子的相互作用方式。
通过研究和了解配位化合物的立体构型,我们能够更深入地理解它们在化学反应和应用中的行为。
参考文献:
1. Miessler, G.L., Tarr, D.A., & Fischer, P.J. (2013). Inorganic Chemistry (5th ed.). Pearson.
2. Cotton, F.A., & Wilkinson, G. (1999). Advanced Inorganic Chemistry (6th ed.). John Wiley & Sons.。
