F0代转基因小鼠鼠尾基因组DNA提取
小鼠基因组提取

小鼠基因组提取1.从小鼠尾巴尖位置减取约0.5cm小鼠尾巴2. 1.5mlEP管中加600μl Tail buffer(+蛋白酶K 20mg/ml)(蛋白酶K: Tail buffer=1:200)65℃2hr以上(消化干净即可)。
期间上下颠倒混匀几次。
3.加400μl体积比为25:24:1的酚:氯仿:异戊醇,漩涡震荡或者剧烈颠倒混匀,直至混合液呈现白色混浊状4.12000r pm 离心5min5.将EP管小心自离心机中取出,吸取400μl上清于一新管中6.加1ml无水乙醇,温和上下颠倒几次7.12000r pm 离心5min,弃上清。
8.12000r pm 再离心5mi n9.移液器吸取上清,沉淀干燥10.用100μl TE buffer溶解沉淀Tail buffer1M Tris (PH=8.0) 5ml5M Nacl 7.5 ml0.5 M EDTA25ml10% SDS 50mlddH2Oup to 500 mlGneoty pingPCR反应体系如下:小鼠基因组模板 2.8μl10×PCR buffer2μldNTP(10μl)1μlForwar d primer1μlRevers e primer1μlTaqE0.2μlddH2Oupto20μlGneoty pingPCR反应程序如下:1.95℃2min2.95℃15s3.退火温度30s4.72℃1Kb/min2-4 35 cycles5.72℃3min6.16℃∞延伸时间和目的基因的片段长度和T a q E 的延伸效率有关,本实验室所用T aq E的延伸效率是1Kb/min。
基因敲除小鼠不同部位提取DNA方法的比较
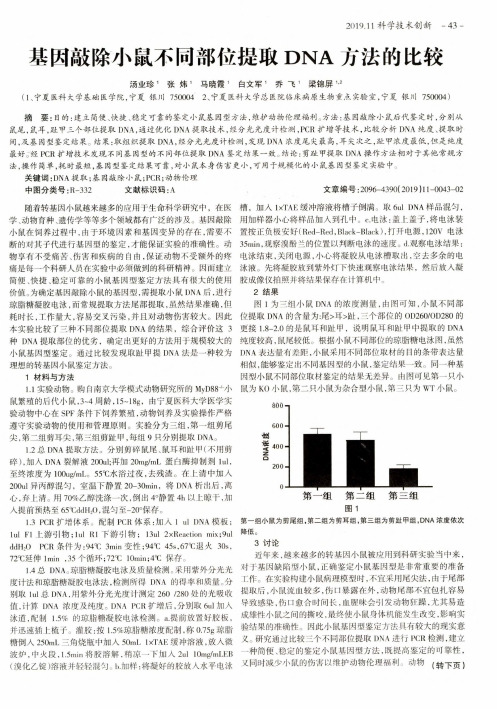
2019.11科学技术创新-43-基因敲除小鼠不同部位提取DNA方法的比较汤业珍'张炜'马晓霞’白文军'乔飞'梁锦屏"(1、宁夏医科大学基础医学院,宁夏银川7500042、宁夏医科大学总医院临床病原生物重点实验室,宁夏银川750004)摘要:目的:建立简便、快捷、稳定可靠的鉴定小鼠基因型方法,维护动物伦理福利。
方法:基因敲除小鼠后代鉴定时,分别从鼠尾,鼠耳,趾甲三个部位提取DNA,通过优化DNA提取技术,经分光光度计检测,PCR扩增等技术,比较分析DNA纯度、提取时间,及基因型鉴定结果。
结果:取组织提取DNA,经分光光度计检测,发现DNA浓度尾尖最高,耳尖次之,趾甲浓度最低,但是纯度最好。
经PCR扩增技术发现不同基因型的不同部位提取DNA鉴定结果一致。
结论:剪趾甲提取DNA操作方法相对于其他常规方法,操作简单,耗时最短,基因型鉴定结果可靠,对小鼠本身伤害更小,可用于规模化的小鼠基因型鉴定实验中。
关键词:DNA提取;基因敲除小鼠:PCR;动物伦理中图分类号:R-332文献标识码:A随着转基因小鼠越来越多的应用于生命科学研究中,在医学、动物育种、遗传学等等多个领域都有广泛的涉及。
基因敲除小鼠在饲养过程中,由于环境因素和基因变异的存在,需要不断的对其子代进行基因型的鉴定,才能保证实验的准确性。
动物享有不受痛苦、伤害和疾病的自由,保证动物不受额外的疼痛是每一个科研人员在实验中必须做到的科研精神。
因而建立简便、快捷、稳定可靠的小鼠基因型鉴定方法具有很大的使用价值。
为确定基因敲除小鼠的基因型,需提取小鼠DNA后,进行琼脂糖凝胶电泳,而常规提取方法尾部提取,虽然结果准确,但耗时长,工作量大,容易交叉污染,并且对动物伤害较大。
因此本实验比较了三种不同部位提取DNA的结果,综合评价这3种DNA提取部位的优劣,确定出更好的方法用于规模较大的小鼠基因型鉴定。
通过比较发现取趾甲提DNA法是一种较为理想的转基因小鼠鉴定方法。
基因组dna提取步骤

基因组DNA提取步骤1.从无水乙醇中取出少许组织(约50mg)加入干净灭菌的EP管中,剪碎;2.加入400ul 1%的SDS,8ul(20mg/ml)的蛋白酶K,充分浸润,入55℃摇床(100转/分),期间振荡助溶至澄清(5-6h);3.取出消化液,加入6mol/L的NaCl300ul,氯仿200ul,轻柔正反颠倒,使其充分乳化,4℃13000转/分离心30min;4.取出上清(约400ul),加入等体积氯仿抽提一次,轻柔颠倒后,4℃13000转/分离心10min;5.上清加入5μl RNaseA(10μg/μl), 37℃10分钟, 除去RNA(RNA对DNA的操作、分析一般无影响,可省略该步骤)。
6.取上清加入等体积异丙醇,轻柔混匀后-20℃沉淀10min;7.4℃13000转/分离心15min,弃上清;8.用75%乙醇洗涤1-2次(1000ul,11000转/分离心2min),弃上清;9.冰冻无水乙醇洗涤1-2次(1000ul,11000转/分离心4min)弃上清,自然晾干或烘干,DDW溶解,30-50ul。
基因组DNA的提取通常用于构建基因组文库、Southern杂交(包括RFLP)及PCR分离基因等。
利用基因组DNA较长的特性,可以将其与细胞器或质粒等小分子DNA分离。
加入一定量的异丙醇或乙醇,基因组的大分子DNA即沉淀形成纤维状絮团飘浮其中, 可用玻棒将其取出,而小分子DNA则只形成颗粒状沉淀附于壁上及底部, 从而达到提取的目的。
在提取过程中,染色体会发生机械断裂,产生大小不同的片段,因此分离基因组DNA时应尽量在温和的条件下操作,如尽量减少酚/氯仿抽提、混匀过程要轻缓, 以保证得到较长的DNA。
一般来说,构建基因组文库, 初始DNA长度必须在100kb以上,否则酶切后两边都带合适末端的有效片段很少。
而进行RFLP和PCR分析, DNA长度可短至50kb, 在该长度以上,可保证酶切后产生RFLP片段(20kb以下),并可保证包含PCR所扩增的片段(一般2kb以下)。
小鼠genotyping步骤

小鼠genotyping步骤小鼠基因分型是一种用于确定小鼠特定基因型的实验方法。
这种方法通过检测小鼠体内的特定基因的突变来确定基因型。
基因分型对于研究小鼠的遗传特性、基因功能以及治疗疾病的效果都非常重要。
在本文中,我们将详细介绍小鼠基因分型的步骤。
步骤一:DNA提取首先,需要从小鼠体内提取DNA。
可以使用不同的方法来提取DNA,比如裂解细胞膜并分离DNA。
常用的DNA提取试剂盒也可以用于此目的。
提取出的DNA可以通过测量吸光度来确定浓度和纯度。
步骤二:PCR反应接下来,使用聚合酶链反应(PCR)扩增特定基因的DNA片段。
PCR反应需要以下成分:模板DNA,引物对(包括特异性引物和控制引物),聚合酶和dNTPs。
反应条件(温度、时间)需要根据使用的引物和PCR仪的要求进行优化。
步骤三:凝胶电泳PCR反应后,将反应产物进行凝胶电泳以检测DNA片段的大小和纯度。
通常使用琼脂糖凝胶进行电泳分析。
在电泳前,需要将PCR产物与DNA标记物(如DNA分子量标记物)混合,并注入琼脂糖槽中。
然后,通过通电来分离DNA片段。
通过与标准DNA片段比较,可以确定PCR产物的大小。
步骤四:基因型分析通过对凝胶电泳结果进行显微镜观察并与标准DNA标记物比较,可以确定小鼠的基因型。
凝胶电泳可以显示不同基因型的特征带。
例如,如果小鼠是纯合子型(两个等位基因完全相同),则只会显示一个特定大小的带。
如果小鼠是杂合子型(两个等位基因不同),则会显示两个大小不同的带。
步骤五:验证和文献回顾在确定基因型后,应该验证结果的准确性。
可以选择一部分样本进行重复测试,以确认结果的一致性。
此外,还可以参考相关文献以确保基因型的准确性和合理性。
注意事项:1.PCR反应条件需要根据实验需要进行优化。
特异性引物和控制引物的设计非常重要,以确保PCR反应的特异性和敏感性。
2.在进行凝胶电泳之前,确保琼脂糖凝胶被充分固化,并根据需求进行样品槽的制作。
3.在进行凝胶电泳时,要小心不要损坏琼脂糖凝胶或让凝胶与电极接触。
基因敲除小鼠的实验流程

获取鼠尾组织
每只小鼠鼠尾加入500ul裂解液和10ul 蛋白酶 K(20mg/ml),55度水浴过夜,至鼠尾溶解。
提DNA步骤: 1. 每管鼠尾加入300ul饱和NaCl,充分混匀,
12500rpm 离心20min 2. 取上清700ul至新的离心管中,加入预冷的异丙
醇700ul,上下颠倒混匀,动作轻柔,直至看到 絮状DNA析出为止, 12500rpm 离心20min, 弃上清
向正极移动。由于不同大小和构象的核酸分子电荷密度 大致相同,因此在自由泳动时,各种核酸分子的迁移率 相似,无法分开。然而,在浓度适当的凝胶中,由于分 子筛效应,使大小和构象不同的核酸迁移率出现差异, 从而把它们分开。核酸在凝胶中的迁移率取决于其分子 大小、高级结构、胶浓度和电场强度,与分子的碱基组 成及电泳温度(4℃~30℃之间)无明显关系。一般说, 同样构象的分子迁移率与分子量对数及胶浓度成反比, 与电场强度(小于5V/cm)成正比。
琼脂糖凝胶电泳
3. 加入800ul 75%乙醇于离心管中,洗沉淀, 12500rpm离心10min
4. 晾干沉淀,加入100ul的PCR级的水。
二、PCR扩增
变变 90变95变
70变75变
cycle
变变
变变 40变60变
25~30 次循环后,模板DNA的含量可以 放大100万倍以2x Mix 无菌水 2pmol引物1 2pmol引物2 2pmol引物3 模板DNA
10ul 2ul 2ul 2ul 2ul 2ul
PCR扩增仪
95℃ 3min 95℃ 30sec 60℃ 30sec 72℃ 30sec 72℃ 5min
35 cycles
三、琼脂糖凝胶电泳
原理: 在pH8.0~8.3的缓冲液中,核酸分子带负电荷,
PCR步骤

转基因小鼠的鉴定一,剪鼠尾1,剪鼠尾的时间当新生的小鼠年龄达到两到三周(耳朵已经长开)时剪鼠尾较好,此时鼠尾剪起来比较容易且小鼠的生命力比较强。
2,分辨小鼠的年龄a当小鼠整个身体较红且腹部无奶时,此小鼠当天出生或前一晚出生;b当小鼠腹部有奶(腹部有一小团白色物质),此小鼠出生2~3天;c当小鼠背部长出皮毛时,此小鼠出生3~4天;d当小鼠毛长全,但眼未开时,此小鼠出生10天左右;e当小鼠眼刚开,耳未开时,此小鼠出生12天左右;f当小鼠耳刚开时,此小鼠出生14天左右。
3,剪鼠尾后对小鼠的标记一般在小鼠的耳朵或指甲上做标记,如果在用剪指甲来标记的话,时间过长则不易分辨。
所以一般还是选择用左右耳朵上剪的刀数来标记,正常情况下一笼小鼠不会超过10只,依次标记为左1刀,右1刀,左2刀,右2刀,左1右1刀,左2右1刀,左1右2刀,左2右2刀,左3刀,最后一只不剪耳。
二,从鼠尾中提取DNA1,剪0.5cm的鼠尾,放入1.5ml的EP管中。
2,加入500μlSNET,其中蛋白酶K浓度是400μl/ml。
注:SNET鼠尾裂解液配方(100ml):200mM的Tris-Cl 取1M的Tris-Cl(PH8.0)2ml5mM的EDTA 取0.5M的EDTA(PH8.0)1ml400mM的NaCl 取2.34g1%(m/v)SDS 取10ml 10%SDS加水定容至100ml临用时加蛋白酶K400μg/ml,即100ml的SNET加40mg。
3,放入550C孵育过夜(最好放入摇床550C振荡过夜,也可放入550C烘箱过夜,第2天摇床550C振荡2~3个小时)。
4,消化好后,每只EP管内加入14μl 6M NaCl溶液,涡轮振荡仪上剧烈振荡30s-1min。
5,12000rpm离心10min,取上清400μl 到另一1.5mlEP管内。
注:a离心时EP管对称放置且最好开口处靠近轴部;b取“另一1.5mlEP管”时,选择盖子内部正常无多余部分,以免第6步的絮状沉淀挂在多余部分。
小鼠基因组提取
小鼠基因组提取1.从小鼠尾巴尖位置减取约0.5cm小鼠尾巴2. 1.5mlEP管中加600μl Tail buffer(+蛋白酶K 20mg/ml)(蛋白酶K: Tail buffer=1:200)65℃2hr以上(消化干净即可)。
期间上下颠倒混匀几次。
3.加400μl体积比为25:24:1的酚:氯仿:异戊醇,漩涡震荡或者剧烈颠倒混匀,直至混合液呈现白色混浊状4.12000rpm 离心5min5.将EP管小心自离心机中取出,吸取400μl上清于一新管中6.加1ml无水乙醇,温和上下颠倒几次7.12000rpm 离心5min,弃上清。
8.12000rpm 再离心5min9.移液器吸取上清,沉淀干燥10.用100μlTE buffer 溶解沉淀Tail buffer1M Tris (PH=8.0) 5ml5M Nacl 7.5 ml0.5 M EDTA 25ml10% SDS 50mlddH2O up to 500 mlGneotyping PCR反应体系如下:小鼠基因组模板 2.8μl10×PCR buffer 2μldNTP(10μl) 1μlForward primer 1μlReverse primer 1μlTaq E 0.2μlddH2O up to 20μlGneotyping PCR反应程序如下:1.95℃2min2.95℃15s3.退火温度30s4.72℃1Kb/min2-4 35 cycles5.72℃3min6.16℃∞延伸时间和目的基因的片段长度和Taq E 的延伸效率有关,本实验室所用Taq E的延伸效率是1Kb/min。
基因组dna的提取课件
纯度(OD260/OD280)
紫外分光光度计进行测量(选择正确的稀释倍数)
OD260/OD280 < 1.7
说明有蛋白的污染
OD260/OD280 =1.8 (1.7~1.9) 说明纯度很好
OD260/OD280 > 1.9 说明有部分降解或有RNA污
染
得率
紫外分光光度计进行测量
Yield= OD260×50ng/μL×稀释倍数(双链DNA)
干心吸得附到材的料溶中液残再余加的入漂吸洗附液柱; CB3中, 室 温 放 置 2min , 12,000rpm 离 心 将2m吸in附;柱转入干净的离心管中,向吸 附膜的中间部位悬空滴加100uL洗脱 缓洗冲脱液液T的E,pH室值温对放于置洗5m脱in效;率有很大 影响,应在7.0-8.5范围内; 12,0OOrpm离心2min,将DNA溶液收集 到DN离A心产管物中应保存在-20℃。
裂解的样本 加入吸附柱 缓冲液冲洗 DNA洗脱收集
沉淀核酸 核酸吸附
漂洗去杂 洗脱DNA
注意:
洗脱前要充分空甩,以除去乙醇 的影响;
采用合适的缓冲液 将洗吸脱附缓柱冲放液回体收积集不管应中少,于1520,0μ0L0,rp体m,
离积心过2小m影in响,回倒收掉效废率液;: 将为吸增附加柱基开因盖组放D置NA5m的i得n,率以,彻可底将晾离
17
【操作流程Ⅱ】 (总结)
加 乙醇 200 µL
充分混匀 短暂离心
动作 轻柔
溶液和絮状 勿加入组 沉淀转入 织块!!
12,000rpm,离心 30s ,弃废液
加 GD 500 µL
12,000rpm,离心 30s ,弃废液
加 PW 700 µL
基因组dna 的提取
基因组dna 的提取DNA提取是生物学研究中的重要步骤,它可以帮助我们了解生物体的基因信息。
在这篇文章中,我们将探讨DNA提取的原理、步骤以及一些实用技巧和指南。
首先,我们来了解一下DNA提取的原理。
DNA是生物体内负责遗传信息传递的分子,存储着生物的全部基因组。
DNA提取的目的就是从生物体中分离出纯净的DNA。
这样,我们可以进一步进行基因测序、PCR 扩增等实验,从而深入了解生物个体的遗传特征。
接下来,我们将介绍DNA提取的步骤。
首先,收集合适的生物体样本,如人体组织、动植物组织、微生物菌落等。
我们需要确保样本新鲜,并且避免受到外界杂质的污染。
然后,将样本加入提取缓冲液中进行细胞破裂,以释放细胞内的DNA。
常用的方法有机械破碎、热澄清和化学溶解等。
接着,使用一系列溶液和离心等技术,使DNA分离出来。
最后,通过适当的洗涤、沉淀和纯化步骤,可以得到纯净的DNA 样品。
同时,我们还需要注意一些操作细节。
首先,实验过程应该在干净、无菌的实验室环境中进行,以避免污染。
其次,手套和口罩是必备的防护用具,避免DNA受到外界的污染。
另外,为了增加DNA提取的产量和纯度,可以根据样本的特点调整提取缓冲液的配方和pH值。
此外,提取过程中的温度和时间也是关键因素,需要根据具体实验进行优化。
DNA提取不仅在科学研究中有着重要的应用,也广泛应用于医学、农业和法医等领域。
在医学上,DNA提取可以帮助诊断疾病、确定遗传病因,对于疾病的治疗和预防起着重要作用。
在农业中,DNA提取可以用于品种鉴定、基因改良和种质资源保护等方面。
在法医学中,DNA提取可以作为犯罪嫌疑人的身份鉴定工具,有助于司法实践的公正与准确。
综上所述,DNA提取是一项重要的实验技术,它为我们了解生物体的遗传特征提供了基础。
在进行DNA提取时,我们需要注意实验条件的控制和操作步骤的规范,以确保提取到高质量的DNA样品。
这项技术不仅在科研中有着广泛应用,而且在医学、农业和法医等领域也发挥着重要作用。
基因组dna的提取
基因组dna的提取基因组DNA是有机体遗传物质的载体,它蕴藏了丰富的基因信息,是生物进化过程中必不可少的,有着重要的科学意义。
基因组DNA的提取是进一步探索生物学问题的基础,而基因组DNA的提取也是一项复杂的工序,新的技术必须不断研究和发展,以提高效率和准确性。
在基因组DNA提取的过程中,研究者首先要获得明确的DNA提取获取样品,也就是需要提取的生物。
通常情况下,这些生物可以是细胞,组织,蛋白质或其他有机物质。
接下来,一般需要对样品进行细胞或组织无菌处理,以保证提取的DNA不受外来污染。
接着,研究者需要将样品中的细胞或组织放入离心机中,并离心去除细胞悬液或提取组织的提取液。
接下来,研究者通常会采用两种方法对提取液进行DNA提取,分别是改性非晶合金技术和有机溶剂技术。
改性非晶合金技术是最常用的DNA提取技术,它是通过将磁性合金颗粒和DNA反应来实现DNA提取的。
这种技术有利于快速,高效,灵活和可重复性强的DNA提取。
此外,它还可以提取多种细胞类型,并具有广泛的应用前景。
有机溶剂技术是一种有效的DNA提取方法,它的主要原理是将有机溶剂与样品混合,以帮助DNA和细胞膜分离。
借助有机溶剂可以实现全基因组DNA的提取,特别是在一些特殊的细胞类型(如血液细胞)中,有机溶剂技术可以更快,更高效地将DNA从细胞中提取出来。
除了改性非晶合金技术和有机溶剂技术,还有其他一些DNA提取技术,例如免疫捕获技术,手性内切酶和PCR技术等。
这些技术可以从不同的样品中获得基因组DNA,有助于细胞类型和组织类型的比较分析和分子遗传学研究。
综上所述,基因组dna的提取是一个复杂的过程,需要考虑不同的参数,使用不同的技术,以便获得最优效果。
然而,要想在基因组DNA提取中取得预期的结果,最重要的是保证样品质量,以确保提取的DNA不受外来污染,从而更准确地获取基因组DNA。
