环境化学中的水体污染物分析与控制
环境化学第6章典型污染物在环境各圈层中的转归与效应

体内的许多器官产
生影响 。
2020/10/27
砷 中 毒 肾 病
砷中毒皮肤组织增殖细胞
第二节 有机污染物
大量的有机化学品以各种形式进入 环境,产生各种各样的环境效应,直接 或间接地危及人体健康。其中以对生态 环境和人类健康影响最大的难降解的、 有致癌、致突变作用的有机物的环境行 为最受人们关注。
2020/10/27
பைடு நூலகம்
3、甲基汞脱甲基化与汞离子还原 湖底沉积物中甲基汞可被某些细菌
降解而转化为甲烷和汞。也可将Hg2+还 原为金属汞。
CH3Hg+ +2H
Hg+CH4+H+
HgCl2+2H
Hg+2HCl
2020/10/27
4、汞的生物效应
甲基汞能与许多有机配位体基团结 合,如-COOH、 - NH2、 - SH、 - C S - C - 、 - OH等。由于烷基汞具有高脂 溶性,且它在生物体内分解速度缓慢(其 分解半衰期为70d),因此烷基汞比可溶 性无机汞化合物的毒性大10—100倍。
2020/10/27
卤代烃在大气中的转化
卤代烃的转化
对流层 含氢卤代烃与HO自由基的反应
2020/10/27
平流层
受到高能光子的攻击而被破坏
多氯联苯(PCBs)
多氯联苯的结构与性质
多氯联苯是一组由 多个氯原子取代联苯分子 中氢原子而形成的氯代芳 烃类化合物。
由于PCBs理化性质稳定,用途广泛,已成 为全球性环境污染物,而引起人们的关注。
多氯代二苯并二恶英(PCDD )和多氯代二苯并呋喃(PCDF) 是目前已知的毒性最大的有机氯 化合物。他们是两个系列的多氯 化物。其结构式为:
第三章 水环境化学水中无机污染物的迁移转化汇总

20
1. 胶体颗粒凝聚的基本原理和方式
1) 带电胶粒稳定性的经典理论--DLVO理论 带电胶粒的两种相互作用力
双电层重叠时的静电排斥力 粒子间的长程范德华吸引力
DLVO理论认为,当吸引力占优势时,溶胶发生聚 沉; 当排斥力占优势,并大到足以阻碍胶粒由于 布朗运动而发生聚沉时,则胶体处于稳定状态。 颗粒在相互接近时两种力相互作用的总位能随相 隔距离的变化而变化: 总位能 VT=VR+VA 式中:VA——由范德华力所产生的位能; VR——由静电排斥力所产生的位能。
4
一 、 颗粒物与水之间的迁移
2、水环境中颗粒物的吸附作用
专属吸附是指吸附过程中,除了化学键的作
用外,尚有加强的憎水键和范德华力或氢键在 起作用。
专属吸附作用不但可使表面电荷改变符号, 而且可使离子化合物吸附在同号电荷的表面上。
5
表3-8水合氧化物对金属离子的专属吸附 与非专属吸附的区别
项目 非专属吸附 专属吸附 发生吸附的表面净电荷的符号 - -、0、+ 金属离子所起的作用 反离子 配位离子 吸附时发生的反应 阳离子交换 配位体交换 发生吸附时体系的PH值 >零电位点 任意值 吸附发生的位置 扩散层 内层 对表面电荷的影响 无 负电荷减少, 正电荷增多 注:本表摘自陈静生主编,1987。
(4)水体悬浮沉积物
悬浮沉积物是以矿物微粒,特别是粘土矿物 为核心骨架,有机物和金属水合氧化物结合在矿 物微粒表面上,成为各微粒间的粘附架桥物质, 把若干微粒组合成絮状聚集体(聚集体在水体中 的悬浮颗粒粒度一般在数十微米以下),经絮凝 成为较粗颗粒而沉积到水体底部。
(5)其他
3
一、 颗粒物与水之间的迁移
第三章水环境化学水中无机污染物的迁移转化

胶体微粒的吸附和聚沉对污染物的影响
④吸附和聚沉对污染物的影响
有人研究某入海河口铬、铜、汞的迁 移机制,测定了该河口底层水和表层底 泥中铬、铜、汞的含量及它们在底泥中 的富集系数(相对底层水),发现多年来 该河口水中铬、铜、汞含量,基本稳定 在标准以下,而部分站位表层底泥中有 时出现超标的情况;而且在表层底泥中 铬、铜、汞的平均富集系数很大,分别 为980~1100、164~500、18~45,呈 现明显的富集能力,其中对铬尤为显著。
第二节 水中无机污染物的迁移转化
无机污染物主要通过沉淀-溶解、氧化-还原、配合作 用、胶体形成、吸附-解吸等一系列物理化学作用进行 迁移转化,参与和干扰各种环境化学过程和物质循环 过程,最终以一种或多种形态长期存留在环境中,造 成永久性的潜在危害。
实际上微量污染物在水体中的浓度和形态分布,在 很大程度上取决于水体中各类胶体的行为。胶体微粒 作为微量污染物的载体,它们的絮凝沉降、扩散迁移 等过程决定着污染物的去向和归宿。在天然水体中, 重金属在水相中含量极微,而主要富集于固相中,在 很大程度上与胶体的吸附作用有关。因此,胶体的吸 附作用对水环境中重金属的过程转化及生物生态效应 有重要影响。
27
胶体微粒的吸附和聚沉对污染物的影响
②不同吸附剂对金属离子的吸附有较大
的差别
P.A.Krenkel和E.B.Shin等研究了各种天然 和人工合成的吸附剂对HgCl2的吸附作用, 其吸附能力大致顺序是:含硫的沉积物(还 原态的)>商业去污剂(硅的混合物、活性 碳)>三维黏土矿物(伊利石、蒙脱石)>含 蛋白去污剂>铁、锰氧化物及不含硫的天 然有机物>不含硫但含胺的合成有机去污 剂、二维黏土矿物和细砂。
26
补充:胶体微粒的吸附和聚沉对污染物的 影响
水环境化学1
α0 , α1 , α2为分布系数,与pH 有关。
因此封闭碳酸体系各主要形态与pH有关,而CT与pH无关
④开放碳酸体系特点及各主要形态计算 特点: * CT ≠常数 * [H CO *]总保持与大气相平衡的固定数值 2 3 即:[CO 2 (aq)] = KH p CO 2
CT = [H2CO 3 *] /α0 =[CO 2 (aq)] /α0 = KH p CO 2 /α0 [HCO 3 - ] = α1KH p CO 2 /α0 = K1 KH p CO 2 / [H+ ]
(3)水生生物
自养 异养
几个问题 天然水中主要离子总量可以粗略地作为TDS
A.名词—总含盐量(TDS)(≡总溶解固体量)
TDS=[Ca 2 + +Mg 2 + + Na+ +K+ ]+ [HCO3 - + SO4 2 - +Cl - ]
总含盐量 (总溶解固体量)为1000~10000 mg/L
的天然水称为咸水(淡水的总含盐量< 1000mg/L)
[CO32-] = K2[HCO3-] / [H+]
(2)
= 4.69×10-11×1.00×10-3 /1.00×10-8
= 4.69 ×10-6mol.L-1
例2
若 水 体 pH 升 高 到 10.00, 碱 度 仍 保 持
1.00×10-3 mol•L-1 ,再计算该水体中各碱度 成分的浓度。 碱度 = [ HCO3-] + 2[CO32-] + [ OH-]( mol.L-1) [OH-] = 1.00×10-4 mol.L-1
查表3-1(教材P102),氧气在25℃水中的亨利常数 KO2=1.28×10-8moL/(L· Pa) 则根据亨利定律,氧气在水中的溶解度为: [O2(aq)]=KO2· 2=1.28×10-8×0.2029×1.013×105 PO =2.63×10-4moL/L 由于氧的分子量为32,所以其溶解度为8.4mg/L或8.4PPm. 结论:25℃时 [O2(aq)]=8.4mg/L 问:若已知25℃湖水中溶解氧浓度为0.32 mg/L,大气中氧的分压 为多少?
第三章水环境化学-第四节水质模型介绍

水质模型,是一个用于描述物质在水环境中的混合、 迁移、扩散和转化过程(包括物理、化学、生物作用过 程)的数学方程(或方程组) .
水质模型的基本原理是质量守恒原理;建立水质模 型的目的是用来描述污染物数量与水环境影响因素之间 的定量关系,从而为水质分析、预测和水环境管理提供 基础的量化依据。
本节讨论的水质模型主要是:氧平衡模型、湖泊富 营养化模型和有毒有机污染物归趋模型。
一、氧平衡模型
1. Streeter-Phelps(S-P)模型(河流水质自净模型)
S-P模型的建立基于两项假设: (1)只考虑好氧微生物参加的有机物降解反应,并 认为该反应为一级反应。 (2)河流中的耗氧只是有机物降解反应引起的。有 机物的降解反应速率与河水中溶解氧(DO)的减少速 率相同,大气中的氧进入水体的复氧速率与河水中 的亏氧量 D 成正比。
极限距离:
极限溶解氧:
(DC为极限氧亏)
2.托马斯(Thomas)模型
对于一维静态河流,在S—P模型的基础上考虑沉淀、絮 凝、冲刷和再悬浮过程对BOD变化的影响,引入了BOD沉 浮系数k3 dL
u -(k1 k3 ) L dx u dD k L - k D 1 2 dx
湖泊水质模型的类型:
湖泊水质模型可划分为:多元相关模型;输入输出 模型;富营养化预测模型和扩散模型,这里仅讨论富 营养化预测模型。
2. 富营养化预测模型 对于停留时间很长、水质基本处于稳定状态的中小 型湖泊和水库,可视为一个均匀混合的水体。 沃兰伟德假定,湖泊中某种营养物的浓度随时间的 变化率,是输入、输出和在湖泊内沉积的该种营养物量 的函数,用质量平衡方程表示就是:
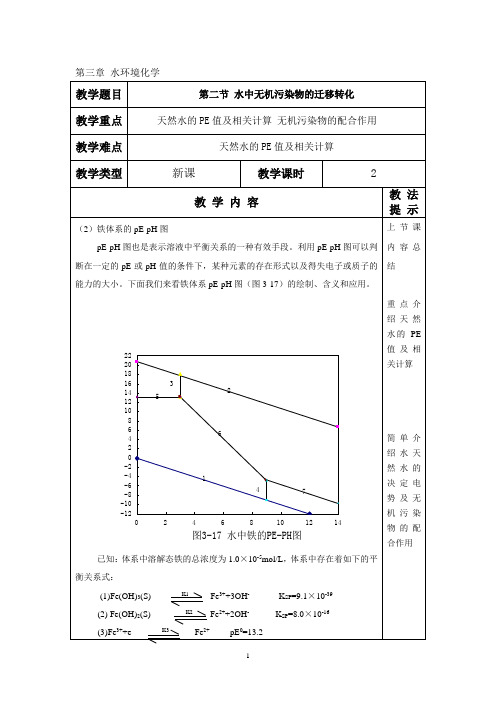
环境化学教案 第三节水中无机污染物的迁移转化(氧化还原2)
由此反应可知,当有机物进入天然水后,水体中溶解氧的含量会迅速降低。如果有机物的数量非常多的话,可以使水体中溶解氧全部被消耗掉,甚至可以使水体转换成为沼泽。在水中,NH4+只有被氧化成NO3-后,氮才能被藻类利用。
例2求被大气氧所饱合的中性天然水的pE值。
解:该体系溶解氧起决定电势作用,溶解氧的氧化还原反应为:
pE=pE0+ [H+]
已知:pE0=20.75
pH=7 [H+]=10-7
将已知条件代入pE的表达式,得:pE=13.58。该体系pE值较高,是一个氧化性体系。
例3求微生物作用产生甲烷的中性厌氧水的pE值及溶解氧的分压
天然水是一个非常复杂的混合体系,其中存在着众多的氧化剂和还原剂。其中常见的氧化剂包括溶解氧、Mn(IV)、Fe(III)、和S(VI),常见的还原剂包括有机物、Mn(II)、Fe(II)、S(-II)。当我们要求得某种天然水的pE值时,首先需要确定哪种物质起决定电势作用,然后根据起决定电势作用物质的氧化还原反应,求得体系的pE值。一般的天然水体中起决定电势作用的物质是溶解氧,当有机物含量非常高时,则有机物起决定电势作用。铁和锰起决定电势作用的情况则比较少见。下面我们来看两种极端情况下体系的pE值。
pE=-4.13
将已知条件代入pE的表达式,得: =3.0×10-72atm。
由此可见该体系中溶解氧的分压非常低,一般水体中的溶解氧的分压均超过此值。由于天然水的pE值随水中溶解氧的减少而降低,因此表层水pE值较高,底层水pE值较低。
例3:从湖水中取出深层水,其PH=7.0,含溶解氧浓度0.32mg/L,请计算PE和Eh。(KH=1.26*10-8[mol/(L·Pa)]
生态环境化学中的农药残留和有机污染物
生态环境化学中的农药残留和有机污染物在当今社会,农业发展与经济建设密不可分,但是这也伴随着农药残留和有机污染物对生态环境的严重危害。
农药残留和有机污染物对生态环境的污染已经成为国际性的难题,对于环境保护和健康保障提出了新的挑战。
一、农药残留农药残留是农作物、水体、土壤等环境中存在的不同类型的农用化学品的残留物,农药残留对于生态系统和人体健康双重造成严重危害。
农药残留的主要来源是农业生产和农民的生活。
在农业生产中,农民使用农药是控制农业害虫、杂草和病害的一种必需手段。
但是,由于使用不当和习惯种植重病害抗性、高产量的农作物,导致农药残留的累积,给生态环境带来了重大危害。
为了达到农业生产和环境保护的双重目标,必须采取有效的减少农药残留的方法:1. 技术改进:应用先进的化学杀虫剂、生物农药和物理熏蒸等新技术。
2. 种植管理:采取有机农业技术、加强生态环境建设、进行规范和科学化的种植管理等。
3. 环保监管:加强农药生产、销售和使用过程中的监管机制,对违法经营行为进行严格惩处,强化购买农药登记、使用登记的制度,防止农药的滥用和乱用。
二、有机污染物有机污染物是指由有机碳组成的化学物质,常见的有机污染物主要有苯系物质、多环芳烃、氯代烃、甲苯、苯并芘等。
有机污染物对环境和健康也带来了严重的危害,严重污染的土壤和地下水资源使得农作物生产和大自然的生态环境受到了极大的影响。
有机污染物的防治应该从源头入手,采取一系列物理、化学和生物手段进行处理,如改进生产工艺、换用低污染的替代品、利用高效吸附介质,通过生物修复和植物修复等来减少有机污染物的生成和累积。
综上所述,农药残留和有机污染物是影响生态环境的严重问题。
通过加强环保监管、技术改进和种植管理等措施,可以有效减少农药残留和有机污染物的污染。
同时,我们也应该更加注重科学技术的发展,推动农业、生态和经济的可持续发展,为保护生态环境和人类健康作出更多的贡献。
【环境化学】第3.2章 水环境化学——水中无机污染物的配合作用
总反应:Zn2++2NH3→Zn(NH3)22+ β2 总反应:Zn2++3NH3→Zn(NH3)32+ β3 总反应:Zn2++4NH3→Zn(NH3)42+ β4
逐级稳定常数:K1、 K2 、 K3 、 K4 累积稳定常数: β1 、 β2 、 β3 、 β4 累积稳定常数与逐级稳定常数的关系
设:α={ 1+ β1 [OH-]+ β2 [OH-]2+ β3[OH-]3 + β4 [OH-]4 }
得:[Me]T= [Me2+]·α
11
第三章/第二节/2.5 配合作用
2.5.4 金属配合物
一、羟基对金属离子的配合作用
2. 各种羟基配合物占金属总量的百分数φ 各种羟基配合物的比例
φ0= [Me2+] / [Me]T =1/ α φ1= [Me(OH)+] / [Me]T = {β1[Me2+][OH-] }/ [Me]T = β1[OH-] / α = φ0 β1[OH-] φ2 = [Me(OH)2] / [Me]T = φ0 β2[OH-] 2 φ3 = [Me(OH)3-] / [Me]T = φ0 β3[OH-] 3 φ4 = [Me(OH)42-] / [Me]T = φ0 β4[OH-]4
Hum
COO O
Fe
OH (H2O)-x-1
+ H+
[ Hum
COO O
Fe
OOHH(H2O)x-2]+2H+
在低pH时,从腐植质的酸性基团中置换出一个质子。 在高pH时,则从金属水合物中的水分子中释放出一个质子。
20
第三章/第二节/2.5 配合作用
第三章水环境化学
TDS=[K++Na++Ca2++Mg2+]+[HCO3-+NO3-+Cl-+SO42-
2、天然水的性质
(Characteristic of Natural Waters) (1)碳酸平衡(Balance of H2CO3) 水体中存在四种化合态:
CO2、CO32-、HCO3-、H2CO3
第三章 水环境化学
(Water Environmental Chemistry)
本章重点
1、无机污染物在水体中进行沉淀-溶解、氧化-还原、 配合作用、吸附-解吸、絮凝-沉淀的基本原理;
2、计算水体中金属存在形态;
3、pE计算;
4、有机污染物在水体中的迁移转化过程和分配系数、 挥发速率、水解速率、光解速率和生物降解速率的 计算方法。
农药
有机氯 有机磷
多氯联苯 (PCBS) 卤代脂肪烃 醚
单环芳香族化合物 苯酚类和甲酚类 酞酸酯类 多环芳烃(PAH) 亚硝胺和其他化合物
2、金属污染物 (Metal Pollutant)
Cd、 Hg、 Pb、 As、 Cr、 Cu、 Zn、 Tl、 Ni、 Be
第二节 水中无机污染物的迁移转化
强酸 弱酸 强酸弱碱盐
总酸度= [H+]+ [ HCO3-] +2[H2CO3*] - [ OH-] CO2酸度= [H+]+ [H2CO3*] - [CO32-] - [ OH-] 无机酸度= [H+]- [ HCO3-]-2 [CO32-] - [ OH-]
二、水中污染物的分布及存在形态
1、有机污染物 (Organic Pollutant)
多介质中污染物风险
加强废水、废弃物管理,实施清洁生产;合理使用化肥、农 药等农业投入品;开展生态修复工程,提高土壤自净能力。
04
大气中污染物风险
大气污染来源与途径
工业排放
工业生产过程中产生的废气、废水和 固体废弃物等,是大气污染的主要来 源之一。
农业活动
农业活动中使用的化肥、农药、畜禽 粪便等,经过挥发、沉降等过程进入 大气,造成大气污染。
多介质中污染物风险
汇报人: 日期:
目录
• 多介质环境概述 • 水体中污染物风险 • 土壤中污染物风险 • 大气中污染物风险 • 多介质中污染物风险的综合评
估与管理 • 研究展望
01
多介质环境概述
定义与特点
定义
多介质环境是指由两种或多种介 质组成的环境,这些介质包括空 气、水体、土壤等。
特点
多介质环境具有复杂的物理、化 学和生物交互作用,污染物在这 些不同介质之间会发生迁移、转 化和归趋等过程。
目前针对多介质中污染物的研究,仍 存在数据采集的准确性和处理方法的 科学性等问题,需要进一步完善数据 采集和分析方法。
环境影响评估
针对多介质中污染物的环境影响评估 方法仍有待完善,需要加强评估方法 的研发和应用。
污染物迁移转化规律
目前对于污染物在多介质中的迁移转 化规律尚不完全明确,需要加强研究 ,完善相关理论。
自然污染源
火山喷发、山洪暴发等自然现象也可能导致污染物质进入 水体。
水体中主要污染物种类与危害
重金属
如铅、汞、镉等,长期 接触对人体健康产生严 重影响,如智力低下、
贫血等。
有机污染物
如苯、甲苯、二甲苯等 ,具有致癌、致畸、致
突变等危害。
营养盐
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
环境化学中的水体污染物分析与控制水是生命之源,对于人类和地球生态系统而言,水的质量至关重要。
然而,随着工业化和城市化的快速发展,水体污染问题日益严峻。
环
境化学作为一门研究水体污染问题的科学,对水体污染物的分析与控
制起着重要作用。
本文将就环境化学中的水体污染物分析与控制进行
探讨。
一、水体污染物的分析方法
1. 化学分析方法
化学分析方法是一种常用的水体污染物分析手段。
通过对水样
中污染物的化学性质进行分析,可以确定污染物的种类和含量。
常用
的化学分析方法包括光谱法、色谱法、比色法等。
例如,使用紫外-可
见光谱法可以测定有机物的浓度,气相色谱法可以分析水中的挥发性
有机物。
2. 生物分析方法
生物分析方法是一种基于生物反应的水体污染物分析手段。
通
过观察和测量生物对污染物的反应,可以确定水体中的污染物含量。
常用的生物分析方法包括生物指示法、生物传感器等。
例如,使用细
菌感应法可以检测水中的重金属污染物。
二、水体污染物的控制措施
1. 削减污染源
水体污染物的控制的首要任务是削减污染源。
通过改进工业生
产工艺、提高污染物处理设施效率等方式,减少污染物的排放量。
例如,采用先进的废水处理技术可以降低工业废水中污染物的浓度。
2. 加强监测与管理
加强对水体污染物的监测与管理也是控制水体污染的重要手段。
建立完善的水体污染监测网络,及时掌握水体污染状况。
制定严格的
法律法规,加强对水污染行为的管理与处罚。
3. 采用物理化学方法进行处理
物理化学方法是一种有效的水体污染物处理手段。
通过物理、
化学反应等方式,将污染物从水中分离出来或将其转化为无害物质。
常用的物理化学方法包括混凝沉淀法、活性炭吸附法等。
例如,使用
沉淀剂可以将水中的悬浮颗粒物快速沉降下来。
三、未来的发展方向
随着科技的进步与环境问题的日益突出,环境化学在水体污染
物分析与控制领域的发展也愈发重要。
未来环境化学在水体污染物分
析与控制方面的发展可以从以下几个方向着手:
1. 发展绿色环保的化学分析方法。
针对传统化学分析方法中存在的环境污染和资源消耗等问题,
研发更加绿色环保的化学分析方法,减少对环境的负面影响。
2. 深入研究生物分析方法。
生物分析方法在水体污染物分析与控制中具有巨大潜力。
加强对生物分析方法的研究,开发新的生物指示物和生物传感器,提高生物分析方法的灵敏度和准确性。
3. 探索新的污染物控制技术。
针对新出现的污染物和难降解污染物,积极探索新的污染物控制技术。
例如,开发高效的光催化和电化学技术,提高污染物的降解效率。
结语
环境化学在水体污染物分析与控制中发挥着重要的作用。
通过选择合适的分析方法,我们可以准确地确定水体中的污染物种类和含量;通过采取有效的控制措施,我们可以降低水体污染水平,保护水资源和生态环境的持续健康。
同时,未来的研究方向也呼唤着环境化学的不断创新和发展,为解决水体污染问题作出更大的贡献。
