高考化学钠及其化合物综合练习题附答案解析
高考化学钠及其化合物综合经典题附答案
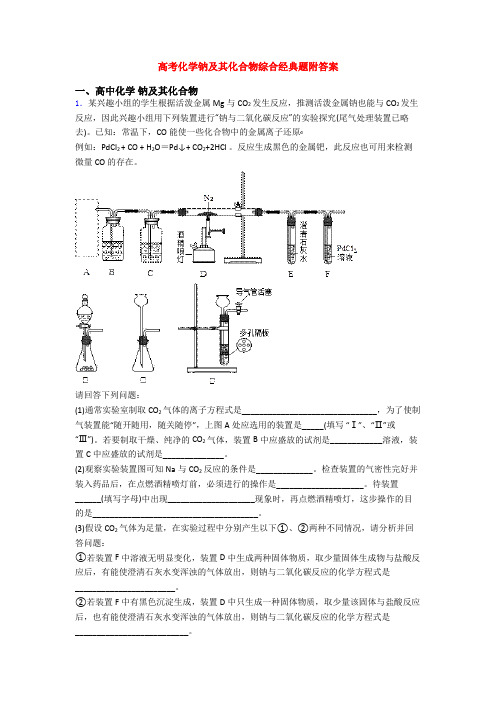
高考化学钠及其化合物综合经典题附答案一、高中化学钠及其化合物1.某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此兴趣小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。
已知:常温下,CO能使一些化合物中的金属离子还原例如:PdCl2 + CO + H2O=Pd↓+ CO2+2HCl 。
反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。
请回答下列问题:(1)通常实验室制取CO2气体的离子方程式是_______________________________,为了使制气装置能“随开随用,随关随停”,上图A处应选用的装置是_____(填写“Ⅰ”、“Ⅱ”或“Ⅲ”)。
若要制取干燥、纯净的CO2气体,装置B中应盛放的试剂是____________溶液,装置C中应盛放的试剂是______________。
(2)观察实验装置图可知Na与CO2反应的条件是_____________。
检查装置的气密性完好并装入药品后,在点燃酒精喷灯前,必须进行的操作是____________________。
待装置______(填写字母)中出现____________________现象时,再点燃酒精喷灯,这步操作的目的是______________________________________。
(3)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请分析并回答问题:①若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是_______________________。
②若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是__________________________。
备战高考化学复习钠及其化合物推断题专项综合练附详细答案

备战高考化学复习钠及其化合物推断题专项综合练附详细答案一、钠及其化合物1.下图为一些物质之间的转化关系,其中部分反应中反应物或生成物未列全。
已知A、H、I、K均为家庭厨房中的常见物质,其中A是食品调味剂,H是消毒剂的有效成分,I、K 可用作食品发泡剂。
B是一种有机酸盐,E、F、G均为氧化物,L是红褐色沉淀。
根据以上信息,回答下列问题:(1)B的组成元素为_____。
(2)鉴别等物质的量浓度的I、K稀溶液的实验方法为_____。
(3)G→J的离子方程式为_____。
(4)M是含氧酸盐,反应①中H、L、D的物质的量之比为3:2:4,则M的化学式为_____。
【答案】Fe、C、O 取I、K的稀溶液,分别滴加CaCl2溶液,出现白色沉淀者为I2FeO+H2O2+6H+=2Fe3++4H2O Na2FeO4【解析】【分析】A是食品调味剂,H是消毒剂的有效成分,则A为NaCl,H为NaClO,G为氧化物,加H2SO4、H2O2生成J,J加D得L,L为红褐色沉淀,则L为Fe(OH)3,D为NaOH,以此逆推可知J为Fe2(SO4)3,G为FeO,则B中含有Fe元素,C为Cl2,B为有机酸盐,则一定含有C、O两元素,E、F为氧化物,结合框图,则F为CO,E为CO2,I为Na2CO3(纯碱),K为NaHCO3(小苏打)。
【详解】(1)由以上分析可知B加热分解可生成CO、CO2、FeO,则应含有Fe、C、O三种元素,故答案为:Fe、C、O;(2)I为Na2CO3(纯碱),K为NaHCO3(小苏打),Na2CO3与氯化钙反应生成CaCO3为白色沉淀,可加入CaCl2溶液鉴别,出现白色沉淀者为Na2CO3,故答案为:取I、K的稀溶液,分别滴加CaCl2溶液,出现白色沉淀者为I;(3)G→J的反应为FeO生成Fe2(SO4)3的过程,H2O2具有氧化性,反应的离子方程式为2FeO+H2O2+6H+=2Fe3++4H2O,故答案为:2FeO+H2O2+6H+=2Fe3++4H2O;(4)H、L、D分别为:NaClO、Fe(OH)3、NaOH,根据物质的量之比为3:2:4,结合生成一种含氧酸盐M,可确定M的化学式为Na2FeO4,方程式为3NaClO+2Fe(OH)3+4NaOH=2Na2FeO4+3NaCl+5H2O,故答案为:Na2FeO4。
高考化学钠及其化合物的综合题试题及答案解析

高考化学钠及其化合物的综合题试题及答案解析一、高中化学钠及其化合物1.已知钠与氧气在不同条件下会发生不同的反应。
(1)将金属钠长时间放置于空气中可发生如下一系列变化,写出此变化中①③步转化的化学方程式:Na Na2O NaOH Na2CO3·10H2O→Na2CO3①___________;③__________。
(2)将钠置于坩埚内,在空气中加热,可燃烧生成一种淡黄色物质。
①钠在空气中燃烧的化学方程式为___________。
②某学习小组通过实验研究Na2O2与水的反应。
操作现象向盛有4.0gNa2O2的烧杯中加入50mL蒸馏水剧烈反应,产生能使带火星木条复燃的气体,得到的无色溶液a向溶液a中滴入两滴酚酞ⅰ.溶液变红ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色Na2O2与水反应的离子方程式是___________,甲同学认为过氧化钠中阴离子结合水中氢离子生成了H2O2,溶液a中的H2O2将酚酞氧化导致褪色。
用实验证实H2O2的存在:取少量溶液a,加入试剂___________(填化学式),有气体产生。
【答案】4Na+O2=2Na2O 2NaOH+CO2+9H2O=Na2CO3•10H2O 2Na+O2Na2O22Na2O2+2H2O=4Na++4OH-+O2↑ MnO2【解析】【分析】(1)反应①是钠和氧气在常温下生成氧化钠;反应③是NaOH和CO2反应生成Na2CO3•10H2O;(2)①钠在空气中燃烧生成过氧化钠;②能使带火星木条复燃的气体是氧气,碱使酚酞变红,说明过氧化钠和水反应生成氢氧化钠和氧气;双氧水在MnO2的催化作用下发生分解反应生成氧气;【详解】(1)反应①是钠和氧气在常温下生成氧化钠,反应方程式是4Na+O2=2Na2O;反应③是NaOH和CO2反应生成Na2CO3•10H2O,反应方程式是2NaOH+CO2+9H2O=Na2CO3•10H2O;(2)①钠在空气中燃烧生成过氧化钠,反应方程式是2Na+O2Δ=Na2O2;②过氧化钠和水反应生成氢氧化钠和氧气,反应的离子方程式是2Na2O2+2H2O=4Na++4OH-+O2↑;双氧水在MnO2的催化作用下发生分解反应生成氧气,取少量溶液a,加入试剂MnO2,有气体产生,能证明H2O2的存在。
高考化学—钠及其化合物的综合压轴题专题复习附答案解析

高考化学—钠及其化合物的综合压轴题专题复习附答案解析一、高中化学钠及其化合物1.纯碱、烧碱等是重要的化工原料。
(1)利用如图所示装置可间接证明二氧化碳与烧碱溶液发生了反应。
将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是______。
若其它操作不变,将A与C连接,可观察到的现象是_______。
(2)向100 mL2 mol/L的NaOH 溶液中通入一定量CO2,结晶,得到9.3 g白色固体,该白色固体的组成是_______(写化学式)。
设计实验确认该白色固体中存在的阴离子,试完成下列方案。
实验操作实验现象结论①取少量白色固体于试管中,加____________足量水溶解,再加足量BaCl2溶液②过滤,取2 mL滤液于试管____________中,滴加酚酞(3)现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:已知NaHCO3在低温下溶解度较小。
反应I为:NaCl+CO2+NH3+H2O NaHCO3↓+NH4Cl,处理母液的两种方法如下。
①向母液中加入石灰乳,可将其中_____循环利用,同时得到融雪剂_____。
②向母液中通入NH3,加入细小的食盐颗粒并降温,可得到NH4Cl晶体。
试写出通入NH3后,溶解度较小的酸式碳酸盐转变为溶解度较大的碳酸盐的离子方程式:______________。
【答案】水沿导管由广口瓶进入烧瓶广口瓶中的长导管口有气泡产生 NaOH和Na2CO3产生白色沉淀原白色固体中有CO32-存在溶液变红溶液中含有氢氧化钠 NH3 CaCl2 HCO3—+NH3=NH4++H2O【解析】【分析】(1)CO2与NaOH反应生成Na2CO3,烧瓶内压强减小;(2)先根据钠原子守恒,通过极值法确定白色固体的组成;根据题中所给试剂,要首先利用中性溶液BaCl2检验出碳酸钠,并将碳酸根离子全部沉淀,再通过检验溶于的pH来确定是否含有NaOH;(3)①根据流程可知,母液中含有氯化铵,加入石灰乳后可以生成氨气;②碳酸氢钠溶于水,母液为碳酸氢钠饱和溶液,向母液中通入氨气,氨气与碳酸氢钠反应碳酸钠和碳酸铵。
高考化学 钠及其化合物综合试题含详细答案

高考化学钠及其化合物综合试题含详细答案一、高中化学钠及其化合物1.有一包NaHCO3和KHCO3的混合物样品。
某研究性学习小组对其进行如下探究。
实验装置如图所示。
将一定质量的混合物样品加入锥形瓶中,用针筒a分次注入一定体积的稀硫酸充分反应,再用针筒b收集生成气体的体积(忽略针筒壁之间的摩擦)(1)为了较准确地测量反应生成的CO2体积,必须保证整个装置的气密性良好。
如果往锥形瓶中注入稀硫酸的体积为V1mL,充分反应后,针筒b中气体的读数为V2mL,则反应中生成的CO2气体体积为______________mL。
(2)某学生通过实验,测得如下数据(所用稀硫酸的物质的量浓度相同),下列分析推理错误的是_________。
50mL稀硫酸50mL稀硫酸50mL稀硫酸m(混合物)9.2g15.7g27.6gV(CO2)(标况)2.24L3.36L3.36L①稀硫酸的物质的量浓度为1.5mol/L②15.7 g混合物恰好与稀硫酸完全反应③加入混合物9.2 g时稀硫酸未反应完④计算出样品中NaHC03和KHC03物质的量之比为1:1(3)某同学设计了另一种方案,其操作流程如下:在转移溶液时,如果溶液转移不完全,则测得的混合物中NaHC03和KHC03物质的量之比______________(选填“偏人”、“偏小”或“不变”)。
【答案】V2-V1②偏大【解析】【分析】【详解】(1)由于在密闭体系中注入V1mL的硫酸,导致此时注射器中也应该为V1mL才能维持内部压强相等,所以后来生成的气体会导致体积在V1mL的基础上增大,硫酸消耗引起的体积变化可以忽略不计,所以二氧化碳的体积为两者的差;即V2-V1mL;所以本题答案:V2-V1;(2)①m(混合物)= 15.7gg,V(CO2)标况)=3.36L, m(混合物)= 27.6g,V(CO2)标况)=3.36L,说明此时混合物过量,根据HCO3−+H+=H2O+CO2↑,可知c(H+)=n/V=3.36L/22.4L∙mol-1/0.05L=3mol/L,所以稀硫酸的物质的量浓度为1.5mol/L,故①正确;②由m(混合物)= 9.2g,V(CO2)标况)=2.24L,根据HCO3−+H+=H2O+CO2↑可知n(HCO3-)=0.1mol,混合物的平均摩尔质量为=9.2g/0.1mol=92 g/mol,15.7g/92 g∙mol-1=0.17mol,50mL 硫酸中氢离子的物质的量为n(H+)=0.15mol,所以15.7 g混合物恰好与稀硫酸不能完全反应,故②错误;③锥形瓶中发生的反应是碳酸氢钠、碳酸氢钾与稀硫酸的反应,其离子反应方程式为HCO3−+H+=H2O+CO2↑,由表中的数据可知:m(混合物)= 9.2g,V(CO2)标况)=2.24L此时硫酸有剩余,故③正确;④由m(混合物)= 9.2g,V(CO2)标况)=2.24L,根据HCO3−+H+=H2O+CO2↑可知n(HCO3-)=0.1mol,混合物的平均摩尔质量为=9∙2g/0.1mol=92 g/mol,根据所以样品中NaHCO3和KHCO3物质的量之比为1:1,故④正确;所以本题答案:②;(3)NaHCO3和KHCO3的混合物与过量的盐酸反应,溶液中溶质为NaCl 和KCl,该实验方案最后称量的是氯化钠和氯化钾质量,如果溶液转移不完全,称量的氯化钠和氯化钾质量偏小。
高考化学 钠及其化合物 综合题附答案

高考化学钠及其化合物综合题附答案一、高中化学钠及其化合物1.纯碱、烧碱等是重要的化工原料。
(1)利用如图所示装置可间接证明二氧化碳与烧碱溶液发生了反应。
将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是______。
若其它操作不变,将A与C连接,可观察到的现象是_______。
(2)向100 mL2 mol/L的NaOH 溶液中通入一定量CO2,结晶,得到9.3 g白色固体,该白色固体的组成是_______(写化学式)。
设计实验确认该白色固体中存在的阴离子,试完成下列方案。
实验操作实验现象结论①取少量白色固体于试管中,加____________足量水溶解,再加足量BaCl2溶液②过滤,取2 mL滤液于试管____________中,滴加酚酞(3)现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:已知NaHCO3在低温下溶解度较小。
反应I为:NaCl+CO2+NH3+H2O NaHCO3↓+NH4Cl,处理母液的两种方法如下。
①向母液中加入石灰乳,可将其中_____循环利用,同时得到融雪剂_____。
②向母液中通入NH3,加入细小的食盐颗粒并降温,可得到NH4Cl晶体。
试写出通入NH3后,溶解度较小的酸式碳酸盐转变为溶解度较大的碳酸盐的离子方程式:______________。
【答案】水沿导管由广口瓶进入烧瓶广口瓶中的长导管口有气泡产生 NaOH和Na2CO3产生白色沉淀原白色固体中有CO32-存在溶液变红溶液中含有氢氧化钠 NH3 CaCl2 HCO3—+NH3=NH4++H2O【解析】【分析】(1)CO2与NaOH反应生成Na2CO3,烧瓶内压强减小;(2)先根据钠原子守恒,通过极值法确定白色固体的组成;根据题中所给试剂,要首先利用中性溶液BaCl2检验出碳酸钠,并将碳酸根离子全部沉淀,再通过检验溶于的pH来确定是否含有NaOH;(3)①根据流程可知,母液中含有氯化铵,加入石灰乳后可以生成氨气;②碳酸氢钠溶于水,母液为碳酸氢钠饱和溶液,向母液中通入氨气,氨气与碳酸氢钠反应碳酸钠和碳酸铵。
高考化学 钠及其化合物综合试题附答案

高考化学钠及其化合物综合试题附答案一、高中化学钠及其化合物1.纯碱、烧碱等是重要的化工原料。
(1)利用如图所示装置可间接证明二氧化碳与烧碱溶液发生了反应。
将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是______。
若其它操作不变,将A与C连接,可观察到的现象是_______。
(2)向100 mL2 mol/L的NaOH 溶液中通入一定量CO2,结晶,得到9.3 g白色固体,该白色固体的组成是_______(写化学式)。
设计实验确认该白色固体中存在的阴离子,试完成下列方案。
实验操作实验现象结论①取少量白色固体于试管中,加____________足量水溶解,再加足量BaCl2溶液②过滤,取2 mL滤液于试管____________中,滴加酚酞(3)现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:已知NaHCO3在低温下溶解度较小。
反应I为:NaCl+CO2+NH3+H2O NaHCO3↓+NH4Cl,处理母液的两种方法如下。
①向母液中加入石灰乳,可将其中_____循环利用,同时得到融雪剂_____。
②向母液中通入NH3,加入细小的食盐颗粒并降温,可得到NH4Cl晶体。
试写出通入NH3后,溶解度较小的酸式碳酸盐转变为溶解度较大的碳酸盐的离子方程式:______________。
【答案】水沿导管由广口瓶进入烧瓶广口瓶中的长导管口有气泡产生 NaOH和Na2CO3产生白色沉淀原白色固体中有CO32-存在溶液变红溶液中含有氢氧化钠 NH3 CaCl2 HCO3—+NH3=NH4++H2O【解析】【分析】(1)CO2与NaOH反应生成Na2CO3,烧瓶内压强减小;(2)先根据钠原子守恒,通过极值法确定白色固体的组成;根据题中所给试剂,要首先利用中性溶液BaCl2检验出碳酸钠,并将碳酸根离子全部沉淀,再通过检验溶于的pH来确定是否含有NaOH;(3)①根据流程可知,母液中含有氯化铵,加入石灰乳后可以生成氨气;②碳酸氢钠溶于水,母液为碳酸氢钠饱和溶液,向母液中通入氨气,氨气与碳酸氢钠反应碳酸钠和碳酸铵。
高考化学钠及其化合物综合经典题含答案解析

高考化学钠及其化合物综合经典题含答案解析一、高中化学钠及其化合物1.为测定某样品中碳酸氢钠的质量分数(假设仅含杂质氯化钠),某学生设计了如下实验方案:(1)称量所需要的仪器是_______________;(2)样品放在_________(仪器名)中灼烧,在_________(仪器名)中冷却;(3)实验中操作A的名称为_______________;(4)灼烧后的样品若在空气中冷却,会造成实验结果_______(填“偏大”、“偏小”或“不变”);(5)样品中碳酸氢钠的质量分数为_________(保留3位有效数字)。
已知该样品碳酸氢钠的质量分数为0.800,则本次实验的相对误差为___________;(6)将灼烧后的样品加足量稀硫酸溶解,生成的气体在标准状况下的体积为_____毫升(按碳酸氢钠质量分数0.800计算)。
【答案】电子天平坩埚干燥器恒重偏大0.768-4%640【解析】【详解】(1)托盘天平不能精确到小数点后三位,精确称量固体质量的仪器是电子天平,故答案为:电子天平;(2)灼烧应放在坩埚中,灼烧后的样品放在空气中冷却,碳酸钠吸水,所以放在干燥器中冷却,故答案为:坩埚,干燥器;(3)反复灼烧至固体质量不再变化的实验操作叫恒重法,故答案为:恒重;(4)灼烧后的样品放在空气中冷却,碳酸钠吸水,会造成实验结果偏大,故答案为:偏大;(5)碳酸氢钠受热分解生成碳酸钠,根据化学反应方程式2NaHCO3Na2CO3 + H2O + CO2↑计算,当168g NaHCO3分解时固体质量减少62g,现在减少3.000g - 2.150g =0.850g,所以NaHCO3的质量为2.303g,碳酸氢钠的质量分数为2.303g0.7683.000g==,相对误差0.7680.800100%4%0.800-=⨯=-,故答案为:0.768,-4%;(6)根据化学反应方程式2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑,当168g NaHCO3参加反应时,产生CO244.8L = 44800mL,当3.000g×0.800=2.400g参加反应时生成CO2640mL,故答案为640。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学钠及其化合物综合练习题附答案解析一、高中化学钠及其化合物1.如图所示,“二氧化碳是否在有水存在时,才能与过氧化钠反应?”这个问题可通过以下实验加以证明。
(1)按图装置,在干燥的试管Ⅲ中装入Na2O2后,在通入CO2之前,应事先将活塞(K1、K2)关闭好,目的何在?____。
(2)试管I内的试剂X是__时,打开活塞K1、K2,加热试管Ⅲ约5分钟后,将带火星的小木条插入试管Ⅱ的液面上,可观察到带火星的小木条不能剧烈地燃烧起来,且Ⅲ内淡黄色粉末未发生变化,则所得的结论是____。
(3)试管I内试剂为CO2饱和水溶液时,其他操作同(2),通过____的现象,可以证明Na2O2与潮湿的CO2能反应且放出O2。
(4)CO2与过氧化钠反应机理也可用示踪原子分析加以证明,请完成下列反应方程式:__Na2O2+____C18O2+____H218O→____。
【答案】以防止试管Ⅲ内的过氧化钠和外界相通时发生吸潮现象浓H2SO4过氧化钠与干燥的CO2不反应带火星的小木条在试管Ⅱ的液面上复燃,同时,Ⅲ内固体由淡黄色变为白色 2 2 2 ═2Na2C18O3+O2↑+2H2O【解析】【详解】(1)本题旨在利用对比实验,探究Na2O2与CO2反应的环境,故实验步骤中,首先让Na2O2与干燥CO2反应,必须保证整个环境中不能有H2O,故通入反应装置前CO2必须干燥,故答案为以防止试管Ⅲ内的过氧化钠和外界相通时发生吸潮现象;(2)二氧化碳必须是干燥的,所以使用试剂X浓硫酸进行干燥;由带火星的小木条不能剧烈地燃烧起来,且Ⅲ内淡黄色粉末未发生变化,说明干燥的二氧化碳与过氧化钠没有发生反应,故答案为浓H2SO4;过氧化钠与干燥的CO2不反应;(3)过氧化钠与潮湿的二氧化碳反应会生成氧气,所以带火星的小木条在试管Ⅱ的液面上会复燃;Ⅲ内固体由淡黄色变为白色,说明淡黄色的过氧化钠由于参加了反应生成了白色的碳酸钠,故答案为带火星的小木条在试管Ⅱ的液面上复燃,同时,Ⅲ内固体由淡黄色变为白色;(4)过氧化钠与潮湿的二氧化碳反应的实质为:二氧化碳与水结合生成碳酸,碳酸电离的氢离子与过氧化钠反应,碳酸中18O完全存在于碳酸根离子中,生成的水中不含18O,反应的化学方程式为:2Na2O2+2C18O2+2H218O═2Na2C18O3+O2↑+2H2O,故答案为2;2;2;═2Na2C18O3+O2↑+2H2O。
【点睛】本题考查了碱金属及其化合物的性质,该题是高考中的常见考点和题型,试题基础性强,旨在考查学生的逻辑推理能力。
本题的易错点为(4),碳酸电离的氢离子与过氧化钠反应,碳酸中18O 完全存在于碳酸根离子中。
2.已知①Na 2O 2 ②O 2 ③HClO ④H 2O 2 ⑤Cl 2 ⑥NaClO ⑦O 3七种物质都具有强氧化性。
请回答下列问题:(1)上述物质中互为同素异形体的是_____(填序号,下同)。
(2)含非极性键的共价化合物是_________。
(3)属于离子化合物的有______种。
(4)Na 2O 2、HClO 、H 2O 2均能用于制备O 2。
①HClO 在光照条件下分解生成O 2和HCl ,用电子式表示HCl 的形成过程:_________________________。
②写出Na 2O 2与H 2O 反应制备O 2的化学方程式:____________________________________。
③H 2O 2在二氧化锰催化作用下可以制备O 2。
若6.8g H 2O 2参加反应,则转移电子数目为_________,生成标准状况下O 2体积为_______L 。
【答案】②⑦ ④ 22Na 2O 2 +2H 2O=4NaOH +O 2↑ 1.204x1023或0.2N A 2.24【解析】【分析】根据物质的分类的依据,熟悉同素异形体、离子化合物的概念,用电子式表示共价化合物的物质形成的过程。
【详解】(1)同种元素组成的结构不同的单质互为同素异形体。
故O 2与O 3互为同素异形体; (2)Na 2O 2既含有非极性共价键又含有离子键的离子化合物;HClO 是含有极性键共价键而不含非极性共价键的化合物;H 2O 2既含有极性共价键又含有非极性共价键的化合物;NaClO 既含有极性共价键又含有离子键的离子化合物;O 2、O 3、Cl 2属于单质,不属于化合物,故含非极性键的共价化合物是④H 2O 2;(3)由(2)可知,Na 2O 2、NaClO 属于离子化合物,故属于离子化合物的有2种; (4)HCl 是共价化合物,用电子式表示HCl 的形成过程是:; (5)Na 2O 2与H 2O 反应生成氧气和氢氧化钠,其反应的化学方程式为2Na 2O 2+2H 2O=4NaOH +O 2↑;(6)2H 2O 22MnO O 2↑+2H 2O ,每生成1mol 转移2mol 电子,故6.8g H 2O 2的物质的量:16.8g 34g mol -⋅=0.2mol ,生成氧气的物质的量为0.1mol ,转移的电子的数目为0.1mol×2×6.02×1023mol -1=1.204x1023;V(O 2) = 0.1mol×22.4L·mol -1=2.24L 。
3.10℃时加热NaHCO3饱和溶液,测得该溶液的pH随温度的升高发生如下变化:甲同学认为,该溶液pH升高的原因是随温度的升高HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为____________________。
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3,该分解反应的化学方程式为_______________。
丙同学认为甲、乙的判断都不充分。
丙认为:(1)只要在加热煮沸的溶液中加入足量的BaCl2溶液,若产生沉淀,则乙判断正确。
为什么?能不能选用Ba(OH)2溶液?_____________________________________________。
(2)将加热后的溶液冷却到10 ℃,若溶液的pH______(填“高于”、“低于”或“等于”)8.3,则__________(填“甲”或“乙”)判断正确。
【答案】HCO3-+H2O H2CO3+OH-大于 2NaHCO3Na2CO3+CO2↑+H2O 若原因是HCO3-水解程度增大,则溶液中几乎没有CO32-,所以可用BaCl2溶液检验溶液中是否含有CO32-来推知乙的观点是否正确,但不能选用Ba(OH)2溶液,因为Ba2++OH-+HCO3-===BaCO3↓+H2O,若用Ba(OH)2溶液检验,无论哪种观点都会有沉淀产生等于甲【解析】【分析】HCO是弱酸根离子,HCO水解出碳酸和氢氧根离子;碳酸氢钠加热分解为碳酸钠、二氧化碳、水;碱性越强,说明水解程度越大;(1) CO能与钡离子结合成碳酸钡沉淀,HCO与钡离子不反应;Ba(OH)2和碳酸钠、碳酸氢钠都能反应生成碳酸钡沉淀;(2)水解反应可逆,恢复到原温度,水解平衡逆向移动;【详解】HCO水解出碳酸和氢氧根离子,水解方程式:HCO+H2OƒH2CO3+OH-。
碳酸氢钠加热分解为碳酸钠、二氧化碳、水,反应方程式是2NaHCO3Δ=Na2CO3+CO2↑+H2O;碱性越强,说明水解程度越大,所以Na2CO3的水解程度大于NaHCO3;(1)CO能与钡离子结合成碳酸钡沉淀,HCO与钡离子不反应,在加热煮沸的溶液中加入足量的BaCl2溶液,若产生沉淀,说明溶液中含有CO;由于Ba(OH)2和碳酸钠、碳酸氢钠都能反应生成碳酸钡沉淀,所以不能选用Ba(OH)2溶液;(2)水解反应可逆,若恢复到原温度,水解平衡逆向移动,将加热后的溶液冷却到10 ℃,若溶液的pH等于8.3,则甲判断正确。
【点睛】本题考查碳酸钠、碳酸氢钠的性质,注意碳酸钠的水解程度大于碳酸氢钠,鉴别碳酸钠、碳酸氢钠用氯化钙或氯化钡溶液,不能用氢氧化钙或氢氧化钡。
4.①盐酸、②铁、③碳酸氢钠、④二氧化硅是常见的物质。
请回答下列问题。
(1)上述4种物质中属于盐的是______ (填序号,下同);水溶液能使紫色石蕊溶液变红的是______ 。
(2)写出盐酸的电离方程式___________。
(3)写出二氧化硅与氢氧化钠溶液反应的化学方程式_____________。
(4)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为_______。
等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO 2的量,前者_______后者(填“>”、“<”或“=”)。
(5)氯碱工业是以电解饱和食盐水为基础的基本化学工业。
电解饱和食盐水的产物中一种是所有气体中密度最小的气体、一种是黄绿色气体和一种易溶、易电离的碱,则电解食盐水的化学方程式:___________。
【答案】③ ① HCl=H ++Cl - SiO 2+2NaOH=Na 2SiO 3+H 2O HCO 3-+H +=H 2O+CO 2↑ = 2NaCl+2H 2O电解2NaOH+H 2↑+Cl 2↑ 【解析】【分析】(1)由金属阳离子(或铵根离子)和酸根离子组成的化合物属于盐;酸使紫色石蕊溶液变红;(2)盐酸是强酸,完全电离产生氢离子和氯离子;(3)二氧化硅与氢氧化钠反应生成硅酸钠和水,据此写出反应的方程式;(4)碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,根据离子方程式的书写方法书写;二者都可与盐酸反应生成二氧化碳气体,结合方程式判断;(5)根据电解饱和食盐水的电解原理,阴极产生氢气和氢氧化钠,阳极产生氯气,写出电解饱和食盐水的电解方程式。
【详解】(1)①盐酸属于酸、能使紫色石蕊溶液变红②铁是单质③碳酸氢钠是盐④二氧化硅是氧化物;故答案为:③;①;(2)盐酸是强酸,完全电离产生氢离子和氯离子,方程式为:HCl=H ++Cl -,故答案为:HCl=H ++Cl -;(3)二氧化硅与氢氧化钠溶液反应生成了硅酸钠和水,反应的离子方程式为:SiO 2+2NaOH=Na 2SiO 3+H 2O ,故答案为:SiO 2+2NaOH=Na 2SiO 3+H 2O ;(4)碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,反应的离子方程式为:HCO 3-+H +=H 2O+CO 2↑;碳酸氢钠与足量盐酸反应的化学方程式为:NaHCO 3+ HCl= NaCl+ H2O+CO 2↑,碳酸钠与足量盐酸反应的化学方程式为:Na 2CO 3+2HCl=2NaCl+H 2O+CO 2↑,由以上两个化学方程式可以看出,等物质的量的Na 2CO 3和NaHCO 3分别与HCl 反应,产生CO 2的物质的量之比为:1: 1;故答案为:HCO 3-+H +=H 2O+CO 2↑;=;(5)通电后阴极氢离子放电,阴极产生氢气和氢氧化钠,阳极上氯离子放电产生氯气,电解反应方程式: 2NaCl+2H 2O 电解2NaOH+H 2↑+Cl 2↑;故答案为:2NaCl+2H2O 电解2NaOH+H2↑+Cl2↑。
