精品人教版九年级第3单元课课题2原子结构(共53张)精品中学PPT课件
合集下载
人教版化学九年级上册教学课件:第三单元课题2 原子的结构(2)
“阳”)离子。
16 2 3.某粒子的结构示意图如图所示,则m= ,n= ,
8 S x= 。该粒子是
(填粒子的化学符号)
第3题图
第4题图
4.某粒子的结构示意图如图所示,若该粒子带2个
单位负电荷,它的化学符号是 O2- ;若该粒子带
2个单位正电荷,它的化学符号是Mg2+ ;若该
粒子不显电性,它的化学符号是 Ne 。
原 子:质子数 = 核外电子数 阳离子:质子数 >核外电子数 阴离子:质子数< 核外电子数
原子和阴,阳离子之间是怎样 相互转化的?
阳 离 子
失电子 得电子
原 子
得电子 失电子
阴 离 子
①1个H2中含多少个质子和电子? 2,2 ②1个H3中含多少个质子和电子? 3,3 ③1个H3+中含多少个质子和电子?3,2 ④1个H3O+中含多少个质子和电子?11,10 ⑤1个NH4+中含多少个质子和电子?11,10
)。
A.
B.Leabharlann C.D.5.已知碘元素(I)原子结构示意图
为
,请回答下列问题:
⑴ x 的值为_53_;
⑵(多选)一般情况下,元素原子最外层电子数相 同,具有相似化学性质.碘元素的化学性质与
下列元素的化学性质最相似的是(AB ).
A.
B.
C.
D.
钠原子最外层有1个 电子、氯原子最外层有 7个电子,最外层都没有 达到相对稳定结构,它 们发生化学反应时,怎 样才能达到相对稳定结 构?
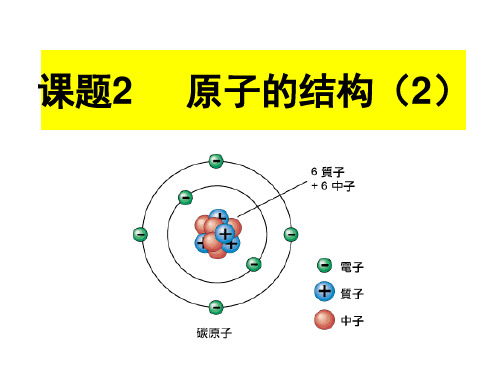
课题2 原子的结构(2)
你知道吗?
原子核的半径为原子半径 的十万分之一
原子核的体积为原子体积 的千亿分之一
所以在原子核外有很大的空间,电子就在 这广阔的空间里高速运动。
16 2 3.某粒子的结构示意图如图所示,则m= ,n= ,
8 S x= 。该粒子是
(填粒子的化学符号)
第3题图
第4题图
4.某粒子的结构示意图如图所示,若该粒子带2个
单位负电荷,它的化学符号是 O2- ;若该粒子带
2个单位正电荷,它的化学符号是Mg2+ ;若该
粒子不显电性,它的化学符号是 Ne 。
原 子:质子数 = 核外电子数 阳离子:质子数 >核外电子数 阴离子:质子数< 核外电子数
原子和阴,阳离子之间是怎样 相互转化的?
阳 离 子
失电子 得电子
原 子
得电子 失电子
阴 离 子
①1个H2中含多少个质子和电子? 2,2 ②1个H3中含多少个质子和电子? 3,3 ③1个H3+中含多少个质子和电子?3,2 ④1个H3O+中含多少个质子和电子?11,10 ⑤1个NH4+中含多少个质子和电子?11,10
)。
A.
B.Leabharlann C.D.5.已知碘元素(I)原子结构示意图
为
,请回答下列问题:
⑴ x 的值为_53_;
⑵(多选)一般情况下,元素原子最外层电子数相 同,具有相似化学性质.碘元素的化学性质与
下列元素的化学性质最相似的是(AB ).
A.
B.
C.
D.
钠原子最外层有1个 电子、氯原子最外层有 7个电子,最外层都没有 达到相对稳定结构,它 们发生化学反应时,怎 样才能达到相对稳定结 构?
课题2 原子的结构(2)
你知道吗?
原子核的半径为原子半径 的十万分之一
原子核的体积为原子体积 的千亿分之一
所以在原子核外有很大的空间,电子就在 这广阔的空间里高速运动。
人教版九年级化学上册第三单元课题2原子的结构课件.pptx

= 原子中:质子数核外电子数
> 阳离子:质子数核外电子数 < 阴离子:质子数核外电子数
练习:哪些表示原子、阳离子、阴离子?
+16 2 8 6
S原子
+11 2 8 1
Na原子
+17 2 8 8
阴离子Cl-
+8 2 8
阴离子O2-
+10 2 8
Ne原子
+11 2 8
阳离子Na+
下列关于原子、离子的说法正确的是() C A、原子是不可分割的最小微粒,离子是带电的 原子或原子团。 B、原子都是不稳定结构,而离子都是稳定结构。 C、分子、原子、离子都总在不断运动。 D、原子和离子之间不可以相互转化。
7.离子与原子的关系
原子和阴,阳离子之间是怎样相 互转化的?
阳 离 子
失电子 得电子
原 子
得电子 失电子
阴 离 子
• [模拟训练]
• 点燃条件下,镁带可以在空气中燃烧生成氧化 镁。这个反应在微观世界里是怎样发生的?
失去2个电子
+12 2 8 2
+12 2 8
镁原子(Mg)
镁离子(Mg2+) 阳离子
请你动手试一试:
元 质子 电子 素 数 层数 H1 1
O8 2 Ne 10 2
Mg 12 3
Cl 17 3
各层电子数 第1层 第2层 第3层
1
26
28
28 2
28
7
2.原子结构示意图:
第一层 第二层 第三层(最外层)
弧线表示 电子层
+11 281
弧线上的数字表示各电子层上的电子数
数字1也可以表示 最外层电子数
最新人教版初中化学九年级上册《3课题2原子的结构》PPT课件 (1)

•1.认识原子的构成 • 2.了解原子核外电子是分层排布 的及原子结构的表示方法
最新初中化学精品课件设计
原子体积很小
最新初中化学精品课件设计
知识点1 原子的构成(P53) 我们已经知道:原子是化学变化 中的最小粒子。
最新初中化学精品课件设计
原
子
道尔顿模型(1803)—“原子不可分”观点
结
构
模
汤姆生模型(1904) —“枣糕”模型
最新初中化学精品课件设计
电子在核外做高速的运转
现代原子构成
原子
原子核
核外
种类 质子数 中子数 电子数
钠 11 11 11
氯 17 18 17
最新初中化学精品课件设计
原子核 原子 原子核比原子小得多
像钠原子、氯原子,核外的多个电子是如 何运动的?有无规律?
最新初中化学精品课件设计
知识点2 原子核外电子的排布(P54) 分层排布(高速运动)
最新初中化学精品课件设计
原子是一个平均分布着正电荷的粒子, 其中镶嵌着许多带负电的电子,中和了正电
荷,从而形成了中性原子。
+
- +-
-+ +-
-
+
+- +
面包里的葡萄干
最新初中化学精品课件设计
最新初中化学精品课件设计
电子在原子核外空间的一 定轨道上分层绕核做高速的圆
周运动。
最新初中化学精品课件设计
各原子最外层电子数目的特点
原子种类
最外层 电子数
是否稳定 结构
得失 化学性 电子 质
最外层电子数决定了原子的化学性质。
最新初中化学精品课件设计
[想一想]通过今天的学习, 你有哪些收获?
[问一问]你对所学的知识 还存有哪些疑问?
最新初中化学精品课件设计
原子体积很小
最新初中化学精品课件设计
知识点1 原子的构成(P53) 我们已经知道:原子是化学变化 中的最小粒子。
最新初中化学精品课件设计
原
子
道尔顿模型(1803)—“原子不可分”观点
结
构
模
汤姆生模型(1904) —“枣糕”模型
最新初中化学精品课件设计
电子在核外做高速的运转
现代原子构成
原子
原子核
核外
种类 质子数 中子数 电子数
钠 11 11 11
氯 17 18 17
最新初中化学精品课件设计
原子核 原子 原子核比原子小得多
像钠原子、氯原子,核外的多个电子是如 何运动的?有无规律?
最新初中化学精品课件设计
知识点2 原子核外电子的排布(P54) 分层排布(高速运动)
最新初中化学精品课件设计
原子是一个平均分布着正电荷的粒子, 其中镶嵌着许多带负电的电子,中和了正电
荷,从而形成了中性原子。
+
- +-
-+ +-
-
+
+- +
面包里的葡萄干
最新初中化学精品课件设计
最新初中化学精品课件设计
电子在原子核外空间的一 定轨道上分层绕核做高速的圆
周运动。
最新初中化学精品课件设计
各原子最外层电子数目的特点
原子种类
最外层 电子数
是否稳定 结构
得失 化学性 电子 质
最外层电子数决定了原子的化学性质。
最新初中化学精品课件设计
[想一想]通过今天的学习, 你有哪些收获?
[问一问]你对所学的知识 还存有哪些疑问?
九年级化学上册《第三单元 课题2 原子的结构》说课课件(共38张PPT)

原子(0)
C4E、O 全中班子交(流0)结果:核电荷数=核内质子
数=核外电子数
总结新知核外电子(-)
材料二:原子“绝对不可再分”的观点在19世纪末受到了新的科学发现 的冲击。1879年,英国剑桥大学物理学家汤姆生利用阴极射线能被电 场和磁场联合偏转的作用,验证了一种带负电荷的粒子是原子的共同组 成部分,并称之为电子。1903年电子发现者汤姆生提出一个原子的 “葡萄干面包”模型,认为由于原子对外不显电性,所以原子是一种正 电荷平均分布着的粒子,电子嵌在原子中,如同葡萄干嵌在面包中一样。
阅读材料
三
卢瑟福眼中的原 子结构
小组交流、讨论
卢瑟福认为的原子 结构是什么样的。
学生展讲
推荐一个卢瑟福展讲, 学生补充,试画原子, 教师评价。
教师点拨
随着学生的展讲, 教师播放α粒子散 射实验视频,教
师点拨。
第四部分 说教学流程
由于卢瑟福的实验既证明了原子核 的存在,又显示出原子核体积小质量大 的特点,并且显正电,非常重要,而有 很多学生看不懂资料三,所以学生展讲 以后,趁学生的求知欲望高涨,教师播 放卢瑟福所做的α粒子散射实验视频,并 简要解释,让学生直观地认识原子的构 成,教师做适当点拨。
阅读材料
二
汤姆生眼中的原 子结构
小组交流、讨论
汤姆生认为的原子 结构是什么样的。
学生展讲
推荐一个汤姆生展讲, 并试画原子,教师评 价。
教师点拨
随着学生的展讲, 教师播放与汤姆 生相关的原子结
构图片。
第四部分 说教学流程
原子并不是构成物质的最小微粒 ——汤姆生发现了电子(1897年)
汤 姆 生
枣糕模型
电子
带正电荷 的物质
人教版化学-九年级上册化学上册第三单元课题2 原子的结构(课件)

第1层 第2层 第3层
(也叫最外层)
+2 2
+10 2 8
+18 2
8
8
+11
2
8 1
+12 2 8 2
氦(He) 氖(Ne) 氩(Ar) 钠(Na) 镁(Mg)
+6 2 4 +7 2 5
+8 2 6
+9 2 7
+13 2 8 3
碳(C) 氮(N) 氧(O) 氟(F) 铝(Al)
3、核外电子排布的规律
1、离子 带电的原子
2、离子分类
阴离子 (电子数>质子数) 阳离子 (电子数<质子数)
3、离子的表示——离子符号
n±
X
离子带正或负电
离子所带电荷数(得失电子 数;当n=1时略去不写 )
4、离子也是构成物质的一种粒子
宏 物质
组成
观
4
元素 只讲种类
不讲个数
构
微
成
观
既讲种类 又讲个数
分子 构成 原子 形成 离子
2、 原子的构成
原 子
原核
子
质子:一个质子带一个单位 的正电荷
中子:中子不带电
电子:一个电子带一个单位的负电荷
探究:
铁、铝等金属都是原子直接构成的,原子中存 在带电荷的粒子(质子和电子),原子是否显 电性?
原子不显电性
原子不显电性的原因:
由于原子核所带电量和核外电子的 电量相等,但电性相反,所以整个原 子不显电性。
+8 2 8
+10 2 8
+11 2 8
+17 2 8 8
①它们都带有电荷 ②它们都具有稳定结构 ③它 们核外电子排布相同 ④它们属于不同种元素 A①② B②③ C②④ D③④
(也叫最外层)
+2 2
+10 2 8
+18 2
8
8
+11
2
8 1
+12 2 8 2
氦(He) 氖(Ne) 氩(Ar) 钠(Na) 镁(Mg)
+6 2 4 +7 2 5
+8 2 6
+9 2 7
+13 2 8 3
碳(C) 氮(N) 氧(O) 氟(F) 铝(Al)
3、核外电子排布的规律
1、离子 带电的原子
2、离子分类
阴离子 (电子数>质子数) 阳离子 (电子数<质子数)
3、离子的表示——离子符号
n±
X
离子带正或负电
离子所带电荷数(得失电子 数;当n=1时略去不写 )
4、离子也是构成物质的一种粒子
宏 物质
组成
观
4
元素 只讲种类
不讲个数
构
微
成
观
既讲种类 又讲个数
分子 构成 原子 形成 离子
2、 原子的构成
原 子
原核
子
质子:一个质子带一个单位 的正电荷
中子:中子不带电
电子:一个电子带一个单位的负电荷
探究:
铁、铝等金属都是原子直接构成的,原子中存 在带电荷的粒子(质子和电子),原子是否显 电性?
原子不显电性
原子不显电性的原因:
由于原子核所带电量和核外电子的 电量相等,但电性相反,所以整个原 子不显电性。
+8 2 8
+10 2 8
+11 2 8
+17 2 8 8
①它们都带有电荷 ②它们都具有稳定结构 ③它 们核外电子排布相同 ④它们属于不同种元素 A①② B②③ C②④ D③④
人教九年级上册第三单元课题原子的结构原子核外电子的排布PPTPPTppt文档

人教九年级上册第三单元课题原子的结构原子核外电子的 排布PPTPPT
的结构第2课时原子 核外电子的排布共 22张PPT共23张
PPT
4.元素的性质与原子最外层电子数的关系
元素的分类 最外层电 稳定性 得失电 化学性
子数
子趋势 质
金属元素
一般<4 不稳定
易失去 电子
容易 发生化
非金属元素 一般>4
则x= 18 。 3)当y=8时,若该微粒带有二个单位负电荷,
则该微粒符号为 S2- 。
Na变成Na+有哪些变化?Cl变成Cl-?
1、最外层电子数一定 改变 。 2、核电荷数或质子数一定 不变 。 3、电子层 可能改变 。 4、化学性质 改变 。
某微粒的结构示意图如下表示:+x 2 8 y
1)该微粒有 3个
电子层。
y与微粒的 化学性质
关系非常密切。
2)当y=8时,若该微粒为中性原子,
离子
构成物质的基本粒子有 分子、原子 、离子等。例如 氢气的构成粒子是_氢__分__子_, 汞的构成粒子是汞__原__子__, 氯化钠是由_钠___离___子___和_氯____离___子__构成的。
练习:哪些表示原子、阳离子、阴离子?
+16 2 8 6
S原子
+8 2 8
阴离子O2-
+11 2 8 1
失去2个电子
+12 2 8 2
+12 2 8
镁原子(Mg)
镁离子(Mg2+ ) 阳离子
得到2个电子 +8 2 6
+8 2 8
氧原子(O)
氧离子( O2- )阴离子
8、离子也是构成物质的一种粒子
的结构第2课时原子 核外电子的排布共 22张PPT共23张
PPT
4.元素的性质与原子最外层电子数的关系
元素的分类 最外层电 稳定性 得失电 化学性
子数
子趋势 质
金属元素
一般<4 不稳定
易失去 电子
容易 发生化
非金属元素 一般>4
则x= 18 。 3)当y=8时,若该微粒带有二个单位负电荷,
则该微粒符号为 S2- 。
Na变成Na+有哪些变化?Cl变成Cl-?
1、最外层电子数一定 改变 。 2、核电荷数或质子数一定 不变 。 3、电子层 可能改变 。 4、化学性质 改变 。
某微粒的结构示意图如下表示:+x 2 8 y
1)该微粒有 3个
电子层。
y与微粒的 化学性质
关系非常密切。
2)当y=8时,若该微粒为中性原子,
离子
构成物质的基本粒子有 分子、原子 、离子等。例如 氢气的构成粒子是_氢__分__子_, 汞的构成粒子是汞__原__子__, 氯化钠是由_钠___离___子___和_氯____离___子__构成的。
练习:哪些表示原子、阳离子、阴离子?
+16 2 8 6
S原子
+8 2 8
阴离子O2-
+11 2 8 1
失去2个电子
+12 2 8 2
+12 2 8
镁原子(Mg)
镁离子(Mg2+ ) 阳离子
得到2个电子 +8 2 6
+8 2 8
氧原子(O)
氧离子( O2- )阴离子
8、离子也是构成物质的一种粒子
(名师整理)最新人教版化学9年级上册第3单元课题2《原子的结构》精品课件
()
A.x B.x+2
C.x-2
D.x+4
当堂训练:
1、某元素R的微粒的结构示意图为: ⑴当x=10+y时,该粒子为______。 (填“阴离子”、“阳离子”或“原子”下同), 当x<10+y时,该粒子为______。 ⑵当y=2时,x=______,该元素能形成的离子
符号为______。 ⑶若该结构示意图表示的粒子是R-, +x 2 8 y
Cl-
Na Cl
离子是由原子 得失电子形成的
2、什么是离子?离子符号怎样表示?
⑴离子:_带__电__的__原_子__(__或__原__子_团__)__叫__离__子___.
⑵符号写法:失几,几正。得几,几付。 阳离子:Na+、 Mg2+、 Al3+、 NH4+ 阴离子:Cl-、 OH-、 O2-、 SO42-
A.中子数为72 B.质子数为72 C.电子数为53 D.质子数和中子数之和为125 4.用其质量的1/12作为相对原子质量的标准的碳原子 相对原子的质量是( )。 A.12g B.12 C.1/12g D.1/12
原子构成的规律:
⑴构成原子的粒子有质子、中子、电子 ⑵不同种类的原子质子数不同 ⑶质子数不 一 定 等于 中 子数 ⑷原 子 中 不 一 定 含 有 中 子 ⑸核电荷数=质子数=核外电子数 ⑹原子质量主要集中在原子核上 ⑺相等原子质量=质子数+中子数
是一种相对稳定结构。
结论: 结构决定性质 元素的化学性质主要由原子的_最__外__层_电__子__数_决定的。
自学检测:
1.氯原子的结构示意图为 +17 2 8 7 下列粒子的 化学性质与氯原子相似的是( )
(名师整理)最新人教版化学9年级上册第3单元课题2《原子的结构》精品课件
相对原子质量
相对原子质量(Ar)
相对原子质量就是碳以原一子种质量 (1.66×10-27Kg)的1/12为标准, 其他原子的质量跟它比相比较所得到
的 A=rx。mmcx×1/12
“相对原子质量”是一个比值, 没有“千克”等质量单位,单位 为“原1子。的质量”,有“千克”等质 量单位。
3、原子质量和相对原子 质量比较
(5)高锰酸钾____(6)氯酸钾______
(7)氯化钾___________
28.根据下列几种粒子的结构示意图,回答问题:
① +8 26 ②+8 28 ③ +16 286 ④ +11 281
(1)其中属于阴离子的是
。(填序号,下同)
(2)属于同种元素的是
。
(3)位于第三周期的是
。
(4)具有相似化学性质的是
1.通过对原子内容的学习,知道原子的构成及构成粒子之间 的关系,知道原子结构示意图的表示方法。 2.了解原子核外的电子是分层排布的,掌握典型原子(稀有 气体、金属和非金属)的原子核外电子的排布特点,并了解 结构与性质的关系。 3.了解离子的形成过程,初步认识离子是构成物质的一种粒 子; 4.知道相对原子质量的含义及计算方法,并学会查找相对原 子质量。
C.一切原子的原子核都是由
质子、中子构成的
D.相对原子质量的单位是“1”
8.有两种不同的原子,一种
原子核内有6个质子和6个中
子,另一种原子核内有7个中
子和6 个质子,它们不相等的
是( )。
A.核电荷数
B.核外
电子数
C.原子所带电量 D.相对
原子质量
4、铝原子(Al)和铝离子(Al3+)都属于铝元素,它
(名师整理)最新人教版化学9年级上册第3单元课题2《原子的结构》精品课件
3、离子的表示——离子符号
元素符号
Xn±
离子带正或负电
离子所带电荷数(得失电子 数;当n=1时略去不写 )
4、离子符号的意义
表示每个镁离子带2个单位的正电荷
2Mg2+
表示两个镁离子
1.元素的化学性质取决于原子结构中的 ( D )
A.电子层数
B.中子数
C.核外电子数
D.最外层电子数
2.右图是钠原子的结构示意图: 弧线表示 电子层 。 原子核内的质子数
最外层具有8个电子(只有一
趋向达到相对稳定结构 个电子层的具有2个电子)的
结构
Na
+11
28 1
失去1个电子 +11
28
Cl
得到1个电子
+17 2 8 7
+17 288
金属元素
非金属元素
原子最外层电子 原子最外层电子 数一般少于4个 数一般多于4个
稀有气体元素
原子最外层电子 数是8(氦2个)
不稳定结构
相对原子质量=
一个原子的质量 一个碳12原子的质量的1/12
光读书不思考也许能使平庸之辈知识 丰富,但它决不能使他们头脑清醒。
—— 约·诺里斯
1.通过对原子内容的学习,知道原子的构成及构成粒子之间 的关系,知道原子结构示意图的表示方法。 2.了解原子核外的电子是分层排布的,掌握典型原子(稀有 气体、金属和非金属)的原子核外电子的排布特点,并了解 结构与性质的关系。 3.了解离子的形成过程,初步认识离子是构成物质的一种粒 子; 4.知道相对原子质量的含义及计算方法,并学会查找相对原 子质量。
钠 + 氯气 点燃 氯化钠
(Na) (Cl 2)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原子的最外层电子数
5、某原子结构示意图如下图:则该原子核电荷数为
有 16个电子,第二层16上有 个电子,
8
最外层有 6个电子,在化学反应中易 电子得。
,核外
+16 2 8 6
6、下列原子结构示意图所表示的元素,化学性质最稳定的是( ) A
+10 2 8
A
+11 2 8 1
B
+12 2 8 2
C
+17 2 8 7
D
四 Na原子与Cl原子在化学变化中怎样达到 相对稳定结构?
Na +11 2 8 1 失去1电子 Cl +17 2 8 7
Na+ +11 2 8
Cl- +17 2 8 8
阳离子
静电作用
阴离子
Na+ Cl-
不带电的化合物NaCl
质子数 11 >电子数 10
质子数 17 <电子数 18
带一个单位正电荷
三 原子核外电子的排布有什么规律?
核外电子的排布规律:
⑴第一层最多容纳___个2电子,第二层最多容纳___个电子8。 (2)最外层不超过 个8 电子,只有1层的不超过___个电子。2 ⑶电子先排满第___层1 ,再排第___层,2排满第___层,再2排第___层。 (按照3能量由低到高的顺序分层排布)
终于抛弃了原子不可分割的陈旧观念。
科学史话——原子结构的探索历程
英国科学家
行星有核模型
卢瑟福
1911年,卢瑟福通过精密的实验证明在原子中心有
一个极小的核,电子绕核做高速旋转。
科学史话——原子结构的探索历程
+ ++
一 原子是怎样构成的?
+பைடு நூலகம்
【智慧阅读】结合原子结构的探索历程,阅
++
读书P53讨论:
1. 原子是实心球体吗?原子的体积大小怎样? 原子不是实心球体,它的体积很小。
2. 原子是由哪几个部分构成的?
原子由原子核和核外电子构成。 3. 原子核由哪几种粒子构成?
4. 原子原中子各核种由粒质子子带和电中情子况构如成何。?
每个质子带一个单位正电荷,每个电子带一个单位负电荷, 5. 什中么子叫不核带电电荷。数?它与质子数有什么关系?
(3)_原_子__可_分__为_原__子_核__和_核__外_电__子_。____________
原子不是实心球体,原子内部有很大空间。
二 核外电子是怎样运动的? 观看原子的核外电子运动的模拟动画。
氢原子的结构 (1个电子)
行星绕太阳运功
原子核外电子运动的特征
核外电子的运动有自己的特点,没有 固定的轨道,但却有经常出现的区域
决定
【合作与交流】
1、金属原子与非金属原子最外层电子数的特点是什么?2、化学反 应中,它们怎样才能达到相对稳定结构? 3、归纳其化学性质主要取决于原子结构中哪一部分?
对比归纳:
4、原子化学性质与核外电子排布的关系:
一般<4个 一般≥4个
8个(氦为2个)
活泼 易失电子
活泼 易得电子
不活泼 不易得失电子
特点:核外电子是分层运动的,这种分层运动也叫分层排布。
核外电子分层排布示意图
核外电子分层排布规律
电子层: 1 2 3 4 5 6 7
离 核: 近
远
能 量: 低
高
能量低的在离核近的区域运动, 能量高的在离核远的区域运动。
钠原子的结构 (11个电子)
第一层(2个)
第二层(8个)
第三层(1个) (最外层)
数字1也可以表示
圆圈表示 原子核 圈内数字表示 质子数 “+”表示 原子核带正电
最外层电子数
3. 某原子的原子结构示意图为
,该原子的
核电荷数为 1,3 核外有 个3电子层,第二层上
有 8 个电子,最外电子层上有 个电3子。
【亲手尝试】根据氧原子的结构图画出结构示意图
第一层(2个) 第二层(6个)
带一个单位负电荷
Na+
Cl-
4、离 子:
1、定义: 带电荷的原子(或原子团)叫做离子
2、分类:
阳离子:带正电荷的原子(或原子团) 阴离子:带负电荷的原子(或原子团)
原子核外电子运动的特征
核外电子的运动有自己的特点,没有 固定的轨道,但却有经常出现的区域
电子在原子核外一定区域内出现,这些区域叫作叫做 “电子层”,核外电子是在不同的电子层内运动的,此 现象叫做核外电子的分层排布。
钠原子的结构 (11个电子)
第一层 第二层 第三层
二.原子核外电子的排布
1. 核外电子的分层排布
2、核外电子排布特点:
(1)、各层最多能容纳的电子数为2n2个;
(2)、最外层不超过8个(除第一层不超过 2个);次外层最多容纳18个电子。
(3)、能量低的优先排满,依次再排能量 逐步升高的电子层里。
3. 原子结构示意图:
第一层
第二层
第三层(最外层)
弧线表示
电子层
+11 2 8 1
弧线上的数字表示 各电子层上的电子数
(最外层)
+8 2 6
4. 下列原子结构示意图书写正确的是(
)C
+3 3 A
6 2 4 +10 2 8 +14 2 7 5
B
C
D
5、画出下表中各原子结构示意图:
【思考与交流】根据所学知识判断,以上哪些原子的结构是相对稳定的?
稀有气体原子。
最外层电子数等于8个(He为2个),这样的结构被认为是相对 稳定结构,即化学性质不活泼。
原子核所带的正电荷数即核电荷数,其等于质子数。
【分组讨论】 观察表3-1中不同原子中各微粒的数目,你能找出
哪些规律?
原子中:核电荷数==质子数==核外电子数 质子数不一定等于中子数。 不是所有的原子都有中子(氢原子没有中子) 不同原子,质子数不同。
原 性子 ?中某些粒整子个是原带子电不的显,电以性氧。原子为例,说明为什么原子不显电
【情景激活】
原子还可以再分吗? 原子究竟是什么样子呢? 今天,咱们就来畅游原子的世界!
科学史话——原子结构的探索历程
英国化学家道尔顿
实心球模型
1803年,道尔顿提出:构成物质的最小粒子是原子 ,原子是不可再分的实心球体。
科学史话——原子结构的探索历程
英国物理学家 汤姆生
枣糕模型
1897年,汤姆生在原子内部发现了电子,人们
1. 填写下表中的空格。
8
8
16
16
12
12
2. 英国科学家道尔顿于19世纪初提出了近代原子学说。 他认为物质是由原物子质构是成由的原,子这构些成原的子是微小的、不可 分割的实心不球可体分。割请你指实出心道球尔体顿原子学说中与现代科 学实验证明的事实不相符的地方:
(1)________________________________ (2)物__质_并__不_都__是_由__原_子__构_成__的_,_分_子__也_可__以_构__成_物__质_。
