2011届高考化学好题速递备考测试题2
2011届高三化学第二轮复习测试题3

连州中学2011届高三化学二轮复习反应原理题训练1.16分) 二甲醚(CH 3OCH 3)被称为21世纪的清洁、高效能源。
(1)合成二甲醚反应一:3H 2(g) + 3CO(g)CH 3OCH 3(g) + C O 2(g) ΔH =-247kJ/mol一定条件下该反应在密闭容器中达到平衡后,要提高CO 的转化率,可以采取的措施是 。
A .低温高压B .加催化剂C .体积不变充入N 2D .增加CO 浓度E .分离出二甲醚(2)合成二甲醚反应二:2CH 3OH(g)CH 3OCH 3(g) + H 2O (g)。
在某温度下,在1L 密闭容器中加入C H① 该温度的平衡常数(写计算过程)②10 min 内平均反应速率v (CH 3OH) = ; (3)右图为绿色电源“二甲醚燃料电池” 的工作 原理示意图。
该反应的还原剂是 (写名称); 若b 电极的反应式为:3O 2+12e -+12H +==6H 2O ,则a 电 极的反应式为: 。
2.(16分)汽车排气中的CO 、NO X 已经成为大气的主要污染物,使用稀土等催化剂能将CO 、NOx 、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。
(1)已知:N 2(g)+ O 2(g)=2NO(g) △H =+180.5 kJ/mol2C(s)+ O 2(g)=2CO(g) △H =-221.0 kJ/mol C(s)+ O 2(g)=CO 2(g) △H =-393.5 kJ/mol试写出NO 与CO 催化转化成N 2和CO 2的热化学方程式 (2)在容积相同的两个密闭容器内(装有等量的某种催化剂),分别充入同量的NO x 及C 3H 6,在不同温度下,同时发生以下反应: 18NO (g )+2C 3H 6(g )9N 2(g )+6CO 2(g )+6H 2O (g ); 18NO 2(g )+4C 3H 6(g )9N 2(g )+12CO2(g )+12H 2O (g );并分别在t 秒时测定其中NO x 转化率,绘得图象如下图所示:二甲醚+H 22①从图中可以得出的结论是结论一:从测定NO X 转化数据中判断,相同温度下 结论二: ②在上述NO 2和C 3H 6反应中,提高NO 2转化率的措施有 。
2011年浙江省高考化学(含解析版)

2011年高考浙江化学试题及答案1.(2011浙江高考)下列说法不正确的是A .化学反应有新物质生成,并遵循质量守恒定律和能量守恒定律B .原子吸收光谱仪可用于测定物质中的金属元素,红外光谱仪可用于测定化合物的官能团C .分子间作用力比化学键弱得多,但它对物质熔点、沸点有较大影响,而对溶解度无影响D .酶催化反应具有高效、专一、条件温和等特点,化学模拟生物酶对绿色化学、环境保护及节能减排具有重要意义2.(2011浙江高考)下列说法不正确的是A .变色硅胶干燥剂含有CoCl 2,干燥剂呈蓝色时,表示不具有吸水干燥功能B .硝基苯制备实验中,将温度计插入水浴,但水银球不能与烧杯底部和烧杯壁接触C .中和滴定实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用D .除去干燥CO 2中混有的少量SO 2,可将混合气体依次通过盛有酸性KMnO 4溶液、浓硫酸的洗气瓶 3.(2011浙江高考)X 、Y 、Z 、M 、W 为五种短周期元素。
X 、Y 、Z 是原子序数依次递增的同周期元素,且最外层电子数之和为15,X 与Z 可形成XZ 2分子;Y 与M 形成的气态化合物在标准状况下的密度为 0.76 g/L ;W 的质子数是X 、Y 、Z 、M 四种元素质子数之和的1/2。
下列说法正确的是A .原子半径:W >Z >Y >X >MB .XZ 2、X 2M 2、W 2Z 2均为直线型的共价化合物C .由X 元素形成的单质不一定是原子晶体D .由X 、Y 、Z 、M 四种元素形成的化合物一定既有离子键,又有共价键4.(2011浙江高考)将NaCl 溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示。
导致该现象的主要原因是液滴之下氧气含量比边缘少。
下列说法正确的是 A .液滴中的Cl ―由a 区向b 区迁移B .液滴边缘是正极区,发生的电极反应为: O 2+2H 2O +4e -=4OH -C .液滴下的Fe 因发生还原反应而被腐蚀,生成的Fe 2+由a 区向b 区迁移,与b 区的OH ―形成Fe(OH)2,进一步氧化、脱水形成铁锈D .若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl 溶液,则负极发生的电极反应为Cu -2e -=Cu 2+5.(2011浙江高考)褪黑素是一种内源性生物钟调节剂,在人体内由食物中的色氨酸转化得到。
2011年高考化学模拟试题及答案(十一)

2011年高三备考化学“好题速递”系列(时间:45分钟满分:100分)一、选择题(每小题5分,共50分)1.下列说法正确的是()A.NaOH的摩尔质量为40 gB.1 mol O2的质量与它的相对分子质量相等C.1 mol OH-的质量为17 g·mol-1D.氦气的摩尔质量(单位g·mol-1)在数值上等于它的相对原子质量2.下列叙述正确的是(用NA代表阿伏加德罗常数的值)()A.2.4 g金属镁变为镁离子时失去的电子数为0.1NAB.1 mol HCl气体中的粒子数与0.5 mol/L盐酸中溶质的粒子数相等C.在标准状况下,22.4 L CH4与18 g H2O所含有的电子数均为10 N AD.CO和N2为等电子体,22.4 L的CO气体与1 mol N2所含的电子数相等3.由阿伏加德罗常数(N A)和一个水分子的质量(m水)、一个水分子的体积(V水),不能确定的物理量有()A.1摩尔水的质量B.1摩尔水蒸气的质量C.1摩尔水的体积D.1摩尔水蒸气的体积4.下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。
其中能表示等质量的氢气与氦气的是()5.在同温同压下,相同体积的甲、乙两种气体的质量比是17∶14。
若乙气体是CO,则甲气体可能是()A.H2S B.HCl C.NH3D.Cl26.在三个密闭容器中分别充入Ne、H2、O2三种气体,在以下各种情况下排序正确的是()A.当它们的体积和温度、压强均相同时,三种气体的密度ρ(H2)>ρ(Ne)>ρ(O2)B.当它们的温度和密度都相同时,三种气体的压强p(H2)>p(Ne)>p(O2)C.当它们的质量和温度、压强均相同时,三种气体的体积V(O2)>V(Ne)>V(H2)D.当它们的压强和体积、温度均相同时,三种气体的质量m(H2)>m(Ne)>m(O2)7.在一定温度和压强下,1 L X气体和1 L Y气体完全反应后生成1 L水蒸气和1 L氮气。
2011高考化学试题分类汇编 金属及其化合物 2

/大家网111高考化学试题分类汇编-金属及其化合物2011CO质量分数的是和NaHCO,混合物中Na1.(2011北京高考11)下列实验方案中,不能测定NaCO..33322 b克A.取a克混合物充分加热,建中 b克固体B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得 b克C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重 b克固体。
a克混合物与足量Ba(OH)溶液充分反应,过滤、洗涤、烘干,得D.取2受热易分解生成碳酸钠、水和二氧化碳,所以通过加热分解利用差量法即可计算出解析:NaHCO3固bg CO和NaHCO均可与盐酸反应生成水、二氧化碳和氯化钠,所以质量分数,NaCO A正确;Na33322正确;混合物与足量稀硫酸充分反应,也会生B体是氯化钠,利用守恒法可计算出NaCO质量分数,32成水和二氧化,所以逸出的气体是二氧化碳,但会混有水蒸气,即碱石灰增加的质量不是二氧化碳的反应,反应的Ba(OH)和NaHCO都与CO质量,因此选项C不能测出混合物中NaCO质量分数;Na233223方程式为222++---,所以可以BaCO+OBa+BaCO=BaCO↓、HCO+OH+Ba↓,因此最后得到的固体是=HCO323333质量分数,选项D也正确。
计算出NaCO32答案:C W的一组化合物是得到福建高考9)下表各选项中,不能利用置换反应通过Y2.(2011..选项化合物 A B C D点燃3222高温2Fe+AlO2AlO热反应,方程式为Fe+;C项中是金属Na与CHOH反应,方程式为2Na523232+2CHCHOH=2CHCHONa+H↑。
这三个反应都是置换反应。
D项中是发生Cu+2FeCl=CuCl+2FeCl,23223232不是置换反应,但学生可能将此反应记错,认为生成了铁单质。
此题难度不大,但素材来自教学一线,考查学生平时学习的错误,对实际教学有一定的指导作用。
答案:D3.(2011广东高考10)某同学通过系列实验探究Mg及其化合物的性质,操作正确且能达到目的的是A、将水加入浓硫酸中得到稀硫酸,置镁片于其中探究讨Mg的活泼性大家网,大家的!更多精品在大家!/545299672.doc211B、将NaOH溶液缓慢滴入MgSO溶液中,观察Mg(OH)沉淀的生成24C、将Mg(OH)浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀2D、将Mg(OH)沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl固体22解析:本题考察镁及其化合物的性质、常见的基本实验操作。
2011年高考题化学反应速率 化学平衡 整理及答案
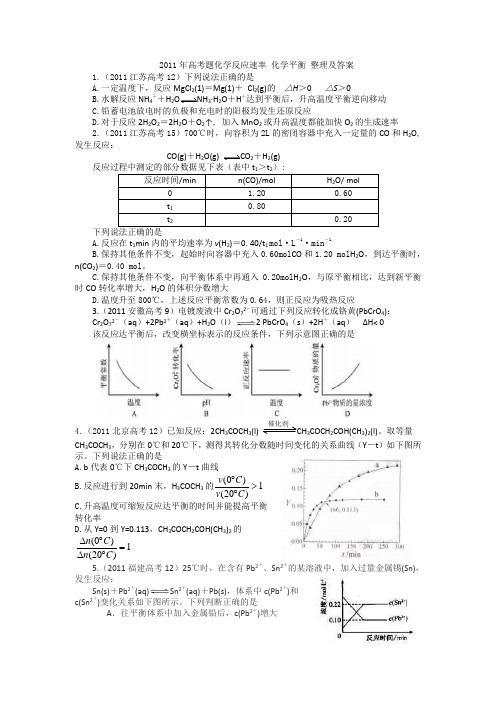
2011年高考题化学反应速率 化学平衡 整理及答案1.(2011江苏高考12)下列说法正确的是A.一定温度下,反应MgCl 2(1)=Mg(1)+ Cl 2(g)的 △H >0 △S >0B.水解反应NH 4++H 2O NH 3·H 2O +H +达到平衡后,升高温度平衡逆向移动C.铅蓄电池放电时的负极和充电时的阳极均发生还原反应D.对于反应2H 2O 2=2H 2O +O 2↑, 加入MnO 2或升高温度都能加快O 2的生成速率2.(2011江苏高考15)700℃时,向容积为2L 的密闭容器中充入一定量的CO 和H 2O ,发生反应:CO(g)+H 2O(g) CO 2+H 2(g)A.反应在t 1min 内的平均速率为v (H 2)=0.40/t 1 mol ·L -1·min -1B.保持其他条件不变,起始时向容器中充入0.60mol CO 和1.20 mol H 2O ,到达平衡时,n(CO 2)=0.40 mol 。
C.保持其他条件不变,向平衡体系中再通入0.20mol H 2O ,与原平衡相比,达到新平衡时CO 转化率增大,H 2O 的体积分数增大D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应3.(2011安徽高考9)电镀废液中Cr 2O 72-可通过下列反应转化成铬黄(PbCrO 4):Cr 2O 72-(aq )+2Pb 2+(aq )+H 2O (l ) 2 PbCrO 4(s )+2H +(aq ) ΔH< 0该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是4.(2011北京高考12)已知反应:2CH 3COCH 3(l) 催化剂CH 3COCH 2COH(CH 3)2(l)。
取等量CH 3COCH 3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y -t )如下图所示。
下列说法正确的是A.b 代表0℃下CH 3COCH 3的Y -t 曲线B.反应进行到20min 末,H 3COCH 3的(0)1(20)v C v C ︒>︒C.升高温度可缩短反应达平衡的时间并能提高平衡转化率D.从Y=0到Y=0.113,CH 3COCH 2COH(CH 3)2的(0)1(20)n C n C ∆︒=∆︒ 5.(2011福建高考12)25℃时,在含有Pb 2+、Sn 2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb 2+(aq)Sn 2+(aq)+Pb(s),体系中c(Pb 2+)和c(Sn 2+)变化关系如下图所示。
2011高考试题——理综化学(浙江卷)试题+答案+解析

2011年普通高等学校招生全国统一考试(浙江卷)理科综合 化学试题相对原子质量:H -1;C -12;N -14;O -16;Na -23;Mg -24;Cl -35.5;Ca -40一、选择题(本题共16小题,每小题6分,共120分,每小题只有一项是符合题目要求的) 7.[11.浙]下列说法不正确...的是 A .化学反应有新物质生成,并遵循质量守恒定律和能量守恒定律B .原子吸收光谱仪可用于测定物质中的金属元素,红外光谱仪可用于测定化合物的官能团C .分子间作用力比化学键弱得多,但它对物质熔点、沸点有较大影响,而对溶解度无影响D .酶催化反应具有高效、专一、条件温和等特点,化学模拟生物酶对绿色化学、环境保护及节能减排具有重要意义8.下列说法不正确...的是 A .变色硅胶干燥剂含有CoCl 2,干燥剂呈蓝色时,表示不具有吸水干燥功能 B .硝基苯制备实验中,将温度计插入水浴,但水银球不能与烧杯底部和烧杯壁接触 C .中和滴定实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用D .除去干燥CO 2中混有的少量SO 2,可将混合气体依次通过盛有酸性KMnO 4溶液、浓硫酸的洗气瓶9.X 、Y 、Z 、M 、W 为五种短周期元素。
X 、Y 、Z 是原子序数依次递增的同周期元素,且最外层电子数之和为15,X 与Z 可形成XZ 2分子;Y 与M 形成的气态化合物在标准状况下的密度为0.76 g/L ;W 的质子数是X 、Y 、Z 、M 四种元素质子数之和的1/2。
下列说法正确的是 A .原子半径:W >Z >Y >X >MB .XZ 2、X 2M 2、W 2Z 2均为直线型的共价化合物C .由X 元素形成的单质不一定是原子晶体D .由X 、Y 、Z 、M 四种元素形成的化合物一定既有离子键,又有共价键10.将NaCl 溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示。
2011年高考化学模拟试题及答案(四)
2011年高三备考化学“好题速递”系列(考试时间:90分钟 总分:100分)可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27第Ⅰ卷 (选择题共41分)一、选择题(本题包括13小题,每小题只有一个选项符合题意,每小题2分,共26分。
将正确选项填到答题表中)1.化学科学需要借助化学专用语言来描述,下列有关化学用语错误的是 ( )A .Na +的结构示意图:B .HCIO 的电子式:C .乙炔的结构简式:CH≡CHD .质量数为2的氢原子:H 21 2.分类是化学研究中常用的方法,下列分类方法中,正确的是 ( )A .依据分子组成中,含有氢原子的数目,将酸分为一元酸和二元酸等B .依据是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应C .依据分散质的直径大小,可以把“烟”、“雾”区分开来D .依据能量变化,碍化学反应分为“化合、分解、复分解、置换”四类3,轰动全国的“三鹿奶粉”事件,引起了人们对食品安全的重视。
在目前蛋白质含量测定中,用的“凯氏测氮法”间接推算蛋白质含量,用此法不能区别奶制品中有无违规化学物质。
在奶制品中添加三聚氰胺会导致泌尿系统疾病等。
下列有关说法正确的是: ( )A .三聚氰胺化学式为C3N3H6,其含氮量为66.6%,B .三聚氰胺、尿素、硝铵中,含氮量依次降低C .有二种合成三聚氰胺方法是:236632236)(6CO NH H N C NH CO ++一定条件该反应为加聚反应D .已知三聚氰胺呈弱碱性,pH 约为8,是因为“一NH 2”上易结合带负电荷的氢氧根(OH —) 4.高温下,某反应达到平衡,平衡常数K =)()()()(222H c CO c O H c CO c ⋅⋅。
恒容时,温度升高,H 2浓度减小。
下列说法正确的是()A.该反应的焓变为正值B.恒温恒容下,增大压强,H2浓度一定减小C.升高温度,逆反应速率减小D.该反应化学方程式为5.若两物质恰好完全发生化学反应,下列各项中,反应前后一定不发生变化的是()①电子总数②原子总数③分子总数④物质种类⑤物质的总质量⑥物质的总能量A.①③⑤B.②④⑥C.①②③④⑤⑥D.①②⑤6.25 ℃时,水的电离达到平衡:H20 H++OH-,下列叙述正确的是()A.向水中加入NaOH溶液,平衡逆向移动,c(OH—)降低B.向水中加NaHS04固体,平衡逆向移动,c(H+)增大C.向水中加入少量固体NH4C1,平衡正向移动,c(OH—)=C(H+)D.将水加热,平衡正向移动,Kw不变,pH不变7.为提纯下列物质(括号内为少量杂质),’所选用除杂试剂和分离方法正确的是8()A.太阳能电池可采用Si材料制作,其应用有利环保,应大力推广B.发电厂燃煤经脱硫处理,人们购物时不用一次性塑料袋,都是对环保的贡献,应大力推广C.2008年北京奥运会“祥云”火炬,使用燃料为丙烷,外形材料为铝合金和塑料,燃料环保,外形材料可回收D.磷是生物生长的营养元素,则含磷合成洗涤剂可以推广使用H8),下列说法不正确的是9.下列有关立方烷<分子式:C()A.它的一氯代物只有一种同分异构体,其二氯代物有两种同分异构体B.分子中存在极性键、非极性键,是一种非极性分子C.它不是芳香烃,但与苯乙烯互为同分异构体D.它含碳质量分数与乙炔、苯等物质相同10.在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2的化合物是()11.在pH=13的无色溶液中,可以大量共存的一组离子是()A.NH+、N03-、K+、S042-B.K+、AlO2-、Ba2+、N03-C.Cu2+、S042-、Na+、C1-D.Al3+、C032-、Na+、Cl-12.下列离子方程式书写正确的是()A.AgN03溶液中加入过量氨水Ag++NH3·H20=AgOH +NH4+B.苯酚钠溶液中通入少量C02C.酸性高锰酸钾溶液中滴加双氧水2Mn04-+H2O+6H+=2Mn2-+3O2十4H20D.用小苏打治疗胃酸过多HCO3—+H+=CO2 +H2013.灰锡(以粉末状存在)和白锡是锡的两种同素异形体。
2011届高考理综化学备考模拟试题(六)(计算)
化学有机物的相关计算预测一、命题落点有机物的相关计算,也是高考命题的一个热点和难点,在高考命题中主要出现三种题型:计算性的选择题、计算性的填空题、计算题。
从内容上来看包括所有的有机化学部分;从形式上来分析,主要是两点:第一点通过计算讨论分析物质的结构,第二点通过计算讨论物质的组成,有些考题把这两点放在一起来考查。
二、热点题型(一) 比较燃烧耗氧量大小【例1】1mol 下列有机物充分燃烧耗氧量最小的是( ) (A )C 3H 4 (B )C 2H 5OH (C )CH 3OH (D )CH 3CH 3 解题思路根据分子式CxHyOz 计算24z y x -+大小,24z y x -+ 值越大,耗氧量越多(A )4443=+ (mol) (B) 321462=-+ (mol)(C) 5.121441=-+ (mol) (D) 5.3462=+ (mol)参考答案 (C)【评注】也可用改写分子式法来解此类题。
改写分子式的原则是:若是烃则1molC 与4molH 耗氧量相等;若是烃的衍生物,则观察分子式,看是否可把分子式中的O 、C 、H 写成“CO 2”或“H 2O”形式,再比较剩余的C 、H 耗氧量即可。
【例2】下列等质量有机物燃烧耗氧量最大的是( )(A )C 6H 6 (B )C 2H 6 (C )C 3H 8 (D )C 7H 12解题思路 比较等质量烃燃烧耗氧量大小,一般思路是:12gC 燃烧耗氧气1mol ,12gH 2燃烧耗氧气3mol ,即等质量的C 、H 燃烧耗氧:H >C所以,比较等质量烃燃烧耗氧量大小只要比较烃分子中H 质量百分数即可,烃的H 质量百分数越大,烃燃烧耗氧量就越大。
把各分子式改写成CHx 形式(A )C 6H 6~~CH (B )C 2H 6~~CH 3 (C )C 3H 8~~CH 8/3 (D )C 7H 12~~CH 12/7 参考答案 耗氧量最大的是C 2H 6【评注】 把烃分子式改写为CHx 形式,CHx 式中x 值越大,烃的H 质量百分数越大,烃燃烧耗氧量越大。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
可能用到的原子量: H 1 C 12 N 14 O 16 Mg 24 Al 27 Br 80 S 32 Ca 40 Fe 56 1.1食品安全专项整治紧急会议安排从2010年2月1日开始为期10天的乳品和乳制品专项整治三聚氰胺魅影重现 国内紧急启动乳业大清查。三聚氰胺简称三胺,也被人们称为“蛋白精”,其结构简式如下,下列说法正确..的是 ( A.三聚氰胺从中学常见物质分类上看,即属于有机物,也属于碱类, 所以能与盐酸反应 B.1mol三聚氰胺可以与3mol氢气发生加成反应 C.三聚氰胺所有原子有可能共平面 D.三聚氰胺的分子式为C3N6H6,含氮量较高,奶粉中可以适当添加 2. A、B、C、D四种短周期元素,其核电荷数依次增大,已知元素A和D可形成两种常温下均为液体的化合物,B原子最外层电子数是最内层电子数的两倍。则下列由四种元素形成的化合物的化学式不正确...的是 ( )
A.B2A6CD2 B.B2A5D2C C. D. 3.用 NA 表示阿伏加德罗常数的值,下列说法中正确的是 ( ) A.1.0L l mol·L-1氨水中 NH3·H2O 的分子数为 NA B.标准状况下, 11.2 L 氯仿中含有的C-Cl 键的数目为 1.5NA C.0.6 g CaCO3 与 KHCO3 的混合物中所含质子数为 0.3NA D.工业上铜的电解精炼,电解池中每转移 1 mol 电子时阳极上溶解的铜原子数为 0.5NA 4.下列叙述中,结论(事实)和对应的解释(事实)均不正确的是 ( ) A.金刚石的熔沸点高于晶体硅,因为C--C键能大于Si--Si键能 B.稀有气体的晶体属于原子晶体,因为其组成微粒是原子,不存在分子间作用力 C.二氧化硅晶体中不存在简单的SiO2分子,因为其晶体是含有硅氧四面体的空间网状结构 D.分子空间构型为正四面体结构的分子中化学键的键角不一定是109028’,因为键角
还有可能为600 5.用NaOH溶液吸收二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴阳膜组合循环再生机理如图,则下列有关说法正确的是 ( ) A.阳极区酸性减弱 B.阴极区电极反应式为:2H++2e—=H2↑
C.该过程主要是为了获得H2SO4 D.电解时两个电极都只能用惰性材料 6.向某NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如下图所示。则下列分析与判断不正确...的是(不计CO2的溶解) ( ) A.若OB=0,则形成溶液M所发生的离子反应方程式为: OH—+CO2=HCO3— B.若OB=BC,则溶液M为Na2CO3溶液 C.若OB>BC,则溶液M中大量存在的阴离子为CO32-和HCO3
-
D.若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3) 7.下列图象能正确表示相关反应中产物物质的量(横、纵坐标单位:mol)的变化的是 ( ) A.图1:n(O2)=2mol时,高温下C和O2在密闭容器中的反应产物 B.图2:n(NaOH)=1mol时,CO2和NaOH溶液反应生成的盐 C.图3:n(HCl)=1mol时,K2CO3和HCl溶液在敞口容器反应生成的气体 D.图4:n(HNO3)=1mol时,Fe和稀HNO3反应生成的氧化产物(还原产物为NO)
8.某温度下,在体积为5L的密闭容器中,充入1molA气体,发生如下可逆反应:2A(g)B(g)+C(?);△H=akJ·mol-1 ,2min后反应达到平衡,A为0.4mol。下图是改变一个条件得到的反应速率(v)与时间(t)变化图。下列叙述正确的是 ( )
A.A物质的反应速率为0.04mol·(L·min)-1 B.充分反应后,该反应吸收热量为0.4akJ C.C为非气体 D.若温度和容器体积不变,起始时B、C各0.5mol,则达到平衡时A的物质的量仍为0.4mol
9.(15分)某无色澄清溶液,可能含有较大量的Cu2+、Ba2+、SO42-、NO3-、I-、Cl-、H+、K+等离子中的两种或多种,做如下实验: ①取适量溶液加入少量Na2SO3后有气体产生,也有白色沉淀生成,再加盐酸沉淀不消失,过滤; ②在①的滤液中加入AgNO3溶液,又有白色沉淀生成,再加硝酸沉淀不消失。 回答下列问题: (1)在第①步反应中生成无色易溶于水的气体是 ,生成的白色沉淀是 ;在第②步反应中生成的白色沉淀是 。 (2)由以上实验,可判断原溶液中一定含有的离子是 ,一定不含有的离子是 。 (3)设计一个简单实验,对可能含有的离子进一步确认。
10.(15分)下图中,A为气体非金属单质,D是空气中含量最多的气体,B、E、Z为无色氢化物,其中B、E为有刺激性气味的气体,C是由三种短周期非金属元素组成的离子化合物,F、I、L为白色沉淀,其中F不溶于稀硝酸,N、P是金属单质;反应②在E的浓溶液中进行,反应⑦在E的稀溶液中进行,反应②、⑦均可用于实验室制取某种气体(图中部分反应物和生成物没有列出)。
请按要求回答: ⑴写出C的电子式 ,I的化学式 ; ⑵反应③的化学方程式为 ; ⑶反应④的离子方程式为 ; ⑷由C制取E时反应物的状态是 ,由J制取L时反应的环境是 。 11.(15分)某学校化学兴趣小组要证明如图A装置中产生的气体成分。请从下图中选择适当的装置(装置符合气密要求,加热装置等已略去;其他用品可自选,已知NH3与CuO在加热条件下发生如下反应:3CuO+2NH3N2+3Cu+3H2O)。将所选用的仪器(可重复选用)连接顺序由上到下依次填入下表,并写出该仪器中应加的试剂的名称及作用。 选用的仪器 加入试剂 加入试剂的作用 A Na与NH4Cl溶液 (此空格不必填写)
检验是否有氢气生成 12.(15分)中国人向来喜欢吉利,如第29届奥运会开幕定在——2008年8月8日8时。在有机化学中就有这样一个“吉利分子C8H8O8”,它与08年的奥运会同样有着引人注目
的数字特征。“吉利分子C8H8O8”可以通过如图转化关系制得:
已知:①X的相对分子质量小于180,其中氧的质量分数约为49.4%;1molX在稀硫酸中发生水解反应生成2mol甲醇和1molA;X中没有支链。②E为高分子化合物;③B为环状结构。试根据以上信息回答下列问题: (1)1个X分子中,可能含有 个氧原子,A中官能团的名称为 ; (2)②的反应类型为_____________,③的反应类型为 ; (3)写出④的化学方程式__________________________________________; (4)符合条件的有机物B有 种结构,写出其中一种含六元环的B的结构简式____________; (5)一定量的A物质与乙醇的混合物完全燃烧生成27g水和V LCO2(标准状况),则等物质的量该混合物完全燃烧消耗氧气的物质的量为_________。 参考答案 1.B【解析】 该试题与现实生活相联系,考查物质结构与性质的知识,中等难度。三聚氰胺因含有氨基,所以可以与盐酸反应,但从物质分类角度分析,不应该属于碱类,A错误;三聚氰胺因为含有不饱和键,所以能够与氢气发生加成反应,B正确;因为氨气所有原子不共面,而氨基有其类似的结构,所以三聚氰胺分子中所有原子不可能共平面,C错误;三聚氰胺为化工原料,非食品添加剂,含氮量高,也不能在奶粉中添加,D错误。 2.A【解析】本题重要考查元素周期律和有机物质的结构。B原子最外层电子数是最内层电子数的两倍,马上可以确定是碳;元素A和D可形成两种常温下均为液体的化合物,马上确定A是H,D是O;A、B、C、D四种短周期元素,其核电荷数依次增大,马上确定C是N。B2A6CD2就是C2H6NO2,显然C2H5NO2才符合,其他的都符合。 3.C【解析】氨水为弱电解质,部分电离后NH3·H2O 的分子数小于NA,A选项错误;标况下氯仿为液态,B选项错误;电解精炼时,有可能比铜活泼的杂质先放电,阳极上溶解的铜原子数小于 0.5NA,D选项错误。 4.B【解析】选项A均正确;选项B稀有气体的晶体属于分子晶体,组成微粒原子间存在分子间作用力;选项C二氧化硅晶体中不存在简单的SiO2分子说法正确,原因是二氧化硅属于原子晶体;选项D均正确。 5.B【解析】由题知,阳极区HSO3─、SO32─失电子被氧化成HSO4─、SO42─,区域酸性增强,A选项错误;阴极区电极反应式为:2H++2e—=H2↑,B选项正确;该过程也得到
了Na2SO3,C选项错误;在阴极为得电子,金属不能得电子,故可使用金属材料,D选项错误。 6.C【解析】向Na2CO3溶液中逐滴加入盐酸,反应原理为:Na2CO3+HCl=NaCl+NaHCO3,NaHCO3+HCl=NaCl+CO2+H2O,即从Na2CO3到NaHCO3所消耗盐酸的量相等。对A,若OA=0,表明开始滴加盐酸就有气体生成,则M中的溶质NaHCO3,反应为CO2+OH—=HCO3—;对B,若OB=BC,说明生成HCO3—消耗的H+与HCO3—产生CO2消耗的H
+
相等,则M中的溶质为Na2CO3;对C,OB>BC,说明不产生CO2消耗H+大于产生CO2
消耗的H+量,M中溶质应为NaOH和Na2CO3,若OB<BC,说明不产生CO2消耗H+
小于产生CO2消耗的H+量,M中溶质应为Na2CO3和NaHCO3;对D,3OB=BC,M中溶质为Na2CO3和NaHCO3,因为Na2CO3~NaHCO3,故c(NaHCO3=2c(Na2CO3)。 7.D【解析】图1中知n(O2)=1mol,C少量时生成CO2,过量时生成CO,A选项错误;向n(NaOH)=1mol的溶液中通入CO2,应该是先生成Na2CO3,再生成NaHCO3,B选项错误;向n(HCl)=1mol的溶液中通入K2CO3,生成的CO2到达最大之后并不会减小,C选项错误;向n(HNO3)=1mol的溶液中加入Fe,首先得到Fe(NO3)3,待HNO3反应完后Fe(NO3)3与过量的Fe归中反应得到Fe(NO3)2。 8.D【解析】由图1可以确定C为气体,理由改变压强平衡不移动;升高温度向正向移动,则正反应为吸热反应即a>0;A物质的反应速率为(1—0.4)mol/5L×2min=0.06mol·(L·min)-1,A项错误,达到平衡后,A物质转化率0.6,该反应吸收热量为0.6akJ,B项错误。达到平衡后,保持温度和容器体积不变,再充入1molA,相当于增大压强,但由于气体分子数没变,所以平衡不移动。若温度和容器体积不变,起始时B、C各0.5mol,与起始加入A的量相当,可以到达同一平衡状态,所以达到平衡时A的物质的量仍为0.4mol。
