基础化学第二章后习题答案
高中化学选择性必修2第二章分子结构与性质单元基础练习题含答案

C. 分子与H+结合成 ,O原子的杂化类型未发生改变
D. 离子空间结构:正四面体形
3.氰气的化学式为 ,结构式为 ,其性质与卤素气体单质相似,氰气可用于有机合成、制农药,也可用作消毒、杀虫的熏蒸剂等。下列叙述正确的是()
A.在所有气体单质分子中,一定有 键,可能有 键
20.分析第ⅡA族和第ⅢA族,第ⅤA族和第ⅥA族第一电离能出现逆反的原因___________。
参考答案:
1.B
【详解】sp3杂化形成的AB4型分子的立体构型应该为正四面体形,例如甲烷、四氯化碳等。
故选B。
2.A
【详解】A.通过公式计算中心原子的孤电子对数 , ,所以二者的孤电子对数目不相等,故A错误;
A. 属于非极性分子
B.分子的极性:
C. 是非极性分子,在 中的溶解度比在水中大
D.由价层电子对互斥模型可确定 分子中N原子是 杂化,分子呈平面三角形
15.据预测,到2040年我国煤炭消费仍将占能源结构的三分之一左右。H2S在催化活性炭(AC)表面的迁移,对煤的清洁和综合应用起了很大的促进作用,其机理如图所示,其中ad表示物种的吸附状态。下列有关叙述正确的是()
B.氰气分子中 键的键长大于 键的键长
C.1个氰气分子中含有3个 键和4个 键
D. 不能与氢氧化钠溶液发生反应
4.如图所示,小黑球表示相关元素的原子中除去最外层电子的剩余部分,小白球表示氢原子,小黑点表示没有形成共价键的最外层电子,短线表示共价键。下列说法中正确的是()
A.分子中,中心原子采用 杂化的只有①③
A.简单离子半径:r(W)>r(Z)>r(Y)
B.W的氧化物对应的水化物为强酸
基础化学习题答案chap12

第一章绪论习题答案1.指出下列哪些单位属于SI单位,那些不是。
时间单位min、能量单位J、体积单位L、质量单位μg、长度单位nm、温度单位℃2.SI制的大体单位有哪几个?3.我国的法定计量单位和SI制单位有什么联系和不同?*******************************************************************************1.答:能量单位J、质量单位μg、长度单位nm、温度单位℃属于SI单位;其他不是。
2.答:SI大体单位:m、kg、s、A、K、mol、cd3.答:一切属于国际单位制的单位都是我国的法定计量单位。
按照我国的实际情况,在法定计量单位中还明确规定采用了若干可与国际单位制并用的非国际单位制单位。
第二章稀溶液的依数性习题答案1. 20C时,水的饱和蒸气压为2.34kpa。
若于100g水中溶入10.0g蔗糖(C12H22O11,相对分子质量为M r=342),求此溶液的蒸气压。
2.现有四种处于相同温度和压力下的理想稀溶液。
(1) 0.1 mol蔗糖溶于80 mol水中,水蒸气压为p1(2) 0.1 mol萘溶于80 mol苯中,苯蒸气压为p2(3) 0.1 mol葡萄糖溶于40 mol水中,水蒸气压为p3(4) 0.1 mol尿素溶于80 mol水中,水蒸气压为p4这四个溶液的蒸气压之间的关系为:( )(A) p1≠p2≠p3≠p4(B) p2≠p1=p4>p3(C) p1=p2=p4=(1/2)p3(D) p1=p4<2p3≠p23.医治脱水、电解质失调与中毒静脉滴注的林格氏(Ringer)液的处方是:在1.00L 注射用水中溶有8.50gNaCl,0.30gKCl,0.33gCaCl22H2O。
林格氏液的渗透浓度是多少?101.3kpa下凝固点为多少?它与人体血浆溶液等渗吗?4.将7.00g难挥发非电解质溶于250g水,该溶液在101.325kpa下,沸点为100.510C。
《基础化学》课后习题参考答案(有机部分)
均为 Na + , K + , Br , Cl 离子各 1mol 。
第十章开链烃1、扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答:2、NaCl 相同?如将 CH 4 及 CCl 4 各 1mol 混在一起,与 CHCl 3 及 CH 3Cl 各 1mol 的混合物是否相同? 为什么?答: NaCl 与 KBr 各 1mol 与 NaBr 及 KCl 各 1mol 溶于水中所得溶液相同。
因为两者溶液中 - -由于 CH 4 与 CCl 4 及 CHCl 3 与 CH 3Cl 在水中是以分子状态存在,所以是两组不同的混合 物。
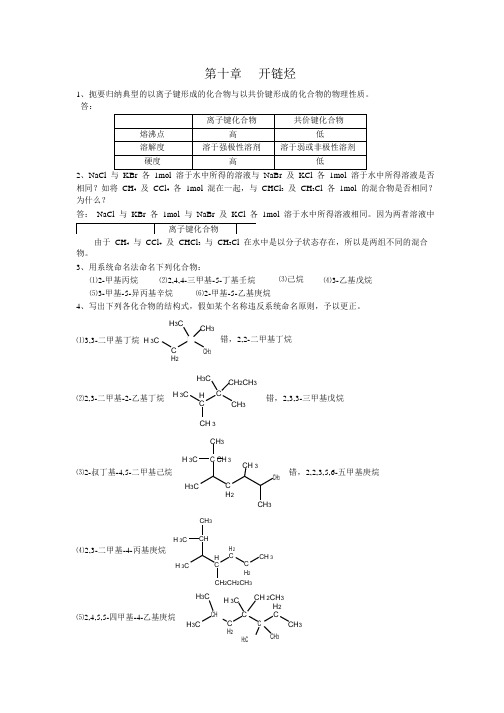
3、用系统命名法命名下列化合物:⑴2-甲基丙烷⑵2,4,4-三甲基-5-丁基壬烷⑶己烷⑷3-乙基戊烷⑸3-甲基-5-异丙基辛烷⑹2-甲基-5-乙基庚烷4、写出下列各化合物的结构式,假如某个名称违反系统命名原则,予以更正。
H 3CCH 3 ⑴3,3-二甲基丁烷 H 3CH 2CH 3H 3C错,2,2-二甲基丁烷CH 2CH 3 ⑵2,3-二甲基-2-乙基丁烷 H 3C HC C3错,2,3,3-三甲基戊烷CH 3CH 3⑶2-叔丁基-4,5-二甲基己烷H 3CC CH 3CH 33错,2,2,3,5,6-五甲基庚烷H 3CC H 2CH 3CH 3H 3CCH⑷2,3-二甲基-4-丙基庚烷H 3H CH 2 CC H 2CH 3CH 2CH 2CH 3H 3CH 3CCH 2CH 3H 2⑸2,4,5,5-四甲基-4-乙基庚烷H 3CHC H 2 CH 3CC C 3 32 CH32CH2 3CH 2 3CH 3 3CH 3 2CH 3⑹2,2,3-三甲基戊烷H3CH3CCCH3CH2CH35、写出分子式为C6H14的烷烃的各种异构体,用系统命名法命名,丙标出伯、仲、叔、季碳原子。
1oCH 32oCH 2 2 o22 oCH2 oCH 21 o己烷1oCH 3oCH 21 o CH32 o CHo1 oCH32-甲基戊烷1 o CH31oCH 32ooCH2 oCH2 1 oCH3 3-甲基戊烷1oCHo3 oCH1 o3 2,3-二甲基丁烷1 o CH31 o1 o CH31oCH2o4 oCCH32,2-二甲基丁烷H3C 1 o 1 o CH36、⑶>⑵>⑸>⑴>⑷7、写出2,2,4-三甲基戊烷进行氯代反应可能得到的一氯代产物的结构式。
2018基础化学课后习题参考答案

一、判断题 4 ×1.氧化数在数值上就是元素的化合价。 ×2.NH4+中,氮原子的氧化数为-3;ClO-中,氯原子的氧化数为+7。 ×3.两根银丝分别插入盛有 0.1 mol·L-1 和 1 mol·L-1 AgNO3 溶液的烧杯中,且用盐桥和导线将 两只烧杯中的溶液连接起来,便可组成一个原电池。 √4.在设计原电池时,EӨ值大的电对应是正极,而EӨ值小的电对应为负极。 √5.原电池中盐桥的作用是盐桥中的电解质中和两个半电池中过剩的电荷。 √6.标准电极电势表中的EӨ值是以标准氢电极作参比电极而测得的标准电极电势值。 √7.电极电势大的氧化态物质氧化能力强,其还原态物质还原能力弱。 一、 判断题 5 1.配合物在水溶液中全部电离成外界离子和配离子,配离子在水溶液中也能全部离解为中心 离子和配位体。() 2.中心离子的配位数等于配合物中配位体的数目。() 3.复盐就是配合物。() 4.配合物转化为沉淀时,难溶电解质的溶解度愈小,则愈易转化。(√) 5.配离子在任何情况下都能转化为另一种配离子。() 6.酸度对配合物稳定性无影响。() 7.任何氧化还原反应都能改变配位平衡移动的方向。() 8.配合物转化为沉淀时,配合物的稳定常数越大愈易转化。() 一、 判断题 6
左手按前面滴定操作方法滴加溶液右手运用腕力摇动锥形瓶使溶液向同一方向作圆周运动边摇边滴滴定时当接近终点时应一滴或半滴地加入并用洗瓶吹入少量水冲洗锥形瓶内壁使附着的溶液全部流下直至终反应题chchchptchchchchchchkmnohcchcl无水alclcoohchclalcl
基础化学课后习题参考答案
,E Sn4 / Sn2
0.154V
ห้องสมุดไป่ตู้,E Fe2 / Fe
0.44V 。
在标准状态下,下列各组物质中能共存的是 C 。
第二章 稀溶液的依数性-基础化学-新基础化学

2.溶液的凝固点降低
P/kPa
101.3
原因:溶液蒸气压下降
B’ 水的凝固点T º:273K
f
B
溶液的凝固点: Tf
0.611
A A’
Tf < Tfº
⊿Tf = Tf0-Tf
Tf0 Tb0 Tb
T/K
Why ?
Tf
2.溶液的凝固点降低
P/kPa
101.3
△Tf1 △P1
=
△Tf2 △P2
B
B’ C’
Tf /℃ 17.0 5.5 -22.9 -116.2 80.0 0.0
Kf /K· kg· mol-1
3.90 5.10 32.0 1.8 6.9 1.86
△Tf =KfbB
(2.6)
说明:稀溶液的△Tf∝bB,即只与一定量 的溶剂中所含溶质的微粒数有关,而与溶 质种类和本性无关。
∴ △Tf 也是 一 种依数性
水、冰的蒸气压随温度的变化曲线
P/kPa
101.3
B
水的蒸气压曲线
0.611
A A’
冰的蒸气压曲线
T/K
Tf0 273
T b0 373
纯溶剂
一、液体的蒸汽压(vapor pressure of liquid)
实验测定25C时 水的饱和蒸汽压: p (H2O) = 3167.7 Pa; 0.5 mol/kg糖水的蒸汽压: p (H2O) = 3135.7 Pa; 1.0 mol/kg糖水的蒸汽压: p (H2O) = 3107.7 Pa。
校正因子 i >1
难挥发强电解质稀溶液
i 为电解质一个“分子”解离出的离子个数
二、溶液凝固点(冰点)降低 (freezing point depression) 1.液体的凝固点(Tf)
1现代基础化学(第二版) 课后答案(第三版也可用) 化学工业出版社

《现代基础化学》答案化学工业出版社第一章,习题答案,P44-461. E = -B/n2 (B=2.18⨯ 10-18 J∆E = -B/52 + B/22 = 4.58 ⨯ 10-19 Jhv = ∆E, λν = cλ = c ⨯h ÷∆E = 434 nm3.①②不存在;③④存在4.Ni 3s2 3p6 3d8 4s2的四个量子数是:3s2: n= 3, l=0, m=0, m s = +1/2; n= 3 , l=0, m=0, m s = -1/23p6: n= 3, l=1, m=-1, m s = +1/2; n= 3, 1=1, m=-1, m s = -1/2; n= 3, 1=1, m=0, m s = +1/2 n= 3, 1=1, m=0, m s = -1/2; n= 3, 1=1, m=1, m s = +1/2; n= 3, 1=1, m=1, m s = -1/2 3d8: n= 3, 1=2, m=-2, m s = +1/2; n= 3, 1=2, m=-2, m s = -1/2; n= 3, 1=2, m=-1, m s = +1/2 n= 3, 1=2, m=-1, m s = -1/2; n= 3, 1=2, m=0, m s = +1/2; n= 3, 1=2, m=0, m s = -1/2n= 3, 1=2, m=1, m s = +1/2; n= 3, 1=2, m=2, m s = +1/24s2: n= 4, 1=0, m=0, m s = +1/2; n= 4, 1=0, m=0, m s = -1/25.①3d ②4f ③2s ④3d ⑤1s ⑥3p; 结果:⑤< ③< ⑥< ①= ④< ②6.①n=4;②l=1;③m=0;④m s=1/2或-1/27.8.①n>3;3d②l = 1;2p③m= -1 /0/+1; 3p④ m s = +1/2 或-1/2, 4s9.48Cd 4s24p64d105s2.10.①有三个19K;24Cr;29Cu②均第四周期, K: s区,,IA族;Cr: d区VIB族;Cu: ds区IB族11.(1) Ar: 1s22s22p63s23p6 (2)Fe: 1s22s22p63s23p64s23d6(3) I: 1s22s22p63s23p63d104s24p64d105s25p5 ;(4) Ag: 1s22s22p63s23p63d104s24p64d105s112.①(1)Ca: s区, 第四周期,IIA族;(2) Cl: p区,第三周期,VIIA;(3) Ti: d区,第四周期,IVB;(4) Hg: ds区, 第六周期, IIB族②Ca: +2,Cl: +7,Ti: +4,Hg: +2③(1)<(3)<(4)<(2)13.铁原子3d64s2;26Fe14.48;[Kr]4d105s2, IIB族;48Cd15.甲:3s23p5,VIIA,非金属,电负性高;乙:3d24s2,IVB,金属,电负性低。
基础化学第二版课后习题答案
基础化学第二版课后习题答案【篇一:基础化学第二版习题答案chap5】1.何谓沉淀溶解平衡?同物质的量的bacl2和h2so4混合溶液中,含有哪些离子?这些离子浓度之间存在着哪些关系?答:难溶电解质溶解和沉淀速度相等,固体的量和溶液中分子或离子的量不再改变的状态,称为沉淀溶解平衡。
ba2+、cl-、so4、h+、oh-2?2.活度积、溶度积、离子积之间有何区别与联系?答:活度积、溶度积指平衡状态下的活度积或浓度积,对给定的难溶电解质其活度积只与温度有关,溶度积不但与温度有关,还和溶液离子强度有关,对于ma型难溶电解质:?ksp(ma)。
离子积指任意状态下的浓度积,其值是任意的。
?(m?)??(a?)3.无副反应时,沉淀的溶度积与溶解度有何关系?溶度积小的物质,它的溶解度是否一定小?举例说明。
答:s?mmnn不同类型难溶电解质的溶解度不能根据溶度积数值大小直接判断。
溶度积小的物质,它的溶解度是不一定小,如ag2cro4与agcl。
4.除了沉淀物质本性以外,影响沉淀溶解度的主要因素有哪些?答:除了沉淀物质本性以外,影响沉淀溶解度的主要因素还有:同离子效应、盐效应、酸碱效应、配位效应等。
5.判断下列操作中可能发生的反应和现象并予以解释。
(1)将少量caco3固体放入稀hcl中。
(2)将少量mg(oh)2放入nh4cl溶液中。
答:(1)caco3固体溶解,有无色无味气体产生。
caco3(s)ca2+ + co32-+2h+h 2co 3→co2 +h 2o(2)mg(oh)2固体溶解,有无色刺激性气体产生。
的氨水,有肉色沉淀生成。
原因是饱和h2s水溶液提供的s2-很少,此时mg(oh)2(s)mg2+ + 2oh-+2nh4+(4)黑色固体变成白色固体。
so42- +h2o(5)白色沉淀变成黄色沉淀。
agcl(白)+ i-(6)浅兰色沉淀消失,生成深兰色溶液。
cu(oh)2 + 4nh3pb2++so42-→pbso4↓(白)agi(黄)+cl-[cu(nh3)4](oh)2答:(1)(2)减小(同离子效应);(3)增大(盐效应);(4)增大(配位效应)。
智慧树答案基础化学知到课后答案章节测试2022年
第一章1.在使用物质的量单位(mol)时,要注意基本单元的表示。
若n(H2O)=1.0mol,则n(1/2H2O) 的数值为()答案:2.0 mol第二章1.对于非电解质稀溶液,其渗透浓度在数值上等于其质量摩尔浓度。
答案:对2.临床上将葡萄糖溶液与溶液作为等渗溶液使用。
如将此两溶液以任意比例混合,则所得混合液也必然是等渗溶液。
答案:对3.渗透浓度为的NaCl溶液和的葡萄糖溶液,它们的渗透压相等,则它们的物质的量浓度也相等。
答案:错4.由于0 ℃的冰与0 ℃的NaCl溶液温度相同,所以该两相可以共存。
答案:错5.难挥发非电解质稀溶液的沸点升高、凝固点降低均由溶液的蒸气压下降引起。
答案:对6.无论溶质是电解质还是非电解质,凝固点降低值较小的溶液的渗透压一定低于凝固点降低值较大的溶液。
答案:对7.由于苯比水易挥发,故在相同温度下,苯的蒸气压比水大。
答案:对8.将相同质量的葡萄糖和甘油分别溶于1 L水中,则两溶液的△p1=△p2,△Tb1=△Tb2,p1=p2(T一定)。
答案:错9.纯溶剂通过半透膜向溶液渗透的压力称为渗透压。
答案:错10.渗透浓度均为的NaCl溶液和葡萄糖溶液,NaCl溶液的渗透压大。
答案:错11.渗透压较高的溶液其物质的量浓度一定较大。
答案:错12.下列方法最适用于测定蛋白质相对分子质量的是()答案:渗透压法13.已知水的,测得某人血清的凝固点为-0.56 ℃,则该血清的渗透浓度为()答案:301 mmol·L-114.已知苯的凝固点为5.35 ℃,。
若将0.320 g萘溶于40 g苯,所得溶液的凝固点为5.03 ℃,则萘的相对分子质量为()答案:12815.已知钠的相对原子质量为23,Cl的相对原子质量为35.5。
某患者需补充Na+ 50.0 mmol,应输入生理盐水()答案:325mL16.溶解0.50 g某非电解质于50 g水中,测得该溶液的凝固点为-0.31℃。
已知水的,则该非电解质的相对分子质量为()答案:6017.溶解1.0 g非电解质及0.488 g NaCl(Mr =58.5)于200 g水中,测得该溶液的凝固点为-0.31℃。
基础生物化学练习题及答案
基础生物化学习题第一章核酸的结构和功能一、选择题1、热变性的DNA分子在适当条件下可以复性,条件之一是()。
A、骤然冷却B、缓慢冷却C、浓缩D、加入浓的无机盐2、在适宜条件下,核酸分子两条链通过杂交作用可自行形成双螺旋,取决于()。
A、DNA的Tm值B、序列的重复程度C、核酸链的长短D、碱基序列的互补3、核酸中核苷酸之间的连接方式是()。
A、2’,5’—磷酸二酯键B、氢键C、3’,5’—磷酸二酯键D、糖苷键4、tRNA的分子结构特征是()。
A、有反密码环和3’—端有—CCA序列B、有反密码环和5’—端有—CCA序列C、有密码环D、5’—端有—CCA序列5、下列关于DNA分子中的碱基组成的定量关系()是不正确的。
A、C+A=G+TB、C=GC、A=TD、C+G=A+T6、下面关于Watson-Crick DNA双螺旋结构模型的叙述中()是正确的。
A、两条单链的走向是反平行的B、碱基A和G配对C、碱基之间共价结合D、磷酸戊糖主链位于双螺旋内侧7、具5’-CpGpGpTpAp-3’顺序的单链DNA能与下列()RNA杂交。
A、5’-GpCpCpAp-3’B、5’-GpCpCpApUp-3’C、5’-UpApCpCpGp-3’D、5’-TpApCpCpGp-3’8、RNA和DNA彻底水解后的产物()。
A、核糖相同,部分碱基不同B、碱基相同,核糖不同C、碱基不同,核糖不同D、碱基不同,核糖相同9、下列关于mRNA描述,()是错误的。
A、原核细胞的mRNA在翻译开始前需加“PolyA”尾巴。
B、真核细胞mRNA在 3’端有特殊的“尾巴”结构C、真核细胞mRNA在5’端有特殊的“帽子”结构D、原核细胞mRNA在5’端有特殊的“帽子”结构10、tRNA的三级结构是()。
A、三叶草叶形结构B、倒L形结构C、双螺旋结构D、发夹结构11、维系DNA双螺旋稳定的最主要的力是()。
A、氢键B、离子键C、碱基堆积力 D范德华力12、下列关于DNA的双螺旋二级结构稳定的因素中()是不正确的。
工程化学基础(第二版)习题解答
<<工程化学基础(第二版)>>练习题参考答案第一章 绪 论练习题(p.9)1. (1)×; (2)√; (3)×; (4)√。
2. (1)C 、D ;(2)C ;(3)B 。
3. 反应进度;ξ; mol 。
4. 两相(不计空气);食盐溶解,冰熔化,为一相;出现AgCl ↓,二相;液相分层,共三相。
5. 两种聚集状态,五个相:Fe (固态,固相1),FeO (固态,固相2),Fe 2O 3(固态,固相3),Fe 3O 4(固态,固相4),H 2O (g )和H 2(g )(同属气态,一个气相5) 6. n =(216.5 -180)g / (36.5g · mol -1) = 1.0 mol7. 设最多能得到x 千克的CaO 和y 千克的 CO 2,根据化学反应方程式: CaCO 3(s) = CaO(s) + CO 2(g) 摩尔质量/g ·mol -1 100.09 56.08 44.01 物质的量/mol100095%10009103⨯⨯-. x 56.08×-310 y 4401103.⨯-因为n(CaCO 3)=n (CaO)=n (CO 2) 即100095%10009103⨯⨯-.=x 56.08×-310=y 4401103.⨯-得 x =m (CaO) =532.38kg y =m (CO 2) =417.72kg分解时最多能得到532.28kg 的CaO 和417.72kg 的CO 2。
8. 化学反应方程式为3/2H 2+1/2N 2 = NH 3时:22(H )6mol4mol 3(H )2n ξν∆-===-22(N )2mol4mol 1(N )2n ξν∆-===-33(NH )4mol4mol 1(NH )n ξν∆===化学反应方程式为3H 2+ N 2 = 2NH 3时:22(H )6mol 2mol 3(H )n ξν∆-===-22(N )2mol2mol 1(N )n ξν∆-===-33(NH )4mol 2mol 2(NH )n ξν∆===当反应过程中消耗掉2mol N 2时,化学反应方程式写成3/2H 2+1/2N 2 = NH 3,该反应的反应进度为4 mol ;化学方程式改成3H 2+ N 2 = 2NH 3,该反应的反应进度为2 mol 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
百度文库 - 让每个人平等地提升自我 1 第二章后习题答案 习题 1. 水在20℃时的饱和蒸气压为2.34 kPa 。若于100g水中溶有10.0 g蔗糖(Mr= 342),求此溶液的蒸气压。
解 根据 BAAAnnnx,
mol56.5mol18.0g100gO)(H1-2n mol0292.0molg342g0.10)(1蔗糖n 995.0mol0292.0mol56.5mol56.5)(O)(HO)(HO)(H222蔗糖nnnx kPa33.2995.0kPa34.2O)(H20xpp 2. 甲溶液由1.68 g蔗糖(Mr=342)和20.00 g水组成,乙溶液由2.45 g (Mr= 690)的某非电解质和20.00 g水组成。 ⑴ 在相同温度下,哪份溶液的蒸气压高? ⑵ 将两份溶液放入同一个恒温密闭的钟罩里,时间足够长,两份溶液浓度会不会发生变化,为什么? ⑶ 当达到系统蒸气压平衡时,转移的水的质量是多少?
解 (1) mol004912.0molg342g68.1)(1甲n mol003551.0molg690g45.2)(1乙n 1kgmol2456.0kg0200.0mol004912.0(甲)b
1kgmol1775.0kg0200.0mol003551.0(乙)b
溶液乙的蒸气压下降小,故蒸气压高。 (2)乙溶液浓度变浓, 甲溶液浓度变稀。因为浓度不同的溶液置于同一密闭容器中,百度文库 - 让每个人平等地提升自我 2 由于Bb不同,P不同, 蒸发与凝聚速度不同。乙溶液蒸气压高,溶剂蒸发速度大于甲溶液蒸发速度,所以溶液乙中溶剂可以转移到甲溶液。 (3)设由乙溶液转移到甲溶液的水为x(g), 当两者蒸气压相等时,则 (乙)甲bb)(
g)00.20(mol003551.0g)00.20(mol004912.0xx x = 3.22g 3. 将2.80 g难挥发性物质溶于100 g水中,该溶液在101.3 kPa下,沸点为100.51℃ 。
求该溶质的相对分子质量及此溶液的凝固点。(Kb = 0.512 K·kg·mol-1,Kf = 1.86K·kg·mol-1) 解 K51.0K)15.27300.100(K)15.27351.100(0bbbTTT
11bbBkgmol996.0molkgK512.0K51.0ΔKTb
11Brmolg1.28kg100.0kgmol996.0g80.2VbmM
K85.1kgmol996.0molkgK86.111BffbKT 该溶液的凝固点fT为-1.85℃ 4. 烟草有害成分尼古丁的实验式是C5H7N,今将538 mg尼古丁溶于10.0 g水,所得溶液在101.3 kPa下的沸点是100.17 ℃。求尼古丁的分子式。 解 K17.00bbbTTT
11bbBkgmol332.0molkgK512.0K17.0ΔKTb
11Brmolg162kgmol332.0kg0100.0g538.0bmM
尼古丁的分子式为: 21410NHC 5. 溶解3.24 g硫于40.0 g苯中,苯的凝固点降低1.62℃。求此溶液中硫分子是由几个百度文库 - 让每个人平等地提升自我 3 硫原子组成的?(Kf = 5.10 K·kg·mol-1 ) 解 11ffBkg0.318molmolkg5.10K1.62KΔKTb
11Brmol255gkg0.318mol0.0400kg3.24gbmM
此溶液中硫原子是由8个硫原子组成。 6. 试比较下列溶液的凝固点的高低:(苯的凝固点为5.5 ℃,Kf = 5.12 K·kg·mol-1,水的Kf = 1.86 K·kg·mol-1) ⑴ 0.1 mol·L-1蔗糖的水溶液; ⑵ 0.1 mol·L-1乙二醇的水溶液; ⑶ 0.1 mol·L-1乙二醇的苯溶液; ⑷ 0.1 mol·L-1氯化钠水溶液。 解 对于非电解质溶液BffbKT,电解质溶液Bff
ΔbiKT,故相同浓度溶液的凝
固点的大小顺序是: ⑶>⑴=⑵>⑷ 7. 试排出在相同温度下,下列溶液渗透压由大到小的顺序: ⑴ c(C6H12O6)= 0.2 mol·L-1; ⑵ 132Lmol2.0)CONa21(c;
⑶ 143Lmol2.0)PONa31(c ; ⑷ c(NaCl)= 0.2 mol·L-1。 解 根据非电解质溶液cRT, 电解质溶液icRT,渗透压大小顺序是: ⑷ > ⑵ > ⑶ > ⑴ 8. 今有一氯化钠溶液,测得凝固点为 -0.26 ℃,下列说法哪个正确,为什么? ⑴ 此溶液的渗透浓度为140 mmol·L-1; ⑵ 此溶液的渗透浓度为280 mmol·L-1; ⑶ 此溶液的渗透浓度为70 mmol·L-1; ⑷ 此溶液的渗透浓度为7 153 mmol·L-1 。 解 由于 NaCl 在水溶液中可以电离出2倍质点数目,该溶液的渗透浓度可认为
11-kgmolBLmol0s}2{}{
bc:
kgmol140.0molkg86.126.0211KKbB
所以(1)正确,氯化钠溶液的渗透浓度应为140 mmol·L-1 9. 100 mL水溶液中含有2.00 g 白蛋白,25 ℃ 时此溶液的渗透压力为0.717 kPa 求白蛋白的相对分子质量。 解 141-1Lmol1089.2K)25273(KmolLkPa314.80.717kPa)(RTΠc白蛋白 百度文库 - 让每个人平等地提升自我 4 141-4molg1092.6L100.0Lmol1089.2g00.2(白蛋白)M
10. 测得泪水的凝固点为 -0.52 ℃,求泪水的渗透浓度及 37 ℃时的渗透压力。 解 11Bkgmol280.0molkgK86.1K52.0b
泪水的渗透浓度为1Lmmol280。 722kPa 37)K(273KmolL8.314kPaLmol28.0-111Π
11.今有两种溶液,一为1.50 g 尿素(Mr = 60.05)溶于200 g 水中,另一为42.8 g 某非电解质溶于1000 g 水中,这两种溶液在同一温度下结冰,试求该非电解质的相对分子质量。 解 若两溶液在同一温度下结冰,则 (某非电解质)尿素bb)(,
VMmKbKTBrfff/
有 g1000/8.42g200molg05.60/g50.1r1Mg
1rmolg343M
12. 在0.100kg的水中溶有0.020 mol NaCl, 0.010 mol Na2SO4和0.040 mol MgCl2。假如它们在溶液中完全电离,计算该溶液的沸点升高值。 解 1kgmol20.0kg100.0mol020.0(NaCl)b
142kgmol10.0kg100.0mol010.0)SO(Nab
12kgmol40.0kg100.0mol040.0)(MgClb
他们在溶液中完全电离,溶液中总质点数目为:
1111242kgmol9.1 kgmol40.03kgmol10.03kgmol20.02 )MgCl(3)SONa(3)NaCl(2)(
bbbb总
K97.0kgmol9.1molkgK512.011bT Exercises 1. What are the normal freezing points and boiling points of the following solution?(a)21.0g NaCl in 135mLof water.(b) 15.4g of urea in 66.7 mL of water. 百度文库 - 让每个人平等地提升自我 5 Solution: (a)11Lmol659.20.135Lmolg21.0g/58.5NaCl)(c K89.9Lmol659.2molkgK86.1211fT C89.9ofT K72.2Lmol659.2molkgK512.0211bT C72.102obT (b) 1142Lmol848.30.0667Lmolg15.4g/60.0)HCON(c K16.7Lmol848.3molkgK86.111fT C16.7ofT K97.1Lmol848.3molkgK512.011bT C97.101obT 2. If 4.00g of a certain nonelectrolyte is dissolved in 55.0g of benzene, the resulting solution freezes at 2.36℃. Calculate the molecular weight of the nonelectrolyte. Solution: C14.3C36.2C5.5ooofoffTTT
11Bkgmol616.0molkgK10.5K14.3b
11-molg118kg.616mol0g/0.0550kg00.4rM
3. The average osmotic pressure of seawater is about 30.0 atm at 25℃. Calculate the concentration (molarity) of an aqueous solution of urea (NH2CONH2)that is isotonic with seawater. Solution: kPa3039atm1kPa3.101atm0.30
11122Lmol23.1 K298molKLkPa314.8kPa3039)NCONHH(
RTc
4. A quantity of 7.85g of a compound having the empirical formula C5H4 is dissolved 301g of benzene. The freezing point of the solution is 1.05℃ below that of pure benzene. What are the molar mass and molecular formula of this compound?
