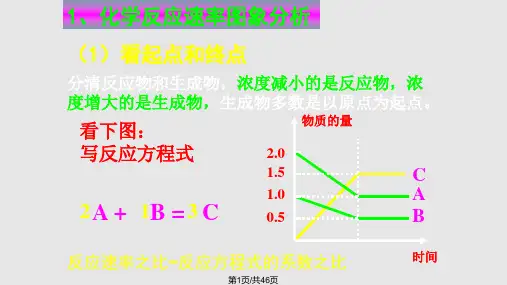
完整化学平衡移动图像专题(课堂PPT)
合集下载
2.2.4 化学平衡图像-高二化学课件(人教版2019选择性必修1)

该反应有两种情况: ① t1时刻加入了催化剂; ②反应前后气体系数不变的反应中t1时刻压强增大。
(2)“渐变”图像
推断出
图像有连接点
t1时刻v′正突增,v′逆逐渐增大;v′正>v′逆,平 衡向正反应方向移动。t1时刻所改变的条件是: 增大反应物的浓度。
推断出
t1时刻v′正骤减,v′逆逐渐减小;v′逆>v′正,平 衡向逆反应方向移动。t1时刻所改变的条件是: 减小反应物的浓度。
2. 解题方法: (1)改变条件使平衡移动的瞬间曲线是连续的,则是物质浓度改变。 (2)改变条件使平衡移动的瞬间曲线出现断点,则是温度或压强改变。 (3)改变条件反应速率变化但是平衡不移动,则是使用催化剂或是反应前后气体系 数不变的反应中压强改变。
对点练习
1.可逆反应aX(g)+bY(g) ⇌ cZ(g)在一定温度下的一密闭容器内达到平衡后,t0 时改变某一外界条件,化学反应速率(v)-时间(t)图像如图所示。下列说法中 正确的是( D )
推断出
该反应有两种情况: ①正反应为吸热反应,t1时刻所改变的条件是温度升高; ②正反应为气体物质的量减小的反应,t1时刻所改变的条 件是压强增大。
推断出
该反应有两种情况: ①正反应为吸热反应,t1时刻所改变的条件是温度降低; ②正反应为气体物质的量减小的反应,t1时刻所改变的条 件是压强减小。
推断出
t1
t2
t
部分连续
(3)温度变化
例如2NO2(g) ⇌ N2O4(g) ΔH = -56.9 KJ/mol
升温
v(逆) v(正)
c v-t图像→c-t图像
降温
v(正) v(逆)
v-t 图像全是断点 c-t 图像全部连续
c
化学平衡图像PPT课件
(D)
D%
1 增大 B 的浓度
2 升高反应温度 3 缩小反应容器的体积 4 加入催化剂
a
b
时间 t
A. 1 2 B. 1 3
C. 2 3 D. 3 4
第31页/共46页
五.基本题型
题型1:由化学方程式的特点判断图像
例:可表示为可逆反应2A(g)+B(g)
的图象是( B )
C%
700oC v V正
v
Z%
B. 增大Y的浓度
C. 降低温度
D. 增大体系压强
b
a
0
t
第17页/共46页
反应X(g)+Y(g) 2Z(g); △H<0,在 一定条件下,反应物Y的转化率与反 应时间(t)的关系如右下图所示。若 使曲线a变为曲线b可采取的措施是 A 加催化剂 B 降低温度 C 增大压强 D 增大Y的浓度
第18页/共46页
v
V(正)
V(正)
V(逆)
V(逆)
时间 t
第37页/共46页
3 .在容积固定为2L的密闭容器中充入X、Y各2mol,发生反应:
X( g) + 2Y(g)
2Z(g)
达到平衡时,以Y的浓度改变表示的关系如下图所示:
回答下列问题:
(1)用S表示面积,如 Obd 的面积 意可义表是示:为表_S_(示_O_bd反_),_应__则正__S向_(a_bd进_O_)行_表__时示__减的__少_
___的__Y__的__物__质__的__量__浓__度________。
v(Y)
a V(正) b
(2)平衡时 Y 的物质的量浓度可
表示为:__1_-__S__( a_O__b_) __mol/L。
常见化学平衡图像及分析(课堂PPT)

转
化
率
10 oC
0
t
(A)
0
P
(B)
0
P
(C)
18
图面
像线
点
分 变化量
②只加入催化剂,画出改变条件后的v-t图像。
V正
V正
V逆
V正
V逆
0
V逆
0
0 t0
t1
t2 t
0 t0
t1
t
7
V-t图解题思路: 1.分析反应特点:
物质状态、反应前后气体计量数变化、△H 2.根据勒夏特列原理判断平衡移动方向,推知:
改变条件后 V正、V逆的相对大小 3.根据反应速率的影响因素,推知:
解题思路:从反应特点入手,观察物质状态、 反应前后体积变化以及反应热
理论依据:以勒夏特列原理为核心,化学反应 速率和化学平衡理论综合运用
2
一、v-t图模型建立 问mA题规(g1):律+n当:B(向gv)密-⇌t闭图pC容中(g器)V+中q正D充、(g入),V一逆从定的反量应相的开A始和到B,若达发到生化反学应平: 衡时对,大如小何用决v定-t图平定衡性的建表立示的此方过程向?
随后正、逆反应速率如何变化? 2.画出改变条件后v-t图像,并分析平衡移动情况。
V
V正
V正
V逆
V逆
0
0 t0
t1
t2 t
练习1:在t1时刻,其他条件不变,只减小反应物的浓
度,画出改变条件后的v-t图像。
4
二、 v-t图像常见形式及分析
增大c(反) V正增大V逆瞬间不变平应方衡向向移正动反V正V逆大于原平衡
常见化学平衡图像及分析
1
一定条件下,可逆反应:N2(g)+3H2(g)⇌2NH3(g) △H <0,
高中化学选修4人教版2.3化学平衡图像课件 (共29张ppt)

与压强的关系如图所示。下列说法正确的是( C )
A. 温度:T1>T2>T3 B. 正反应速率:
v(a)>v(c)、v(b)>v(d) C. 平衡常数:
K(a)>K(c)、K(b)=K(d) D. 平均摩尔质量:
M(a)<M(c)、M(b)>M(d)
PART 5
5、其它图像
5、其它图像
(反应物) 转化率
P2
一切和温
大
度一样
t
P1>P2 m+n=p+q
③同时确定ΔH和左右气体系数
mA(g)+nB(g) ⇌ pC(g)+qD(g) ΔH
B%
T2P2
P2>P1 m+n<p+q
升温右移
T1>T2 ΔH>0
T1P2
加压左移 T1P1
t
PART 4 4、恒温线、恒压线
4、恒温线、恒压线
mA(g)+nB(g) ⇌ pC(g)+qD(g) ΔH
C. 反应方程式中的 x=1,正反应为 放热反应
D. 该反应20~30 min的平衡常数比30~40 min的平衡常数大
PART 3 ɑ-t-T图像和ɑ-t-P图像
3、ɑ-t-T图像和ɑ-t-P图像 mA(g)+nB(g) ⇌ pC(g)+qD(g) ΔH
①确定ΔH A 的 转 化 率
T1 升温左移
A的转化率 加压左移
10MPa 100MPa
A%
500℃
200℃
1000MPa
升温左移 T1
T
ΔH<0 m+n<p+q
P
请自己分析此图像
A. 温度:T1>T2>T3 B. 正反应速率:
v(a)>v(c)、v(b)>v(d) C. 平衡常数:
K(a)>K(c)、K(b)=K(d) D. 平均摩尔质量:
M(a)<M(c)、M(b)>M(d)
PART 5
5、其它图像
5、其它图像
(反应物) 转化率
P2
一切和温
大
度一样
t
P1>P2 m+n=p+q
③同时确定ΔH和左右气体系数
mA(g)+nB(g) ⇌ pC(g)+qD(g) ΔH
B%
T2P2
P2>P1 m+n<p+q
升温右移
T1>T2 ΔH>0
T1P2
加压左移 T1P1
t
PART 4 4、恒温线、恒压线
4、恒温线、恒压线
mA(g)+nB(g) ⇌ pC(g)+qD(g) ΔH
C. 反应方程式中的 x=1,正反应为 放热反应
D. 该反应20~30 min的平衡常数比30~40 min的平衡常数大
PART 3 ɑ-t-T图像和ɑ-t-P图像
3、ɑ-t-T图像和ɑ-t-P图像 mA(g)+nB(g) ⇌ pC(g)+qD(g) ΔH
①确定ΔH A 的 转 化 率
T1 升温左移
A的转化率 加压左移
10MPa 100MPa
A%
500℃
200℃
1000MPa
升温左移 T1
T
ΔH<0 m+n<p+q
P
请自己分析此图像
化学反应速率与化学平衡——图像专题(共52张)
v
pC(g)+qD(g),条件改变时有
右图变化反应;b.___加__压___,
m+n__>_p+q;平衡向__正__反应 方向移动。
v
②若对上述反应降温或减小 压强,画出平衡移动过程中 的 v-t图。
v正 v逆
t1
t2 t
v逆
v正
t1
t2 t
2.速率----时间图像
(3) 催化剂 压强变化b
①对于mA(g)+nB(g)
v
pC(g)+qD(g),条件改变时有
右图变化,改变的条件可能
为:a.__加__正__催__化__剂__;
b.__加__压____,m+n__=_p+q;平
衡向__正__反应方向移动。 v
②若对上述反应加负催化剂 或减小压强,画出平衡移动 过程中的 v-t图。
v正 v逆
t1
t
v正 v逆
t1
t
2.速率----时间图像
原因分类:
(1)若a、b无断点,则平衡移动肯定是改变某一物质的浓 度导致。
(2)若a、b有断点,则平衡移动原因可能是:①改变反应 体系的压强;②改变反应体系的温度;③同时不同程度地改 变反应物(或生成物)的浓度;
(3)若改变条件后,正、逆反应速率仍相等,则原因可能 是:①反应前后气体分子体积不变;②使用了催化剂;③等 效平衡
__增__大__反__应__物__浓__度___,
平衡将向__正__反应方向移动。
②引起平衡移动的因素是: v
__减__小__生__成__物__浓__度___, 平衡将向_正___反应方向移动。
v正
v逆
t1
t2 t
3 第三单元 化学平衡的移动(共70张PPT)

向___气__体__体__积__减__小____的方
增大压强
压强(对 反应前后气体
向移动
有气体 分子数改变
向___气__体__体__积__增__大___的方
减小压强
参加的
向移动
反应) 反应前后气体 改变压强
分子数不变
____平__衡__不__移__动____
温度
升高温度 降低温度
向__吸__热____反应方向移动 向__放__热__反应方向移动
催化剂
使用催化剂
___平__衡__不__移__动___
栏目 导引
专题7 化学反应速率与化学平衡
[自我检测] 1.对于一定条件下的可逆反应, 甲:A(g)+B(g) C(g) ΔH<0 乙:A(s)+B(g) C(g) ΔH<0 丙:A(g)+B(g) 2C(g) ΔH>0 达到化学平衡后,改变条件,按要求回答下列问题: (1)升温,平衡移动方向分别为(填“向左”“向右”或“不移 动”,下同) 甲________,乙________,丙________; 混 合 气 体 的 平 均 相 对 分 子 质 量 变 化 分 别 为 ( 填 “ 增 大 ”“ 减 小”或“不变”,下同) 甲________,乙________,丙________。
栏目 导引
专题7 化学反应速率与化学平衡
例如:①对于反应 A(g)+B(g) C(g),增大反应物 A 的浓度, 平衡右移,A 的浓度在增大的基础上减小,但达到新平衡时, A 的浓度一定比原平衡大;②若将体系温度从 50 ℃升高到 80 ℃,则化学平衡向吸热反应方向移动,达到新的平衡状态时 50 ℃<T<80 ℃;③若对体系 N2(g)+3H2(g) 2NH3(g)加压, 如从 30 MPa 加压到 60 MPa,化学平衡向气体分子数减小的方 向移动,达到新的平衡时 30 MPa<p<60 MPa。 (4)在分析化学平衡移动后颜色、压强、浓度等的变化时,有时 可以先建立一个平台,“假设平衡不移动”,然后在此平台的 基础上进行分析、比较就容易得到正确答案。
平衡移动图像讲解 ppt课件
2020/12/27
4
练习:
2.今有正反应放热的可逆反应,若反应开始经t1s后 达平衡,在t2s时由于反应条件改变,使平衡破坏, 到t3s时又达平衡,如右图所示,(1)该反应的反应 物是_X_、__Y(2)该反应的化学方程式为_X_+_Y______Z_
(3)分析从t2到t3时曲线改变的原因是( D ) A、增大了X或Y的浓度
2020/12/27
26
例6:(2010全国I卷)
在溶液中,反应A+2B C分别在三种不同实验条件下进行,它 们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)= 0mol/L。反应物A的浓度随时间的变化如下图所示。
2020/12/27
27
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条 件和判断的理由是:
v正
的因素可能是 a.升高温度
b.增大压强。根据反应方
t1
t2 t 程式,升高温度平衡向逆
反应方向移动,与图示相符;增大压强平衡
向正反应方向移动,与图示不相符。故此题
中2引020/1起2/27 平衡移动的因素是升高温度。 9
二、速度-时间图:
•对于反应mA(g)+nB(g) pC(g)+qD(g)有如下 图所示的变化,请分析t1时的改变因素可能 是什么?并说明理由。
2AB(g)
(正反应放热)当其达到平衡时,在下图的曲线中, 符合勒沙特列原理的曲线是
A ①② 2020/12/27 B ③④ C ① D ①⑤ 17
四、某物质的转化率(或百分含量)-温度 (或压强)图:
•对于反应mA(g)+nB(g) pC(g)+qD(g)
2.2 课时5 化学平衡图像分析(22张PPT) 课件 高二化学人教版(2019)选择性必修1
>
T3
放
<
5.几种特殊的图像
化学反应mA(g)+nB(g) ⇌pC(g)+qD(g),L线上所有的点都是平衡点。
1、L线的左上方(E点),A的百分含量大于此压强时平衡体系的Байду номын сангаас的百分含量,所以,E点v正>v逆;2、L线的右下方(F点),v正<v逆。
mM(s)+ nN(g) ⇌ pQ(g) △H<0 。在一定温度下平衡时N%与压强的关系如图,下列有关叙述正确的是 A、A点时混合物的V(正)> V(逆) B、A点比B点反应速率快 C、n>p D、m+n>p
三、做判断:先拐先平数值大,定一议二
B
1.可表示为可逆反应2A(g)+B(g) ⇌ 2C(g) △H < 0的图象是( )
2.化学反应mA(g)+nB(g) qC(g)+pD(g),l 线上所有的点都是平衡点,A的百分含量随压强的变化曲线图如下图所示,下列表述不正确的是(单选)( )
化学平衡图像分析
第二章 化学反应速率与化学平衡
1.掌握浓度-时间图(重点);2.理解某物质的转化率(或百分含量)-时间-温度(或压强)图;3.理解某物质的转化率(或百分含量)-温度(或压强)图(难点);4.了解其他特殊的平衡图像。
化学平衡图像题的解题方法
1.一看轴,即横坐标和纵坐标的意义。2.二看点,即一些特殊点如起点、拐点、交点、终点、最高点的意义。3.三看线即弄清图像中线的走向和变化趋势。4.四看辅助线弄清图像斜率的大小。 5.五看量的变化如浓度、温度、转化率、物质的量斜率的变化等。
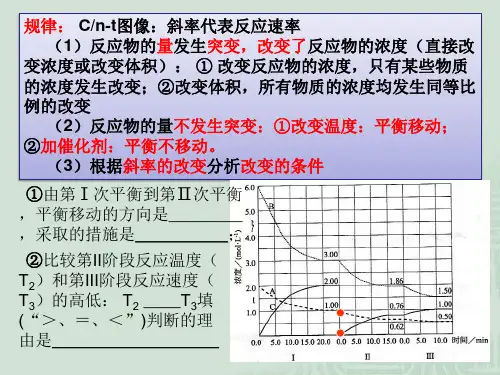
t0~t1,t2~t3,t3~t4,t5~t6
增大反应物浓度
使用催化剂
T3
放
<
5.几种特殊的图像
化学反应mA(g)+nB(g) ⇌pC(g)+qD(g),L线上所有的点都是平衡点。
1、L线的左上方(E点),A的百分含量大于此压强时平衡体系的Байду номын сангаас的百分含量,所以,E点v正>v逆;2、L线的右下方(F点),v正<v逆。
mM(s)+ nN(g) ⇌ pQ(g) △H<0 。在一定温度下平衡时N%与压强的关系如图,下列有关叙述正确的是 A、A点时混合物的V(正)> V(逆) B、A点比B点反应速率快 C、n>p D、m+n>p
三、做判断:先拐先平数值大,定一议二
B
1.可表示为可逆反应2A(g)+B(g) ⇌ 2C(g) △H < 0的图象是( )
2.化学反应mA(g)+nB(g) qC(g)+pD(g),l 线上所有的点都是平衡点,A的百分含量随压强的变化曲线图如下图所示,下列表述不正确的是(单选)( )
化学平衡图像分析
第二章 化学反应速率与化学平衡
1.掌握浓度-时间图(重点);2.理解某物质的转化率(或百分含量)-时间-温度(或压强)图;3.理解某物质的转化率(或百分含量)-温度(或压强)图(难点);4.了解其他特殊的平衡图像。
化学平衡图像题的解题方法
1.一看轴,即横坐标和纵坐标的意义。2.二看点,即一些特殊点如起点、拐点、交点、终点、最高点的意义。3.三看线即弄清图像中线的走向和变化趋势。4.四看辅助线弄清图像斜率的大小。 5.五看量的变化如浓度、温度、转化率、物质的量斜率的变化等。
t0~t1,t2~t3,t3~t4,t5~t6
增大反应物浓度
使用催化剂
