二氧化硅的性质与用途
集成电路工艺原理 第二章 氧化

氧化杂质 特定的杂质,特别是氯化氢(HCl)中的氯, 若氧化环境中含有氯,它将影响氧化生长速率, 实践证明在有氯化氢的情况下,生长速率可提 高1%~5%。 多晶硅氧化 与单晶硅相比,多晶硅可以更快、更低或 相似,主要取决于多晶硅的生长方法,若用化 化 学气相淀积法生长多晶硅,则与淀积温度、淀 学气相淀积 积压力、掺杂的类型和浓度有关。
快速热氧化 高压 炉管反应炉 化学氧化 阳极氧化 电解槽
化学的
2.4 水平炉管反应炉 最早使用也一直延续至今。主要用在氧化、扩 散、热处理及各 装载区 源区 中央区 种淀积工艺中。 水平炉管反应炉 消声器 的截面图如下: 氧化 炉管 整个系统包含 反应室、 反应室、温度 控制系统、 控制系统、反 比例 控制器 应炉、 应炉、气体柜 清洗站、 、清洗站、装 平区 片站等 片站 温度
进入或落在硅片表面,在氧化过程中, 污染 物在表面形成新的氧化层,是污染物远离了电 子活性的硅表面。也就是说污 染物被禁锢在二氧化硅 膜中,从而减小了污染 物对器件的影响。 2.1.2 掺杂阻挡层 器件制造过程中的掺杂是定域(有选择的 区域)掺杂,那么不需要 掺杂的区域就必须进行 保护而不被掺杂。如图 所示。
第二章 氧 化
概述 硅表面SiO2的简单实现,是硅材料被广泛 应用的一个重要因素。本章中,将介绍SiO2的 生长工艺及用途、氧化反应的不同方法,其中 包括快速热氧化工艺。另外,还简单介绍本工 艺中最重要的部分---反应炉,因为它是氧化、 扩散、热处理及化学气相淀积反应的基本设备。 2.1 二氧化硅的性质、用途 二氧化硅的性质、 在半导体材料硅的所有优点当中,SiO2 的极 易生成是最大的有点之一。当硅表面暴露在氧 气当中时,就会形成SiO2。(有良好的化学稳定 性和电绝缘性,能对某些杂质起到掩蔽作用)
二氧化硅与硝酸反应方程式

二氧化硅与硝酸反应方程式
一、二氧化硅的性质和用途
二氧化硅(SiO2)是一种常见的无机化合物,具有良好的化学稳定性和热稳定性。
在自然界中,二氧化硅以石英、长石、云母等形式存在。
二氧化硅广泛应用于玻璃、陶瓷、水泥等工业领域,还可用作催化剂、涂料、塑料等材料的添加剂。
二、硝酸的性质和用途
硝酸(HNO3)是一种强酸,具有强烈的腐蚀性和氧化性。
硝酸广泛应用于化学工业,用于制造肥料、染料、炸药等化学品。
此外,硝酸还用于电镀、金属清洗、废水处理等领域。
三、二氧化硅与硝酸的反应方程式
在适当的条件下,二氧化硅与硝酸可以发生反应。
反应方程式如下:
SiO2 + 2HNO3 → Si(NO3)4 + H2O
四、反应条件的影响
反应速率和平衡常数受温度、浓度、催化剂等因素的影响。
在酸性条件下,硝酸的氧化性增强,有利于反应进行。
此外,添加催化剂可以提高反应速率。
五、实际应用案例
在实际工业生产中,二氧化硅与硝酸反应可用于制备硅酸盐肥料、陶瓷釉料等。
此外,该反应还可用于分析化学中测定二氧化硅的含量。
总之,二氧化硅与硝酸反应在化学领域具有广泛的应用。
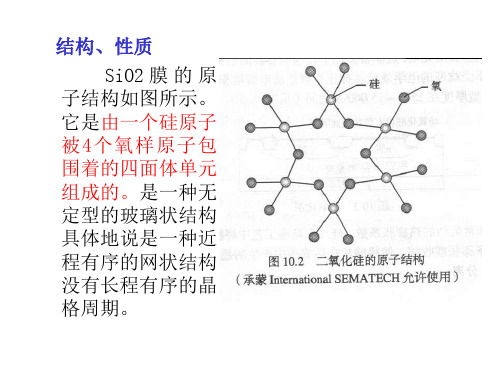
二氧化硅的性质
经常采用方法。因为温度越高时间越长越会引起其
它负面影响,比如,晶园表面层中“错位”和温
度及高温下的时间密
不锈钢套
石英 反应 管
切相关,而这种错位
对器件特性是很不利 高压惰性气体 的。高温氧化系统如 高压氧化气体
图所示。
和普通水平反应炉相似,不同的是炉管 是密封的,氧化剂被用10~25倍大气压的压力 泵入炉管。在这种压力下,氧化温度可降到 300~700℃而又能保证正常的氧化速率。在这 种温度下晶园的错位生长可降到最小。
不均匀的氧化率及氧化步骤
经过一些制作工艺后,晶园表面的条件会 有所不同,有的是场氧化区,有些是掺杂区, 有些是多晶硅区等等。每个区上面氧化层厚度 不同,氧化层厚度的不同被称为不均匀氧化。
不同的氧化率导致了在晶
园表面形成台阶(见图) 。
硅晶片
图中显示的是与比较厚的
再氧化之前
场氧化区相邻的氧化区形
(a)
7.2.1 影响氧化速率的 因素
晶格方向
因为不同晶向其
原子密度不同,所以
在相同的温度、氧化
气压等条件下,原子
密度大的晶面,氧化
生长速率要大,而且 在低温时的线性阶段
1000 û C
更为明显。如图所示。10
<111> 硅 <100> 硅
11120000
û û
C C
900 û C 800 û C 700 û C
成了一个台阶,在暴露区
台阶
的氧化反应较快。
硅晶片
再氧化之后 (b)
7.3 热氧化方法
从氧化反应方程式可以看出,氧和硅的反应 似乎很简单,但是要达到硅技术中的氧化必须 附加条件,那就是加热,给反应过程足够的能 量是其满足要求,所以常称之为热氧化。
二氧化硅工业用途

二氧化硅工业用途二氧化硅是一种广泛应用于工业领域的重要材料,具有多种用途。
本文将介绍二氧化硅的工业用途,并详细探讨其在不同领域中的应用。
二氧化硅在建筑材料领域具有重要作用。
由于其良好的物理和化学性质,二氧化硅常被用作建筑材料的添加剂。
例如,它可以用于制造混凝土,以提高混凝土的强度和耐久性。
此外,二氧化硅还可以用作涂料和涂层的添加剂,以提高涂层的附着力和耐候性。
二氧化硅在电子行业中有广泛的应用。
由于其良好的绝缘性能和热导率,二氧化硅常被用作电子元件的绝缘材料和散热材料。
在集成电路制造中,二氧化硅被用作隔离层和介质层,以提高电路的稳定性和可靠性。
此外,二氧化硅还可以用作光学材料,用于制造光纤和光学元件。
二氧化硅在化工工业中也有重要的应用。
由于其化学稳定性和吸附性能,二氧化硅常被用作催化剂和吸附剂。
例如,它可以用于制备催化剂,用于化工反应中的催化过程。
同时,二氧化硅还可以用作吸附剂,用于分离和纯化化工原料和产品。
此外,二氧化硅还可以用作填料和增稠剂,用于改善化工产品的流变性能。
二氧化硅还在食品和制药工业中有广泛的应用。
由于其良好的吸湿性和防结块性,二氧化硅常被用作食品和制药品的防潮剂和流变性调节剂。
例如,它可以用于制造食品添加剂,以保持食品的新鲜和口感。
同时,二氧化硅还可以用作制药原料的填充剂和稳定剂,以提高药物的稳定性和溶解性。
二氧化硅还在能源领域中发挥着重要作用。
由于其高温稳定性和导热性能,二氧化硅常被用作高温隔热材料和导热材料。
例如,在太阳能电池板制造中,二氧化硅被用作太阳能电池板的隔热层,以提高太阳能电池板的效率和寿命。
此外,二氧化硅还可以用作储能材料的填充剂,用于提高能源储存设备的性能。
二氧化硅在工业领域中具有多种用途。
它在建筑材料、电子、化工、食品和制药、能源等领域中发挥着重要作用。
随着科技的不断发展,二氧化硅的应用领域将会进一步扩大,为工业发展和人类生活带来更多的便利和创新。
二氧化硅石油化工用途

二氧化硅石油化工用途二氧化硅(SiO2)是一种非常重要的无机化合物,具有广泛的用途。
在石油化工领域中,二氧化硅也是一种常用的材料,主要应用于催化剂、填料、涂料和粘合剂等方面。
首先,二氧化硅可用作催化剂。
催化剂是化学反应中起催化作用的物质。
二氧化硅因其具有较大的比表面积和较高的化学稳定性,被广泛应用于催化剂领域。
例如,它可以通过多孔二氧化硅的添加来固定催化剂,提高其活性和选择性,增强反应效果。
此外,二氧化硅还可以用于合成氧化硅负载金属催化剂,如二氧化硅负载铂催化剂,用于加氢反应和氧化反应等。
其次,二氧化硅还可用作填料。
填料是指在油田开发过程中为了调整井的物理性质或降低油井压力而加入的一种物质。
二氧化硅具有较小的比重、低渗透和高可压缩性,可用于填充油井中的空隙,提高油井的渗透性和稳定性。
此外,由于二氧化硅的高温稳定性和耐蚀性,它还可以用作高温高压井眼填料,用于油井封堵、固井和补盖。
再次,二氧化硅在石油化工中还可以用作涂料成分。
涂料是一种用于保护和美化物体表面的涂层材料。
由于二氧化硅具有良好的光学性能、耐候性和化学稳定性,它可以作为涂料中的重要成分,如作为增稠剂、消光剂、催化剂等。
二氧化硅还可以改善涂层的耐磨性、耐划伤性和抗冲击性,提高涂层的光泽和硬度。
此外,二氧化硅还可以用作粘合剂。
粘合剂是一种用于粘合两个或多个物体的材料。
由于二氧化硅具有较高的粘度和强度,它可以用作粘合剂,如在油井中固化水泥、粘合陶瓷、金属和非金属材料等。
此外,二氧化硅还可以用作粘接剂的填料,提高粘接剂的强度和稳定性。
总之,二氧化硅在石油化工中具有广泛的应用,主要用于催化剂、填料、涂料和粘合剂等方面。
它不仅可以提高反应效果和油井的渗透性,还可以改善涂层的性能和粘接剂的强度。
随着石油化工技术的发展和进步,相信二氧化硅在该领域中的应用也将不断扩大和深化。
二氧化硅及硅酸盐

SiO2的化学性质(很不活泼)
1.酸性氧化物
与碱性氧化物反应生成盐:
SiO2+
CaO
高温
==
CaSiO3
与强碱反应生成盐和水:
SiO2 + 2NaOH = Na2SiO3 +H2O 硅酸钠
2.特性
与 HF 的反应 :
SiO2 + 4HF = SiF4↑+ 2H2O *用途:雕刻玻璃
SiO2+2C =高温= Si+2CO↑ 4.与某些盐反应 SiO2 + Na2CO3 =高温= Na2SiO3+CO2↑
。
3.结构
SiO2晶体是 立体 网状结构,每个Si周围结合 4 个O, 每个O周围有 2 个Si,N(Si)∶N(O)= 1∶2 。
O Si
5.用途
(1)沙子是基本的建筑材料。 (2)纯净的SiO2是现代光学及光纤制品的 基本材料,可以制作 光导纤维 。 (3)石英和玛瑙制作饰物和工艺品。 (4)实验室中使用 石英 坩埚。
结论:H2SiO3酸性比H2CO3酸性 弱 。
△
(2)不稳定性:H2SiO3==== SiO2+H2O。
性质:白色固体(胶体),难溶于水的物质。酸性比碳酸弱。 用途: 可作干燥剂和催化剂的载体。
小结
2
存在形态:固态。 物理性质:熔点高、硬度大、不溶于水。 化学性质:与氢氟酸、碱性氧化物、强碱反应 。
B.因为 CaCO3+SiO2=高==温==CaSiO3+CO2↑,所以硅
酸的酸性比碳酸强
C.CO2 和 SiO2 都能与碳反应,且都作氧化剂
D.SiO2 既能和 NaOH 反应,又能某同学根据 SiO2 既可与碱反应,也能与氢氟酸反应, 推断 SiO2 为两性氧化物,是否正确?
二氧化硅的性质和用途资料

教学目标
1.能说出硅在自然界的含量、存在、用途。 2.了解二氧化硅的物理性质和用途,能熟练写出二氧化 硅的相关方程式。
3. 能简单说出硅酸的用途。
4、通过观赏惟妙惟肖的图片,让学生感受到大自然的 魅力。
一、二氧化硅和硅酸
1.二氧化硅 (1)存在 存在形态有________ 结晶 形和__________ 无定形 两大类,水晶、 玛瑙的主要成分是_____________________ 。 结晶的二氧化硅
2NaOH+CO2 SiO2+2NaOH 与碱的反应 =Na2CO3+H2O =Na2SiO3+H2O
一、CO2与SiO2的比较 Na2SiO3+CO2+H2O= SiO2+CaCO3 CaSiO3+CO2↑ SiO2+Na2CO3 Na2SiO3+CO2↑
与 Na2CO3+H2SiO3↓ 盐 反 Ca(ClO) +CO +H O= 2 2 2 应 CaCO3↓+2HClO 与 碳 C+CO2 反 应
D.二氧化硅和二氧化碳在物理性质上有很大差异
解答该类题时要注意以下两个易出错的问题: (1)SiO2既能与NaOH溶液反应,也能与氢氟酸反
【 名 师 点 睛 】
应,但SiO2不属于两性氧化物而属于酸性氧化物。 (2)SiO2和CO2的物理性质差别很大,是由于二者 结构上的差别造成的,SiO2是立体网状结构的晶体,
CO2的结构差别较大,故物理性质差别较大,化学性质类
似,C项正确。 【答案】D
2.硅酸 (1)硅酸的性质 原理:强酸制 弱酸
①弱酸性
向Na2SiO3溶液中通入CO2,反应的化学方程式为
Na2SiO3+CO2+H2O =H2SiO3↓+ _____________________________ 。Na2CO3
si和sio2的用途

si和sio2的用途Si和SiO2的用途Si和SiO2是两种非常重要的材料,它们在现代工业和科技领域中有着广泛的应用。
本文将从Si和SiO2的性质、制备方法和应用领域三个方面来介绍它们的用途。
一、Si的用途Si是一种非金属元素,它的化学性质非常稳定,具有良好的导电性和半导体性质。
Si的制备方法主要有两种:一种是从矽石中提取,另一种是通过化学反应制备。
Si的应用领域非常广泛,下面列举几个典型的应用:1.半导体材料Si是半导体材料的主要成分之一,它在电子工业中有着广泛的应用。
例如,Si可以用来制造晶体管、集成电路、太阳能电池等电子元器件。
2.光学材料Si具有良好的光学性质,可以用来制造光学器件。
例如,Si可以用来制造光纤、光学透镜、光学滤波器等。
3.化学材料Si可以用来制造各种化学材料,例如,Si可以用来制造硅橡胶、硅油、硅藻土等。
二、SiO2的用途SiO2是一种无机化合物,它的化学性质非常稳定,具有良好的耐热性和耐腐蚀性。
SiO2的制备方法主要有两种:一种是从石英矿中提取,另一种是通过化学反应制备。
SiO2的应用领域也非常广泛,下面列举几个典型的应用:1.建筑材料SiO2可以用来制造各种建筑材料,例如,SiO2可以用来制造玻璃、陶瓷、水泥等。
2.电子材料SiO2可以用来制造电子材料,例如,SiO2可以用来制造电容器、电阻器、电感器等。
3.化学材料SiO2可以用来制造各种化学材料,例如,SiO2可以用来制造催化剂、吸附剂、分离剂等。
Si和SiO2是两种非常重要的材料,它们在现代工业和科技领域中有着广泛的应用。
随着科技的不断发展,它们的应用领域还将不断扩大。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二氧化硅的用途
二氧化硅的存在
二氧化硅广泛存在于自然界中,与其他矿物共同构成了岩石。天然存
在的二氧化硅也叫硅石,是一种坚硬难熔的固体。
石英的主要成分也是二氧化硅,透明的石英晶体,就是我们常说的水
晶。
二氧化硅的化学性质
二氧化硅的化学性质不活泼,不与水反应,也不与酸(氢氟酸除外)
反应,但能与碱性氧化物或碱反应生成盐。例如:
高温
2NaOH+SiO2===Na2SiO3+H2O
CaO+SiO2===CaSiO3
二氧化硅的化学性质特点:SiO2是酸性氧化物,是硅酸的酸酐。然
而SiO2与其它的酸性氧化物相比却有一些特殊的性质。
(1)酸性氧化物大都能直接跟水化合生成酸,但SiO2却不能直接跟
水化合。它所对应的水化物——硅酸,只能用相应的可溶性硅酸盐跟
酸反应制得(硅酸不溶于水,是一种弱酸,它的酸性比碳酸还要弱
(2)酸性氧化物一般不跟酸作用,但SiO2却能跟氢氟酸起反应,生
成气态的四氟化硅。
SiO2+4HF==SiF4↑+2H2O
普通玻璃、石英玻璃的主要成分是二氧化硅。因而可用氢氟酸来腐蚀
玻璃。用氢氟酸在玻璃上雕花刻字,实验室里氢氟酸不能用含二氧化
硅的玻璃、陶瓷、瓷器、陶器盛放,一般可用塑料瓶。
(3)SiO2与强碱溶液反应可生成水玻璃,它是一种矿物胶,常用作
粘合剂。所以实验室盛放碱溶液的试剂瓶不用玻璃塞,而用橡胶塞。
二氧化硅的用途表现
1、二氧化硅的用途很广,目前已被使用的高性能通讯材料光导纤维
的主要原料就是二氧化硅晶体。
2、二氧化硅晶体水晶常用来制造电子工业的重要部件、光学仪器,
也用来制成高级工业品和眼镜片等。
3、二氧化硅玻璃体是平板玻璃、浮法玻璃、玻璃制品(玻璃罐、玻
璃瓶、玻璃管等)、光学玻璃、玻璃纤维、玻璃仪器、导电玻璃、玻
璃布及防射线特种玻璃等的主要原料。
一般较纯净的石英,可用来制造石英玻璃。石英玻璃膨胀系数很小,
相当于普通玻璃的1/18,能经受温度的剧变,耐酸性能好(除HF外),
因此,石英玻璃常用来制造耐高温的化学仪器。
4、石英砂常用作建筑材料、陶瓷及耐火材料
混凝土、胶凝材料、筑路材料、人造大理石、水泥物理性能检验材料
(即水泥标准砂)等。瓷器的胚料和釉料,窑炉用高硅砖、普通硅砖
以及碳化硅等的原料。
