2018-2019学年化学同步鲁科版必修2学案:第1章第2节第2课时元素周期表含答案
高中化学鲁科版 必修2第一章 第2节 元素周期律与元素周期表

1、周期:
具有相同电子层数而 又按照原子序数递增 顺序由左往右排列的 一系列元素。
周期数 = 电子层数
电子层数 最外层电子数
电子层数 最外层电子数
结论:同周期元素电子层数相同, 从左到右最外层电子数依次增加。
2、族: 不同横行中最外层电子
数相同的元素按电子层数递 增的顺序由上到下排成纵行。
周期
短周期
长周期
具有电子层数相同的横行
七主分两边,七副站中间,
族: 零族排末尾, VIII族括纵三。
最外层电子数相等的纵行
IA 主族 7个
零族 0
IIA
IIIA IVAVAVIAVIIA
副族 7个 第八族
IIIB IVB VB VIB VIIB VIII IB IIB
判断正误
1. (1)元素周期表有18个纵列,共16个族( √) (2)短周期元素中可能有副族元素( × ) (3)原子序数之差为2的两种元素不可能位于同一主族 (× ) (4)元素周期表中Ⅷ族元素种类最多( × ) (5)同周期相邻主族元素的原子序数之差都为1( × ) (6) 元 素 周 期 表 中 镧 系 元 素 和 锕 系 元 素 都 占 据 同 一 格 , 它们互为同位素×( )
2.确定下列元素在周期表的位置。
(1)已知硒(Se)元素具有抗癌抗衰老的作用,其原子结
构示意图为
,该元素位于周期表中第 4 周
期 ⅥA 族。
(2)据报道,某些花岗岩会产生放射性元素氡,其原子
结构示意图为
,则该元素的质子数为 86 ,位于周 期表中的第 6 周期 0 族。
3.主族元素在周期表中所处的
C. N/C
高中化学鲁科版(2019)必修第二册第1章原子结构 元素周期律-第2节元素周期律和元素周期表基础训练

高中化学鲁科版(2019)必修第二册第1章原子结构元素周期律-第2节元素周期律和元素周期表基础训练一、单选题1.焰火“脚印”“笑脸”“五环”,让北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色试验”知识相关。
下列说法中错误的是()A. 焰色反应一定发生化学变化B. 每次做焰色反应前都要用盐酸洗净铂丝或铁丝C. 观察硫酸钾的焰色反应透过蓝色钴玻璃D. NaCl与Na2CO3灼烧时火焰颜色相同2.下列关于焰色试验的说法正确的是( )A. 可以用铜丝代替铂丝B. 不能用光亮无锈的铁丝代替铂丝C. 观察钠及含钠化合物的火焰时应直接观察,火焰呈黄色D. 观察钾和含钾化合物的火焰时不能透过蓝色的钴玻璃观察3.短周期元素W、X、Y、Z的原子序数依次增加,Y和W、Y和Z分别相邻,且W、Y和Z三种元素的原子最外层电子数之和为19,x原子的电子层数与最外层电子数相等。
下列说法错误的是()A. 单质的沸点:Y>W>ZB. 离子半径:X<YC. 气态氢化物的稳定性:W>YD. W与X可形成离子化合物4.一种新型漂白剂(如下图)可用于漂白羊毛等,其中W、Y、Z为不同周期不同主族的短周期元素,W、Y、Z 的最外层电子数之和等于X的最外层电子数,W、X对应的简单离子核外电子排布相同。
下列叙述正确的是()A. 工业上通过电解熔融的WX来制得WB. Z、X两元素形成的某种化合物可做消毒剂C. Y的最高价氧化物对应水化物为强酸D. 该漂白剂中各元素均满足8电子稳定结构5.X、Y、Z三种短周期元素,原子半径的大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。
X、Y、Z三种元素的常见单质在适当的条件下可发生如图所示的变化,其中A为X、Y组成的双原子分子,B和C均为10电子分子。
下列说法不正确的是()A. X元素位于第ⅥA族B. A不能溶于B中C. A和C不可能发生氧化还原反应D. C溶于B形成的溶液呈碱性6.下列关于11~17号元素性质的比较中,正确的是()①元素的最高正化合价依次升高②元素的非金属性逐渐增强③元素的金属性逐渐增强④元素的最高价氧化物对应的水化物的碱性逐渐减弱,酸性逐渐增强A. ①②B. ③④C. ①②④D. ①②③④7.某元素的离子.结构示意图为,该元素在周期表中的位置是()A. 第5周期零族B. 第6周期第ⅠB族C. 第5周期第ⅦA 族D. 第6周期第ⅠA族8.X 和Y 属短周期元素,X 原子的最外层电子数是次外层电子数的一半,Y 位于X 的前一周期,且最外层只有一个电子,下列的说法正确的是()A. X可能是第二周期非金属元素B. X 可能是第三周期金属元素C. Y可能与X 同主族D. Y 一定是金属元素9.门捷列夫周期表是常见的经典形式,人们在研究前18号元素时发现,还可以将它们排成如图所示的“海螺”形状,图中每个“·”代表一种元素,其中O点代表氢元素。
2019-2020学年化学鲁科版必修2学案:第1章第2节 元素周期和元素周期表 第2课时

第2节元素周期律和元素周期表第2课时元素周期表学习目标1.认识元素周期表的结构以及周期、族等概念,理解原子结构与元素在周期表中的位置间的关系。
2.了解ⅡA族、ⅤA族和过渡金属元素的某些性质和用途。
3.通过化学史知识——元素周期表和元素周期律,认识人类对客观事物的认识是随着社会和科学的发展不断深入的。
引入:元素周期律使人们认识了杂乱无章的化学元素之间相互联系和变化规律,如何把这种规律具体地表现出来呢?【小组探讨】观察元素周期表。
思考周期表中周期和族划分的依据是什么?【归纳】1.通过周期表,我们可以了解元素的、元素符号、、原子序数、相对原子质量、价层电子排布、是否人造元素、是否放射性元素等信息;通过周期表,我们还可以对元素进行分区,如沿着和的交界处画一条虚线,虚线的左侧为金属元素,右侧为非金属元素;位于虚线附近的元素,既表现金属元素的性质,又表现为非金属元素的性质。
在元素周期表中,行称为,列称为。
2.同一周期:电子层数相同,原子序数递增的元素从左到右为同一周期;同一族:最外层电子数相同,原子序数逐渐增大的元素从上到下为同一族。
【交流研讨】P14【归纳】3.周期:周期序数= 数共有个横行,个周期:长短不全,除第1、第7周期外,每一周期都是以 _______ _元素开始到,最后以稀有气体元素结束。
4.族: 周期表中共有 个纵行,第8、9、10三个纵行称为 族,第18列稀有气体称为 ,其余的族分为 族和 族。
分别用A 、B 表示。
(1)主族序数 = 数(2)在周期表的18个纵行16个族中,各族从左到右的排列顺序如何? 阅读教材P15【归纳】元素周期表中的部分元素和焰色反应(1)ⅡA 、ⅤA 和过渡元素的性质(2)焰色反应某些金属或它们的化合物在灼烧时火焰呈现特征颜色的反应。
如钠: 色,钾 色。
【例1】下列说法中正确的是( ) A.元素周期表有七个横行,分为七个周期 B.元素周期表有九个横行,分为七个周期 C.元素周期表有十六个纵行,分为十六个族D.元素周期表有十八个纵行,分为十八个族【例2】2.已知某原子结构示意图为,下列说法中正确的是()A.该元素位于第二周期,第Ⅷ族B.该元素位于第三周期,第ⅠA族C.该元素属于稀有气体元素D.该元素属于金属元素【当堂检测】1.判断正误。
2018版高中化学 第1章 原子结构与元素周期律 1.2.1 元素周期律学案 鲁科版必修2
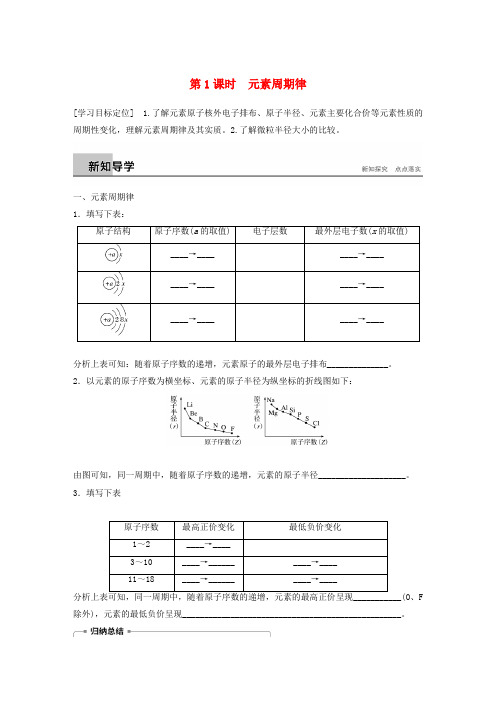
第1课时元素周期律[学习目标定位] 1.了解元素原子核外电子排布、原子半径、元素主要化合价等元素性质的周期性变化,理解元素周期律及其实质。
2.了解微粒半径大小的比较。
一、元素周期律1.填写下表:分析上表可知:随着原子序数的递增,元素原子的最外层电子排布______________。
2.以元素的原子序数为横坐标、元素的原子半径为纵坐标的折线图如下:由图可知,同一周期中,随着原子序数的递增,元素的原子半径____________________。
3.填写下表、F 除外),元素的最低负价呈现__________________________________________________。
1.元素周期律是______________________________________________________。
2.元素周期律的实质是_________________________________________________。
关键提醒稀有气体元素原子半径的测量依据与其他原子半径的测量依据不同,不能进行比较;氟没有正价,氧没有最高正价。
1.下列各组元素性质或原子结构递变情况错误的是( )A.Li、Be、B原子最外层电子数依次增多B.P、S、Cl元素最高正化合价依次升高C.N、O、F原子半径依次增大D.P、S、Cl元素的最低化合价依次为-3、-2、-12.下列各组元素中,按最高正价递增的顺序排列的是( )A.C、N、O、F B.K、Mg、C、SC.H、He、Li、Be D.P、S、Cl、Ar二、微粒半径大小比较与元素化合价的确定1.试比较下列微粒半径大小(填“>”或“<”)(1)r(F)____r(Cl)____r(Br)____r(I),r(F-)____r(Cl-)____r(Br-)____r(I-);r(Li)____r(Na)____r(K),r(Li+)____r(Na+)____r(K+)。
鲁科版2019必修第2册第1章第2节元素周期律和元素周期表作业

第2节元素周期律和元素周期表1.(2020山东威海高一月考)下列原子中半径最大的是()A.NaB.ClC.AlD.F答案A一般元素的原子核外电子层数越多,原子半径越大;当原子核外电子层数相同时,原子序数越小,原子半径越大。
由于F原子核外只有2个电子层,而Na、Cl、Al原子核外都有3个电子层,三者中Na的原子序数最小,所以原子半径最大的是Na,故A正确。
2.萤石的主要成分是氟化钙,其阳离子比阴离子的半径()A.大B.小C.相同D.无法确定答案A钙离子比氟离子多一个电子层。
3.X元素最高价氧化物对应的水化物为H3XO4,则它对应的气态氢化物为()A.HXB.H2XC.XH4D.XH3答案D X元素的最高正价是+5价,则其最低负价为-3价,故X元素对应的气态氢化物的化学式为XH3。
4.结合元素周期律的知识分析下列说法,其中正确的是()A.原子序数为15的元素的最高化合价为+5B.随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现C.随着元素原子序数的递增,元素的最高化合价总是从+1到+7,最低化合价总是从-7到-1重复出现D.B、C、N、O、F元素的最高正化合价依次增大答案A原子序数为15的元素原子最外层电子数是5,所以其最高化合价是+5;1、2号元素的最外层电子数是从1到2的变化;金属元素一般无负价,O无最高正价、F无正价。
5.已知砷为33号元素,下列有关砷元素的说法正确的是()A.原子结构示意图:B.砷是金属元素C.根据砷原子的结构可以推断砷元素的最高正价和硫元素的一样D.砷元素的氢化物为H2As答案A砷元素原子最外层有5个电子,得到3个电子达到8电子稳定结构,因此其最高正价为+5价,最低负价为-3价,氢化物为H3As。
砷元素为非金属元素。
293Lv的叙述错误的6.(2020天津高一月考)第116号元素Lv的名称为。
关于116是()A.原子序数为116B.中子数为177C.核外电子数为116D.相对原子质量为116答案D7.下列有关元素周期表中“族”的说法正确的是()A.元素周期表中共有七个主族、八个副族、一个0族B.同一主族元素原子最外层的电子数目不一定相同C.同一主族元素的化学性质相同D.族序数后标注A的元素是主族元素答案D元素周期表中还有Ⅷ族,元素周期表中有七个副族,A错误;同一主族元素原子最外层的电子数目均相同,B错误;同一主族元素的化学性质相似而不是相同,C错误。
最新鲁教版高中化学必修二全册学案(全册 共368页 附答案)

最新鲁教版高中化学必修二全册学案(全册共368页附答案)目录第一章原子结构与元素周期律第一节原子结构第1课时原子核核素第2课时核外电子排布第二节元素周期律和元素周期表第1课时元素周期律第2课时元素周期表第三节元素周期表的应用第1课时认识同周期元素性质的递变规律第2课时预测同主族元素的性质第1章原子结构与元素周期律重点突破第二章化学键化学反应与能量第一节化学键与化学反应第1课时化学键及其类型第2课时化学键与物质类别第3课时化学键与化学反应中的能量变化第二节化学反应的快慢和限度第1课时化学反应的快慢第2课时化学反应的限度第三节化学反应的利用第1课时利用化学反应制备物质第2课时化学反应为人类提供能量第三章重要的有机化合物第一节认识有机化合物第1课时甲烷的性质与结构第2课时有机化合物的结构特点第二节石油和煤重要的烃第1课时石油的炼制乙烯第2课时煤的干馏苯第三节饮食中的有机化合物第1课时乙醇第2课时乙酸第3课时酯和油脂第4课时糖类蛋白质第四节塑料橡胶纤维第1课时有机高分子化合物第2课时塑料橡胶纤维第1章原子结构与元素周期律本章知识体系构建与核心素养解读宏观辨识与微观探析能用原子或物质结构解释元素或相关物质的性质,其实质是能根据原子核外电子排布、典型物质的结构(电子式、结构式等)、典型物质(最高价氧化物对应的水化物、氢化物)性质的变化规律等,通过知识的类比迁移,推断、比较、解释元素及相关物质的性质。
例析短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )A.原子半径:W>Z>Y>XB.最高价氧化物对应水化物的酸性:X>W>ZC.最简单气态氢化物的热稳定性:Y>X>W>ZD.元素X、Z、W的最高化合价分别与其主族序数相等答案 A解析 根据短周期元素W 原子的质子数是其最外层电子数的3倍,可推知W 是P 元素。
2019年高中化学第1章第2节第2课时元素周期表课堂演练含解析鲁科版必修22019110714
第2课时元素周期表1.在元素周期表中,第1、2、3、4周期元素的数目分别是( )A.2、8、8、18 B.2、8、18、18C.2、18、18、18 D.2、8、18、32解析:元素周期表中,1至6周期元素数目分别为2、8、8、18、18、32。
答案:A2.下列说法中,错误的是( )A.原子及其离子的核外电子层数等于该元素所在的周期序数B.元素周期表中从ⅢB族到ⅡB族10个纵列的元素都是金属元素C.除He外的所有稀有气体元素原子的最外层电子数都是8D.ⅡA族与ⅢA族之间隔着10个纵列解析:Na+、Mg2+、Al3+等阳离子的核外电子层数等于元素上一周期的周期序数,A项错误;ⅡA族和ⅢA族之间隔着7个副族和1个Ⅷ族(3个纵列)共10个纵列,D项正确。
答案:A3.甲、乙是周期表中同主族相邻元素,若甲的原子序数为x,则乙的原子序数不可能是( )A.x+2 B.x+4 C.x+8 D.x+18解析:同一主族相邻两元素的原子序数可以相差2(H和Li)、8(如O和S)、18(如Cl 和Br),但不能相差4。
答案:B4.据报道,1995年我国科研人员在兰州首次合成了镤元素的一种同位素镤239,并测出其原子核内有148个中子。
现有A元素的一种同位素,比镤239的原子核内少54个质子和100个中子,则A元素在周期表中的位置是( )A.第3周期ⅠA族B.第4周期ⅠA族C.第5周期ⅠA族D.第3周期ⅡA族解析:镤元素的质子数为239-148=91,则A元素同位素的质子数为91-54=37,同位素质子数相同,则A的质子数也为37,位于周期表第5周期ⅠA族。
答案:C5.下列各表是元素周期表中的一部分,表中数字表示的原子序数与其在周期表中的位置相符的是( )答案:D6.(1)第3周期第ⅣA族的元素原子序数是________。
(2)钠元素的原子序数为11,短周期中相邻的同族元素的原子序数是________。
2018-2019版高中化学第1章原子结构与元素周期律本章知识体系构建与核心素养解读学案鲁科版必修2
第1章原子结构与元素周期律本章知识体系构建与核心素养解读宏观辨识与微观探析能用原子或物质结构解释元素或相关物质的性质,其实质是能根据原子核外电子排布、典型物质的结构(电子式、结构式等)、典型物质(最高价氧化物对应的水化物、氢化物)性质的变化规律等,通过知识的类比迁移,推断、比较、解释元素及相关物质的性质。
例析短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )A.原子半径:W>Z>Y>XB.最高价氧化物对应水化物的酸性:X>W>ZC.最简单气态氢化物的热稳定性:Y>X>W>ZD.元素X、Z、W的最高化合价分别与其主族序数相等答案 A解析根据短周期元素W原子的质子数是其最外层电子数的3倍,可推知W是P元素。
结合元素在周期表中的相对位置可知:X是N元素,Y是O元素,Z是Si元素。
A项,同周期元素,由左到右原子序数增大,原子半径减小;同主族元素,由上到下原子序数增大,原子核外电子层数增多,半径增大。
所以原子半径关系为Si>P>N>O,错误;B项,元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,元素的非金属性:N>P>Si,所以它们的最高价氧化物对应的水化物的酸性:HNO3>H3PO4>H2SiO3,正确;C项,元素的非金属性越强,其对应的最简单气态氢化物的热稳定性就越强,元素的非金属性:O>N>P>Si,所以对应最简单气态氢化物的热稳定性:H2O>NH3>PH3>SiH4,正确;D项,主族元素原子的最外层电子数一般等于该元素的最高正化合价(O、F除外),也等于主族序数,故N、Si、P的最高正化合价分别与其主族序数相等,正确。
高中化学鲁科版2019必修第二册课件第1章第2节第2课时元素周期表
课堂篇 素养提升
探究一 有关原子序数的推断
【问题探究】 融雪剂的作用是融雪化冰,可代替食盐用于城市道路、高速公路、机场、 港口、桥梁等设施的除雪化冰,有的融雪剂还可用作建筑工程冬季施工冰 雪融化的速融剂和防冻外加剂等。融雪剂不能对道路、混凝土构件、桥 梁设施有损害,也不能破坏花草树木、农作物、动物及对人有损害。有一 种融雪剂,其主要成分的化学式为XY2,X、Y均为元素周期表中前20号元 素,其中阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
2022
第1章 第2课时 元素周期表
内
01 课前篇 素养初探
容
索
02 课堂篇 素养提升
引
【素养目标】
1.知道元素周期表的结构,知道元素原子结构、元素性质与元素在周期表 中位置的关系。 2.从宏观和微观相结合的角度认识变化的观念,理解元素周期表的编排方 法,能运用元素周期表揭示元素周期律。 3.知道金属元素、非金属元素在元素周期表中的位置,用变化的观点认识 元素性质的递变规律。 4.了解ⅡA族、ⅤA族和过渡元素的某些性质和用途,培养科学态度与社会 责任的化学核心素养。
【素能应用】 例1已知A、B是元素周期表中同主族相邻的两种元素,A、B所在周期分别 有a、b种元素。若A的原子序数为x,则B的原子序数可能为( ) ①x+a ②x-a ③x+b ④x-b A.仅①③ B.仅①④ C.仅②③ D.①②③④ 答案 D 解析 以ⅦA族的元素F、Cl、Br、I、At为例进行分析,它们的原子序数分 别为9、17、35、53、85,所在周期元素种数分别为8、8、18、18、32。 如9号为氟元素,9+8=17号为氯元素,即①x+a正确;如17号为氯元素,17-8=9 号为氟元素,即②x-a正确;同理③、④都正确。
2018-2019版化学课堂导练必修二鲁科版试题:1.2.1 元素周期律 Word版含解析
第2节元素周期律和元素周期表第1课时元素周期律课后篇巩固提升A组1.下列关于元素周期表的说法中,不正确的是()A.周期表中的副族、Ⅷ族都是金属元素B.周期表中的ⅡA族都是金属元素C.周期表中的非金属元素都位于短周期0族元素都是非金属元素解析长周期中的第4周期的As、Br等元素都是非金属元素,C项错误。
答案C2.下列关于同一种元素的原子或离子叙述正确的是()A.原子半径比阴离子半径小B.原子半径比阴离子半径大C.原子半径比阳离子半径小解析同一元素的阴离子半径大于原子半径,如r(Cl-)>r(Cl),A项正确,B项错误;同一元素的原子半径大于阳离子半径,如r(Na)>r(Na+),C项错误;带正电荷少的阳离子半径大于带正电荷多的阳离子半径,如r(Fe2+)>r(Fe3+),D项错误。
答案A3.下列各组元素中,按最高正化合价递增顺序排列的是()A.C、N、FB.Na、Mg、Al、Br D.P、Cl、S解析各元素原子的最外层电子数等于其最高正化合价数,注意氟元素无正价。
答案B4.下列各组微粒半径之比大于1的是()A. B. C. D.解析A项中,r(Na+)<r(Na);B项中,r(Mg)<r(Na);C项中,r(Cl)<r(P),只有D项符合题意。
答案D5.原子序数从3~10的元素,随着核电荷数的递增而逐渐增大的是()B.电子数C.原子半径D.化合价解析原子序数从3~10的元素,原子的电子层数都为两层,A错误;除了10号稀有气体元素原子外,从3~9号元素原子的核电荷数越大,原子半径越小,C错误;因氧无最高正价、氟无正价,D 错误。
答案B6.下列关于元素周期律的叙述正确的是()A.随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现B.元素的性质随着原子序数的递增而呈周期性变化C.随着元素原子序数的递增,元素的最高正价从+1到+7,负价从-7到-1重复出现D.元素性质的周期性变化是元素原子半径周期性变化的必然结果解析从第二周期开始,随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现,而在第一周期,随着元素原子序数的递增,原子最外层电子数是从1到2,故A错误;元素周期律的内容:元素的性质随着原子序数的递增而呈周期性变化,故B正确;元素的最低负价是-4价,最高正价是+7价,随着元素原子序数的递增,一般情况下元素的最高正价从+1到+7,负价从-4到-1重复出现,故C错误;元素性质的周期性变化是元素原子核外电子排布周期性变化的必然结果,故D错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第2课时 元素周期表 [课标要求] 1.认识元素周期表的结构以及周期、族等的概念,理解原子结构与元素在周期表中位置的关系。 2.了解ⅡA、ⅤA族和过渡金属元素的某些性质和用途。
1.元素周期表的结构“七横(行)十八纵(列)”。 2.横行叫周期,现有一至七,三长三个短,第7尚不满。 3.纵列称作族,共有十六族,一纵一个族,Ⅷ族搞特殊,三列算一族,占去8、9、10。 4.主族序数=最外层电子数=最高正价(O、F除外),周期序数=电子层数。
元素周期表的结构 1.元素周期表与元素信息
2.元素周期表的编排原则
3.元素周期表的结构 (1)周期(7个横行,7个周期) 短周期 长周期 序号 1 2 3 4 5 6 7
元素种数 2 8 8 18 18 32 32
0族元素原子序数 2 10 18 36 54 86 118
(2)族(18个纵行,16个族) 主族 列 1 2 13 14 15 16 17 族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 副族 列 3 4 5 6 7 11 12
族 ⅢB ⅣB ⅤB ⅥB ⅦB ⅠB ⅡB Ⅷ族 第8、9、10,共3个纵行 0族 第18纵行 4.元素周期表中元素的分区
(1)分界线:如上图所示,沿着元素周期表中铝、锗、锑、钋与硼、硅、砷、碲、砹的交界处画一条虚线,即为金属元素区和非金属元素区分界线(氢元素除外)。 (2)各区位置:分界线左下方为金属元素区,分界线右上方为非金属元素区。 (3)分界线附近元素的性质:既表现金属元素的性质,又表现非金属元素的性质。
1.判断正误(正确的打“√”,错误的打“×”)。 (1)元素周期表中共有18个纵行,16个族(√) (2)同主族元素的最外层电子数一定相同(√) (3)元素周期表中位于金属与非金属分界线附近的元素属于过渡元素(×) (4)ⅠA族全部是金属元素(×) (5)元素周期表中镧系元素和锕系元素都占据同一格,它们是同位素(×) (6)某元素原子的核电荷数为53,则该元素位于第5周期ⅦA族(√) 2.结合下图所示元素周期表,回答下列问题:
(1)表中所列元素,属于短周期元素的有______________(填字母,下同),属于主族元素的有________________; g元素位于第________周期第________族,i元素位于第________周期第________族。 (2)f元素位于第________周期第________族,请按氦元素的式样 写出该元素的原子序数、元素符号、元素名称、相对原子质量。 解析:(1)周期表共有18个纵行,16个族,从左到右依次为ⅠA、 ⅡA、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ、ⅠB、ⅡB、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA和0族。 (2)f元素位于第三行,第16列,则为第3周期第ⅥA族的硫元素,原子序数为16,相对原子质量为32。 答案:(1)a、b、c、d、e、f、g a、b、c、d、e、f 3 0 4 ⅡB
(2)3 ⅥA 元素周期表中的部分重要元素和焰色反应
1.碱土金属——ⅡA族元素 元素名称 铍 镁 钙 锶 钡 镭 元素符号 Be Mg Ca Sr Ba Ra
原子 结构 电子层数 2 3 4 5 6 7 最外层电子数均是2个 焰色 - - 砖红 洋红 黄绿 - 存在形态 都是化合态 物理性质 单质都呈银白色,而且具有良好的导电性 化学性质 单质呈强还原性,易失去最外层上的两个电子 用途 钙、锶、钡的化合物可用于制造焰火 2.氮族元素——ⅤA族元素 (1)氮族元素:包括氮、磷、砷、锑、铋等元素。其中,氮和磷是典型的非金属元素。 (2)磷的存在形态:自然界中没有游离态的磷元素。磷元素主要以磷酸盐的形式存在于矿石中,动物的骨骼、牙齿、脊髓和神经组织以及植物的果实和幼芽里也含有磷元素。磷是维持生物体正常生理活动的重要元素。 3.过渡元素 元素周期表中的第3~12列元素称为过渡元素。 (1)过渡元素包括大部分金属元素。 (2)过渡元素包括所有副族和第Ⅷ族元素,不包括主族和0族元素。 (3)过渡金属的主要性质 ①大部分单质坚硬、有光泽,金、铜等单质具有独特的色泽。 ②所有单质都是电的良导体。 ③多数单质性质稳定,与空气和水反应缓慢或根本不能反应。 4.焰色反应 某些金属或它们的化合物在灼烧时火焰呈现特征颜色的反应,如钠:黄色,钾:浅紫色。 [特别提醒] (1)同主族元素原子最外层电子数相同,化学性质相似。 (2)同主族元素原子从上到下电子层数增多,化学性质呈现递变性。
1.下列关于ⅡA族元素的说法中,不正确的是( ) A.元素的主要化合价都是+2价 B.元素的单质都呈亮白色 C.有的元素的单质可在自然界中稳定存在 D.其中包括被誉为“国防金属”的元素 解析:选C ⅡA族元素的原子最外层都有2个电子,这部分电子容易失去,因此ⅡA族元素的主要化合价都是+2价;ⅡA族元素都是金属元素,都呈亮白色;元素原子的失电子能力较强,单质的性质活泼,在自然界中都以化合态存在;镁的合金大量用于制造飞机、导弹等的材料,因此被誉为“国防金属”,镁元素位于元素周期表的第3周期ⅡA族。 2.下列不属于过渡元素的通性的是( ) A.单质具有还原性 B.单质比较稳定,有的不能与空气和水反应 C.单质都有良好的导电性 D.单质都有很低的熔点和较小的硬度 解析:选D 在过渡元素的单质中,只有汞在常温常压下呈液态,其他的都有较高(或很高)的熔点,较大(或很大)的硬度。 3.用光洁的铂丝蘸取某无色溶液在无色火焰上灼烧,直接观察到火焰呈黄色,下列各判断正确的是( ) A.只含有Na+ B.一定含有Na+,可能含有K+ C.既含有Na+,又含有K+ D.可能含有Na+,可能还含有K+ 解析:选B Na元素的焰色为黄色,而K元素的焰色为浅紫色(透过蓝色钴玻璃观察),如果直接观察则黄色会干扰浅紫色,无法判断是否含有K元素,所以答案为B项。
原子序数与元素在周期表中的位置的推导
1.元素的原子序数的推导 (1)用稀有气体元素的原子序数作参数推算原子序数的方法 ①ⅠA、ⅡA族的第n周期元素的原子序数=第(n-1)周期稀有气体元素的原子序数+主族序数。 ②ⅢA~ⅦA族的第n周期元素的原子序数=第n周期稀有气体元素的原子序数+主族序数-8。 (2)用各周期元素的种数作参数推算原子序数的方法 ①ⅠA、ⅡA族的第n周期元素的原子序数=相邻的第(n-1)周期同族元素的原子序数+第(n-1)周期元素的种类数。 ②ⅢA~ⅦA族的第n周期元素的原子序数=相邻的第(n-1)周期同族元素的原子序数+第n周期元素的种类数。 2.元素在周期表中位置的推导 (1)由原子序数推导 ①如果原子序数较小,可先画出该元素的原子结构示意图,依据结构与位置的对应关系来确定它在元素周期表中的位置。 ②如果原子序数较大,画原子结构示意图不方便,可根据与该原子原子序数最接近的稀有气体元素的原子序数,然后左移或到下一周期右移,确定该元素的位置。 (2)根据离子的电子层结构推导
如:若A-与氖原子具有相同的电子层结构,A元素必和氖在同一周期,且比氖少一个电子,则A元素位于第2周期ⅦA族,名称为氟。
1.已知X、Y、Z三种主族元素在元素周期表中的相对位置如图所示,且X的原子序数为a。下列说法不正确的是( ) Y X Z A.Y、Z的原子序数之和可能为2a B.Y的原子序数可能是a-17 C.Z的原子序数可能是a+31 D.X、Y、Z一定都是短周期元素 解析:选D Y、X、Z三种元素在元素周期表中的具体位置是不确定的。若三种元素分别位于第1、2、3周期,则Y的原子序数为a-8+1=a-7,Z的原子序数为a+8-1=a+7,则Y、Z的原子序数之和为2a;若三种元素分别位于第2、3、4周期,则Y的原子序数为a-8+1=a-7,Z的原子序数为a+18-1=a+17;若三种元素分别位于第3、4、5周期,则Y的原子序数为 a-18+1=a-17,Z的原子序数为a+18-1=a+17,则Y、Z的原子序数之和为2a;若三种元素分别位于第4、5、6周期,则Y的原子序数为a-18+1=a-17,Z的原子序数为a+32-1=a+31。综上分析可知,只有D项说法不正确。 2.M2+有2个电子层,则M在元素周期表中的位置是( ) A.第2周期零族 B.第2周期Ⅷ族 C.第2周期ⅡA族 D.第3周期ⅡA族
解析:选D M2+有2个电子层,M原子结构示意图为 ,由电子层数=周期 序数,最外层电子数=主族序数可知,M元素位于第3周期ⅡA族。 [三级训练·节节过关]
1.在元素周期表中,铂的表示如图所示,下列对图示解读正确的是( )
A.铂是非金属元素,在常温下呈固态 B.“78”是铂的原子序数 C.“195.1”是铂的质量数 D.铂的名称为Pt 解析:选B 铂为金属元素,A错;“78”是铂原子的质子数即铂的原子序数,B正确;“195.1”是铂的相对原子质量,C错;Pt是铂的元素符号,D错。 2.下列关于元素周期表的叙述正确的是( ) A.周期表是按各元素的相对原子质量递增的顺序从左到右排列的 B.同族元素的最外层电子数一定相同 C.同周期元素的电子层数相同 D.每一周期的元素都是从碱金属开始,以稀有气体结束 解析:选C 周期表是按各元素的原子序数从小到大的顺序排列的,A项错误;同主族元素的最外层电子数不一定相同,如对于0族元素而言,最外层电子数则可能是2、8,B项错误;在元素周期表中,同一周期必然具有相同的电子层数,C项正确;第一周期起始元素为氢,为非金属,D项错误。 3.若某ⅡB族原子序数为x,那么原子序数为x+1的元素位于( ) A.ⅢB族 B.ⅢA族 C.ⅠB族 D.ⅠA族 解析:选B 据元素周期表结构可知第ⅡB族右侧紧邻第ⅢA族。
