环氧化合物和大环多醚环氧化合物
环氧化合物及其在胶原改性中的应用1【WORD可复制可编辑】

环氧化合物及其在胶原改性中的应用1但年华1,3,但卫华1 **,曾睿2,米贞建3, 林海1,陈驰1,曲健健1,叶易春1,关林波11. 皮革化学与工程教育部重点实验室(四川大学),成都,610065;2.四川大学轻纺与食品学院,成都,610065; 3.成都佰乐金生物科技有限公司,成都,610065;联系人:但卫华,教授,博导,Tel*************,E-mail:***************摘 要:本文讨论了环氧化合物的化学性质与合成方法,阐述了它与胶原的氨基、羧基、羟基以及其它基团的相互作用机理与反应影响因素,归纳了环氧化合物的种类与结构对胶 原的改性效果的影响,特别强调了环氧化合物在医用生物材料方面的应用特点和应用性 能。
关键词:环氧化合物;胶原;改性;应用1.引言胶原是组成结缔结织的主要结构蛋白,在哺乳动物中约占总蛋白质的 1/3,广泛存在于 动物皮肤、骨、软骨、肌腱、韧带和血管壁等之中。
胶原具有低的免疫原性、低刺激性、低 细胞毒性、良好的生物相容性、良好的促进细胞生长的性能以及生物可降解性等诸多优点, 在生物医学领域应用日益广泛。
然而,未经改性的胶原在体内降解过快,难以与目标组织的 生长相匹配。
通过物理、化学方法对胶原进行改性,有利于降低抗原性,增加物理机械性能, 降低生物降解性,从而有效提高其使用性能[1-2]。
环氧化合物(Epoxy Compound ,EC )是常 用的化学改性剂之一[3],能与胶原中的氨基、羧基等发生单点、双点或多点结合,从而改善 胶原的性能。
迄今为止,EC 已用于心脏瓣膜、心包、血管、韧带、肌腱、真皮等的改性 [4-7]。
2.环氧基(epoxy group )与环氧化合物[8]环氧基是由两个碳原子和一个氧原子组成的三元环,处于同一平面上,有共振性。
由于 氧的电负性比碳大,静电极化使氧原子周围电子云密度增加,从而形成电子云密度较高的氧 原子和电子云密度较低的碳原子两个可反应的活性中心,因此,容易受到亲核试剂和亲电试 剂的进攻。
有机化学第8章第三节醚2013
二巯基丙醇(BAL)
CH2 CH CH2 SH SH SO3Na
二巯基丙磺酸钠
HS HC CO2Na HS HC CO2Na
二巯基丁二酸钠
上述解毒剂与金属离子的亲和力较强,它们不仅能 与进入体内的重金属离子结合成不易解离的无毒配合物 由尿排出体外,以保护酶系统,而且还能夺取已经与酶 结合的重金属离子,使酶的活性恢复,从而达到解毒的 目的。但若酶的巯基与重金属离子结合过久,酶的活性 则难以恢复,故重金属中毒需尽早用药抢救。
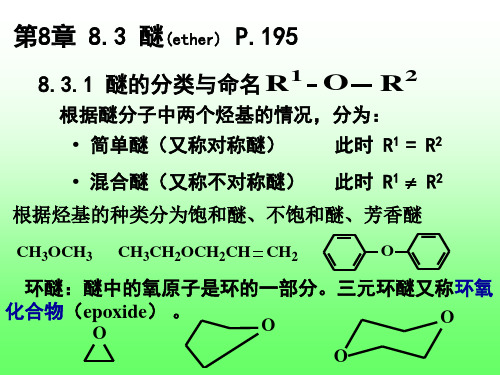
第8章 8.3 醚(ether) P.195
1 O R 8.3.1 醚的分类与命名
R2
根据醚分子中两个烃基的情况,分为:
• 简单醚(又称对称醚) 此时 R1 = R2
• 混合醚(又称不对称醚)
此时 R1 R2
根据烃基的种类分为饱和醚、不饱和醚、芳香醚
CH3OCH3 CH3CH2OCH2CH CH2 O
CH3CH2OCH2CH3 + O2
CH3CHOCH2CH3 O OH
形成的过氧化物遇热容易爆炸,所以储存时间长的醚在 使用前必须进行检查,若会使湿的KI-淀粉试纸变蓝或使 FeSO4-KCNS 混合液变红,则表明醚中含有过氧化物。 加铁粉或用FeSO4水溶液洗涤,可破坏其中的过氧化物。
8.3.3 醚的制备
1)酸性
RSH + NaOH
RSNa + H2O
C2H5SH > H2O >C2H5OH pKa 10.5 15.7 15.9
2).与重金属作用
与无机硫化物类似,硫醇可与 Pb、 Hg 、Cd、 Ag 、Cu 等重金属盐或氧化物作用生成不溶于水 的硫醇盐。
有机化学醚

3oROH不能制得醚,而只能得到烯烃。
二、 Williamson 合成法(混醚)
RONa ArONa
+ +
R'X RX
SN2
ROR' Ar-O-R
+ +
NaX NaX
12
SN2
例:
CH3CH2CH2CH2O—Na + I—CH2CH3 CH3CH2CH2CH2OC2H5 71%
(CH3)2CHO—Na + Cl—CH2-C6H5
(CH3)2CH—O—CH2-C6H5 84%
(CH3)2SO4 ONa +
或
O—CH3
CH3—I
13
由于该反应是SN2反应,为尽量减少E2消除,卤代 烷部分尽可能避免采用仲卤代烷和叔卤代烷。例:
CH3 CH3—C—ONa + BrCH2CH3 SN2 CH3 CH3 CH3—C—O—C2H5 CH3
R R O + BF3
气态 bp:-1010C
R O + RMgX R X
R R O BF3
溶液
R R O Mg O R
R 2 R
如:格氏试剂在金属镁的表面生成,与醚形成络合物 后脱离金属镁的表面进入溶液,使得格氏试剂的制备 得以进行。
16
二、醚键断裂的反应
醚与浓的HCl、HBr、HI作用,醚键可发生断裂。 HX的反应活性:HI > HBr > HCl 醚键断裂的顺序:30烷基>20烷基>10烷基>芳烃基 1、 若两个是10烷基则发生SN2,小烃基生成碘代烷, 大烃基生成醇。若氢碘酸过量则均生成碘代烷。
OCH2CH3
间乙氧基苯酚
4
(完整版)环氧树脂种类及性能

环氧树脂种类及性能一、定义1、环氧树脂( Epoxy Resin )是泛指含有两个或两个以上环氧基,以脂肪族、脂环族或芬芳族等有机化合物为骨架并能经过环氧基团反响形成实用的热固化产物的高分子低聚体(Oligomer )。
当聚合度 n 为零时,称之为环氧化合物,简称环氧化物( Epoxide )。
这些低相对分子质量树脂虽不完整知足严格的定义但因拥有环氧树脂的基本属性在称号时也不加差别地统称为环氧树脂。
典型的环氧树脂构造以下式。
2、环氧基是环氧树脂的特征基团,它的含量多少是这种树脂最为重要的指标。
描绘环氧基含量有以下几种不一样的表示法:⑴环氧当量:是指含有 1 mol环氧树脂的质量,低相对分子质量(分子量)环氧树脂的环氧当量为 175~200 , 跟着分子量的增大环氧基间的链段越长,所以高分子量环氧树脂的环氧当量就相应的高。
⑵环氧值:每 100g 树脂中所含有环氧基的物质的量(摩尔)。
这种表示方法有益于固化剂用量的计量和用量的表示。
因为固化剂用量的含义是每 100g 环氧树脂中固化剂的加入量(p art perhundred of resin 缩写成 phr )。
我国采纳环氧值这一物理量。
环氧当量 =100/ 环氧值3、粘度的定义粘度:液体在流动时,在其分子间产生的内摩擦的性质,称为液体的黏性,黏性的大小用黏度表示,是用来表征液体性质有关的阻力因子。
粘度单位有两种:1、厘泊 (cps) 2、毫帕秒(m· pas)1厘泊( cps ) = 1 毫帕秒( m· pas)二、种类及性能1、双酚 A 型环氧树脂:双酚A(即二酚基丙烷)型环氧树脂即二酚基丙烷缩水甘油醚。
在环氧树脂中它的原资料易得、成本最低,因此产量最大(在我国约占环氧树脂总产量的 90%,在世界约占环氧树脂总产量的75%~ 80%),用途最广,被称为通用型环氧树脂。
由双酚 A 型环氧树脂的分子结构决定了它的性能拥有以下特色:⑴ 是热塑性树脂,但拥有热固性,能与多种固化剂,催化剂及增添剂形成多种性能优秀的固化物,几乎能知足各样使用需求。
环氧化合物的环开反应机理与催化剂设计

环氧化合物的环开反应机理与催化剂设计环氧化合物是一类重要的有机化合物,具有广泛的应用领域。
环开反应是环氧化合物的一种重要转化方式,可以将环氧化合物转化为醇、醚、胺等有机化合物,具有重要的合成意义。
本文将探讨环氧化合物的环开反应机理与催化剂设计。
环开反应是指环氧化合物中的环氧环被打开,形成新的化学键。
这种反应可以通过酸、碱、金属离子等催化剂的作用来实现。
在环开反应中,环氧化合物的环被打开后,产生的中间体可以进一步与其他化合物发生反应,形成新的化学键。
环开反应的机理主要包括两个步骤:环氧环的断裂和中间体的重排。
在环氧环的断裂步骤中,催化剂可以通过提供酸性或碱性环境来促进环氧环的断裂。
酸催化的环开反应中,催化剂提供质子,使环氧环中的氧原子带正电荷,从而使环氧环的C-O键断裂。
碱催化的环开反应中,催化剂提供氢氧根离子,使环氧环中的氧原子带负电荷,从而使环氧环的C-O键断裂。
在环氧环的断裂后,产生的中间体可以通过重排反应进一步转化为醇、醚、胺等有机化合物。
催化剂的设计对环开反应的效率和选择性起着重要作用。
催化剂的选择应考虑反应条件、底物特性和所需产物。
常用的酸催化剂包括硫酸、磷酸等,而碱催化剂则包括氢氧化钠、氢氧化钾等。
此外,金属离子也可以作为催化剂参与环开反应。
金属离子可以通过与环氧环中的氧原子形成配位键,从而促进环氧环的断裂。
催化剂的设计还可以通过改变其结构和活性位点来提高环开反应的效率和选择性。
例如,引入酸性或碱性基团可以增强催化剂的酸碱性质,从而提高环开反应的速率和选择性。
此外,调控催化剂的孔道结构和表面性质也可以改善反应效果。
例如,调节催化剂的孔径大小可以控制底物的吸附和扩散,从而提高反应效率。
此外,改变催化剂的表面活性位点也可以调控反应的选择性。
总之,环开反应是一种重要的有机合成反应,可以将环氧化合物转化为醇、醚、胺等有机化合物。
环开反应的机理包括环氧环的断裂和中间体的重排。
催化剂的选择和设计对环开反应的效率和选择性起着重要作用。
(整理)环氧树脂的一般概念-类型-合成-活性-反应

环氧树脂的一般概念—类型、合成、命名、活性、各种反应环氧树脂的类型环氧树脂的种类很多,并且不断有新品种出现。
环氧树脂的分类方法也很多。
通常按其化学结构和环氧基的结合方式大体上分为五大业。
这种分类方法有利于了解和掌握环氧树脂在固化过程中的行为和固化物的性能。
(1)缩水甘油醚类,(2)缩水甘油酯类,(3)缩水甘油胺类,(4)脂肪族环氧化合物,(5)脂环族环氧化合物。
此外,还有混合型环氧树脂,即分子结构中同时具有两种不同类型环氧基的化合物。
例如:TDE—85环氧树,AFG-90环氧树脂。
也可以按官能团(环氧基)的数量分为双官能团环氧树脂和多官能团环氧树脂。
对反应性树脂而言,官能团数的影响是非常重要的。
还可以按室温下树脂的状态分为液态环氧树脂和固态环氧树脂。
这在实际使用时很重要。
液态树脂可用作浇注料、无溶剂胶粘剂和涂料等。
固态树脂可用于粉末涂料和固态成型材料等。
这里所说的固态环氧树脂不是己达到,b阶段的环氧树脂固化体系,也不是达到C阶段的环氧树脂固化物(已固化的树脂),而是相对分子质量较大的单纯的环氧树脂,是一种热塑性的固态低聚物。
环氧树脂的合成方法环氧树脂的合成主要有两类方法:(1)多元酚、多元醇、多元酸或多元胺等含活泼氢原子的化合物与环氧氯丙烷等含环氧基的化合物经缩聚而得。
(2)链状或环状双烯类化合物的双键与过氧酸经环氧化而成。
注:树脂化学组分用两位阿拉伯数字表示,如“1”类树脂写作“01”,“10”类树脂写作“10”。
对由两类不同化学组分组成的树脂混合物,可用符号“00”表示。
注:①如果使用多种添加剂或规定有多种特征标示,应标出最主要的一种。
②全面评定材料的燃烧性,至少需要测定燃烧性、引火性、放出热量、释放的有毒气体和烟密度等性能。
(3)命名举例。
例1-某种环氧树脂(EP),化学组分为脂肪族缩水甘油醚(03),教度为l-5Pa·s(3),环氧当量为291-525g/mol(6),不含改性剂(1),密度为1.15-1.19 g/cm3(3),未规定添加剂(0)和特征(o),其名称为EP0336l-300。
环氧基反应

环氧基反应环氧基反应是一种常见的有机反应,在有机合成中具有广泛的应用。
本文将介绍环氧基反应的基本原理、反应机理、应用领域以及一些典型的环氧基反应。
环氧基反应是指环氧化合物(环氧环)与其他化合物发生反应,使环氧环打开,并形成新的化学键。
环氧化合物是一类具有环氧环结构的有机化合物,通常由醇或醚类化合物经过环氧化反应得到。
环氧基反应包括环氧环的开环反应和环氧环的环化反应两种类型。
环氧基反应的机理较为复杂,但可以总结为以下几个步骤:1、环氧环的开环:环氧环中的氧原子受到亲核试剂的攻击,打开环氧环形成一个负离子中间体;2、中间体的重排:负离子中间体发生重排,重新排列化学键,形成新的化合物;3、中间体的消除:负离子中间体失去一个质子或其他离子,形成最终的产物。
环氧基反应在有机合成中具有广泛的应用。
首先,环氧基反应可以用于合成具有特殊结构和功能的化合物。
通过选择不同的亲核试剂和溶剂,可以合成不同的产物。
例如,环氧基反应可以用于合成含有羟基或胺基的化合物,这些化合物在药物研发和生物医学领域具有重要的应用价值。
环氧基反应也可以用于合成具有环结构的化合物。
环结构化合物在天然产物合成和材料科学中具有重要的地位。
通过环氧基反应,可以将直链化合物转化为环状化合物,从而获得具有特殊性质的产物。
例如,环氧基反应可以用于合成环状聚合物,这些聚合物在材料科学中具有广泛的应用。
环氧基反应还可以用于合成含有官能团的化合物。
官能团是化学物质中具有特定化学性质和反应性的基团。
通过环氧基反应,可以将环氧环转化为其他官能团,从而扩展化合物的化学性质和反应性。
例如,环氧基反应可以用于合成含有羰基、羧基或烯基的化合物,这些化合物在有机合成和材料科学中具有重要的应用。
除了上述应用之外,环氧基反应还有其他一些重要的应用领域。
例如,环氧基反应可以用于合成聚合物,从而获得具有特殊性质的高分子材料。
环氧基反应还可以用于药物研发、农药合成和染料合成等领域。
醚(ethers)和环氧化和物

第八章醚(ethers)和环氧化和物(epoxides)醚是两个烃基通过氧原子连接起来的化合物,环氧化合物多指含有三元环的醚及其衍生物。
最简单的环氧化合物—环氧乙烷为高效灭菌剂,临床上用做医疗器械消毒。
第一节醚一、醚的结构和命名醚结构中氧原子为sp3杂化,键角为1100。
醚结构中与氧原子相连的两个烃基相同的称为单醚,两个烃基不同的称为混醚。
两个烃基中有一个或两个是芳香烃基的为芳香醚(aromatic ether)。
氧原子与碳原子结合成环状化合物,通常称为环醚(cyclic ether)。
对于单醚的命名是在烃基名称后面加“醚”字,混醚命名时,两个烃基的名称都要写出来,较小的烃基其名称放于较大烃基名称前面,芳香烃基放在脂肪烃基前面。
单醚:混醚:对于结构复杂的醚:2-甲氧基戊烷HO-CH2CH2-OC2H52-乙氧基乙醇二、醚的物理性质常温下,甲醚和甲乙醚是气体,其它多数醚在室温下为无色液体,有特殊气味。
低级醚易挥发,所形成的蒸气易燃,使用时注意安全。
液体醚的沸点较同分子量的醇低,与相应的烷烃接近。
三、醚的化学性质醚是一类很不活泼的化合物(环氧乙烷除外)。
它对氧化剂、还原剂和强碱、稀酸或活泼金属都极稳定。
但是在强酸条件下,醚可发生特有的反应。
1、醚的质子化:佯盐的生成醚键上的氧原子有未共电子对,能接受强酸中的质子(H+),以配位键的形式结合生成佯盐。
佯盐不稳定,遇水分解,恢复为原来的醚。
利用醚能溶于冷的强酸,而烷烃或卤代烃与冷的强酸不反应,可区别醚与烷烃或卤代烃。
2、醚键的断裂在加热条件下,醚与氢碘酸反应使醚键断裂。
醚键的断裂有两种方式,通常是含碳原子数较少的烷基形成碘代物。
若是芳香烃基烷基醚与氢碘酸作用,总是烷氧基断裂,生成酚和碘代烷。
伯、仲烷基醚(SN2)烷基苯基醚3、过氧化物的生成醚在空气中久置,α-H易被氧化,生成醚的过氧化物。
过氧化物不稳定,受热易分解而发生爆炸。
蒸馏醚时不可蒸干,以防止爆炸。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
环氧乙烷常见的开环反应
1. 不对称环氧化合物在酸性条件下的开环反应
2. 不对称环氧化合物的碱性条件下开环反应
3. 环氧化合物与氢化锂铝的反应
H CH3
H
H + LiAlH4
O
4 (CH3)2CHOH + LiAlO2
8.3 醚的制备
Preparations of Ethers
一、威廉森(Williamson)合成法
5 43 2 1
O
② 冠醚:含有多个氧的大环醚(Cyclic polyether)
14
15 16 O
17 18
1213O
O1 2
1110O
O4 3
9
8
O 7
6
5
命名一:总原子数 + 冠 + 氧原子数
(对称)二苯并-18-冠-6
命名二:按含杂环的系统命名法命名:
2,3,11,12-二苯并-1,4,7,10,13,16-六氧杂环十八烷
CH3
HI
CH3 C O CH3
CH3
SN1 CH3OH + CH3
CH3 H CH3 C O CH3
CH3
CH3 I-
CH3
C
CH3 C I
CH3
CH3
醚的结构不同,机理不同。
环醚的反应
+ HBr
BrCH2CH2CH2CH2OH
O
HBr
BrCH2CH2CH2CH2Br
+ HCl ZnCl2 ClCH2CH2CH2CH2OH
O
HCl, ZnCl2 ClCH2CH2CH2CH2Cl
醚的反应规律(掌握)
(1) 卤化氢的反应性能:HI>HBr>HCl (浓) (2) 混合醚反应时,碳氧键断裂的顺序:
3o烷基> 2o烷基> 1o烷基>甲基>芳基。
(3)若两边连的是两个伯烷基,一般发生SN2, 小烃基生成碘代烷,大烃基生成醇,若氢碘酸 过量,大烃基也生成碘代烷。
+ ICH2CH3
烷基烯基醚,总是烷基断裂生成碘代烷。
C6H5C CH2 OCH 3
H2O , H pH= 4
O
C6H5CCH 3 +
CH 3OH
(6)对于苄基醚,催化加氢后生成甲苯。
CH 2OCH 2CH3 H2 , Pd
CH 3
+ CH 3CH 2OH
四、过氧化物的生成
CH3CH2OCH 2CH3 O2 CH 3CH OCH 2CH 3 OOH
1. 脂肪醚的合成
为伯卤代烷
RO-Na+ + R'—X
ROR' + NaX
2. 芳香醚的合成
Williamson合成法应用——制备混合醚 例1:以叔丁醇和甲醇为原料合成
CH3 CH3 C OCH3
CH3
例2:以4C以下原料合成
CH3
CH3CH2CHOCH 2CH3
例3:从4C或4C以下原料合成
CH3
CH3CH2OCH2CH3
乙醚
CH3 O C CH3 CH3
甲基叔丁基醚
OCH2CH3
苯乙醚
CH3 OCH2CH CH2
甲基烯丙基醚
OCH2CH CH2 苯烯丙醚
O 环戊基苯基醚
② 系统命名法:把醚看成是烃的烷氧衍生物, 取较长的烃基做母体
2-乙氧基戊烷 1,2-二甲氧基乙烷
1,4-二甲氧基苯
CH3
CH3 C OCH2CH2Br
CH3
O
Mg
CH3
1. HCH
CH3 C OCH2CH2MgBr
CH3
2. H3O
CH3
CH3 C OCH2CH2CH2OH CH3
H2SO4
HOCH2CH2CH2OH + H3C C CH2
H3C
(5) 若是芳醚,总是生成酚和碘代烷。
OCH2CH3 HI
OH
CH3 CH3CH2CH2COCH 2CH
CH3
CH2
3. 环氧化合物的合成
HOCH2CH2CH2CH2Cl RONa
分子内SN2 -Cl-
O
O- Cl
Cl
+ HOCl OH
NaOH
Cl
分子内SN2
O-
O
注意:
HO
Cl OH
H
NaOH E2
O
二、醇脱水
两分子醇在硫酸催化下脱水制备单醚。
CH2 CH2
8.1 结构、命名和物理性质
(Structure, Nomenclature of Ethers)
一、醚的结构特征
二、分类、命名和物理性质
1. 分类与命名 (1) 无环醚
根据烃基结构可分为饱和醚、不饱和醚
和芳醚。 ① 普通命名法:两个烃基名+醚(Ether) 两个烃基名中文按次序规则,英文按字母排列
H
CH2 CH2
H2O
Байду номын сангаас
THF
OH OH
O
原则上讲,醇在浓H2SO4作用下只可以制得 对称的醚。
实际合成中: 1o ROH制醚产率好; 2o ROH 制醚产率不好; 3o ROH无法分离得到醚,如果蒸馏,最后 得到烯。
2. 醚的物理性质
多数醚不溶于水。四氢呋喃和1,4-二氧六
环因氧原子裸露在外面,可以和水形成氢键, 而能与水混溶。
沸点比同碳原子数的醇低得多。
8.2 醚的反应
Reactions of Ethers
一、
定义:氧提供未共用电子对与其他原子或
基团结合成的物质。
一级Yang盐:RO+H2; 二级Yang盐:R2O+H; 三级Yang盐:R3O+。
(2)环醚
环醚包括:环氧化合物和大环多醚
① 环氧化合物: (Epoxides oxiranes)
环氧乙烷 环氧丙烷
1,3-环氧丙烷
CH2 CH CH2Cl O
环氧氯丙烷
O 四氢呋喃
23 1O O 4
65
CH3
1,4-二氧杂环己烷 (1,4-二氧六环) (二噁烷)
CH2-CCH2CH=CH2 4-甲基- 4,5-环氧-1-戊烯
过氧化物
过氧化物是自动氧化形成的。
生成过氧化物的反应机理:多数自动氧化是 通过自由基机理进行的。
化学物质和空气中的氧在常温下温和地进行 氧化,而不发生燃烧和爆炸,这种反应称为自 动氧化。
烯丙位、苯甲位、3oH、醚-位上的H均易 在C-H之间发生自动氧化。
五、环氧化合物的 开环反应
(4) 若一边连的是伯烷基另一边连的是叔烷 基,发生SN1,叔烷基生成碘代烷,伯烷基 生成醇。
例:
+ HI (1mol)
O
OH I
应用:叔丁基醚比较活泼,用硫酸可使醚 键断裂,常用叔丁基保护羟基。
例: HOCH2CH2Br
HOCH 2CH2CH2OH
HOCH2CH2Br
(CH3)2C CH2 H2SO4
二、醚的碳氧键断裂反应及反应规律
氢碘酸引起醚键断裂容易,氢溴酸和盐酸, 在条件非常剧烈时才能使醚键断裂。
CH3OCH3 + HI(1mol)
CH3I + CH3OH
SN2
-+ I + CH3-HO-CH3
SN2
HI
CH3OCH2CH2CH3
SN2
CH3I + HOCH2CH2CH3
HI
ICH2CH2CH3
