有机。第十章醚和环氧化合物
第十章_醚和环氧化合物

H2SO4 170 C
2 CH 2=CH 2 + 2H2O
2CH3CH2OH
H2SO4 140 C
CH3CH2-O-CH2CH3 + H2O
反应特点: 分子间脱水的温度低于分子内脱水; 反应特点:1) 分子间脱水的温度低于分子内脱水; 2) 此法伯醇收率高(SN2机理)。 机理)。 此法伯醇收率高( 机理
环醚一般称为环氧某烃,或氧杂环某烷 环醚一般称为环氧某烃,或氧杂环某烷:
CH2 CH2 CH3 CH CH2 O O
环氧乙烷 1,2-环氧丙烷
CH2 CH CH2 O Cl
3-氯-1,2-环氧丙烷
和环氧化合物的结构 二. 醚和环氧化合物的结构
醚的结构
R-O-R(R’);Ar-O-R或Ar-O-Ar(Ar’) - - ; - - 或 - - ( )
3
CH3OH Protecting group C H
C BrCH2CH2CH2O C H
3
C H
BrCH2CH2CH2OH + CH3 C M g D O
2
2
H 2 S O
4
C H C H
3
3
E t h e r
C C H
3
C H
DCH2CH2CH2O
3
H2 S O
4
C H
3
C H
DCH2CH2CH2OH + CH3-C
冷浓H2SO4
乙醚溶解,呈一相 戊烷不溶解,分层
盐用冰水稀释,则又分解而析出醚。
2、醚中碳氧键的断裂 、
CH3CH2CH2OCH3 HI H CH3CH2CH2OCH3
I
第十章 醚和环氧化合物(修改)

O
O
4.命名
普通命名法: 甲醚 ; 甲乙醚; 乙醚; 烯丙基乙炔基醚.
O
O
O
O
系统命名法
1-甲氧基丁烷; 乙氧基乙烯 1,4-环氧丁烷
O
O
O
二.一般制法
(1)一般用于制备对称醚 产率10>20>30 (30易脱水成烯) (2)可用于制备伯烷基叔烷基醚
OH
+
OH
con.H2SO4 O
叔烷基醚还可以这样制备:
1.乙醚 乙醚通常用于从水中萃取有机物的原因: ① 乙醚微溶于水; ② 乙醚能溶解大多数有机物; ③ 沸点低.
环氧乙烷及其它1,2-环氧化物
制备 ① 烯烃氧化
C C
+
RCO3H Ag
C C O
(过过过过过)
CH2 CH2
+
O2
250℃
CH2 O
CH2
(催过过过)
② β-卤代醇与碱作用
C C X OH
+
CH3 C O C CH3
H
+
CH3 CH3 C CH3
H O
+
CH3 C CH3 CH3
(CH3)3COH CH3 CH3 C CH2
CH3 _ H+
CH3 CH3 C O CH3 CH3
H
+
CH3 CH3 C CH3
H O
+
CH3 CH3 CH3 C+
+
CH3OH CH3 CH3 C CH2
CH3 _ H+
OH
+
H2SO4 O
2. Williamson醚合成法 醚合成法 特点:a.可制混合醚; b.不能用20RX、30RX。
醚和环氧化合物

2-甲氧基- 2-丙醇 - -
上述开环反应可总结为: 上述开环反应可总结为:
R
酸开环
O
碱开环
形成的过氧化物容易爆炸, 形成的过氧化物容易爆炸,所 以储存时间长的醚在使用前必须加 入锌粉还原
3、醚键的断裂 、
醚与氢碘酸共热,则发生 键断裂, 醚与氢碘酸共热,则发生R-O键断裂,生成 键断裂 一分子碘代烷和一分子醇。例如: 一分子碘代烷和一分子醇。例如:
当使用过量的氢碘酸时, 当使用过量的氢碘酸时,则醇也与氢碘酸作 生成碘代烷, 用,生成碘代烷,即
4、环氧化合物的开环反应 、 酸催化开环: 酸催化开环:
亲核试剂进攻取代基比较多的环 碳原子.例如: 碳原子.例如:
O H3C HC CH2 Cl HCl CH3CHCH2OH
碱催化开环: 碱催化开环:
亲核试剂进攻取代基较少的环氧碳原子
O H3C HC OH NaOCH3 CH2 CH3OH CH3CH CH2 OCH3
氢溴酸和盐酸虽然也能进行醚键的断裂反 但其活性差。所以, 应,但其活性差。所以,常采用氢碘酸来使 醚键断裂。 醚键断的断裂,往往是从含碳原子较少的烷 基断裂下来与碘结合。 基断裂下来与碘结合。
当混醚中的一个烃基是芳基时, 当混醚中的一个烃基是芳基时,由于 p、π-共轭效应的影响,芳环与氧原子相 共轭效应的影响, 、 共轭效应的影响 连的键比较牢固,与氢碘酸反应时, 连的键比较牢固,与氢碘酸反应时,发 生烷氧键( 生烷氧键(R-O)断裂,生成碘代烷和 )断裂, 酚。例如:
醚与强酸形成的烊盐溶于冷的浓酸中, 醚与强酸形成的烊盐溶于冷的浓酸中,它 烊盐溶于冷的浓酸中 不稳定,遇水分解成原来的醚, 不稳定,遇水分解成原来的醚,因此利用此 性质可以鉴别和分离 鉴别和分离醚 性质可以鉴别和分离醚。
第10章 醚和环氧习题参考答案
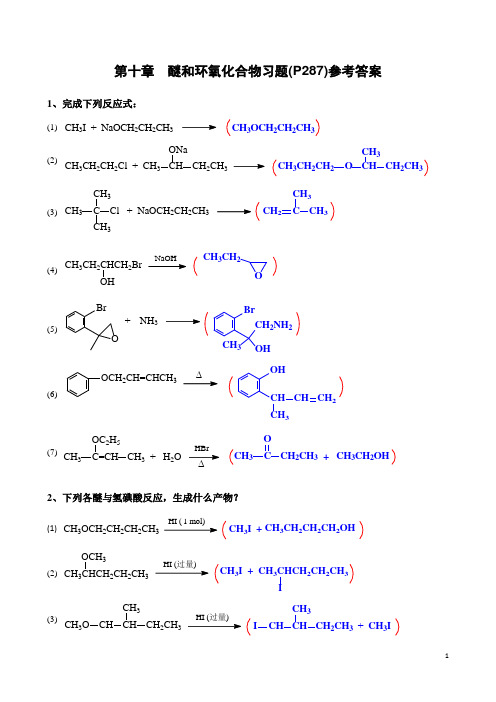
第十章 醚和环氧化合物习题(P287)参考答案1、完成下列反应式:(1) CH 3I + NaOCH 2CH 2CH 3CH 3OCH 2CH 2CH 3(2)CH 3CH 2CH 2Cl + CH 3CH CH 2CH 3ONaCH 3CH 2CH 2O CH CH 2CH 3CH 3(3) CH 3C CH 3CH 3Cl + NaOCH 2CH 2CH3CH 2C CH 3CH 3(4)CH 3CH 2CHCH 2BrOH OCH 3CH 2(5)BrONH 3+BrCH 3OHCH 2NH 2 (6)OCH 2CH=CHCH 3OHCH CH 3CH CH 2(7)CH 3C=CH CH 3 + H 2OOC 2H 5CH 3C OCH 2CH 3+CH 3CH 2OH ∆2、下列各醚与氢碘酸反应,生成什么产物?(1) CH 3I+CH3CH 2CH 2CH 2OHHI ( 1 mol)CH 3OCH 2CH 2CH 2CH 3(2) CH 3CHCH 2CH 2CH 3OCH 3CH 3I + CH 3CHCH 2CH 2CH 3I(3)CH 3O CH CH CH 2CH 3CH3CH CH CH 2CH 3CH 3I+CH 3I3、1,2-环氧丙烷分别与下列试剂反应,各生成什么产物?序号试剂反应产物(1) CH3OH,H+CH3CH CH2OHOCH3(2) CH3OH,CH3ONaCH3CH CH2OCH3OH(3) HBr HOCH2CHCH3Br(4) ①C2H5MgBr;②H+,H2O CH3CHCH2CH2CH3 OH(5) ①CH CNa;②H+,H2O CH3CHCH2COHCH4、乙二醇及其甲醚的沸点随相对分子质量的增加而降低,请解释之。
化合物(1) HOCH2CH2OH(2) HOCH2CH2OCH3(3) CH3OCH2CH2OCH3沸点/℃197 125 84解释两个羟基形成分子间氢键一个羟基形成分子间氢键无羟基,不能形成分子间氢键分子间氢键作用减弱,分子间力减弱,沸点降低5、在3,5-二氧杂环己醇OOOH的稳定椅式构象中,羟基处在a键的位置。
第十章 醚及环氧化合物.

Boiling Points of Ethers and the Isomeric 1-Alkanols
Ether CH3OCH3 CH3OCH2CH3 (CH3CH2)2O Name Methoxymethane (Dimethyl ether) b.p. (oC) -23.0 1-Alkanol CH3CH2OH CH3CH2CH2OH CH3(CH2)3OH CH3(CH2)7OH b.p. (oC) 78.5 82.4 117.3 194.5
反应的动力:亲核试剂强的亲核性,开环后张力减小 2 碱性开环方向
SN2:从位阻小的方向进攻
31
3 碱性开环的立体化学
SN2:从离去基团的背面进攻
32
Summary
环氧化合物在酸性与碱性条件下都可以开环: (1) 酸性开环,为SN2机理,但具有部分SN1的性质, 不对称的 环氧化合物开环时, 开环反应的比较复杂。 (2) 碱性下开环,同样为SN2机理,但不对称的环氧化合物开 环时,开环方向由空间效应所决定,亲核试剂加在取代 少的环碳上。 (3) 无论酸性或是碱性开环,亲核试剂从氧桥的反面进攻中 心碳原子,符合SN2反应的立体化学特征。
§5 冠醚(Crown ether)
高度稀释
18-Crown-6
23
选择性识别
相转移催化-PTC(Phase Transfer Catalysis)
24
§6 环氧化合物的反应
分子内部存在张力,易开环
一、酸性开环
25
1 酸性开环机理:一般SN2
削弱C-O键
2 酸性开环方向
SN2机理但具有部分SN1的性质
Why?
10
二、Williamson Ether Synthesis
有机化学第十章醚和环氧化合物

若邻位已被占领,烯丙基经两次连续重排迁移到对位。
* OCH2CH=CH2 CH3 OH CH3 CH3
CH3
* CH2CH=CH 2
CH3
OCH2CH=CHCH3 CH3
α β γ
OH CH3 CH3 CH2CH=CHCH3
重排机理:经历环状过渡态
第十章
醚和环氧化合物
本章提纲
第一节 醚的命名 第二节 醚的物理性质
第三节 醚的制备
第四节 醚的化学性质
第五节 冠醚
第六节 环氧化合物的反应
什么是醚?
H O H O R(Ar) H O R'(Ar) R(Ar)
水
醇、酚
醚 混醚: R、R’ 不同
单醚或对称醚:R、R’ 相同;
芳香醚:R中有1个或2个为Ar; 环醚:具有环状结构
催化,负离子进攻正性较大的碳。
1. 环氧化合物在酸性条件下的开环反应
H H O CH 3 CH 2CH 3
H+
H H O+ H
CH3 CH2CH3
H H
18
O H
+
CH3 CH2CH3
H2O18
H
H
18 +
OH2
-H+
OH CH 3 CH 2CH 3
H
H
OH
反式开环
OH
CH 3 CH 2CH 3
O
K+
O O
+ K
O
O
K
O
18-crown-6
18-冠-6与K+的配合物 平面型结构
第六节 环氧化合物
第十章 醚和环氧化合物

醚也可以和lewis酸形成络合物:
BF3 R O R' + AlCl3 Mg
lewis 碱
R O R' R O R' R O R'
BF3 AlCl3 Mg R" X
R" X
lewis 酸
10.6.2 酸催化碳氧键断裂
醚与HBr、HI作用,可使醚链断裂:
CH3OCH2CH3 + HI
CH3I + CH3CH2OH (定量进行)
第十章
醚和环氧化合物
水分子中的两个H被烃基R取代形成的化合物叫做醚。
醚键(C-O-C)
C2H5OC2H5
CH3OC2H5 CH2 CH2 O
O CH3
单醚
混醚
环醚
芳醚
10.1
醚和环氧化合物的命名
① 习惯命名法:(常用,适用于简单醚)
¥ ´ Ñ º µ ¿ Ã £ CH3CH2OCH2CH3 (¶ )Ò Ã þ Ò Ñ
(CF3COO)2Hg (CH3)3COH
OC(CH3)3 HgOOCCF3
NaBH4 OH -
OC(CH3)3
(CH3)3C CH=CH2
(1) Hg(OAc)2,CH3OH (2) NaBH4,OH -
(CH3)3C CH CH3 OCH3
P368习题10.2
10.4
① ②
醚的物理性质
相对密度、沸点较低,因为醚分子间不能形成氢键。 水中溶解度与同碳数醇差不多,因醚分子与水分子可形成分子间 氢键:
10.6.4 环氧乙烷与Grignard试剂的反应
环氧乙烷与格氏试剂反应,得到多两个碳的伯醇:
O
有机化学-第十章 醚与环氧化合物-文档资料

17
10.5.2 酸催化醚键断裂
例如: (1) 对称醚键的断裂: 两侧醚键断裂均等
18
(2) 甲基伯烷基醚:醚键断裂在甲基一侧
(3) 叔烷基醚:醚键断裂在叔丁基一侧
(4) 芳基醚:醚键断裂在烷基一侧
19
醚键开裂机理
甲基伯烷基醚:SN2机理(主要考虑位阻影响为主)
叔烷基醚:SN1机理(主要考虑碳正离子稳定性)
11
(3) 立体专一性反应——邻基参与作用
12
10.3.3 不饱和烃与醇的反应
该反应是可逆反应,可利用异丁烯与醇反应生成的叔 丁基醚保护醇羟基。
13
10.4 醚的物理性质和波谱性质
IR:
C–O
Байду номын сангаас
1200 ~ 1050cm-1
14
10.4 醚的物理性质和波谱性质
δ 3.4 ~ 4.0
1H
NMR:
20
两类较易水解的醚类化合物
• 叔丁基醚
用于醇的保护和脱保护
• 烯基醚
21
烯基醚的水解机理
22
10.5.3 环氧化合物的开环反应
稀酸介质 HX溶液
23
反应机理
不对称环氧化物的酸性下开环
反应取向:在取代基多的一端开环,具有SN1性质。
立体化学: 反式开环。
酸的醇溶液
碱性条件下的环氧化物开环
2
。
10.1 醚和环氧化合物的分类
单醚:
乙醚 甲基叔丁醚
醚
混醚: 环醚:
四氢呋喃(THF)
1,4-二氧六环
环氧化合物:
环氧乙烷
3
10.1 醚和环氧化合物的命名 1. 单醚: “二”+“烃基 + 醚”
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
ROSO2OH + H2O ROR + H2SO4
应用化学系
运城学院 合成— 混合醚(或对醚) 二、Williamson合成—制混合醚(或对醚) 合成 Williamson Ether Synthesis
RX + NaOR’ CH3 CH3CH2 O C CH3 CH3 ROR’ + NaX CH3 CH3CH2Br + CH3 C ONa CH3 CH3CH2ONa + CH3 3 CBr 易消除 C2H5OCH2C6H5 + HCl
CH3OCH2CH2OCH2CH2OCH3
3-甲氧基己烷
ß,ß’ - 二甲氧基乙醚 (一缩二乙二醇) 应用化学系
运城学院 3.对于环氧化合物( 3.对于环氧化合物(epoxide) 对于环氧化合物 )
CH2 CH2
CH2 Cl CH O CH2
O 环氧乙烷
3-氯-1,2-环氧丙烷
O
O
THF(环氧丁烷)
O
1,4二氧六环(二噁烷) 应用化学系
运城学院
§10.2 醚的制法
一、醇脱水—制简单对称醚: 醇脱水—制简单对称醚: 对称醚
ROH ROH
浓H2SO4
R O R + H2O
产量 1o > 2o >3o
(3o 醇易生成 烯烃 烯烃)
〈 65 C 140 C
o o
R OH + H2SO4 工业制乙醚: ROSO2OH + ROH
O H
2.椅式构象 椅式) 2. 构相(椅式) 构相(
应用化学系
运城学院 3.制备: .制备: a. 由二元醇脱水制备: 由二元醇脱水制备:
H -H
HO OH
H3PO4
O H O O
O
HOCH2CHOH
应用化学系
运城学院 b. 烯烃与过氧酸加成:(顺式亲电加成) 烯烃与过氧酸加成: 顺式亲电加成)
应用化学系
运城学院
§10.4 醚的物理性质和化学性质
10.4.1 物性 分子间不能形成氢键,沸点较低。 分子间不能形成氢键,沸点较低。 氧原子上有未共用电子对, 氧原子上有未共用电子对,可以作为氢键受 体与水分子形成氢键,因此甲醚溶于水, 体与水分子形成氢键,因此甲醚溶于水,乙 醚在100克水中的溶解度为 克(25℃), 克水中的溶解度为10克 醚在 克水中的溶解度为 ℃ 高级醚不溶于水 ,但THF、乙二醇二甲醚 、 溶于水。 (CH3OCH2CH2OCH3)溶于水。 化学惰性,常用作溶剂,医用麻醉剂。 化学惰性,常用作溶剂,医用麻醉剂。
CH3 碱性 : CH3
O C
OCH3 H
CH2 + CH3O CH3 CH3
OCH3
OCH3 O C CH2OCH3
H
位阻小 CH3
2
CH3 CH3
C OH
CH2OCH3
应用化学系
运城学院 §9.6 其它重要的醚 10.6.1 常见的醚 一、乙醚(ether): 乙醚( ) 环氧乙烷( 二、环氧乙烷(epoxyethane): ) 无色有毒的气体,沸点:11℃ 溶于水、 无色有毒的气体,沸点:11℃,溶于水、醇、醚。 其蒸气与空气混合达到一定的比例时,会爆炸。 其蒸气与空气混合达到一定的比例时,会爆炸 制备: 制备:
CH3 C H H C CH3 C H C H CH3 CH3
过氧间氯苯甲酸,00, 10h
H3 C O CH3 H H H3 C O H + H3C H H CH3
二噁烷60%
过氧间氯苯甲酸,00,
10h
H O CH3
二噁烷60%
应用化学系
运城学院 二、环氧化合物(epoxide): 环氧化合物( ): 环氧乙烷(epoxyethane): 环氧乙烷 : 1. 结构: 结构:
C H
2
a. 酸催化: 酸催化: b. 碱催化: 碱催化:
C H
2
C H
2
H
+
C H
2
C H +o H
N u
2
N u
-
C H
2
C H
2
o
O H
N u
C H
2
o
C H
2
+ N u
O
C H
2
C H
2
H
+
C H
2
C H
2
-
O C H
2 5
2
O H
H
+
O H C H
2 5
C H
2
+
O
C2 H5 O N a
-
H O H
H
H
结构特征:环的张力很大! 张力能: 结构特征:环的张力很大! 张力能:114.1kg.mol-1 应用化学系
运城学院 2. 与亲核试剂作用开环: 与亲核试剂作用开环:
H 2O
H+或OHC2H5OH H+或OHHCl
CH2 OH CH2 OH CH2 OH
CH2 OH CH2 OC2H5 CH2 Cl CH2 NH2 CH2 C6H5 CH2 OCOCH3
应用化学系
: C2H5 O C2H5
(二)乙醚 二
O
二苯醚
运城学院 2.对于结构复杂的醚,把烃基作母体,—OR看作 对于结构复杂的醚,把烃基作母体, 对于结构复杂的醚 看作 取代基。 取代基。
H OCH2CH3
CH3OCH2CH2OH
乙氧基环己烷
CH3CH2CH2CH OCH3 CH2CH3
2-甲氧基乙醇
应用化学系
CH3
运城学院 的生成: 三、过氧化物(peroxidate)的生成: 过氧化物 的生成
C2H5 O C2H5
O2
C2H5 O CH CH3 O O H 氢过氧化乙醚 氢过氧化乙醚
防止:加阻聚剂(对苯二醌等) 防止:加阻聚剂(对苯二醌等) 检验: 检验:加还原剂 (FeSO4)
过氧化物 + Fe
ROR + HCl ROR + Cl H
水
ROR + H
应用化学系
运城学院 2.与缺电子体系形成络合物: 与缺电子体系形成络合物: 与缺电子体系形成络合物
ROR + BF3 R O R F B F F
R’ O Mg X O R
2 ROR + R’ Mg X
R R
R
应用化学系
运城学院 二、醚键的断裂:R—O—R 醚键的断裂: 最有效的试剂为氢卤酸, (最有效的试剂为氢卤酸,HI 或 HBr)
应用化学系
运城学院 10.4.2 化学性质 醚对碱、氧化剂、还原剂都很稳定, 醚对碱、氧化剂、还原剂都很稳定,常温下与 Na不反应 因此可用Na干燥乙醚。 不反应, Na干燥乙醚 Na不反应,因此可用Na干燥乙醚。 一、孤对电子的反应 1.佯盐的生成 佯盐的生成——溶于强浓酸中 佯盐的生成 溶于强浓酸中
NaOH 0 160~180 C
CH2
CH
O
C2H5
应用化学系
运城学院
§10.3 醚的结构
醚的结构: 醚的结构: 醚分子中氧原子采用SP 杂化,键角为110° 醚分子中氧原子采用 3 杂化,键角为 °。 R 可以是烃基,也可以是芳基。 可以是烃基,也可以是芳基。
R O 110 R
SP3 SP3
o
H O H
应用化学系
运城学院 10.6.3 硫醇、硫酚和硫醚 硫醇、
R―O―R’ 醚 ― ―
CH3CH2SCH2 CH3 CH2
R—S—R’硫醚 硫醚
CHCH2 S CH2CH3
乙硫醚
乙基烯丙基醚
一、物性: 物性: 硫醚的沸点大于醚,且不溶于水。 硫醚的沸点大于醚,且不溶于水。 不溶于水。 不溶于水。
应用化学系
+
C H
C H
2
O C2 H
O C2 H
应用化学系
运城学院 c. 不对称环氧乙烷的开环方向: 不对称环氧乙烷的开环方向 方向:
CH3 酸性: CH3 C O CH2
H
CH3 C CH3
H O
CH2
CH3 C CH3
OH CH2
CH3
CH3OH
CH3
C
CH2OH
H
CH3 2C
O C CH2
....
CH2OH
应用化学系
运城学院 §10.1 醚的分类、异构和命名 醚的分类、 一、醚的分类: 醚的分类:
单醚: 单醚: 单醚 C2H5 O C2H5
(二)乙醚
混合醚: 甲基叔丁基醚 混合醚: 混合醚 CH3 O C CH3 3 (小的烃基在前,
O
二苯醚 diphenyl ether
CH2 CH2
O O
C2H5 C2H5
OC2H5
苯乙醚 ethoxybenzene
乙二醇二乙醚 ethylene glycol diethyl ether
应用化学系
运城学院 二、醚的命名: 醚的命名 1.对于结构简单的醚 1.对于结构简单的醚 a. 单醚:(二)某基醚 单醚 b. 混醚:某基某基醚 混醚: 脂肪醚: 脂肪醚:较劣取代基在前 芳香醚: 芳香醚:芳基靠前
CH3 BrCH2CH2CH2OH + CH3 C CH2 CH3 BrMgCH2CH2CH2O C CH3 CH3
H2SO4 D2O H2SO4
CH3 BrCH2CH2CH2O C CH3 CH3 CH3 DCH2CH2CH2O C CH3 CH3 CH2
Mg
DCH2CH2CH2OH + CH3 C
